�E��b�L�@���w
�y�ڎ��z
(i) �Y�f���q�͍ō���4�̌��q�ƌ����ł���
(iii) ���q���A�����Č������邱�Ƃ��ł���
(iv) ���낢��ȕ����ɑ����q�ƌ������邱�Ƃ��ł���
(iii) �G�i���`�I�}�[(�����ِ���)
(1) �L�@���w�Ƃ͉����H
�`���I�Ɂu�L�@���w(organic chemistry)�v�́A�u�Y�f���܂މ������̉��w�v�ƌ��Ȃ���Ă��܂��B1807�N�A�X�E�F�[�f���̉��w�҂ł���C�F���X�E�x���Z���E�X�́A�����͂������́A�܂�L�@�̂̎Y���ł��鍻���Ȃǂ̕������u�L�@������(organic compound)�v�Ƃ��A�������E�̎Y���ł��鐅��H���Ȃǂ̕������u���@������(inorganic compound)�v�ƌĂԂ��Ƃ��Ă��܂����B19���I�����܂ł́A�L�@���q�͐����Ɩ��ڂɊW���Ă���ƍl�����A����̂Ɂu�L�@(organic)�v�Ƃ������t���p����ꂽ�̂ł��B���̍��A�L�@�������́A�����R���̕��q���炵����邱�Ƃ��ł��Ȃ��Ƃ����l�����L��������A�Y�f���܂މ������ɂ́A�u�����́v������Ƃ����ϔO������Ă��܂����B���̂悤�ȍl�������u���C�_(vitalism)�v�Ƃ����܂��B���̂��߁A���w�҂����́A�L�@���������������ō�낤�Ƃ́A�����Ă��Ȃ������̂ł��B
1773�N�A�t�����X�̉��w�҂ł���C���[���E�}�����E���G���́A�A���甒���������̕�����P�����A����͑����������u�A�f�v�ƌĂ��悤�ɂȂ�܂����B�A�f�́A�q�g�̔A���Ƀ^���p�N�����Ƃ��āA1���������30 g���r������Ă��܂��B�ł��ȒP�Ȓ��f�������̓A�����j�ANH3�ł����A�A�����j�ANH3�͐l�̂ɗL�Q�Ȃ��߁A���S�ȔA�f(NH2)2CO�Ƃ��Ē~�����A���n�t�ɂ��Ĕr������Ă���̂ł��B���̕����́A�̓��ō������ꂽ���̂ł��邩��A���炩�ɗL�@�������ł���A�������ō�������͕̂s�\���ƍl�����Ă��܂����B�Ƃ��낪�A1828�N�Ƀh�C�c�̉��w�҂ł���t���[�h���q�E�E�F�[���[�́A���@�������ł���V�A���_�A�����j�E��NH4OCN�̐��n�t�����M���ď��������A������������邱�Ƃɋ��R���������̂ł��B�E�F�[���[�����̌����̐����ׂ�ƁA�V�R�̔A�f(NH2)2CO�ƑS�������ł��邱�Ƃ�������܂����B����́A�����ł͐�ɍl�����Ȃ������ł����B
NH4OCN�@���@(NH2)2CO
�@���������E�F�[���[�́A���t�ł���C�F���X�E�x���Z���E�X�ɁA�u����l�ԂȂǁA�����Ȃ铮���̐t�����g�p�����ɁA�A�f�̍����ɐ����������Ƃ����m�点���Ȃ���Ȃ�܂���v�Ǝ莆�������܂����B�E�F�[���[�͔A�f���������邱�ƂŁA�L�@���ɂ͉��炩�̐����͂�����Ƃ������_���A�L�@���w�Ɩ��@���w�Ƃ����ԉi���̋����˂����̂ł��B�ˑR�A���w�ɖ����̉\�����L����܂����B�A�f���������ō������邱�Ƃ��ł���̂Ȃ�A���̗L�@�������������\�ł��邩������܂���B

�}.1 �E�F�[���[�́A���@���������珉�߂ėL�@�������̔A�f(NH2)2CO����������
�E�F�[���[�̔����ɂ���āA�u���������ƓV�R�����͈Ⴄ�v�Ƃ����A����܂ł̉��w�E�̌Â��l�����͑��苎���܂����B�����A�f���V�R�A�f�Ɖ����牽�܂œ������������߁A�������̐����͂��́u�g���v�ɂ���Č��܂�̂ł���A�u�c��v�ɂ���Č��܂�̂ł͂Ȃ����Ƃ��������܂����B���݂ł́A��_���Y�fCO���_���Y�fCO2�A�Y�_���Ȃǂ������u�Y�f���܂މ������v����ʓI�ɗL�@�������ƌĂсA�u�Y�f�ȊO�̌��f����Ȃ鉻�����v�@�������ƌĂ�ł��܂��B�E�F�[���[�̍����A�f�́A�V�R�̂��̂Ɠ��l�A�ǂ̓_������Ă��엿�Ƃ��ėD��Ă��܂����B���Ȃ݂ɁA���݂ł��A�f(NH2)2CO�́A�H�ƓI�ɓ�_���Y�fCO2�ƃA�����j�ANH3���獇������A����������엿�Ɏg���Ă��܂��B
2NH3�@�{�@CO2�@���@(NH2)2CO�@�{�@H2O
(2) �L�@�������̓���
�@�L�@���w�́A�Y�f�̉��w�ł��B������1�̌��f�̉��w�ł���ɂ�������炸�A�Y�f�̉��w�́u�L�@���w�v�Ɩ��t�����A���̑��̌��f�̉��w�́u���@���w(inorganic chemistry)�v�Ƃ��Ă܂Ƃ߂��Ă��܂��B100���錳�f�̒��ŁA�Ȃ��Y�f�̉������������A���ʂɎ��グ����̂ł��傤���H���̗��R�́A�Y�f�ɂ͑��̌��f�ɂ͂Ȃ��A�Ɠ��Ȑ����������Ă��邩��ł��B�Y�f�ɂ́A���̌��f�Ɣ�r���āA���̂悤�ȓ���������܂��B
(i) �Y�f���q�͍ō���4�̌��q�ƌ����ł���
�Y�f���q�̌��q�ԍ���6�ł���A�Y�f���q��6�̓d�q�������Ă��܂��B6�̓d�q�́A�G�l���M�[���ʂ̒Ⴂ�d�q�O�����珇�ɔz�u����Ă����A�ł�����ȁu�����(ground state)�v�ł́A�Y�f���q�͍ŊO�k�d�q��2�̕s�Γd�q�������܂��B�������A���̂܂܂ł́A�Y�f���q��4�̌��q�ƌ������邱�Ƃ��ł��܂���B�����ŁA���w�����́A�Y�f���q����x�u��N���(excited state)�v�ɂ����A4���̕s�Γd�q����������Ƃɍs���̂ł��B
�Y�f���q�͗�N��ԂɂȂ�ƁA�s�Γd�q��4�ł��āA�����̌����G�l���M�[���l���ł���悤�ɂȂ�܂��B����ɂ���āA��N�ɗv�����G�l���M�[���\���ɕ₤���Ƃ��ł���悤�ɂȂ�܂��B����ɁA�Y�f���q�͂�����N���邾���ł͂Ȃ��A�u�����O��(hybrid orbital)�v������Č������܂��B���̗��R�́A������Ԃ̕����A���q����Ԃ����O�����m�̏d�Ȃ肪�傫���A�d�Ȃ��������̓d�q���x���傫���Ȃ��āA������ȉ��w�������`������邩��ł� (�����O�����Q��)�B
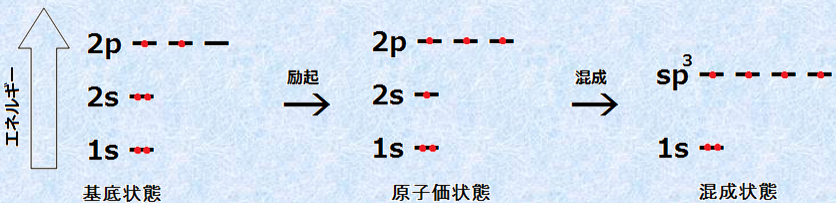
�}.2 �Y�f��sp3�����O��
�܂��A�Y�f���q���������̓d�C�A���x��2.5�ł���̂ŁA���L�������̉��w���������܂��B�Y�f���q1���A�ō���4�̌��q�Ƌ��L�����Ō����ł��邱�Ƃ́A�Y�f�̉��������A���ɑ������Ƃ̑��̗v���ł��B
(ii) ����������邱�Ƃ��ł���
�������́Ap�O�����d�Ȃ邱�Ƃɂ���č���܂��B�������A���̂Ƃ��Ɍ��q���a���傫������ƁAp�O�����m������Ă��܂��A�O���̏d�Ȃ肪���Ȃ��Ȃ�̂ŁA��������������ł��Ȃ��Ȃ��Ă��܂��܂��B���������A���q���a�̏������������̒Y�fC�⒂�fN�A�_�fO�ɂ悭�����̂́A���̂��߂ł��B
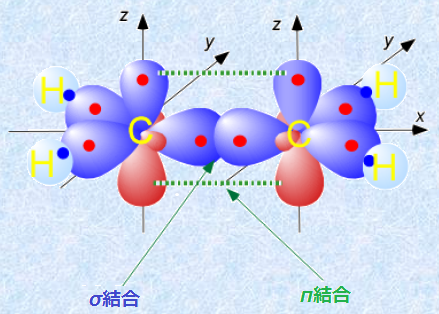
�}.3 �G�`����C2H4�����������������̌`��
�Ƃ���ŁA�������̓d�q�́A�������̓d�q�ɔ�ׂ�ƁA���q�j����̈����t�����ア�̂ŁA���R�d�q�I�Ȑ����������Ă��܂��B����ɁA����������p�O�������s���ĕ��\���́A��ʓI�Ɂu�����n(conjugated system)�v�ƌĂ�܂��B�����n�����d�q���������ƁA���d�q����Ǎ݉����āA���q�S�̂����艻���܂��B�u����(graphite)�v�́A�T�^�I�ȋ����n���������ł���A���d�q�����R�d�q�̂悤�Ȗ���������̂ŁA������ł���Ȃ���A�����d�C�`�����������܂��B
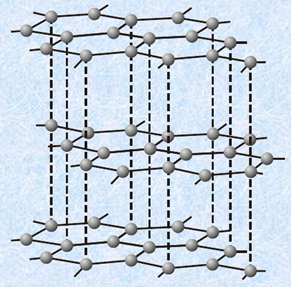
�}.4 �����̊e�w�̖ʓ��ł́Ap�O���ɂ������d�q�̏d�Ȃ肪�傫���̂ŁA�d�C�`�����͍���
�������Ȃ���A���q���a���������Ȃ�A�d�C�A���x���傫���Ȃ肷����ƁA���d�q�����g�Ɉ����t���鋭�����傫���Ȃ�̂ŁA�������d�q�̎��R�d�q�I�Ȑ����������Ă��܂��܂��B����͂��Ȃ킿�A���w���������������邱�Ƃ��Ӗ����Ă��܂��B
�Ⴆ�A�������̌��q�̓d�C�A���x��C��N�Ȃ̂ŁAC��C��N��N�̔��������ׂ�ƁAN��N�̕����������ɂ����̂ł��B�����������͂��̒��fN2�̉��w���������Ⴂ�̂́A���̂��߂ł��B����ɁA�_�fO�̂悤�ɓd�C�A���x�������Ƒ傫���Ȃ�ƁA���q�j�Ƃ̃N�[�����͂��傫���Ȃ肷���āA�������͐ꂪ���ɂȂ�܂��B�_�fO2�́A��ʓI�ɒm���Ă����d���������\���̑��ɁA�s�Γd�q�����\�������₷�����߂ɁA�������������Ȃ�܂��B�Y�fC�́A���̂悤�����d�q�̔����������傤�Ǖ��ʒ��x�ł��邽�߁A��d������O�d�������`�����āA���낢��Ȕ������ƍ\��������������������邱�Ƃ��ł��܂��B
�\.1 ���d�q�̔�����
|
���f |
�Y�f |
���f |
�_�f |
|
�d�C�A���x |
2.5 |
3.0 |
3.4 |
|
������ |
���� |
�Ⴂ |
���� |
|
�\�� |
C��C�AC��C |
N��N |
O��O ↔ O-O |
(iii) ���q���A�����Č������邱�Ƃ��ł���
�@�Y�fC�̓d�C�A���x�́A�傫�������������������Ȃ��̂ŁA�Y�f���������́A���L���������̂悤�ɘA�����Čq�����Ă����܂��B���̐������u�J�e�l�[�V����(catenation)�v�Ƃ����܂��B�܂��A����ɔ����āA���������A�������邱�Ƃ��ł��܂��B
����ŁA�d�C�A���x�̑傫���_�fO�⒂�fN�ł́A�L�d�q�ΊԂ̔������傫�����߁A�A�����������͌`�����ɂ����Ȃ�܂��B�y���I�L�V��(-O-O-)��A�]��(-N��N-)�̍\�����s����Ȃ̂́A���ꂪ���R�ł��B�ߎ_�����fH2O2�́A�y���I�L�V��(-O-O-)�̍\���������߁A�����G�l���M�[�I�ɕs����ŁA�����������ɍ����ł��B
![]()
�}.5 �ߎ_�����fH2O2�͕s����ŁA�_�fO2����o���₷��
�Y�fC�͘A��������������邱�Ƃ��ł��邽�߁A�Y�fC�Ɛ��fH�݂̂łł��鉻�����́A�����㖳���ɂ���܂��B��ʓI�ɒY�fC�Ɛ��fH���݂łł������������u�Y�����f(hydrocarbon)�v�Ƃ����A����͂��ׂĂ̗L�@�������̊�{�ƂȂ��Ă��܂��B�Y�����f�̂����A�Y�f���q�Ԃ����ׂĒP�����̂��̂��u�O�a�Y�����f(saturated hydrocarbon)�v�A��d������O�d�����̂悤�ȕs�O�a�������܂ނ��̂��u�s�O�a�Y�����f(unsaturated hydrocarbon)�v�Ƃ����܂��B�܂��A���q������\���̂��̂��u�����Y�����f(chain hydrocarbon)�v�܂��́u���b���Y�����f(aliphatic hydrocarbon)�v�A��\�����܂ނ��̂��u���Y�����f(cyclic hydrocarbon)�v�Ƃ����܂��B������\���̂��̈ȊO�ɂ��A�}�����ꂪ����\���̂��̂�����܂��B
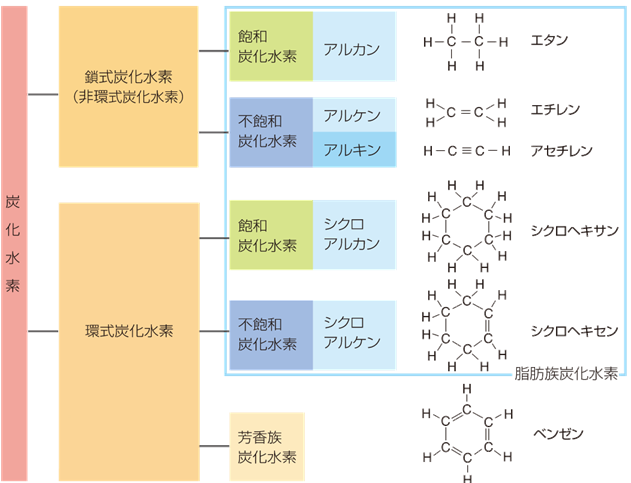
�}.6 �Y�����f�̕���
�����Y�����f�̂����A�O�a�Y�����f���u�A���J��(alkane)�v(���b���Y�����f(�A���J��)���Q��)�A�s�O�a�Y�����f�œ�d����1���܂ނ��̂��u�A���P��(alkene)�v(���b���Y�����f(�A���P��)���Q��)�A�O�d����1���܂ނ��̂��u�A���L��(alkyne)�v(���b���Y�����f(�A���L��)���Q��)�Ƃ����܂��B�܂��A���Y�����f�̂����A�F����(�x���[���Ȃ�)�������s�O�a�Y�����f���u�F�����Y�����f(aromatic hydrocarbon)�v(�F�����Y�����f���Q��)�Ƃ����A���L�̐����������܂��B
����ɁA�F�����Y�����f�������A���Y�����f���u�����Y�����f(alicyclic hydrocarbon)�v�Ƃ����A���̂����A�O�a�Y�����f���u�V�N���A���J��(cycloalkane)�v�A�s�O�a�Y�����f�œ�d��������1�܂ނ��̂��u�V�N���A���P��(cycloalkene)�v�Ƃ����܂��B
(iv) ���낢��ȕ����ɑ����q�ƌ������邱�Ƃ��ł���
�@�Y�f��sp3�����O���Esp2�����O���Esp�����O�����Ƃ��āA���ꂼ�ꐳ�l�ʑ́E���O�p�`�E���������Ɍ��q�ƌ������邽�߁A���낢��Ȍ`��g�ݗ��Ă邱�Ƃ��ł��܂��B�Y�fC�Ɛ��fH����Ȃ�Y�����f�ɁA�_�fO�⒂�fN�A����P�A�t�b�fF�Ȃǂ̂������̌��f��g�ݍ��킹�邾���ł��A�l������\���͖c��ɑ������A���낢��Ȕ�������\�������������q���A���R���݂ɍ��o���܂��B���@�������Ɣ�ׂāA�L�@���������\�����鐬�����f�̎�ނ͏��Ȃ��̂ł����A���̂悤�Ȑ����̂��߂ɁA�������̎�ނ͋ɂ߂đ����Ȃ�̂ł��B�Y�f�����G�ȕ��q���琬�藧���Ă��鐶���L�@�̂̒��S���f�ł���̂́A�܂��ɂ��̂悤�ȒY�f�̓Ɠ��Ȑ����ɂ��Ƃ��낪�傫���ł��B�����Y�f�Ƃ������f���Ȃ������Ȃ�A�����Ɛ����͒a�����Ă��Ȃ������ł��傤�B
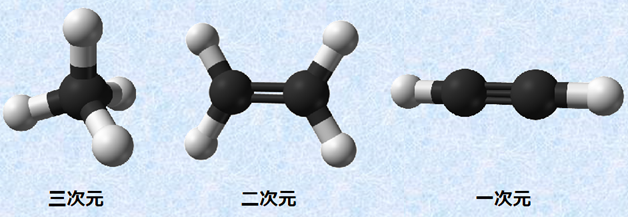
�}.7 �Y�f�̗��̍\��
(3) ���\��
�@���q�c�̒��ɂ́A����炪�������Ă��镪�q���i�̎�ނɂ́A���܂�e������Ȃ����w�I�����������̂�����܂��B�����̌��q�c�́A��ʓI�Ɂu���\��(functial group)�v�ƌĂ�܂��B�u�q�h���L�V��(-OH)�v�͊��\��̈��ł���A���̊��Y�f���i�Ɋ܂މ������́A�u�A���R�[��(alcohol)�v�ƌĂ�܂��B
�L�@�����ł́A�����̉��w�I�ω������\��ŋN�����Ă��A���q�̎c��̕����́A���Ƃ̍\����ێ����Ă���Ⴊ�قƂ�ǂł��B���̂悤�ɉ��w�����ł́A�\�����̑啔�����ω����Ȃ��ŕێ������̂ŁA�L�@���w�̊w�K�́A���ɒP��������܂��B���������āA�������͎�X�̊��\��̉��w�ɒ��ڂ��āA������Ηǂ��Ƃ������ƂɂȂ�܂��B������1���ɂ��Ċw�K����̂ł͂Ȃ��A���ނ�����Q�̉��������ƂɊw�K������������I�ł��B��\�I�ȁu���\��v�̖��́A�\�����A���̊��\����܂މ������̈�ʖ��Ƃ��̓����́A���̕\.2�̒ʂ�ł��B
�\.2 ��\�I�Ȋ��\��̖��́A�\�����A���̊��\����܂މ������̈�ʖ��Ƃ��̓���
|
���\�� |
��ʎ� |
��ʖ� |
��̗� |
���� |
|
�A���R�[���� �q�h���L�V�� |
R-OH |
�A���R�[�� (alcohol) |
CH3OH ���^�m�[�� |
���� ���f�������� |
|
�`�I�[���� |
R-SH |
�`�I�[�� (thiol) |
CH3CH2SH �G�^���`�I�[�� |
���� ���ٓI�Ȉ��L������ |
|
�A���f�q�h�� |
R-CHO |
�A���f�q�h (aldehyde) |
HCHO �z�����A���f�q�h |
���� �Ҍ��������� |
|
�P�g���� |
R-CO-R�f |
�P�g�� (ketone) |
CH3COCH3 �A�Z�g�� |
���� |
|
�J���{�L�V�� |
R-COOH |
�J���{���_ (carboxylic acid) |
CH3COOH �|�_ |
��_�� |
|
�A�V���� |
R-CO- |
�A�V�� (acyl) |
CH3COCl �����A�Z�`�� |
���� |
|
�G�X�e������ |
R-COO-R�f |
�G�X�e�� (ester) |
CH3COOCH2CH3 �|�_�G�`�� |
���� �ǂ����肪���� |
|
�G�[�e������ |
R-O-R�f |
�G�[�e�� (ether) |
CH3CH2OCH2CH3 �W�G�`���G�[�e�� |
���� |
|
�X���t�B�h���� |
R-S-R�f |
�X���t�B�h (sulfide) |
CH3SCH3 �W���`���X���t�B�h |
���� ���ٓI�Ȉ��L������ |
|
�V�A�m�� |
R-CN |
�j�g���� (nitrile) |
CH3CN �V�A�m���^�� |
���� |
|
�j�g���� |
R-NO2 |
�j�g�������� (nitro compound) |
C6H5NO2 �j�g���x���[�� |
���� ������������ |
|
�X���z�� |
R-SO3H |
�X���z���_ (sulfonic acid) |
C6H5SO3H �x���[���X���z���_ |
���_�� |
|
�t�F�m�[���� �q�h���L�V�� |
Ar-OH |
�t�F�m�[���� (phenols) |
C6H5OH �t�F�m�[�� |
��_�� ���f�������� |
|
�A�~�m�� |
R-NH2 |
�A�~�� (amine) |
C6H5NH2 �A�j���� |
��� ���f�������� |
|
�A�~�h���� |
R-NHCO-R�f |
�A�~�h (amide) |
C6H5NHCOCH3 �A�Z�g�A�j���h |
���� ���f�������� |
|
�A�]�� |
R-N��N-R�f |
�A�]������ (azo compound) |
C6H5N2C6H5 �A�]�x���[�� |
���� �F�f������ |
(4) ���f����
�@�L�@�������̐����┽������m�邽�߂ɂ́A���̉������̍\�������肷��K�v������܂��B��ʓI�ɗL�@�������̍\�����́A���̂悤�Ȏ菇�Ō��肳��܂��B
|
�@ �������E�������āA�ړI�̉��������������Ƃ��Ď��o���B �A �L�@�������̍\�����f�̎�ނ⊄���ׁA�g���������肷��B �B �L�@�������̕��q�ʂ𑪒肵�A����Ɋ�Â��ĕ��q�������肷��B �C �L�@�������̕����I�Ȑ����≻�w�I�Ȑ����Ɋ�Â��č\���������肷��B |

�}.8 �\�����̌���菇
�����̕����E�����ɂ́A�u����(distillation)�v��u����(sublimation)�v�A�u�Č���(recrystallization)�v�A�u���o(abstraction)�v�A�u�N���}�g�O���t�B�[(chromatography)�v�Ȃǂ��悭���p����܂��B
����ɁA�L�@�������̍\�����f�̊ܗL�ʂ́A�u���f����(elementary analysis)�v�ɂ���ċ��߂��A�ʏ�́u�j���C���X�y�N�g��(NMR�X�y�N�g��)�v��u�ԊO�z���X�y�N�g��(IR�X�y�N�g��)�v�Ȃǂ̓d���g��p�������@�ɂ���čs���܂��B�����͓���̔g���̓d���g���z������ƁA�G�l���M�[�̒Ⴂ����Ԃ���A�G�l���M�[�̍�����N��Ԃɕω�����悤�ɂȂ�܂��B�����ɓ���̔g���̓d���g���Ǝ˂��āA���̗l�q���ϑ����邱�ƂŁA���q�\������͂ł���̂ł�(�m�l�q(�j���C����)�����@�̊�b���Q��)�B
�܂��A�L�@�������̕��q�ʂ��A�u���ʕ��͌v(MS�X�y�N�g��)�v�ɂ���ċ��߂邱�Ƃ��ł��܂��B�C�̎����ɍ��G�l���M�[�̓d�q�����Ǝ˂���ƁA���q���C�I��������܂��B���q����d�q��1������菜���ꂽ���q�C�I���ƁA���q����������Đ������t���O�����g�C�I���̎��ʕ��z�𑪒肷�邱�Ƃɂ��A�������̕��q�ʂ�\����m�邱�Ƃ��ł���̂ł��B�������A���̕��@�́A��w�Ȃǂ̌����@�ւōs����Ő�[�̕��͋Z�p�ł���A���Z���w�ł́A�����Ɂu���f���́v�Ƃ��āA���̐}.9�̂悤�ȌÓT�I�ȕ��@���s���邱�Ƃ������ł��B�������@�́A1834�N�Ƀh�C�c�̉��w�҂ł��郆�X�g�D�X�E���[�r�b�q�����߂čl�Ă��Ă��̂ł��B
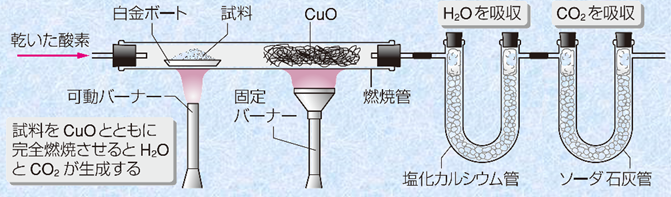
�}.9 �ÓT�I�����f����
�@�Y�fC�E���fH�E�_�fO�������L�@�������̑g���������肷�邽�߂ɂ́A�܂��������������̎��ʂ��ɗʂ�܂��B���ɁA�����_�f���Ŏ��������S�R�Ă����A��������H2O��U���ǒ��̉����J���V�E��CaCl2�ɋz�������A��_���Y�fCO2��U���ǒ��̃\�[�_�ΊD�ɋz�������܂��B�Ȃ��A���̂Ƃ��̎_����(II)CuO�́A�s���S�R�ĕ������S�R�ĕ��ɕς��邽�߂̎_���܂Ƃ��ĉ����Ă���܂��B�_����(II)CuO�́A�_���܂Ƃ��ē����Ɠ�Cu�ɂȂ�܂����A���������_�fO2�ɂ���Ď_������A�_����(II)CuO�ɍĐ����܂��B
CuO�@�{�@CO�@���@Cu�@�{�@CO2
(2Cu�@�{�@O2�@���@2CuO)
�����āA�����J���V�E���ǂƃ\�[�_�ΊD�ǂ̎��ʑ������𑪒肷�邱�Ƃɂ��A����������H2O�Ɠ�_���Y�fCO2�̎��ʂ��A���ꂼ�ꋁ�܂�̂ł��B�����ŁA�����̑g����CxHyOz�́A���̂悤�ɋ��߂܂��B���q����H��1�AC��12�AO��16�Ƃ����ƁA���S�R�ĕ��̎���wCO2�AwH2O���A

�e���f�̎��ʂ����̌��q�ʂŊ���ƁA���̔䂪�����ʂ̔�ɂȂ�܂��B���̂悤�ɂ��āA�����̑g���������߂邱�Ƃ��ł���̂ł��B�܂��A���ӂƂ��āA�����J���V�E���ǂƃ\�[�_�ΊD�ǂ̏������t�ɂ��Ă͂����܂���B�\�[�_�ΊD�́A�_���J���V�E��CaO�Ɛ��_���i�g���E��NaOH���Ă��ł߂����̂ł���A��_���Y�fCO2����H2O���z���ł���̂ł��B�\�[�_�ΊD�ǂ��ɂ��Ă��܂��ƁA�\�[�_�ΊD����_���Y�fCO2�ƈꏏ�ɐ�H2O�܂ŋz�����Ă��܂��A�ʁX�Ɏ��ʂ�����ł��Ȃ��Ȃ��Ă��܂��܂��B
�܂��A���f���̖͂��ł́A�����̌��f�ʎ���%���^�����Ă��邱�Ƃ������A���̏ꍇ�́A���̂悤�ɂ��đg���������߂܂��B�����̂����A�Y�fC��a%, ���fH��b%, �_�fO��c%�܂�ł���Ƃ���ƁA

�@����ɁA���m�������̕��q�������肷�邽�߂ɂ́A�g���������肵�����ƁA���̉������̕��q�ʂ𑪒肷��K�v������܂��B���q�ʂ́A�g�����̎��ʂ̐����{�ɑ�������̂ŁA���q�ʂ�������A�g�������番�q�������߂邱�Ƃ��ł���̂ł��B���q�ʂ́A���ŗ^�����Ă��邱�Ƃ������̂ŁA����𗘗p���ĉ������B���q����(�g����)n�Ə����邱�Ƃ���A
![]()
![]()
�Ȃ��A���q�������܂��Ă��A�L�@�������ɂِ͈��̂������̂ŁA�\���������肷�邽�߂ɂ́A���̉������̕����I�Ȑ����≻�w�I�Ȑ����ׂ�K�v������܂��B���ۂ̌����ł́A�L�@�������̗Z�_�╦�_�Ȃǂ̕����I�Ȑ����ׂ邱�Ƃ������̂ł����A���Z���w�ł́A�\������Ȃǂ̖��ŁA�L�@�������̉��w�I�Ȑ�����₤���Ƃ������ł��B
�Ⴆ�A���q��C2H6O�̗L�@�������ɂ́A�G�^�m�[��C2H5OH(m.p.-115��, b.p.78��)�ƃW���`���G�[�e��CH3OCH3(m.p.-142��, b.p.-25��)��2��ނِ̈��̂�����܂��B�������m�̉��������G�^�m�[��C2H5OH�ł���A�i�g���E��Na�Ɣ������Đ��fH2�������܂��B�������A�W���`���G�[�e��CH3OCH3�ł���A�i�g���E��Na�������Ă��������܂���(�A���R�[�����Q��)�B���̂悤�ȉ��w�I�����̈Ⴂ�𗘗p���āA�L�@�������̍\���������肵�Ă����̂ł��B
(5) ���̉��w
�@���镪�q�ɂ��āA�����g�ݗ��ĂĂ��錳�f�̎�ނƐ���\�������̂��u���q���v�ł��B�������Ȃ���A�������q���ł����Ă��A�e���q���m�̌����̎�ނ�����A���Ȃ킿���q�\�����قȂ�ƁA�݂��ɕ����I�A����щ��w�I�Ȑ����̑S���قȂ������q�ƂȂ�܂��B
���̂悤�ɁA�������q���ł���Ȃ���A�\�����قȂ���̂��u�ِ���(isomer)�v�Ƃ����܂��B�܂��A���镪�q���ِ��̂ɕω����邱�Ƃ��A�u�ِ���(isomerization)�v�Ƃ����܂��B�ِ��̂ɂ́A�傫�������āu�\���ِ���(structural isomer)�v�Ɓu���ِ̈���(stereoisomer)�v������A��ʓI�Ɏ��̐}.10�̂悤�ɕ��ނł��܂��B���ِ̈��̂́A����Ɂu�G�i���`�I�}�[(enantiomer)�v�Ɓu�W�A�X�e���I�}�[(diastereomer)�v�ɕ��ނ���܂��B
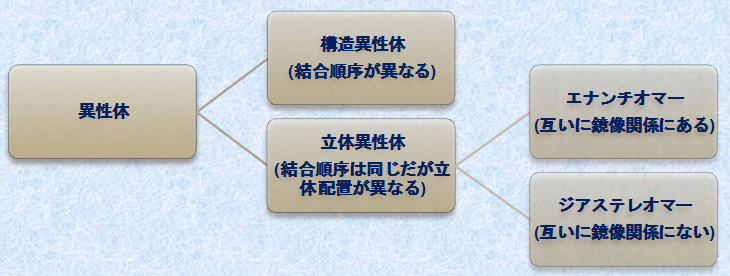
�}.10 �ِ��̂̕���
(i) �\���ِ���
���q�̌����������قȂ�ِ��̂��A�u�\���ِ��́v�Ƃ����܂��B�\���ِ��̂ɂ́A�Y�f���i�̈قȂ���́A���\��̎�ނ̈قȂ���́A���\��̈ʒu�̈قȂ���̂�����܂��B���̐}.11�ɁA��ȁu�\���ِ��́v�������܂��B
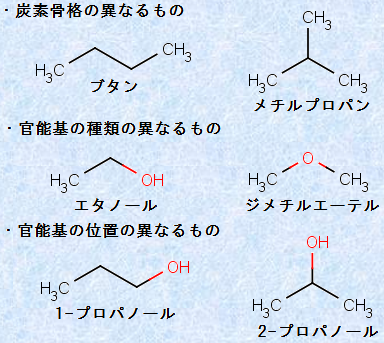
�}.11 ��ȍ\���ِ���
(ii) ���ِ̈���
�u���ِ̈��́v�Ƃ́A���q�Ԃ̌��������͕ς��Ȃ����̂́A��ԓI�Ȍ��q�̔z�قȂ邽�߂ɐ�����ِ��̂̂��Ƃ������܂��B���ِ̈��̓��m�̍\����̈Ⴂ�́A�\���ِ��̓��m�̈Ⴂ�ɔ�ׂ�ƁA�͂邩�ɔ��ׂȂ��̂ł͂���܂��B�������A����ł��ِ��̕��q�̉��w�I�����ɂ́A�d�v�ȈႢ���錴���ɂȂ�܂��B
���ɁA���i�̌����ڂɊւ��Ă����A���ِ̈��̂̂ǂꂪ�g���邩�ɂ���āA�����ڂ╛��p�̗L���ɁA�����ȍ�������邱�Ƃ������ł��B����́A�q�g�̑̓��ɂ����e�̂����A���w�����𗧑̓��ٓI�ɕ��q���x���ŔF�����Ă��邩��ł��B��Ƃ��āA�u�T���h�}�C�h�v�Ƃ������h�C�c�̃O�����l���^�[���Ђ��̔��������l����ƁA�T���h�}�C�h��R �̂́A���������܂��蕨�����~�߂Ƃ��ėL���Ȗ�ł��B�������A�T���h�}�C�h��S �̂́A���ɋ����Ê�������Ă��܂��B�s�̂̃T���h�}�C�h�́AR ����S �̂�1�F1�ɍ��������u���Z�~������(racemic mixture)�v�ɂȂ��Ă����̂ł��B
�}.12 �T���h�}�C�h��S �̂ɂ́A�����Ê������
�T���h�}�C�h��S ���ɂ́A�����铮���َ̑����肩�A�A������ɂ܂Ŋ�`��������قǂ̋����Ê���������̂ł����A�D�P���̓������g���������͍s���Ă��Ȃ������̂ł��B�T���h�}�C�h�p����ƁA��̂̒��ɂ���َ��̎葫�̐����𑣂��^���p�N���̋@�\���j�Q����A�葫�̒������ɒ[�ɒZ���V�������Y�܂�Ă��܂��悤�ɂȂ�܂��B���̏Ǐ�́A�葫���A�U���V�̎��̂悤�ɂȂ邱�Ƃ���A�u�A�U���V���ǁv�Ƃ����܂��B���{�ł́A���̑Ή����x�ꂽ���Ƃ����Q���g�債�A1981�N�܂ł�309�l����Q���ƔF�肳���Ɏ���܂����B
�Ȃ��A�T���h�}�C�h��R �̂����𓊗^���Ă��A�����ɑ̓��ŃT���h�}�C�h��S �̂ɔ������ω����A�u���Z�~��(racemization)�v����Ƃ���������̂ŁA�T���h�}�C�h�𐇖������܂��蕨�����~�߂̖�܂Ƃ��Ďg���̂́A����悤�ł�(�T���h�}�C�h�̉Ȋw���Q��)�B
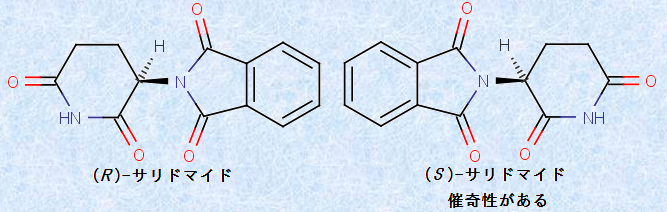
(iii) �G�i���`�I�}�[(�����ِ���)
�@�E��ƍ���͋����̊W�ł���A���ʏ�ŏd�ˍ��킹�邱�Ƃ��ł��܂���B���̂悤�ɁA�����Əd�ˍ��킷���Ƃ̂ł��Ȃ����q���u�L����(chiral)�v�Ƃ����܂��B�u�L�����v�Ƃ����̂́A�M���V�A��́u��(cheir)�v�ɗR�����錾�t�ł��B�L�����ȕ��q���u�L�������q�v�Ƃ����A�L�������q�͉E��ƍ���̂悤�ɁA�݂��ɋ����ł����̗��ِ̈��̂ł��B�����2�ِ̈��̂̊W���A�u�G�i���`�I�}�[(enantiomer)�v�������́u�����ِ��́v�Ƃ����܂��B
�܂��A�݂��ɈقȂ�4��ނ̌��q�A�܂��͌��q�c�ƌ��������Y�f���q���A�u�Ώ�(symmetry)�v��ے肷��u�s��(asymmetry)�v�Ƃ������t���g���āA�u�s�ĒY�f���q(asymmetric carbon atom)�v�Ƃ����܂��B���q���̕s�ĒY�f���q�́A�L���́u*�v���g���ĕ\���܂��B�����̃L�������q�́A�s�ĒY�f���q�Ȃǂ́u�s�Ē��S(asymmetric center)�v�����̕��q���Ɋ܂݂܂��B�������A�s�Ē��S�̑��݂́A�K�������L�����ł��邱�Ƃ̕K�v�����ł��\�������ł�����܂���B
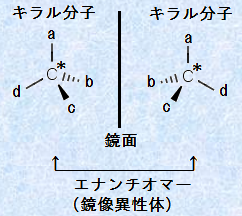
�}.13 �s�ĒY�f���q���܂މ������́A�L�������q�ł��邱�Ƃ�����
�@����ŁA���̕��q�̋����Əd�ˍ��킹�邱�Ƃ��ł��镪�q���u�A�L����(achiral)�v�Ƃ����܂��B�A�L�����ȕ��q�ɂ́A�u�Ώ̖ʁv��u�Ώ̐S�v������A���̂悤�ȓ����������q�́A���ׂăA�L�����ł��B����ɑ��āA�L�����ȕ��q�́A�Ώ̖ʂ�Ώ̐S�������Ȃ��̂ŁA�Ώ̖ʂ�Ώ̐S��T�����ƂŁA���̕��q���L�����ł��邩�A�L�����ł��邩�����ʂ��邱�Ƃ��ł��܂��B�A�L�����ȕ��q�Ƃ��̋����́A���ʏ�ŏd�ˍ��킹�邱�Ƃ��ł���̂ŁA�����̓G�i���`�I�}�[�ɂ͕��ނ���܂���B
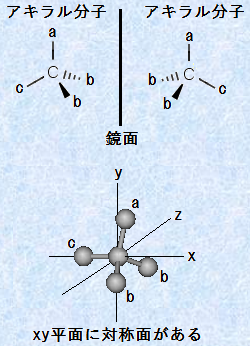
�}.14 �A�L�����ȕ��q�ɂ́A�Ώ̖ʂ�Ώ̐S�����݂���
�@2���̃G�i���`�I�}�[�̂قڂ��ׂĂ̕����I�����͓������ł��B�Z�_�╦�_�A���x�A�n��x�A���ܗ��A�M�`�����Ȃ��̕����I�����́A���҂���ʂ���̂ɖ𗧂��܂���B�������A�����I�����̒��ŁA���B���ł����A����1�����Ⴂ������܂��B����́A2�̃G�i���`�I�}�[���A�ʕΌ��̕Ό��ʂ����ꂼ�ꓯ���p�x�����A�t�����ɉ�]������Ƃ��������ł��B�Ό��ʂ���]���錻�ۂ��u���w����(optical activity)�v�Ƃ����܂��B�Ό��ʂ����v���ɉ�]�����镪�q�́u�E����(dextrorotatory)�v�ł���Ƃ����A��]�������v���ł���u������(levorotatory)�v�ł���Ƃ����܂��B��]������\���ɂ́A�E�����̏ꍇ��(+)�܂���(d)���A�������̏ꍇ��(-)�܂���(l)���������̖��O�̑O�ɕt���܂��B
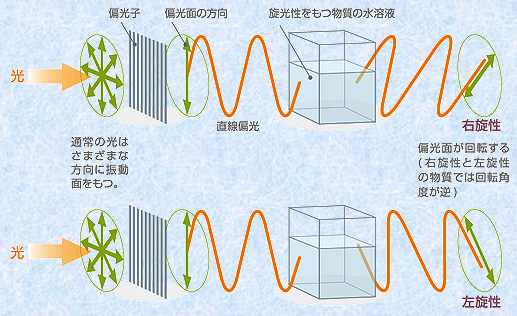
�}.15 �G�i���`�I�}�[�̐�����
�܂��A�E�����ƍ������̃L�������q�����ʍ��݂��Ă���ƁA�������̌��ʂ����E����A�Ό��ʂ̉�]���ϑ�����Ȃ��Ȃ�܂��B���̂悤�ȍ��������u���Z�~��(racemate)�v�Ƃ����܂��B�u���Z�~�v�Ƃ́A�uracemic(�u�h�E��)�v�Ƃ����Ӗ��̌��t���痈�Ă��܂��B����́A�t�����X�̐����w�҃��C�E�p�X�c�[�����A�u�h�E�ʏ`���瓾��ꂽ��Ύ_���̌������烉�Z�~�̂���������ł��B�܂��A�G�i���`�I�}�[�̃��Z�~�̍������ł��邱�Ƃ�\���̂ɁA���������̑O��(�})��t���邱�Ƃ��悭����܂��B
(iv) �W�A�X�e���I�}�[
�@�V�R�ɑ��݂��鐔�����̉������́A2�ȏ�̕s�ĒY�f���q�������Ƃ������ł��B���̂悤�ȏꍇ�A�ِ��̂̐������߂���A�ِ��̊Ԃ̊֘A���𖾂炩�ɂ����肷�邱�Ƃ��A��Ϗd�v�ɂȂ��Ă��܂��B������₷���悤�ɁA�V�R���q�ł͂���܂��A�u2-�u����-3-�N�����u�^���v���Ƃ��čl���Ă݂܂��傤�B���̕��q�ɂ́A�u����v�̂���2�̕s�ĒY�f���q������܂��B����2�̕s�Č��ɑ��āA���ꂼ��ɃG�i���`�I�}�[���ł���̂ŁA�ِ��̂̐��͍��v��2�~2��4�ɂȂ�܂��B��ʓI�ɕs�Č���n����ꍇ�A���̉������ِ̈��̂́A���v2n�ł��܂��B�܂��A�����Œ��ڂ��ė~�������Ƃ́A�G�i���`�I�}�[�̑g�ݍ��킹���A2�g�ł��邱�Ƃł��B���Ȃ킿�AA��B�͏d�ˍ��킹�邱�Ƃ��ł��Ȃ��G�i���`�I�}�[�ł���A���l��C��D���ʂ̃G�i���`�I�}�[�ł��B
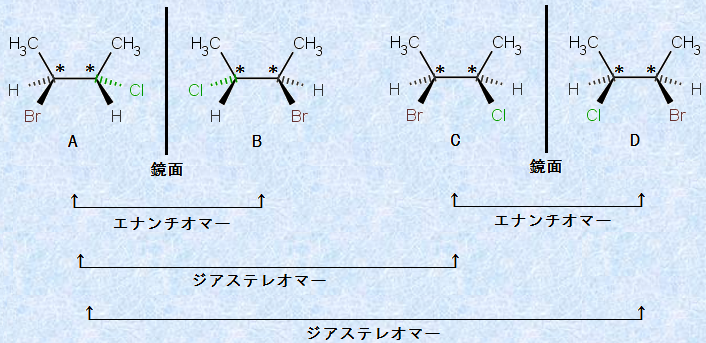
�}.16 2-�u����-3-�N�����u�^���̗��ِ̈���
�����ŁA�L�@���w�ɂ����āA��Ϗd�v�Ȃ���1�̗��̉��w�ɂ��Đ�������K�v������܂��B�}.16�̗��ِ̈��̂�A��C�̊W�ׂĂ݂܂��傤�B�����́A�d�ˍ��킹�邱�Ƃ̂ł��Ȃ����ِ̈��̂ł���Ȃ���A�����W�ł͂���܂���B�܂�A����炪���ِ̈��̂ł��邱�Ƃ͊m���ł����A�G�i���`�I�}�[�ł͂Ȃ��̂ł��B���̂悤�ȊW�ɂ��闧�ِ̈��̂��A�u�W�A�X�e���I�}�[(diastereomer)�v�Ƃ����܂��B���������āA�W�A�X�e���I�}�[�Ƃ́A�݂��������̊W�ɂȂ����ِ̈��̂̑g�ݍ��킹�̂��Ƃł��B(A, C)�E(A, D)�E(B, C)�E(B, D)�̊W�́A���ׂăW�A�X�e���I�}�[�ł��B
����ɁA�G�i���`�I�}�[�ƃW�A�X�e���I�}�[�Ƃ̊Ԃɂ́A�ɂ߂ďd�v�ŁA�����ȑ��Ⴊ����܂��B�G�i���`�I�}�[�́A�݂��ɋ����̂ł��邩��A�Ό��ʂ���]�����鐫���������قȂ�܂��B�������A�Z�_�╦�_��n��x�Ȃǂ̕����͑S������ł��邩��A�Č���������Ƃ����������Ɋ�Â������@�ł́A�G�i���`�I�}�[���ł��܂���B�������A�W�A�X�e���I�}�[�́A�݂��ɋ����̂ł͂Ȃ�����A�L�����e�B�[�ɊW�Ȃ��A���ׂĂ̕������قȂ��Ă��܂��B���Ȃ킿�A�W�A�X�e���I�}�[�́A�݂��ɈقȂ�Z�_�╦�_�A���x�A�n��x�A���ܗ��A�M�`�����Ȃǂ������Ă���A�W�A�X�e���I�}�[�́A2�̈قȂ鉻�w�����Ƃ��Č��Ȃ����Ƃ��ł���̂ł��B
�@�܂��A�W�A�X�e���I�}�[�ɂ́A���ӂ���ׂ����Ƃ�����܂��B����́A�s�ĒY�f���q�������Ă��Ȃ���A�A�L�����ȕ��q�����݂���Ƃ������Ƃł��B��Ƃ��āA�u2,3-�W�N�����u�^���v�̗��ِ̈��̂��l���Ă݂܂��傤�B���̕��q�ɂ́A�s�Ē��S��2���݂��邱�Ƃ�������܂��B
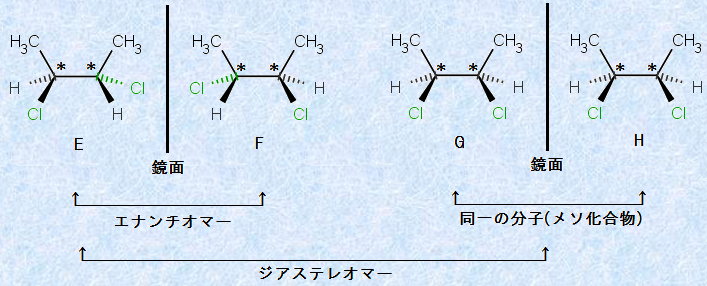
�}.17 2,3-�W�N�����u�^���̗��ِ̈���
�����ŁAE��F�݂͌��ɏd�ˍ��킹�邱�Ƃ̂ł��Ȃ�1�g�̃G�i���`�I�}�[�ł���̂ɑ��āA�c���G��H�݂͌��ɋ����̊W�ɂ���Ȃ���A����̉������ł��B����́AG��H���s�ĒY�f���q�������Ȃ�����A���̕��q�ɑΏ̖ʂ����݂��邩��ł��B���̂悤�ɁA���q�ɕs�Ē��S������Ȃ�����A�����ɑΏ̖ʂ�Ώ̐S�������߂ɃL�����e�B�[�������Ȃ��\�����A�u���\������(meso compound)�v�Ƃ����܂��B
���Z���w�ł́A�s�ĒY�f�����������́A���ׂăL�������q�ł��邩�̂悤�Ɉ����܂��B�������A���\�������̂悤�ȗ�O�����݂���̂ł��B���\�������ł́A�s�Ē��S�̗��̔z�u�́A�݂��ɋt�̊W�ɂȂ��Ă��āA���q�S�̂Ƃ��ăA�L�����ł��邩��A���w�s�����ł��B
�@�܂��A�W�A�X�e���I�}�[�ɂ́A��d�������܂މ������ŁA���̔z�u���قȂ邽�߂ɁA���ِ̈��̂ƂȂ��Ă�����̂�����܂��B���̂悤�ȗ��ِ̈��̂́A��ʓI�Ɂu�ِ���(geometrical isomer)�v�ƌĂ�܂��B�L�@�������̏ꍇ�ł́A���Ɂu�V�X-�g�����X�ِ���(cis-trans isomer)�v�ƌĂ�܂��B�����̗��ِ̈��̂́A��d�����̎��܂��̉�]����������Ă��邽�߂ɗ��̔z�u���قȂ�A�Ώ̖ʂ�Ώ̐S�����݂��邽�߂ɃA�L�����ł��B
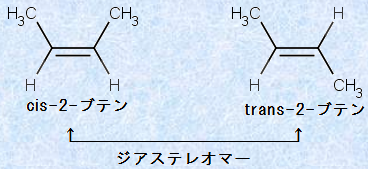
�}.18 2-�u�e���̗��ِ̈���
�ِ��̂̂����A����̌��q�A�܂��͌��q�c���������ɂ�����̂��u�V�X�`(cis)�v�A���Α��ɂ�����̂��u�g�����X�`(trans)�v�Ƃ����܂��B�ِ��̂̓W�A�X�e���I�}�[�Ȃ̂ŁA���ِ̈��̓��m�̕����I�A����щ��w�I�Ȑ����́A���ꂼ��قȂ������̂ɂȂ�܂��B
(6) �s�O�a�x
�@����O�a�ŁA�Y�fC�E���fH�E���fN�E�_�fO����Ȃ�L�@�������ɂ��čl���Ă݂܂��B�Y�fC��n�A���fN��x�A�_�fO��y���Ƃ���ƁAH-H���o�����āA���̂悤�ɑg�ݗ��Ă邱�Ƃ��ł��܂��B
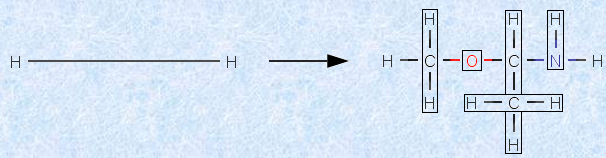
�}.19 ����O�a�ŁA�Y�fC�E���fH�E���fN�E�_�fO����Ȃ�L�@������
�܂�A���̗L�@�������́AH2�{(CH2)n�{(NH)x�{(O)y�ł���ƍl������̂ŁA���q����CnH2n+2+xNxOy�ƕ\�����Ƃ��ł��܂��B���������āAC��n�AN��x�AO��y�������L�@�������̐��f���q����2n+2+x�Ȃ�A���̕��q�͍���ŖO�a�ł���Ƃ����܂��B
����ŁA���q���ɁA���d�������\��������ꍇ�͂ǂ��ł��傤���H���ׂĂ̗L�@�������ɂ́A���f���q����2����ƁA�s�O�a��������\����1������Ƃ����@��������܂��B
�}.20 ���d������i�̌`���Ɛ��f���q���̊W
�@�����ŁA����O�a�̏ꍇ�Ɛ��f���q�����ׂ邱�ƂŁA���d�������\���̐���\�z���邱�Ƃ��ł���̂ł��B����́A�L�@���w�̍\������̖����l����Ƃ��ɁA���ɖ��ɗ����܂��B��ʓI���������̐��Ɗ�\���̐��̘a���u�s�O�a�x(degree of unsaturation)�v�Ƃ����܂��B�s�O�a�x�́A�Y�fC�E���fH�E���fN�E�_�fO�E�n���Q��X����Ȃ�L�@�������̏ꍇ�ł́A���̂悤�ɂȂ�܂��B
![]()
���̎��ŁAC�͒Y�f���q�̐��AH�͐��f���q�̐��AX�̓n���Q�����q�̐��AN�͒��f���q�̐���\���܂��B�_�fO�◰��S�̂悤�ȑ�16�����f�̌��q���́A�ʏ�J�E���g���܂���B�n���Q�����q(F, Cl, Br, I)�́A���f���qH�Ɠ��������q����1�Ȃ̂ŁA���f���qH�Ɠ��������ɂȂ�܂��B
���̂悤�ɂ��ĎZ�o�����s�O�a�x��p���邱�Ƃɂ��A���q�������������̐��Ɗ�\���̐���������̂ł��B�\������̖��ŁA�ŏ��ɕ��q�����^����ꂽ�Ƃ��́A�܂��͈�x�A�s�O�a�x���v�Z���Ă݂邱�Ƃ������߂��܂��B
�}.21 �l�X�ȗL�@�������ƕs�O�a�x(U)
(7) �L�@�������̕���
�@����̗n�}�ɑ���n��x�̍��𗘗p���āA�������̂����A���̗n�}�ɂ悭�n������̂�n�����ĕ���������@���u���o(extraction)�v�Ƃ����܂��B�L�@�������𒊏o�ɂ���ĕ�������ɂ́A�����荇��Ȃ�2�̗n�}�Ƃ��āA���ƃW�G�`���G�[�e���𗘗p���邱�Ƃ������ł��B����́A�W�G�`���G�[�e���͈����ő����̗L�@�����悭�n�����A���������傫�����ߒቷ�ŏ����ł��邩��ł��B���̍ہA2�̗n�}�t�낤�Ƃɓ���A�L�@�����������܂��B
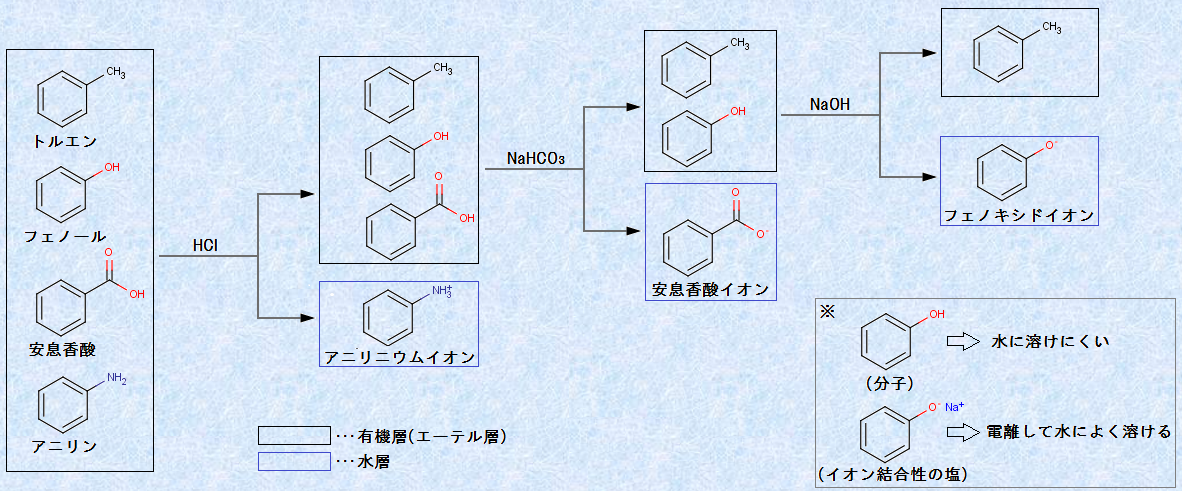
�}.22 �L�@�������̕���
����͌��ǁA�_������𗘗p���������ɂȂ�܂��B�����̗L�@�������́A���̂܂܂ł͑a�����ŁA���ɗn���ɂ����ł��B�����ŁA�_������ŁA�C�I���������̉��ɂ��邱�Ƃɂ���āA�L�@�������͐e�����ƂȂ�A���ɗn���₷���Ȃ�̂ł��B
�}.23 �L�@�������̎_�����
�@�������A�����Œ��ӂ��Ȃ���Ȃ�Ȃ����Ƃ́A�������_�ƃt�F�m�[���̕����ł��B�������_�ƃt�F�m�[���́A�ǂ�����_���������������ł����A�t�F�m�[���́A�Y�_���f�i�g���E��NaHCO3�Ő��n���̉��ɂ��邱�Ƃ��ł��܂���B���̗��R�́A�t�F�m�[���ƒY�_���f�C�I��HCO3- �̔����ŁA�������镨������_���Y�fCO2������ł��B��_���Y�fCO2�́A���ɗn����ƒY�_H2CO3�ƂȂ�A�Y�_H2CO3�ƃt�F�m�[���̎_���x�́A�Y�_(pKa��6.4)���t�F�m�[��(pKa��10)�ł��B���������āA�t�F�m�[���ƒY�_���f�C�I��HCO3- ���������Ă��A�������Ă���Y�_H2CO3�ɂ���Ĕ����������߂���Ă��܂��A���ǂ̂Ƃ���A�t�F�m�[���ƒY�_���f�C�I��HCO3- �͂قƂ�ǔ������邱�Ƃ��ł��Ȃ��̂ł��B
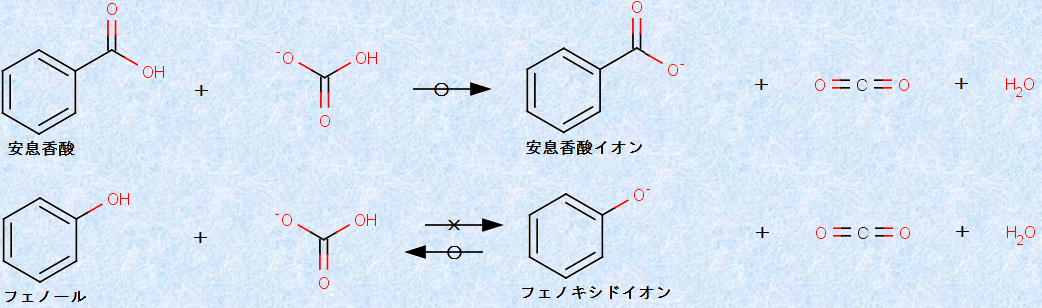
�}.24 �������_�ƃt�F�m�[���̎_�����
�@�ʏ�A�L�@�n�}�͐��������x���������A��w�ɕ����ꂽ�Ƃ��ɁA��w�ɂ���̂��L�@�w�ł���A���w�ɂ���̂����w�ł��B�Ⴆ�A�W�G�`���G�[�e���̖��x��0.71 g/cm3�A�w�L�T����0.65 g/cm3�A�g���G����0.87 g/cm3�ł���A���������������d���������ł��B�������A�n���Q���n�n�}�ł���l�����Y�fCCl4�̖��x��1.6 g/cm3�A�N�����z����CHCl3��1.5 g/cm3�A�������`����CH2Cl2��1.3 g/cm3�ł���A���������������d���傫���̂ŁA�����̗n�}��p�����Ƃ��ɂ́A�L�@�w�����w�ɂȂ�܂��B�܂��A���ʂ̗L�@����n�������ꍇ�ɂ́A�{����w�ɗ���ׂ��L�@�w�����w�ɂȂ邱�Ƃ�����܂��B
�E�Q�l����
1) �ΐ쐳���u�V���n�̉��w(��)�v�x�䕶��(2005�N���s)
2) ꎓ���/������/�R�{����/��19���u���w��b�v�[�ъ�(2012�N���s)
3) �W���[�E�V�������c�u�V�������c���m�̉��w�͂���Ȃɖʔ����v��w�̗F��(2002�N���s)
4) ��ׁؕu�łƖ�y���ׂĂ̓ł́u��v�ɂȂ�!?�z�v�V���o�Ŏ�(2015�N���s)
5) �g�����@�[�E�m�[�g���u���ɂ���Ȑl�̎����̗��j�v���Y�t�H(2012�N���s)
6) H.�n�[�g/L.E.�N���[��/D.J.�n�[�g �����u�n�[�g��b�L�@���w�v�|����(1986�N���s)
7) ���[�g�����h�E�W���[���Y�u�W���[���Y�L�@���w(��)�v�������w���l(2000�N���s)