・脂肪族炭化水素(アルカン)
【目次】
(i) エネルギー資源として注目されているメタンハイドレート
(1) 脂肪族炭化水素とは何か?
「炭化水素(hydrocarbon)」は、人類がエネルギーとして使用する燃料の大部分を供給している石油と天然ガスの主成分であり、それは炭素と水素だけからできている有機化合物です。炭化水素は、その炭素-炭素結合の形式により、大きく3種類に分類されます。1つは「飽和炭化水素(saturated hydrocarbon)」であり、これは炭素-炭素結合だけからできています。もう1つは「不飽和炭化水素(unsaturated hydrocarbon)」であり、これには炭素-炭素多重結合、すなわち、二重結合か三重結合の一方、または両方が含まれています。最後の1つは「芳香族炭化水素(aromatic hydrocarbon)」であり、これはベンゼンC6H6と構造的に関連した特殊な環状化合物になります。次の図.1に、「炭化水素」の分類を示します。
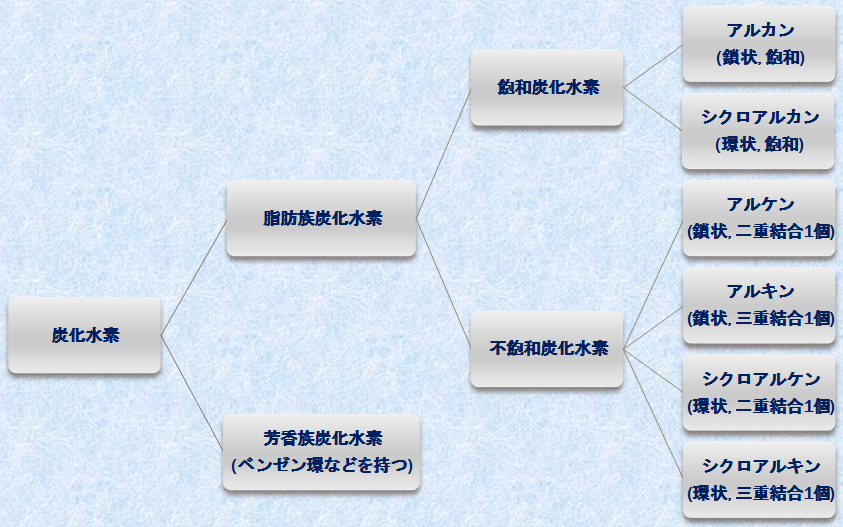
図.1 炭化水素の分類
脂肪族炭化水素とは、鎖状または環状の非芳香族性の炭化水素のことです。したがって、「脂肪族炭化水素」は、「芳香族炭化水素」の対義語ということになります。脂肪族炭化水素のうち、飽和炭化水素で鎖状構造の物質は、「アルカン(alkane)」と呼ばれます。特にアルカンの構造が環状の場合は、「シクロアルカン(cycloalkane)」といいます。また、不飽和炭化水素で二重結合を1つ持つ鎖状構造の物質は、「アルケン(alkene)」と呼ばれます。環状の場合は、「シクロアルケン(cycloalkene)」です。さらに、不飽和炭化水素で三重結合を1つ持つ鎖状構造の物質は、「アルキン(alkyne)」と呼ばれます。環状の場合は、「シクロアルキン(cycloalkyne)」です。
(2) アルカン
最も単純なアルカンは、メタンCH4です。メタンCH4の水素を別の炭素に置き換えて、炭素鎖を延長したあと、炭素の原子価に合わせて、適切な数の水素を付け加えれば、膨大な数の関連分子ができあがります。そして、すべてのアルカンは、一般式CnH2n+2(nは炭素原子数)で表わすことができます。枝分かれのない炭素鎖を持つアルカンは、「直鎖アルカン(normal alkane)」と呼ばれます。この系列の化合物は、炭素数が1個多いものと1個少ないものとでは、メチレン基(-CH2-)の数が1個異なるだけです。
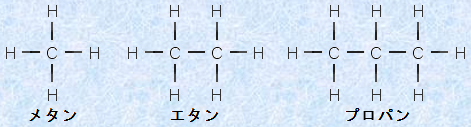
図.2 簡単な直鎖アルカンの構造式
このように、ある単位が規則的に繰り返されることにより形成される化合物は、「同族体(homologous series)」と呼ばれます。それらの化学的性質および物理的性質は、非常によく似ています。その性質は、炭素原子数の増加につれて、少しずつ変化します。アルカンは、炭素原子数が多いものほど、融点や沸点が高くなります。常温常圧では、炭素原子数nが4以下のアルカンは気体で、nが5以上のアルカンは液体、nが17以上のアルカンは固体となります。また、密度は液体のアルカンで約0.6〜0.8 g/mL、固体のアルカンで約0.8 g/cm3であり、いずれも水より軽いです。
(i) アルカンの命名法
初期の有機化学では、新しい化合物の名称は、化合物の原料や用途にちなんで名付けられるのが一般的でした。例えば、柑橘類の果皮に多く含まれる「リモネン」は、原料であるレモンから、独特の強い香りを持つ「マツタケオール」は、原料であるマツタケから、世界初の抗生物質である「ペニシリン」は、青カビの学名「ペニシリウム・ノタツム(Penicillium notatum)」から名付けられました。現在でも、複雑な構造を持った分子に、短くて簡単な名称を付ける必要がある場合に、このような命名法を用いることがあります。例えば、理論上最強の爆薬である「オクタニトロキュバン」や、ペンギンのように見える「ペンギノン」は、その形にちなんで命名されました。
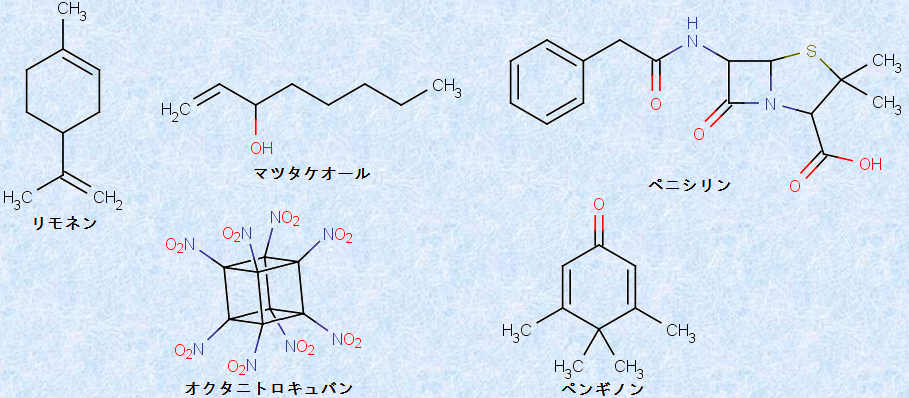
図.3 名称が原料や用途などに由来する有機化合物
しかし、慣用名や通俗名だけに頼ることはできず、化合物を系統的に命名する方法が必要なことは、かなり以前から分かっていました。理想的には、系統的な命名法は、個々の化合物に対して、単一の名称を与えるものでなければなりません。そこで、世界中の有機化学者が認めて使える命名法が考案されました。このシステムは、国際純正応用化学連合(International Union of Pure and Applied Chemistry)が推薦している「IUPACシステム」として知られています。有機化学では、化合物の名称は、主としてIUPAC名を用います。しかし、ある場合には、昔から馴染まれている慣用名が広く使われているので、それも学んでおく必要もあります。例えば、「HCHO」の構造を持つ化合物のIUPAC名は、「メタナール」です。しかし、現実には、慣用名である「ホルムアルデヒド」が、広く好んで使われます。IUPACシステムの規則として、分子の骨格を構成する原子の数や同種の官能基の数を表すには、ギリシア語の数詞を、倍数接頭辞として用います。
表.1 ギリシア語の数詞
|
1 |
モノ(mono) |
6 |
ヘキサ(hexa) |
11 |
ウンデカ(undeca) |
16 |
ヘキサデカ(hexadeca) |
|
2 |
ジ(di) |
7 |
ヘプタ(hepta) |
12 |
ドデカ(dodeca) |
17 |
ヘプタデカ(heptadeca) |
|
3 |
トリ(tri) |
8 |
オクタ(octa) |
13 |
トリデカ(trideca) |
18 |
オクタデカ(octadeca) |
|
4 |
テトラ(tetra) |
9 |
ノナ(nona) |
14 |
テトラデカ(tetradeca) |
19 |
ノナデカ(nonadeca) |
|
5 |
ペンタ(penta) |
10 |
デカ(deca) |
15 |
ペンタデカ(pentadeca) |
20 |
エイコサ(eicosa) |
非環式飽和炭化水素の一般名は、「アルカン(alkane)」です。炭素数1〜4のアルカンは、慣用名を用いますが、それ以上のものは、相当する炭素数の数詞の語尾の「a」を「ane」に換えて命名します。枝分かれ構造のないアルカンの場合は、そのまま炭素原子数に従って命名します。次の表.2に、炭素数10までの直鎖アルカンの名称と示性式を示します。
表.2 炭素数10までの直鎖アルカンの名称と示性式
|
炭素数 |
名称 |
分子式 |
示性式 |
|
1 |
メタン(methane) |
CH4 |
CH4 |
|
2 |
エタン(ethane) |
C2H6 |
CH3CH3 |
|
3 |
プロパン(propane) |
C3H8 |
CH3CH2CH3 |
|
4 |
ブタン(butane) |
C4H10 |
CH3CH2CH2CH3 |
|
5 |
ペンタン(pentane) |
C5H12 |
CH3CH2CH2CH2CH3 |
|
6 |
ヘキサン(hexane) |
C6H14 |
CH3CH2CH2CH2CH2CH3 |
|
7 |
ヘプタン(heptane) |
C7H16 |
CH3CH2CH2CH2CH2CH2CH3 |
|
8 |
オクタン(octane) |
C8H18 |
CH3CH2CH2CH2CH2CH2CH2CH3 |
|
9 |
ノナン(nonane) |
C9H20 |
CH3CH2CH2CH2CH2CH2CH2CH2CH3 |
|
10 |
デカン(decane) |
C10H22 |
CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3 |
また、アルカンから水素原子を1つ取った基は、アルカンの語尾「アン(ane)」を「イル(yl)」に変えて、「アルキル基(alkyl group)」といいます。特に炭素原子数が1〜4個のアルキル基の名称は、極めて一般的に使われるので、有機化学を学ぶ人は、必ず覚える必要があります。アルキル基を示す一般的な記号には、「R」が使用されます。したがって、「R-H」の構造は、すべてのアルカンを表します。次の表.3に、主な「アルキル基」の名称と示性式を示します。
表.3 主なアルキル基の名称と示性式
|
名称 |
示性式 |
略称記号 |
|
メチル基 |
CH3- |
Me |
|
エチル基 |
CH3CH2- |
Et |
|
プロピル基 |
CH3CH2CH2- |
Pr |
|
イソプロピル基 |
(CH3)2CH- |
iPr |
|
ブチル基 |
CH3CH2CH2CH2- |
Bu |
|
イソブチル基 |
(CH3)2CHCH2- |
iBu |
|
sec -ブチル基 |
CH3CH2(CH3)CH- |
sec -Bu |
|
tert -ブチル基 |
(CH3)3C- |
tert -Bu |
枝分かれ構造のあるアルカンの場合には、分子中の最も長い連続した炭素鎖を母体として、側鎖は置換基として命名します。側鎖の位置は、主鎖の端から番号を付けていき、主鎖上の最初の置換基の位置番号が、できるだけ小さくなるように示します。すべての置換基には、その名称とそれが付く主鎖上の炭素の番号を付けます。また、同じ置換基が2個以上主鎖上にある場合には、「ジ(di)」・「トリ(tri)」・「テトラ(tetra)」などの接頭語が使われます。
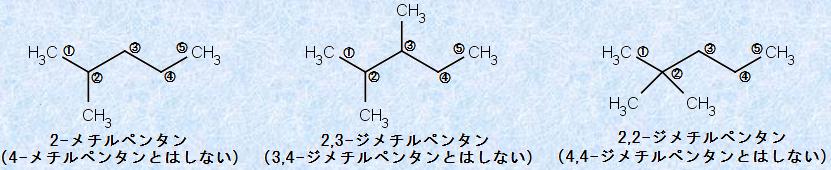
図.4 アルカンにおけるICPACシステムの適用例
アルカンにIUPACシステムを適用するときは、まず最も長い連続した炭素鎖を定めます。これにより、主鎖の炭化水素名が決まります。次に枝分かれする位置に最も近い末端から、順に番号を付けていきます。このようにすれば、どんなアルカンでも、系統的に命名できるはずです。また、環式炭化水素の場合は、相当するアルカンの名称の前に、「シクロ(cyclo)」という接頭語を付けて命名します。
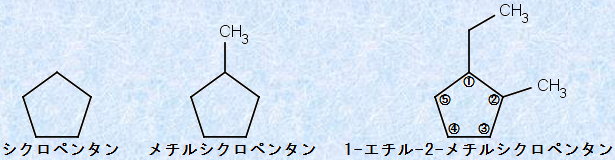
図.5 シクロアルカンにおけるICPACシステムの適用例
環状に置換基が1個だけ存在する場合は、わざわざその位置を示す番号を書く必要はありません。置換基が2個以上存在する場合は、1個目の置換基の位置から順に番号を付けていき、次に他の置換基にできるだけ小さい番号が付くようにして命名します。
(ii) アルカンの物理的性質
簡単なアルカンやシクロアルカンは、無色の気体や透明な液体、あるいは白色の固体です。メタンCH4は都市ガスの主成分であるため、多くの人々は悪臭がすると思っていますが、そんなことはありません。都市ガスの悪臭は、ガス漏れが臭いで分かるように、わざと添加した「エタンチオールC2H5SH」に由来するものであり、メタンCH4は無色無臭で、毒性もほとんどありません。ちなみに、都市ガスに添加されているエタンチオールC2H5SHは、現在ギネスブックにおいて、世界一臭い物質として認定されています。
アルカンは、分子量が大きいほどファンデルワールス力が大きくなるため、沸点や融点が高くなります。その結果、常温常圧では、直鎖状のアルカンの状態は次のようになっています。
C1〜C4:気体 C5〜C16:液体 C17〜:固体
直鎖状のアルカンでは、メチレン基(-CH2-)が1個増えるごとに、ファンデルワールス力はほぼ規則的に大きくなります。そのため、炭素鎖の長さが増すにつれて、沸点はほぼ規則的に上昇します。炭素数がn=5〜15では、メチレン基(-CH2-)が1個増えると、沸点は20〜30℃上昇します。次の図.6に、直鎖アルカンの融点と沸点を示します。
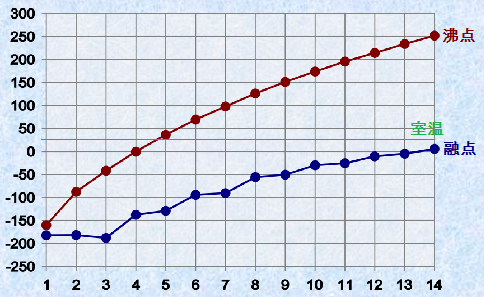
図.6 直鎖アルカンの融点と沸点
例えば、炭素数が3のプロパンC3H8の沸点は−42℃であるから、寒冷地においても気化しやすく、ボンベに詰めて燃料として用いられます。炭素数が4のブタンC4H10はライター、卓上コンロ、キャンプ用コンロのボンベなどに充填されて使われます。ただし、ブタンC4H10の沸点は0℃なので、氷点下ではこれらの器具に着火することができなくなります。炭素数が7〜9程度のアルカンは、「ガソリン」の主成分になります。ガソリンには、ブタンC4H10を溶かしてあります。ブタンC4H10は揮発性が高いので、寒冷地での着火を促進します。炭素数が9〜15程度のアルカンは、「灯油」として家庭の暖房用などに用いられます。引火点は40℃以上であり、普通の使用環境では、火事になる可能性はほとんどありません。炭素数が10〜17程度のアルカンは、「軽油」としてディーゼル燃料となります。より高沸点のものは、「重油」と呼ばれます。炭素数が20程度のアルカンは、「ロウソク」の材料として用いられます。アルカンは消化されることもないので、食品工場では機械の潤滑油として用いられます。
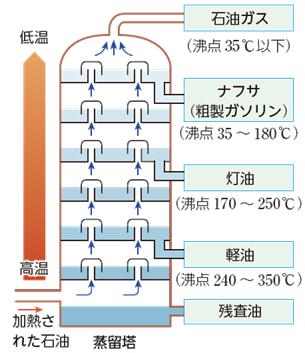
図.7 石油の分留
また、アルカンでは、C-H結合の極性が小さいため、一般的にアルカン分子の極性は小さいです。そのため、アルカンは、極性溶媒である水に溶けにくいです。アルカンと水とが溶け合わない性質は、多くの植物で巧みに利用されています。葉や果実の保護膜は、部分的にアルカンによって形成されていることが多いです。リンゴを磨いたことがある人なら、その表皮には、ワックスが含まれていることを知っているでしょう。確かにその中には、C27H56やC29H60の直鎖アルカンが存在しているのです。これら植物ワックスの主な働きは、葉や果実から水分の損失を防ぐことです。

図.8 リンゴの表皮には直鎖アルカンが含まれるため、磨くとピカピカになる
(3) アルカンの反応
アルカンの結合は、すべて単結合であり、かつ共有結合性で、非極性でもあるので、一般的にアルカンは、化学反応を起こしにくいです。アルカンは、酸や塩基、酸化剤、還元剤などとは、通常反応しません。この不活性な性質を利用して、アルカンは、抽出や再結晶、あるいは他の物質の化学反応のための溶媒として使用されます。実験室においては、ペンタンC5H12(b.p.36℃)やヘキサンC6H14(b.p.69℃)が、極性の低い有機溶媒として用いられることが多いです。しかし、アルカンは、酸素O2やハロゲンのようないくつかの反応剤とは反応するので、次にこれらの反応について説明しましょう。
(i) 酸化と燃焼
アルカンの最も重要な用途は、燃料です。過剰の酸素中で、アルカンを完全燃焼させると、多量の熱を発生させて、二酸化炭素CO2と水H2Oになります。次にエンタルピー変化を付したメタンCH4とブタンC4H10の燃焼反応の化学反応式を示します。
CH4 + 2O2 → CO2 + 2H2O(液) ΔH =−890 kJ
C4H10 + 13/2O2 → 4CO2 + 5H2O(液) ΔH =−2880 KJ
これらの燃焼反応は、天然ガスや灯油を用いて熱を得たり、ガソリンを用いて動力を得たりする基本となっています。ここでは、反応の活性化エネルギーに相当する開始段階が必要であり、通常は、火花や炎を用いて点火します。いったん反応が起これば、大きな燃焼熱のために、自発的かつ発熱的に進行します。一般的に炭素原子数が大きいほど、発熱量も大きくなります。また、炭素原子数が大きいほど、大量の酸素O2が必要になるため、空気中では完全燃焼しにくく、二酸化炭素CO2や水H2Oと同時に、一酸化炭素COやアルデヒドなどを生じやすくなります。
メタンCH4では、炭素原子の4本の結合は、すべてC-H結合です。その燃焼生成物である二酸化炭素CO2では、4本の結合はすべてC-O結合です。つまり、燃焼は酸化反応であり、C-H結合がC-O結合に変換されていきます。メタンCH4では、炭素Cの酸化数は-IVであり、炭素Cは最も還元された形をしています。一方で、二酸化炭素CO2では、炭素Cの酸化数が+IVであり、炭素Cは最も酸化された形をしています。
アルカンが不完全燃焼をすると、炭素Cはその中間状態の酸化数を取るようになります。そこでは、C-H結合の何本かが、C-O結合に変換されているのです。次にメタンCH4が不完全燃焼したときの化学反応式を示します。次に示した3つの化学反応式では、炭素Cの部分酸化が起きています。
CH4 + O2 → C + 2H2O
CH4 + O2 → HCHO + H2O
2CH4 + 3O2 → 2CO + 4H2O
(ii) ハロゲン化
アルカンは、化学反応性が低いため、安定です。そのため、アルカンと塩素ガスの混合物を低温暗所中で保存しても、何の反応も起こりません。しかし、太陽光の照射下や高温では、速やかに反応が起こって、アルカンの水素原子が1個あるいは2個以上、塩素原子に置換されます。この反応は、次の一般式で表されます。
R-H + Cl2 → R-Cl + HCl
例えば、メタンCH4と塩素ガスの混合物に光を当てると、光のエネルギーにより塩素分子Cl2が解離して、反応性の高い塩素原子Cl(不対電子を持つので「塩素ラジカル」と呼ばれている)が生成し、これが反応の糸口を作ります。塩素分子Cl2は、非共有電子対の反発があるので、適当なエネルギーを与えると、共有結合が切断されるのです。塩素ラジカルは、メタン分子と衝突すると水素原子を引き抜き、メチルラジカルを生じさせます。そして、このメチルラジカルが、塩素分子や塩素ラジカルと反応すると、メタン分子中の水素原子が塩素原子で置き換わった、クロロメタンCH3Clが生じるのです。

塩素ラジカルに1電子を奪われたメチルラジカルが、他の塩素分子から電子を引き抜くと、その塩素分子がさらにラジカル化するため、この反応は連鎖的に進行します。そして、反応はラジカル同士が反応して、共有結合を生成するまで続きます。このような反応を、「フリーラジカル連鎖反応(free-radical chain reaction)」といいます。オゾン層の破壊によって形成される「オゾンホール」も、フロンガスから生じた塩素ラジカルが、オゾン分子と連鎖反応を起こすために生じる現象です。
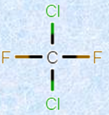
図.9 フロンガスは、冷媒や溶剤として20世紀中盤に大量に使用されたが、現在はほとんど使用されていない
もし塩素ガスが十分にあれば、反応はさらに進行して、メタン分子中の水素原子が次々と塩素原子で置き換わった、メタンの多塩化物が生じます。例えば、この反応で生成する「クロロホルム」には麻酔性があり、19世紀の頃には、麻酔薬として使われたこともありました。
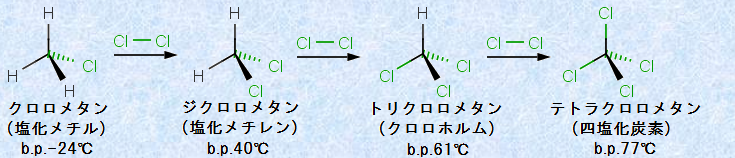
図.10 メタンCH4と塩素Cl2のフリーラジカル連鎖反応
また、メタンCH4と塩素Cl2のフリーラジカル連鎖反応において、反応条件や反応物の比を制御すると、生成物のうちの1種を、優先的に製造することができます。しかし、比較的長い炭素鎖を持つアルカンでは、生成物の組成は一般的に複雑になるので、個々の異性体を分離して、純粋な形で得ることは大変困難になります。したがって、この反応は、高分子量の特定のハロゲン化アルキルの合成方法としては、あまり有効ではありません。例えば、次の図.11で示すプロパンC3H8と塩素Cl2の反応では、生成物は「1-クロロプロパン」と「2-クロロプロパン」の混合物になります。
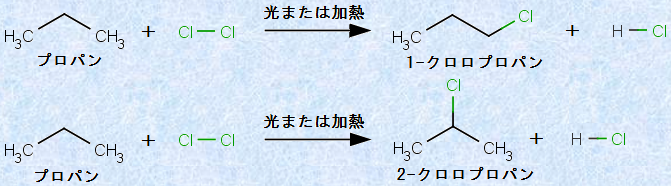
図.11 プロパンC3H8と塩素Cl2のフリーラジカル連鎖反応
メタンCH4と塩素Cl2の反応のように、分子中の原子が他の原子や官能基に置き換わる反応を、「置換反応(substitution reaction)」といいます。また、塩素化合物ができる反応を「塩素化(chlorination)」、臭素化合物ができる反応を「臭素化(bromination)」、一般的にハロゲン化物ができる反応を「ハロゲン化(halogenation)」といいます。有機塩化物やハロゲン化物には、有毒なものが多いです。
(ii-1) 麻酔薬として使われたクロロホルム
クロロホルムを麻酔薬として初めて使ったのは、スコットランドの産科医であるジェームズ・シンプソンです。当時は、出産における麻酔反対論者が、聖職者を中心にして少なからず存在していました。彼らは「出産の苦しみは神が与えたものだから、我々はその痛みに耐えなければならない」と考えていたのです。しかし、1853年にイギリスのヴィクトリア女王が、第8子のレオポルド王子をクロロホルムによる無痛分娩で出産し、「なぜ今までこのようなものを使わなかったのでしょう。至極快適でした」と感想を述べると、クロロホルムの人気は不動のものとなりました。

図.12 シンプソンは、クロロホルムによる麻酔の医学への応用を初めて行ったことで知られる
それまでの外科手術といえば、手術前にアルコール度数の高いウィスキーやブランデーを患者に大量に飲ませ、意識が朦朧としたところでやるというような殺伐としたものでした。患者の首を絞めて頸動脈を圧迫し、失神させてから手術を行ったり、もっと端的に頭を木槌で強く殴って、気を失わせてから手術を行ったりすることもあったらしいです。いずれも大きな危険を伴い、もちろん確実に眠らせることなど、できようはずもありませんでした。それ故に、患者は手足を縛られたり、あるいは屈強な男たちに身体を抑えられたり、その上に泣き叫ぶ患者の悲鳴を消すために傍らで楽隊がドンチャン騒ぎをするなど、馬鹿げたことをやりながら手術をさせられる始末でした。外科手術では簡単なことしかできず、数分を超える手術に耐えられる患者はほとんどいませんでした。
当時の最高の外科医といえば、「最も短時間で手術ができる医者」ということになります。患者の悪夢のような苦しみを最小限に抑える方法は、素早く切断することでした。19世紀の初めには、スコットランドのロバート・リストンという医者が、ユニヴァーシティー・カレッジ・ロンドンで足の切断手術を30秒以内で行い、最も手早く最も優秀な外科医と見なされていました。リストンが切断手術を行うときは、大勢の学生たちが見学に集まったほどです。手術を始めるとき、リストンは同僚に向かって「時間だ、諸君、時間を計ってくれたまえ!」などと叫んでいました。リストンの手さばきがあまりに速すぎて、誤って患者の睾丸を切り落としたり、患者の脚を押さえていたアシスタントの指を数本切り落としたりしたこともあったといいます。
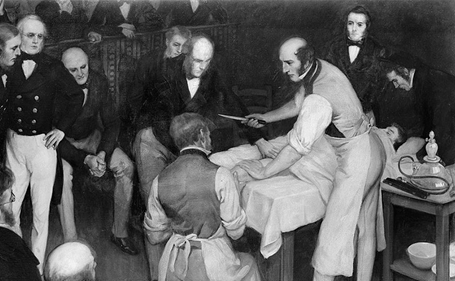
図.13 ロバート・リストンは、その外科手術の技術で有名だった
ジエチルエーテルC2H5OC2H5や笑気ガスN2Oも、この頃には麻酔薬として使われていました(アルコールおよび第15族元素(窒素族元素)を参照)。実際にリストンは、1846年にロンドンで史上初となるエーテル麻酔を使った外科手術を行っています。しかし、エーテルは手術室で引火する危険性があったし、笑気ガスは主に娯楽用ドラッグとして使われていました。こうして、常温では引火せず、麻酔導入に優れたクロロホルムの使用は、急速に広まっていったのです。
しかし、クロロホルムの麻酔の使用例が増えるにつれ、心停止による死亡事故の例が報告されるようになりました。巻き爪手術を受けた少女にクロロホルムを投与して死亡事故が起きた際、クロロホルムが死亡原因として指摘されましたが、シンプソンは自分自身で安全性は実証済みとして、指摘を退けました。しかし、調査によって、クロロホルムの適量と心臓麻痺を引き起こす致死量が、紙一重であることが分かってからは、麻酔薬として使われることはなくなりました。クロロホルムを手術で使用したときの死亡率は、エーテルと比べて4.5倍も高かったのです。エーテルや笑気ガスが次第に人気を取り戻していく中で、シンプソンは、クロロホルム支持の立場を頑なに変えませんでした。シンプソンの患者の10人に1人は、クロロホルムが原因で死亡していたと思われます。また、クロロホルムを使用した手術で死亡した患者の多くは、年齢に関係なく、まるで心臓を撃ち抜かれたかのように、ほとんどが即死していました。その犠牲者は、当時「中毒者の突然死」と表現されました。一説によると、医療目的でのクロロホルムの使用が原因で、10万人以上が死亡したともいわれています。シンプソンは、その後も新しい麻酔剤を発見するための自己実験を続け、遂には健康を損ない、1870年に59歳で死亡しました。
なお、ドラマなどでクロロホルムを嗅がせて失神させるシーンがよく登場しますが、実際にはハンカチに染み込ませたものを数口吸ったぐらいで、気を失うようなものではありません。クロロホルムを大量に染み込ませたハンカチを口に当て、ゆっくり大きく何度も深呼吸をして、5分間くらいは続けないと、通常は気絶しません。しかし、クロロホルムは毒性も強いため、死に至らしめてしまう危険も高いです。現在では、さらに安全な麻酔薬が登場しているため、医療の現場でクロロホルムが麻酔に使われることはありません。
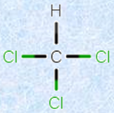
図.14 クロロホルムは、砂糖の40倍という強い甘味を持つ無色の液体である
(iii) クラッキング
高分子量のアルカンを高温でゼオライト系の固体触媒に作用させると、炭素鎖の切断や異性化などの反応が起こり、低分子量のアルカンやアルケンへ熱分解されます。この分解反応を「クラッキング(cracking)」といいます。平均的な炭素-炭素結合の結合エネルギーが345 kJ/molなのに対し、平均的な炭素-水素結合の結合エネルギーは413 kJ/molです。そのため、アルカンを触媒下で高温で反応させると、相対的に不安定な炭素-炭素結合がラジカル的に開裂して熱分解します。次の図.15に、ブタンC4H10のクラッキングの一例を示します。クラッキングは、石油工業化学において非常に重要な反応です。このとき得られるエチレンやプロペンなどの気体は、各種の有機化合物の合成原料となります。また、重油を原料にしてクラッキングすることで、低分子量のガソリンを50%程度の収率で得ることができます。
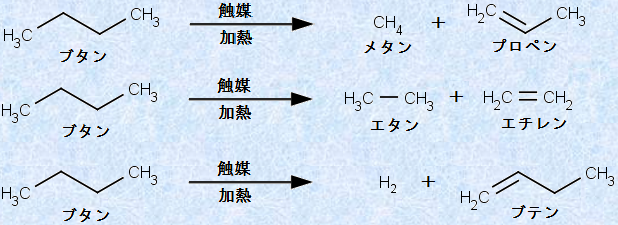
図.15 ブタンC4H10のクラッキング
クラッキングは、500℃程度の高温で原料油と触媒が接触することによって起こります。まず、高温によって軽油や重油を構成する直鎖アルカンが熱分解を起こし、ラジカル的にC-C結合やC-H結合が切断されます。こうして生成したアルキルラジカルが、数段階の反応を経て、低分子量のアルカンやアルケンへ変換されるのです。
(4) メタンの合成と利用
実験室では、メタンCH4は、酢酸ナトリウムCH3COONaと強塩基を共に加熱することで合成します。メタンCH4は、水に溶けにくいので、水上置換で捕集します。ただし、この反応では副生成物として種々のアルケンが発生するので、注意が必要です。次の図.17に、酢酸ナトリウムCH3COONaを用いたメタンCH4の合成反応を示します。

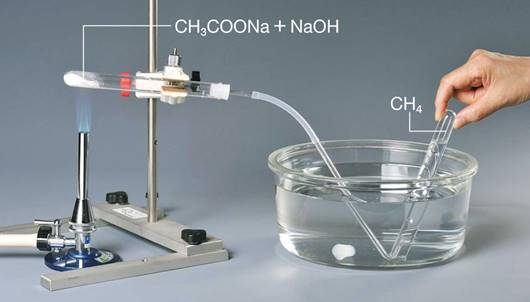
図.17 実験室でのメタンCH4の合成
メタンCH4は、池や沼などの泥が堆積した場所なら、どこでもよく発生しています。これは、嫌気性細菌の「メタノバクテリウム」や「メタノコッカス」などが、無酸素状態で有機物を還元して、メタンCH4に変えているからです。そのため、メタンCH4は和名で「沼気(しょうき)」とも呼ばれます。中国では、沼地の底の泥からメタンCH4を集めて、家事や照明用の燃料として用いているところがあります。日本の下水処理施設でも、この嫌気性細菌を積極的に利用し、有機物で汚れた下水を浄化しています。次に、嫌気性細菌の発酵によるメタンCH4の生成反応を示します。
2CH3CH2CH2COO- + 2H2O + CO2 → 4CH3COO- + 2H+ + CH4
また、メタンCH4は、ウシやヒツジのような反芻動物の消化管中でも、同様に嫌気性細菌により造られています。反芻動物が草を食べて消化できるのは、生まれ持った能力ではなく、消化管に共生している嫌気性細菌が、セルロースを分解するからです。この細菌がエネルギーを作る過程で放出するメタンガスは、強力な「温室効果ガス」でもあり、同量の二酸化炭素CO2の21〜72倍の温室効果をもたらすことで知られます。そして、メタンガスの排出量の実に16%が、「反芻動物のゲップ」によるものであるといわれているのです。世界中の反芻動物を合わせると、トラックなどの輸送業界全体よりも、だいたい50%も多く温室効果ガスを出しています。研究者の中には、カンガルーはメタンCH4を出さないので、ウシやヒツジの代わりにカンガルーを食べるべきだと主張する人もいます。もっと現実的なものであれば、カンガルーの胃に生息する消化バクテリアを、ウシやヒツジに移植しようという研究も行われています。

図.18 カンガルーの肉は、家畜の肉に比べると濃厚な風味があり、食感は柔らかいとされる
(i) エネルギー資源として注目されているメタンハイドレート
資源の乏しい日本において、電力やエネルギーをいかにして確保するかは、常に重要な課題となっています。新たなエネルギー源として注目されている物質に、「メタンハイドレート(methane hydrate:4CH4・23H2O)」があります。これは、メタンCH4を中心にして、周囲を水分子が囲んだ形になっている水和物のことです。常温常圧では、メタンCH4は気体で、水H2Oは液体です。しかし、深海のような低温かつ高圧の環境下では、水分子の作る網状構造内部の隙間にメタン分子が入り込み、氷状の結晶になることがあるのです。メタンハイドレートの生成は発熱的で、エントロピー的には不利な反応です。したがって、ル・シャトリエの法則より、低温・高圧であるほど、メタンハイドレートはよく生成する訳です。
4CH4 + 23H2O ⇄ 4CH4・23H2O
メタンハイドレートの外見は、氷やドライアイスによく似ています。しかし、これに点火すると、内部のメタンCH4が青白い光を出しながら燃焼して、水H2Oだけが残ります。それ故に、メタンハイドレートは「燃える氷」と称されます。メタンハイドレートからは、化石燃料であるメタンガスを取りだすことができ、またメタンCH4は炭素含有率が低いため、燃焼時に排出される二酸化炭素CO2の量は、石炭や石油に比べておよそ半分の量です。
メタンハイドレートは、深海の海底面下や極地方の永久凍土などに多量に存在し、その原始資源量は、天然ガスの数十倍ともいわれています。日本近海の海底面下にも、日本で使用される天然ガスの約100年分に及ぶメタンハイドレートが存在すると推測されており、将来のエネルギー資源として注目されています。もしこれが採掘できるなら、日本は世界有数の資源国になりえます。2013年には、日本で世界初の採掘実験が成功し、実用化まで手が届くところに来ています。

図.19 メタンハイドレートの燃焼の様子
しかし、海底の地層を掘り返すことで、地震などを引き起こす可能性はないのか、生態系を乱したり、環境問題を引き起こしたりしないかなどといった問題は、まだまだ未解決です。それをクリアしたとしても、経済的に引き合うようなコストで、1,000 mの海底から採掘できるのでなければ、いくら埋蔵量があっても、実際的には何の意味も成しません。現段階では、メタンハイドレートは先行きの分からない資源でしかないといえます。
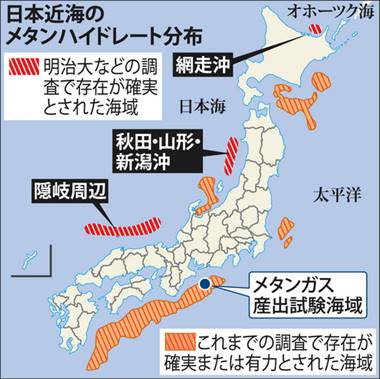
図.20 日本近海は、世界有数のメタンハイドレート埋蔵量を持つといわれている
西大西洋のフロリダ半島、プエルトリコ、バミューダ諸島を結んだ三角形の海域は、「バミューダ・トライアングル」と呼ばれ、昔から恐れられてきました。「この海域に入った船舶や飛行機が、忽然と姿を消してしまう」という行方不明事件が相次いだからです。多くの人々が、その真相に迫ろうと試みてきました。その結果、「天候の急激な変化」や「竜巻」などの他、「深海の怪物の攻撃」や「宇宙人が連れ去った」など奇想天外な説も飛び出しました。19世紀以降、100を超える船舶や飛行機、1,000以上の人が失踪していますが、SOS信号を発信することなく消息を絶ったり、その残骸がほとんど発見されないなど、「異次元へ連れ去られた」という言葉が当てはまるように、消失してしまっています。墜落や沈没した痕跡が残っていないため、「気象の急激な変化」というのも、当てはまらないといわれてきました。
そこで、船だけでなく飛行機も巻き込まれること、痕跡を残さないという点で注目されたのが、2003年にアメリカの物理学雑誌に発表された「深海に眠るメタンハイドレートが関係している」という説です。メタンハイドレートは、暖流とぶつかると融け、メタンガスが大量に発生します。大量のメタンガスによって海面が泡立てられ、そこを通る船は制御不能に陥ってしまいます。さらに、気化したメタンガスは、飛行機のエンジンに引火して、爆発を引き起こします。船舶や飛行機の残骸が発見されない理由は、メタンガスの放出で舞い上がった土砂が、残骸の上に堆積して発見されにくくなるからです。しかし、実際にメタンハイドレートが発生したことと、遭難の因果関係を証明する事案は、1件も確認されていません。結局のところ、「メタンハイドレート説」も推測の域を出ないということです。
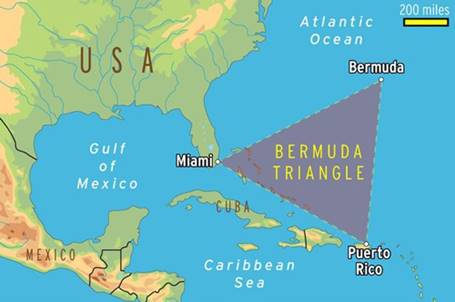
図.21 バミューダ・トライアングルでは、昔から船舶や飛行機が消えてしまうという伝説がある
(ii) ユーリー・ミラーの実験
今から40〜45億年の昔、誕生したての地球は、メタンCH4、アンモニアNH3、硫化水素H2S、水蒸気H2Oなどのガスに覆われていました。そして、このメタンCH4こそが、地球上における生命誕生の貴重な炭素起源であったという説があります。
1953年、アメリカのシカゴ大学で、面白い実験が行われました。アメリカの化学者であるハロルド・ユーリー(重水素の研究で1934年にノーベル化学賞を受賞)と当時大学院生だったスタンリー・ミラー(後のカリフォルニア大学サンディエゴ校の化学科名誉教授)は、フラスコ内をメタンCH4とアンモニアNH3と水蒸気H2Oで満たし、1週間に渡って火花放電を続けました。すると、フラスコ内の溶液は着色し、最終的には赤色っぽくなりました。そして、フラスコの底にたまった水を集め、分析しました――すると、驚くべきことに、ギ酸や酢酸、乳酸などの低級脂肪酸やある種のアルデヒドに混じって、グリシンやアラニン、セリン、アスパラギン酸、グルタミン酸などのアミノ酸が検出されたのです。この実験は、「ユーリー・ミラーの実験」と呼ばれ、多くの人々を驚かせました。こんな単純な実験で、アミノ酸が自然に作られるとは、思いもよらなかったからです。それ以降、色々な人たちが、太陽からの紫外線や雷による放電、火山の爆発による高温などに相当する様々な条件を、フラスコ内に再現させながら、同じような実験を繰り返しました。
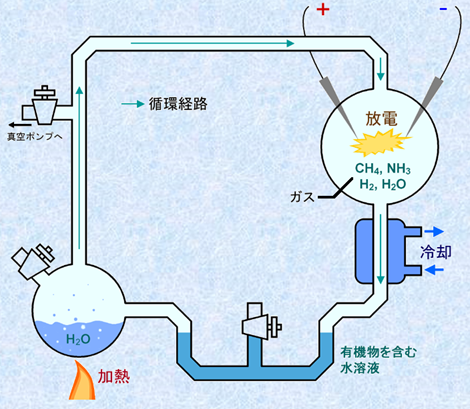
図.22 ユーリー・ミラーの実験は、原始生命の進化に関する最初の実験的検証の1つである
けれども、結果はほとんど同じでした。そして、これらの結果は、「地球上の太古の大気に含まれていたメタンCH4は、太陽からの紫外線や稲妻、火山の爆発などによって、アンモニアNH3や水素H2、水蒸気H2Oなどと反応し、初めはごく簡単な有機化合物を作り出し、それらがやがて複雑に反応しあって生命の誕生に至ったのだ」という、大胆な仮説を生み出したのです。面白いことに、有機化学が進歩し、生物を構成する重要な成分であるタンパク質の組成が分かってくると、色々な生物には、気の遠くなるほど多くの種類のタンパク質が含まれているにも関わらず、それらのタンパク質を作っているアミノ酸は、わずか20種しかないことが明らかになりました。そして、これら20種のアミノ酸のほとんどは、「ユーリー・ミラーの実験」によって作り出せることが確認されたのです。
しかしながら、生命が誕生するには、ただアミノ酸が存在するだけでは不十分です。アミノ酸同士が結合し、生命活動を担うタンパク質に成長しなければなりません。ただし、自然の中でアミノ酸同士が勝手にくっ付いて、勝手にタンパク質ができあがるということはありません。38億年前に生命が誕生したときには、アミノ酸はどうやって結合してタンパク質になったのでしょうか?
現在、生命を誕生させた「ゆりかご」として注目を集めているのが、「熱水鉱床」と呼ばれる場所です。熱水鉱床とは、文字通り海底から熱水が噴き出し、熱水に含まれる成分が冷却され沈殿することにより、鉱床になるというものです。マグマ活動が激しい場所に海水が染み込むことで、熱水が生み出されます。この熱水鉱床では、アミノ酸同士が自動的に結合することが分かっています。海底の熱水鉱床では、高温高圧のため、水は「超臨界流体」という特別な状態になっています。これにより、アミノ酸同士で脱水縮合反応が起き、アミノ酸がつながっていくのです。例えば、水深3,000 mの海底では、407℃を超えると、こうした現象が起きます。もちろん、このような高温の環境下では、生物は生きられません。しかし、温度が高いのは、熱水が噴き出てくるところだけです。熱水鉱床からほんの少し離れただけで、温度は一気に低下しています。それ故に、「熱水の中でアミノ酸が脱水縮合反応を起こしてつながり、熱水鉱床から噴き出たとたんに冷やされ、これが生命の誕生に利用された」というストーリーが考えられる訳です。
![伊豆・小笠原海域青ヶ島沖に新たな海底熱水鉱床を確認 : ニュースリリース | 独立行政法人石油天然ガス・金属鉱物資源機構[JOGMEC]](saturated-hydrocarbon.files/image025.jpg)
図.23 「熱水鉱床」で生命は誕生したと考えられている
1986年、アメリカの生化学者であるウォルター・ギルバードは、「まずアミノ酸ができ、重合してポリペプチド、さらにタンパク質が作り出され、これが触媒として働いて生命を作り出した」という「プロテインワールド仮説(protein world hypothesis)」を提唱しました。この説は、アメリカの微生物学者であるカール・ウーズが1977年に提唱した、「まずRNAが存在し、それが現生生物へと進化した」という「RNAワールド仮説(RNA world hypothesis)」に対抗する有力な仮説となっています。

図.24 ギルバートは、分子生物学の草分けの一人であり、1980年には「核酸の塩基配列の決定」の業績から、ノーベル化学賞を受賞している
40億年もの昔、地球を覆っていた太古の大気中には、酸素O2はほとんど含まれていません。ずっとあとになって生命が誕生し、初めは下等な微生物による「発酵」によって作られた二酸化炭素CO2が水中に溶け、あるいは大気中に放出されました。そして、そこで初めて二酸化炭素CO2を吸収し、光のエネルギーによって還元的に糖を作る働き、すなわち「炭酸同化」を行う生物が出現しました。やがて、豊かに繁茂し始めた緑色植物によって、「光合成」が盛んに行われるようになると、そこで放出される酸素O2によって、大気中の酸素濃度は徐々に上昇していきました。
今では、「ユーリー・ミラーの実験」によって、一種の「ポルフィリン」まで合成されることが分かっています。このポルフィリンこそ、緑色植物が炭酸同化を行うのに必要な「葉緑素(クロロフィル)」や、動物の血液中にある「血色素(ヘモグロビン)」を形作る重要な化合物に他なりません。クロロフィルの場合は中心にマグネシウムMgが、ヘモグロビンの場合は中心に鉄Feが結合しています。このような反応が、太古の地球大気中や地中で行われていたらしいということは、生命の誕生を考える上で、重要な指針を与えてくれました。
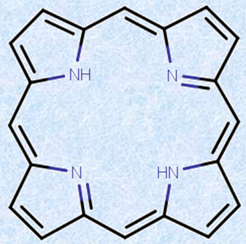
図.25 ポルフィリンの中心部には、鉄FeやマグネシウムMgをはじめとする多くの元素が配位し、錯体を形成する
・参考文献
1) 大東孝司「プラグマティック化学」河合出版(2017年発行)
2) 佐藤健太郎「世界史を変えた薬」講談社(2015年発行)
3) 佐藤健太郎「炭素文明論」新潮選書(2013年発行)
4) スティーヴン・D・レヴィット著/スティーヴン・J・ダブナー著/望月衛訳「超ヤバい経済学」東洋経済新報社(2010年発行)
5) トレヴァー・ノートン「世にも奇妙な人体実験の歴史」文藝春秋(2012年発行)
6) 日本博学倶楽部『[決定版]「科学の謎」未解決ファイル』PHP研究所(2013年発行)
7) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
8) メートランド・ジョーンズ「ジョーンズ有機化学(上)」東京化学同人(2000年発行)
9) 山崎幹夫「新化学読本―化ける、変わるを学ぶ」白日社(2005年発行)
10) 吉田たかよし『宇宙生物学で読み解く「人体」の不思議』講談社(2013年発行)
11) リディア・ケイン/ネイト・ピーダーセン「世にも危険な医療の世界史」文藝春秋(2019年発行)