・脂肪族炭化水素(アルケン)
【目次】
(1) アルケン
エチレンCH2=CH2やプロピレンCH2=CHCH3などの分子は、分子中の炭素原子間に炭素-炭素二重結合を1つ含み、他はすべて単結合です。このような鎖式炭化水素を、一般的に「アルケン(alkene)」といいます。すべてのアルケンは、一般式CnH2n(n≧2)で表されます。アルケンは「不飽和(unsaturated)である」といわれますが、この理由は、アルカンCnH2n+2に比べて、炭素数に対する水素数が少ないからです。1 molのアルケンCnH2nに1 molの水素H2を付加させると、1 molのアルカンCnH2n+2が生成します。
CH2=CH2 + H2 → CH3CH3
不飽和炭化水素の中には、二重結合を2個以上持つ化合物も存在します。2個の二重結合を持つ化合物は「アルカジエン(alkadiene)」であり、一般的には「ジエン(diene)」と呼ばれます。二重結合を3個持つ「トリエン(triene)」、二重結合を4個持つ「テトラエン(tetraene)」、そして二重結合を数多く持つ「ポリエン(polyene)」もまた存在します。
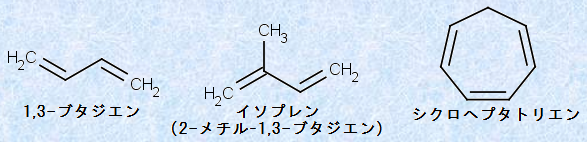
図.1 二重結合を2個以上持つ様々な化合物
(i) 二重結合の特徴
炭素-炭素二重結合には、単結合とは異なるいくつかの特徴があります。例えば、二重結合を構成する各炭素原子は、他に3個の原子としか結合しません。さらに、アルケン分子では、二重結合で結びついている炭素原子2個と、これらの炭素原子に結びついている原子4個の計6個の原子が、同一平面に固定されています。次の図.2に、エチレンCH2=CH2についてこの平面性を示します。
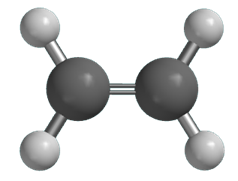
図.2 エチレンCH2=CH2の平面性
エチレンのH-C-HおよびH-C=C角は、ほぼ120°です。単結合(σ結合)のまわりの回転は自由に起こりますが、二重結合のまわりの回転は束縛されています。つまり、2個の水素と結合している炭素原子は、他方の炭素に対して、回転することはありません。さらに、炭素-炭素二重結合は、炭素-炭素単結合より短いことも特徴的です。このような単結合と二重結合の相違点を、次の表.1に示します。
表.1 炭素-炭素単結合および炭素-炭素二重結合の比較
|
|
炭素-炭素単結合 |
炭素-炭素二重結合 |
|
炭素の原子価 |
4(正四面体形) |
3(平面三方形) |
|
回転 |
比較的自由 |
束縛されている |
|
立体構造 |
多数の配座が可能 |
平面 |
|
結合角 |
109.5° |
120° |
|
結合距離 |
0.154 nm |
0.134 nm |
二重結合を構成する炭素原子が、このような性質を示すのは、炭素原子が、自身の2s・2px・2py軌道を組み合わせて、3つの新しい「sp2混成軌道」を作っているからです。次の図.3には、炭素原子がsp2混成軌道を形成する様子が示してあります。なお、混成に使われなかった2pz軌道は、未混成のまま残っています。sp2混成軌道では、単結合(σ結合)に関与する等しいエネルギー準位の軌道が3つあり、これらが他の軌道と重なり合うことで、3つのσ結合を形成します(詳細は混成軌道を参照)。
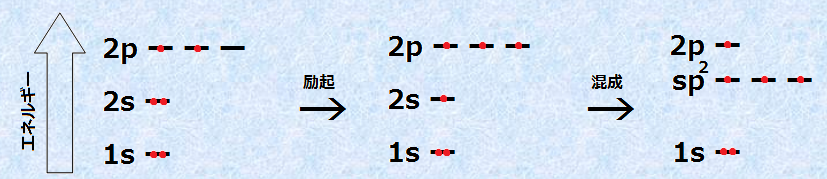
図.3 炭素のsp2混成軌道
σ結合を形成するsp2混成軌道は、各軌道間の電子の反発を最小にするため、各軌道間の角度を120°にします。これによって、各軌道は、他の軌道からできるだけ離れた位置で存在できるようになるので、sp2混成軌道は、同一平面内で正三角形の頂点に向かったような形になるのです。また、σ結合に関与していない2pz軌道の電子は、隣接する炭素の2pz軌道の側面と重なり合い、次の図.4で示すようなπ結合を形成します。
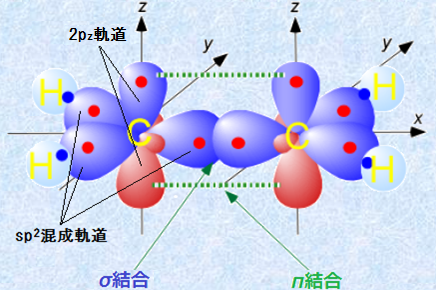
図.4 エチレンC2H4のσ結合とπ結合の形成
二重結合の2本の結合のうち1本は、sp2混成軌道が2つ直線的に重なって生じるσ結合です。2本目の結合の仕方は、これとは異なっています。すなわち、2個の炭素の2pz軌道が、ちょうど平行になるように配置されると、図.4で示すような2pz軌道の側面での重なりが起こり、π結合と呼ばれる結合を形成するのです。つまり、実際の炭素-炭素二重結合は、2本の等価な結合からできているのではなく、1本のσ結合と1本のπ結合による、別々な性質を持つ2本の結合から構成されているのです。π結合は、σ結合と比べて軌道同士の重なり合いが弱く、一般的に高エネルギーで、不安定な結合です。そのため、より弱く高エネルギーのπ結合は、より強く低エネルギーのσ結合よりも、ずっと化学反応性に富んでいます。アルケンの反応では、より弱いπ結合が、反応の場になるのです。
そして、この軌道モデルを用いると、表.1に述べた二重結合の特徴が説明できます。すなわち、二重結合の軸まわりの回転が阻害されているのは、回転が起こるためには、π結合を切断しなければならないからです。エチレンCH2=CH2を例にとると、π結合の切断には、約259 kJのエネルギーが必要であり、これは室温で獲得できるエネルギーより、はるかに大きい値です。それ故に、炭素-炭素二重結合では、結合軸まわりの回転が起こらないのです。また、二重結合が単結合よりも短い理由は、2個の共有された電子対の方が、1個の電子対よりも、2個の原子核を強く引き付けるからです。そのため、結合エネルギーも、二重結合の方がはるかに大きく、炭素-炭素単結合では約390 kJ/mol、炭素-炭素二重結合では約680 kJ/molです。
(ii) アルケンの命名法
アルケンの命名法に関するIUPACの規則は、アルカンに関する規則に似ていますが、二重結合の名称や位置を示すために、さらにいくつかの規則を追加する必要があります。まず、一般的に「アルケン(alkene)」は、相当する炭素数の数詞の語尾の「a」を「ene」に換えて命名します。2個以上の二重結合があるときは、語尾が「ジエン(diene)」や「トリエン(triene)」などのようになります。そして、二重結合を形成している炭素を含むようにして最長の炭素鎖を選び、二重結合に最も近い末端から番号を付け、その二重結合の炭素原子が最小の番号を持つようにして、命名します。
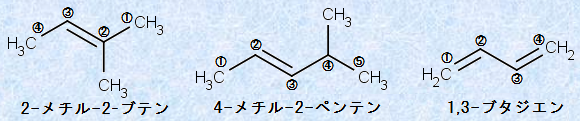
図.5 アルケンにおけるICPACシステムの適用例
なお、二重結合が両端末から等距離にあるときは、最初の枝分かれに最も近い末端から番号を付けます(図.5の2-メチル-2-ブテンを参照)。さらに、IUPACの規則以外にも、数種の慣用名を知っておく必要があります。例えば、簡単なアルケンであるC2H4やC3H6は、一般的に慣用名で、「エチレン」および「プロピレン」と呼ばれています。
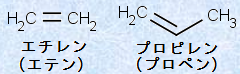
図.6 簡単なアルケンの慣用名
また、炭素-炭素二重結合を含む2種の重要な置換基に、よく知られた慣用名があります。それらは、「ビニル基(-CH=CH2)」と「アリル基(-CH2-CH=CH2)」です。次の図.7に、「ビニル基」と「アリル基」の構造式を示します。これらの置換基名は、種々の化合物の慣用名としても使われています。
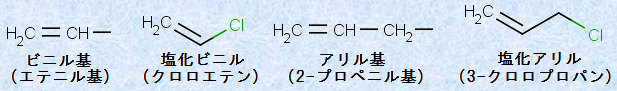
図.7 ビニル基とアリル基
(iii) アルケンの幾何異性
炭素-炭素二重結合では、二重結合の軸まわりの回転が束縛されています。そのため、炭素原子数nが4以上のアルケンでは、「幾何異性体(geometrical isomer)」と呼ばれる立体異性体が存在します。例えば、1,2-ジクロロエテンには、次の図.8で示すような2種の異なる形があります。

図.8 1,2-ジクロロエテンの幾何異性体
これらのクロロ基(-Cl)は、それぞれ「cis(ラテン語で同じ側)」や「trans(ラテン語で反対側)」と呼ばれる関係にあります。幾何異性体は、原子や置換基の空間的な配置が互いに異なるだけです。しかし、それだけで、異性体の物理的および化学的な性質は、互いに異なったものになります。
また、幾何異性体は、それぞれが独立した化合物です。常温では、二重結合まわりの回転によって、相互に変換されることはほとんど起こりません。これらの1,2-ジクロロエテンを相互変換するには、そのπ結合の切断に十分なエネルギーを供給し、引き続いて切れずに残っているσ結合のまわりに回転を起こす必要があります。これに必要なエネルギーは、光または熱によって供給できます。

図.9 幾何異性体の相互変換
(iv) アルケンの物理的性質
アルケンの物理的性質は、アルカンに類似しています。しかし、アルケンの臭いは、やや刺激性が強く、むしろ嫌な臭いがします。事実として、アルケンの古い慣用名である「オレフィン(olefin)」は「油(oil)」に由来し、その臭気を思い起こさせる名前です。次の表.2に、主なアルカンとアルケンの物理的性質を示します。
表.2 主なアルカンとアルケンの物理的性質
|
名称 |
化学式 |
融点(℃) |
沸点(℃) |
|
エタン |
CH3CH3 |
-183 |
-89 |
|
プロパン |
CH3CH2CH3 |
-187.6 |
-42.1 |
|
ブタン |
CH3CH2CH2CH3 |
-138 |
-0.5 |
|
エチレン |
CH2=CH2 |
-169 |
-103.7 |
|
プロピレン |
CH2=CHCH3 |
-185.2 |
-47.4 |
|
1-ブテン |
CH2=CHCH2CH3 |
-185 |
-6.3 |
(2) アルケンの反応
二重結合を構成しているπ結合は、σ結合よりも不安定で、反応性が高いです。そのため、アルケンは、種々の反応剤の攻撃を受けやすくなっています。アルケンで起こる一般的な反応は、「付加反応(addition reaction)」であり、次の図.10のような反応が起こります。
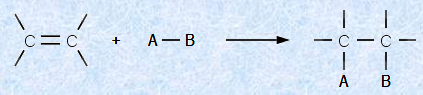
図.10 アルケンの付加反応
アルケンの付加反応では、まずアルケンの不安定なπ結合が開裂し、反応剤A-Bのσ結合も開裂します。その結果、アルケンと反応剤との間に2種の新しいσ結合が生成されます。言い換えれば、付加反応では、1本のπ結合と1本のσ結合が切断され、2本のσ結合が作られることになります。一般的にσ結合は、π結合よりも強い結合です。そのため、π結合がσ結合に変換される付加反応は、反応全体としては発熱的で、有利な反応なのです。
(i) ハロゲンの付加(ハロゲン化)
塩素Cl2や臭素Br2は、触媒なしでアルケンに付加し、「ビシナル二ハロゲン化物」を与えます。「ビシナル(vicinal)」とは、2つの隣接した炭素原子に結合した、2つの官能基を意味します。ここでは、アルカンの隣接する(1,2-)位置に、2つのハロゲンが置換していることを表します。例として、次の図.11に、アルケンに対するハロゲンの付加反応を示します。
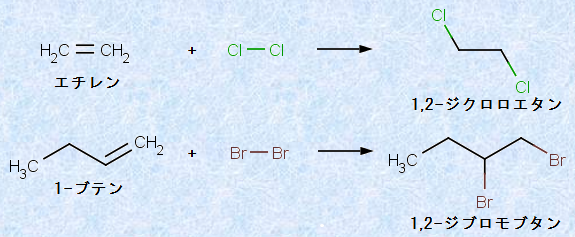
図.11 アルケンに対するハロゲンの付加反応
臭素Br2の付加反応は、赤褐色液体の脱色を伴うので、有機化合物中の不飽和結合(C=CやC≡C)を検出するための化学的試験としてよく用いられます。アルケンに対するハロゲンの付加反応を行う際には、一般的にハロゲンを四塩化炭素CCl4などの不活性溶媒に溶解し、その溶液を少しずつアルケンに滴下していきます。この付加反応は、室温でも瞬時に起こります。臭素Br2の四塩化炭素CCl4溶液は、赤褐色を呈していますが、アルケンとの反応生成物は、一般的に無色です。つまり、臭素Br2溶液をある物質に加えたときに、臭素Br2溶液の赤褐色が消失すれば、「その物質には不飽和結合が含まれている」と推測できるのです。もし検体が、アルカンなどの飽和化合物であれば、臭素Br2とはこの条件では反応しないので、色は消えません。

図.12 アルケンに臭素Br2が付加すると、赤褐色が消失する
なお、他のハロゲンの付加について補足すると、フッ素F2では、反応性が非常に高いために激しくアルケンと反応し、ビシナル二ハロゲン化物がほとんど得られません。ヨウ素I2では、アルケンに付加はしますが、平衡が反応物側に片寄っているので、もとのヨウ素I2とアルケンに戻ってしまいます。結局のところ、アルケンに効率よく付加するハロゲンは、塩素Cl2と臭素Br2のみということです。
(ii) 水素の付加(水素化)
アルケンと水素H2を室温下で混ぜても、何も起こりません。しかし、これらを金属触媒の存在下で混合すると、水素H2の付加反応が効率的に進行し、アルケンは、対応するアルカンに変換されます。この反応は、「水素化(hydrogenation)」と呼ばれています。
CH2=CH2 + H2 → CH3CH3
金属触媒は、一般的に微粉状のニッケルNiや白金Pt、パラジウムPdなどを用います。これらの金属は、表面に水素ガスを吸着し、水素分子を金属表面に固定します。すると、水素分子から水素原子への解離が起こり、解離吸着した原子は、非常に反応しやすい状態となるのです。そして、この水素原子がアルケンに付加することにより、対応するアルカンが生成します。この反応は、還元反応でもあるので、「接触還元(catalytic reduction)」とも呼ばれています。
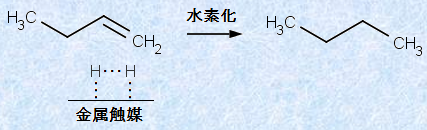
図.13 アルケンの水素化
(iii) 水の付加(水和反応)
酸触媒の存在下で、水はアルケンに付加します。水H2Oは、H-OHの結合で切断されてアルケンに付加し、生成物はアルコールになります。例として、次にエチレンC2H4と水H2Oの付加反応を示します。
CH2=CH2 + H2O → CH3CH2OH
この反応は、段階的な機構で進行し、反応の一段階目で、酸触媒が必要になります。これは、中性な水分子では、反応を開始するためのプロトンH+ を供給できるほど、酸性度が強くないからです。水和反応は、工業的にもときには実験室でも、アルケンからアルコールを合成するのに利用されています。次の図.14に、アルケンの水和反応を示します。
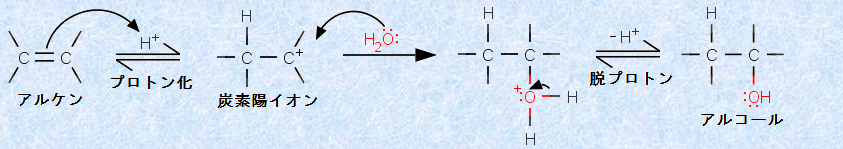
図.14 アルケンの水和反応
図.14のように、結合の開裂・形成様式を両刃型矢印で示した図を、「反応機構(reaction mechanism)」といいます。この図における両刃型矢印は、価電子対の動きを表しています。両刃型矢印は、電子の出発地点から始まり、終着地点で終わります。大学などで有機化学を本格的に学ぶ際には、この矢印表記を習得する必要があります(有機反応機構(求核置換反応と脱離反応)を参照)。
(iv) 酸の付加
水H2Oの付加と同じように、各種の酸も、アルケンに付加します。この反応では、プロトンH+ が二重結合の一方の炭素へ付加し、酸の残りの部分が、他方の炭素へ付加します。例として、次にエチレンC2H4と塩化水素HClの付加反応を示します。
CH2=CH2 + HCl → CH3CH2Cl
この反応も、段階的な機構で進行し、反応の一段階目で、プロトンH+ とアルケンが反応して、不安定な炭素陽イオンが生成します。そして、速やかに酸の残りの部分が炭素陽イオンに付加して、安定な生成物を与えます。次の図.15に、アルケンに対する酸HAの付加反応を示します。
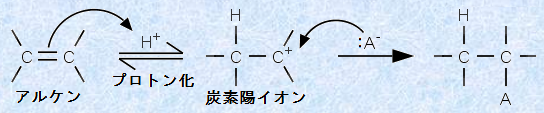
図.15 アルケンに対する酸HAの付加反応
(v) オゾン分解
アルケンは、オゾンO3に速やかに酸化されます。オゾンO3は、酸素ガスを通じながら高圧放電を行うと発生し、そのガスをアルケン溶液に低温で通じながら反応させます。このときの溶媒は、塩化メチレンCH2Cl2のような安定な物質を使います。この反応では、まずアルケンのπ結合がオゾンO3と反応して、「一次オゾニド(primary ozonide)」と呼ばれる3つの酸素を含む5員環を形成します。しかし、酸素-酸素単結合(〜170 kJ/mol)は、非常に不安定な結合であり、より安定な炭素-酸素単結合(360〜380 kJ/mol)を相対的に多く有する「オゾニド(ozonide)」に速やかに転移します。
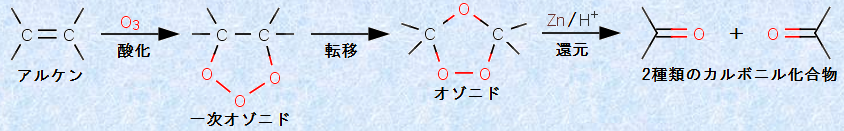
図.16 アルケンのオゾン分解
しかし、これらの生成物は、爆発性のため通常は単離されず、直ちに亜鉛Znなどの還元剤で処理されて、カルボニル化合物として単離されます。結局、この反応は、アルケンの二重結合を開裂して、2個の各炭素上に炭素-酸素二重結合(カルボニル基)を作る反応なのです。この反応全体を、「オゾン分解(ozonolysis)」といいます。オゾン分解は、二重結合の位置を決めるのによく利用されます。例えば、1-ブテンCH2=CHCH2CH3をオゾン分解すると、2種類の異なるアルデヒドが生成しますが、2-ブテンCH3CH=CHCH3からは、1種類のアルデヒドしか生成しません。
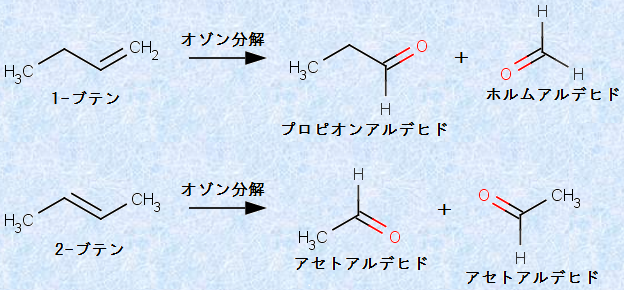
図.17 ブテンのオゾン分解
このように、何のカルボニル化合物が生成するのかを調べることによって、反応物が「どのブテン異性体であるか」が容易に分かるのです。さらに、オゾン分解の生成物の構造から逆にたどることで、未知のアルケンの構造が推定できます。オゾン分解は、有機化学の構造決定問題で頻出の反応です。
(vi) 過マンガン酸イオンによる酸化
アルケンは、過マンガン酸イオンMnO4- にも酸化されます。ただし、過マンガン酸イオンMnO4- は、液性によって酸化力が変化するので、条件によっては、得られる生成物が異なります。問題を解くときには、必ず問題文に指示があるはずなので、よく注意して下さい。
まず、アルケンを塩基性過マンガン酸カリウムKMnO4水溶液と低温で反応させると、アルケンがヒドロキシ化され、「グリコール(glycol)」が得られます。グリコールは、隣接した炭素に2つのヒドロキシ基(-OH)を持つ化合物のことであり、この反応は、グリコールの重要な合成法でもあります。そして、反応が進むにつれて、過マンガン酸イオンMnO4- の赤紫色が消えて、二酸化マンガンMnO2の黒褐色沈殿が生じることから、この反応は、アルケンの検出反応としても利用されます。
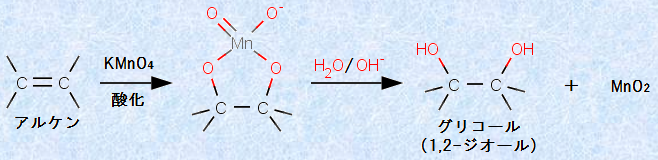
図.18 アルケンと塩基性過マンガン酸カリウムKMnO4の反応
一方で、アルケンを酸性過マンガン酸カリウムKMnO4で熱すると、中間生成物となるグリコールは開裂し、最終的には、ケトンやカルボン酸にまで酸化されます。また、元のアルケンの末端に二重結合がある場合は、水H2Oと二酸化炭素CO2にまで酸化されます。この反応も、一般的にはオゾン分解と同様に、二重結合の位置を決めるのに利用されています。
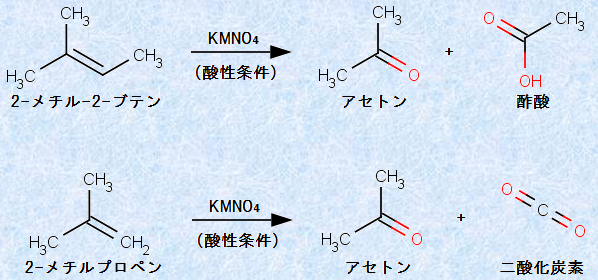
図.19 アルケンと酸性過マンガン酸カリウムKMnO4の反応
二酸化炭素CO2が発生する場合は、そのことが「敢えて問題文に書かれていない」ことがあります。アルケンと酸性過マンガン酸カリウムKMnO4に関する問題を解いていて、炭素数がどうしても合わない場合は、二酸化炭素CO2が発生して、炭素数が1減少したと考えてみてください。そこが構造決定のブレイクスルーになるかもしれません。
(3) マルコフニコフ則
左右非対称なアルケンに対して、左右非対称な反応剤が付加するとき、原理的には、2種類の生成物が生成可能です。例えば、2-メチルプロパンに塩化水素HClが付加すると、2-クロロ-2-メチルプロパンと1-クロロ-2-メチルプロパンの2種類の生成物が考えられます。しかし、このうち前者が主生成物となり、後者が副生成物となります。
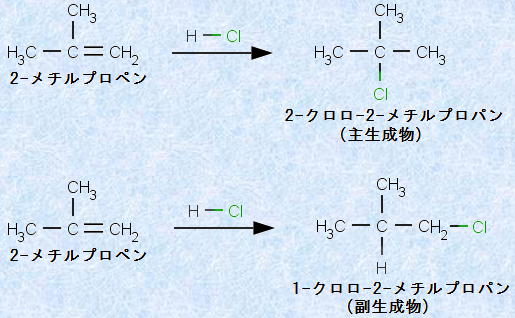
図.20 2-メチルプロパンと塩化水素HClの反応
このような現象は、昔から知られており、この種の付加反応を数多く調べた結果、ロシアの化学者であるウラジミール・マルコフニコフは、1870年に次のような法則を指摘しました。すなわち、「アルケンに対するハロゲン化水素の付加反応においては、より多置換のハロゲン化物が生成する」というのです。これは言い換えると、「より多くの水素が結合している炭素に対して、反応剤の水素が付加した生成物の方が主生成物になる」ということです。この法則は、彼の名を取って、「マルコフニコフ則(Markovnikov’s rule)」と呼ばれています。この法則は、実験より導き出された経験則ですが、現在の化学理論では、どのように説明できるでしょうか?
二重結合のπ電子は、σ電子よりも外側に広がっているため、反応剤の攻撃を受けやすい形をしています。さらに、π結合はσ結合よりも弱いため、アルケンで付加反応の主役となるのは、このπ電子です。二重結合は、電子豊富な結合なので、陽イオンなどの電子を求める反応剤に対して、π電子を供給する役割を演じることになります。このときに、アルケンのように電子豊富な反応剤を「求核剤(nucleophile)」といい、求核剤と反応する電子不足の反応剤を「求電子剤(electrophile)」といいます。有機化学では、それぞれの頭文字を取って、求核剤は「Nu」、求電子剤は「E」と略されることが多いです。
アルケンに対するハロゲン化水素の付加反応においては、炭素-炭素二重結合はπ電子を持っているので、求核剤として働きます。一方で、プロトンH+ は求電子剤であり、これがπ結合に近付くと、2個のπ電子は、プロトンH+ との間にσ結合を作るのに使われます。このσ結合の形成には、π電子を2個とも使うので、残りの炭素上には、正電荷が発生することになります。つまり、「炭素陽イオン(carbocation)」が生成するのです。次の図.21に、「炭素陽イオン」の生成反応を示します。
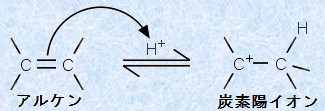
図.21 炭素陽イオンの生成反応
生成した炭素陽イオンは、極めて反応性が高いです。その理由は、陽電荷を持った炭素のまわりには、通常の炭素のように8電子ではなく、6電子しか存在していないからです。このため、炭素陽イオンは、2電子を供給してくれる求核剤と、速やかに結合します。一般的なアルケンの付加反応では、第一段階の炭素陽イオンの生成段階が、第二段階の求核剤との反応よりも、反応速度がずっと遅いです。したがって、付加反応全体の速度は、遅い第一段階の反応によって決まります。
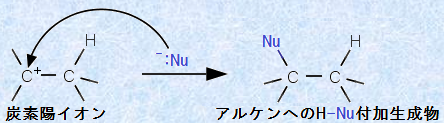
図.22 炭素陽イオンと求核剤の反応
このように、アルケンの付加反応では、炭素陽イオン中間体を経て、付加生成物を与えているのですが、マルコフニコフ則に従えば、より多置換の炭素陽イオン中間体を経て、反応が進行することになります。アルケンの付加反応では、炭素陽イオン中間体の生成段階が、全体の反応速度を決めているので、この中間体の性質を理解することは、非常に重要なことです。炭素陽イオンは、正電荷を持つ炭素上に、アルキル基がいくつ存在するかによって、「第三級(tertiary)」あるいは「第二級(secondary)」、「第一級(primary)」に分類することができます。多くの研究によって、これらの安定性は、次の図.23のようになることが分かっています(機反応機構(求核置換反応と脱離反応)を参照)。
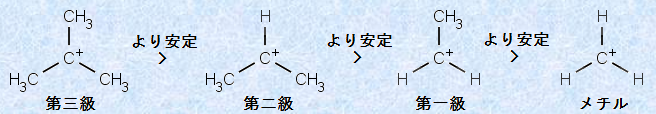
図.23 炭素陽イオンの安定性
したがって、より安定な炭素陽イオン中間体が生成する反応経路ほど、反応全体の速度が速くなるので、競合したときに、より優勢な反応になるのです。マルコフニコフ則を、現代的でより有用な表現に言い換えれば、「非対称のアルケンに非対称の反応剤が付加するとき、最も安定な炭素陽イオン中間体が生成するように反応が進行する」というようになります。実際のところ、第三級や第二級炭素陽イオンを中間体とする反応はよく起こりますが、第一級あるいはメチル陽イオンを中間体とする反応はほとんど起こりません。このように、アルケンに対する付加反応は、求電子剤が付加して、炭素陽イオンが生成する段階が、全体の反応を決めています。そのため、一般的にこの反応は、「求電子付加反応(electrophilic addition)」と呼ばれます。
(4) エチレンの合成と利用
エチレンC2H4は、最も簡単なアルケンです。かすかに甘い臭気を有する無色の気体で、有機反応剤の中で、工業生産額は第一位です。最近の日本におけるエチレンC2H4の年間生産量は、約700万トンにもなります。エチレンC2H4はどのように製造され、何に使用されているのでしょうか?たいていの炭化水素は、クラッキングにより、エチレンC2H4になります。次に、エタンCH4のクラッキングによるエチレンC2H4の生成反応を示します。
CH3CH3 → CH2=CH2 + H2
工業的に生産されるエチレンC2H4のうち、かなりの量は、ポリエチレンに変換されます。現在では、気相重合触媒の開発と流動層技術の進歩により、気相重合法がポリエチレン製造プロセスの主役となっています。その重合反応は、巨大な重合器中で行われ、触媒1 g当たり3,000 g以上のポリエチレンが得られます。触媒粒子は反応の過程で、見た目には分からないほど小さくなるので、この触媒はそのまま製品中に残しておくことができ、回収の必要がありません。生成ポリエチレン粒子は、流動層底部から連続的に抜き出され、脱ガス塔を経て、押出機によりペレット状に加工されて製品となります。
ポリエチレンは、最も単純な構造を持つ高分子化合物であり、容器や包装フィルムをはじめ、様々な用途に利用されています。生産量でいえば、全プラスチックの約1/4がポリエチレンです。その他にも、エチレンC2H4の炭素-炭素二重結合は反応性があるため、様々な工業有機反応剤の製造のための主要な原料となります。エタノールやエチレングリコール、酢酸、酢酸ビニル、塩化ビニルなどは、すべてエチレンC2H4から製造されています。
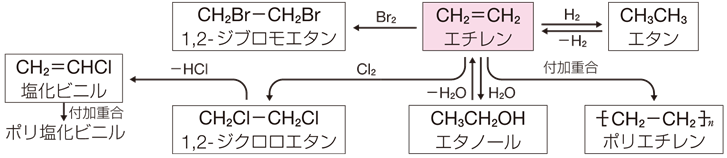
図.24 エチレンC2H4の反応
実験室では、エタノールC2H5OHの脱水反応によって得ます。触媒として少量の濃硫酸H2SO4が必要であり、温度計の先端部を液中に浸し、180℃を保つように加熱します。安全瓶は、水槽の水が逆流して、フラスコ内に入るのを防ぎます。エチレンC2H4は水に溶けにくいので、水上置換で捕集します。
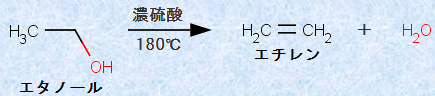
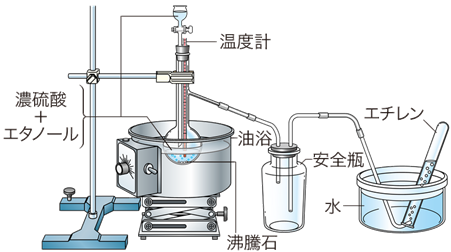
図.25 エタノールC2H5OHを用いたエチレンC2H4の合成反応
(i) 植物ホルモンとして働くエチレン
エチレンC2H4は、有機反応剤の最も重要な工業原料であるばかりでなく、農業において、決定的に重要なある種の生化学的性質を持っています。すなわち、エチレンC2H4は「植物ホルモン」であり、種子を発芽させ、花を開花させ、果実を熟し落果させ、そして葉や花弁をしぼませ、黄変させる作用を持っているのです。これは、エチレンC2H4が溶け込むことによって、細胞膜の浸透性が上がり、ある代謝過程に刺激を与えるためだと考えられています。エチレンC2H4は果実の呼吸作用を促進し、呼吸を異常増大させて、一気に果実を成熟させてしまう効果があるのです。

図.26 レモンやオレンジは、エチレンC2H4の作用によって熟成を早める
20世紀の初め、アメリカのカリフォルニア州では、レモンを未熟な緑色のうちに収穫し、石油ストーブで保温しながら成熟させていました。また、大量に収穫したオレンジを鉄道輸送するときには、寒さで凍るのを防ぐために、貨車の中で石油ストーブを焚いていました。こうすると、レモンやオレンジの果皮の色付きがとても良くなることに、当時の業者の人たちは経験的に気が付いていたのです。しかし、彼らは、これが保温のためだろうとばかり考えていました。そこで、設備を近代化し、石油ストーブをスチームヒーターや電気ヒーターに代えてみました。すると、レモンやオレンジの色付きはかえって悪くなり、大きな損害を受けました。実は、レモンやオレンジの色付きが良くなっていたのは、すべてが石油ストーブの不完全燃焼ガスに含まれるエチレンC2H4の仕業だったのです。それ以降、エチレンC2H4の応用は、実用的な技術の1つとして利用されるようになりました。
レモンやオレンジだけでなく、バナナやメロン、リンゴ、カキ、モモ、ナシ、キウイフルーツなど、多くの果実は、エチレンC2H4によって成熟します。例えば、未熟なバナナ周辺の空気をポンプで抜き、減圧状態にしてエチレンC2H4を除いてみると、バナナが黄色く成熟するのに、倍以上の時間がかかってしまうといいます。逆にバナナ室の中で石油ストーブを燃やしたりして、エチレンC2H4の量を増やしてやると、バナナの成熟はずっと早まります。つまり、果実は、自ら作り出すエチレンC2H4によって成熟するし、他から与えられたエチレンC2H4によっても成熟するのです。未熟なバナナやキウイフルーツなどは、エチレンC2H4を発生しにくいので、エチレンC2H4を発生させやすいリンゴなどと一緒にビニール袋に入れておくと、早く熟して食べ頃になります。

図.27 石油ストーブはエチレンC2H4を発生させ、果物の成熟を早める
また、植物にストレスを与えると、エチレンC2H4の発生が促進されることも分かっています。例えば、傷付いたりカビが生えたりしたミカンが、急に甘くなったりするのは、この現象の現れです。植物の若芽が何かの障害物にぶつかったときにも、多量のエチレンC2H4が放出されて、芽の茎は太く育ち、驚異的な生命力を示します。同様の効果をねらった例として、昔から経験的に行われている「麦踏み」があります。秋撒きの麦が発芽した際に、足で麦を踏みつけると、強く育つことが知られていたのです。
さらに、植物によっては、エチレンC2H4が逆に成長を妨げたりすることもあります。トウモロコシの苗を手で毎日30秒ずつ25日間ゆり動かして、ストレスを与える実験を行ったところ、この苗は、普通の半分ぐらいにしか成長しませんでした。ゆり動かすのを止めると、苗は元通り成長しました。イネやムギの幼植物も、1日に2回程度、30秒ほど手でさすり続けると、だいたい20日ほど経つうちに、成長は著しく妨げられます。
昔から、菊作りの専門家は、数本の茎の高さを揃えるのに、伸びすぎた茎を毎朝軽くなでてやるそうです。プラスチックの洗濯バサミで、軽くはさんでやることもあるといいます。茎丈が揃うまで、この世話は続きます。この行為に、科学的根拠はあるのでしょうか。1977年にベイルとミッチェルの行った実験によると、菊は茎の頂部を刺激されると、伸長が抑制されます。特に午前8時、午後4時、午後12時の実験結果では、午前8時の処理のときに、最も敏感な反応を示したといいます。つまり、日本で昔から伝えられた菊作りの秘訣は、見事に科学的根拠に裏付けられていたことになります。

図.28 菊は薬草や観賞用植物として、平安時代より栽培されていた植物である
・参考文献
1) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
2) メートランド・ジョーンズ「ジョーンズ有機化学(上)」東京化学同人(2000年発行)
3) Peter W. Atkins著/千原秀昭・稲葉章訳「分子と人間」東京化学同人(1993年発行)
4) 山崎幹夫「新化学読本-化ける、変わるを学ぶ」白日社(2005年発行)
5) 高尾賢一/只野金一 共著「有機化学の反応のしくみ」化学と教育65巻12号(2017年)
6) 伊東章「ポリエチレン―ガスからプラスチックを作る―」化学と教育66巻5号(2018年)