・脂肪族炭化水素(アルキン)
【目次】
(1) アルキン
アセチレンHC≡CHやプロピンCH3C≡CHなどの分子は、分子中の炭素原子間に炭素-炭素三重結合を1つ含み、他はすべて単結合です。このような鎖式炭化水素を、一般的に「アルキン(alkyne)」といいます。すべてのアルキンは、一般式CnH2n-2(n≧2)で表されます。アルキンは「不飽和(unsaturated)である」といわれますが、この理由は、アルカンCnH2n+2に比べて、炭素数に対する水素数が少ないからです。1 molのアルキンCnH2n-2に2 molの水素H2を付加させると、1 molのアルカンCnH2n+2が生成します。
CH≡CH + H2 → CH3CH3
アルキンでは、炭素-炭素三重結合に関与している炭素原子2個と、これらの炭素原子に結びついている原子2個は、一直線上に存在しており、最も簡単なアルキンであるアセチレン分子は、直線構造をしています。また、三重結合の距離は約0.121 nmであり、平均的な二重結合の距離(約0.134 nm)や単結合の距離(約0.154 nm)よりも、かなり短いです。これは、両炭素間に存在する三重結合の3個の共有電子対が、二重結合や単結合の共有電子対よりも、2個の炭素原子を、さらに強いクーロン力で引き付けているからです。
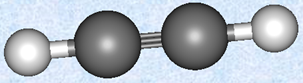
図.1 アセチレンHC≡CHの分子モデル
(i) 三重結合の特徴
アセチレンC2H2の炭素原子は、他の2個の原子と結合しているだけです。したがって、2s軌道と2p軌道1つだけを合わせて、2つの「sp混成軌道」を作ります。次の図.2には、炭素がsp混成軌道を形成する様子が示してあります。なお、混成に使われなかった残りの2p軌道は、未混成のまま残っています。sp混成軌道では、単結合(σ結合)に関与する等しいエネルギー準位の軌道が2つあり、これらが他の軌道と重なり合うことで、2つのσ結合を形成します(詳細は混成軌道を参照)。
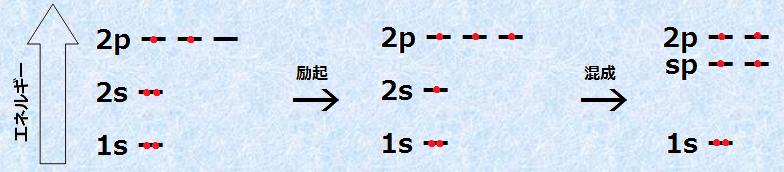
図.2 炭素のsp混成軌道
σ結合を形成するsp混成軌道は、軌道間の電子の反発を最小にするため、2つの軌道は、炭素原子を中心として逆の方向へ広がり、軌道間の角度を180°にします。これによって、2つの軌道は、他方の軌道からできるだけ離れた位置で存在できるようになります。そのために、sp混成軌道は直線構造となるのです。また、σ結合に関与していない2個の2p軌道電子は、sp混成軌道と互いに直交した位置に存在していて、隣接するsp混成炭素の2p軌道の側面と重なり合い、次の図.3で示すようなπ結合を2つ形成します。
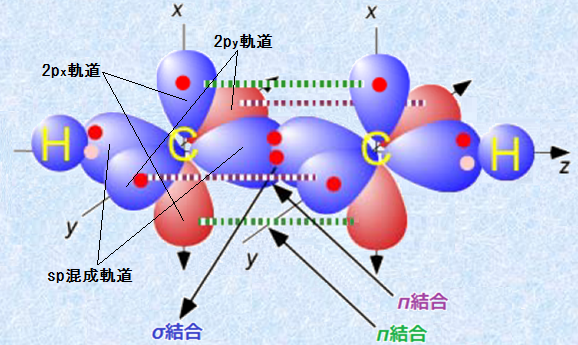
図.3 アセチレンC2H2のσ結合とπ結合の形成
三重結合の3本の結合のうち1本は、sp混成軌道が2つ直線的に重なって生じるσ結合です。2本目および3本目の結合の仕方は、これとは異なっています。すなわち、2個の炭素の2p軌道が、ちょうど平行になるように配置されると、図.3で示すような2p軌道の側面での重なりが起こり、π結合が形成されるのです。三重結合の場合、1個の炭素に2p軌道が2つあるので、π結合が2本形成されます。つまり、実際の炭素-炭素三重結合は、3本の等価な結合からできているのではなく、1本のσ結合と2本のπ結合による、別々な性質を持つ3本の結合から構成されているのです。π結合は、σ結合と比べて軌道同士の重なり合いが弱く、一般的に高エネルギーで、不安定な結合です。そのため、より弱く高エネルギーのπ結合は、より強く低エネルギーのσ結合よりも、ずっと化学反応性に富んでいます。アルキンの反応では、アルケンと同様に、より弱いπ結合が、反応の場になります。
(ii) アルキンの命名法
アルキンの命名法に関するIUPACの規則は、アルカンに関する規則に似ていますが、三重結合の名称や位置を示すために、さらにいくつかの規則を追加する必要があります。まず、一般的に「アルキン(alkyne)」は、相当する炭素数の数詞の語尾の「a」を「yne」に換えて命名します。ただし、簡単なアルキンであるCH≡CHは、一般的に「アセチレン」という慣用名を使うことが多いです。また、2個以上の三重結合があるときは、語尾を「ジイン(diyne)」や「トリイン(triyne)」などのようにして命名します。三重結合と二重結合を1個ずつ持つ物質は、「エナイン(enyne)」といいます。そして、三重結合を形成している炭素を含むようにして最長の炭素鎖を選び、三重結合に最も近い末端から番号を付け、その三重結合の炭素原子が最小の番号を持つようにして、命名します。次の図.4に、アルキンにおけるICPACシステムの適用例を示します。なお、三重結合を形成するsp混成炭素は、本来は180°の結合角を持ちますが、位置番号が分かりやすいように、あえて折れ線で示してあります。
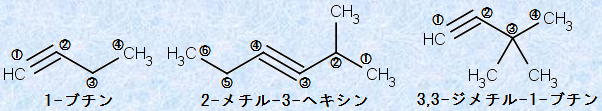
図.4 アルキンにおけるICPACシステムの適用例
三重結合が両端末から等距離にあるときは、最初の枝分かれに最も近い末端から番号を付けます(図.4の2-メチル-3-ヘキシンを参照)。また、三重結合と二重結合が末端から等距離にあるときは、二重結合が優先して、最小番号を持つようにします。次の図.5に、「エナイン」におけるIUPACシステムの適用例を示します。
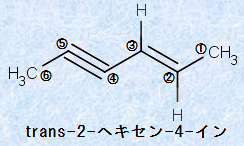
図.5 エナインにおけるICPACシステムの適用例
(iii) アルキンの物理的性質
アルキンの物理的性質は、アルカンやアルケンのそれと非常によく似ています。次の表.1に、いくつかのデータを示します。
表.1 主なアルキンの物理的性質
|
名称 |
化学式 |
融点(℃) |
沸点(℃) |
|
アセチレン |
CH≡CH |
-80.8 |
-74 |
|
プロピン |
CH≡CCH3 |
-101.5 |
-23.2 |
|
1-ブチン |
CH≡CCH2CH3 |
-125.7 |
8.1 |
|
1-ペンチン |
CH≡CCH2CH2CH3 |
-90.0 |
40.2 |
|
1-ヘキシン |
CH≡CCH2CH2CH2CH3 |
-131.9 |
71.3 |
(iv) アルキンの酸性度
塩基B- によって、炭化水素CnHmからプロトンH+ を引き抜いて、炭素陰イオンCnHm-1- を生成するのは、一般的には非常に難しいです。これを言い換えれば、「炭化水素は一般的に非常に弱い酸である」ということです。酸性度の強さは、共役塩基の安定性に依存するので、電気陰性度の小さい炭素原子に負電荷を持たせるような構造は、一般的に極めて不安定なのです。
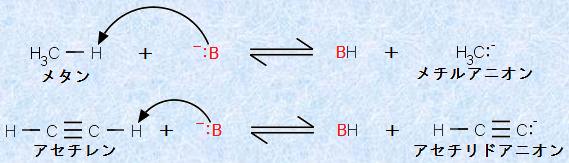
図.6 炭化水素と塩基の反応
しかしながら、末端アルキンRC≡CHの水素Hは、他の炭化水素と比べて、はるかに高い酸性度を示します。すなわち、ほとんどの炭化水素と違って、末端アルキンRC≡CHの水素Hは、塩基によってプロトンH+ として引き抜かれやすいのです。アセチレンは、アルカンより約1030倍も強い酸です。この酸塩基反応で、アルキンから、「アセチリド(acetylide)」と呼ばれる陰イオンが生成します。
RC≡CH → RC≡C- + H+
しかし、ここで注意しなければならないことは、アセチレンHC≡CHは、塩酸HClや硫酸H2SO4のような強酸ではなく、「炭化水素としては比較的強い酸である」ということです。事実として、アセチレンHC≡CHは、水H2OやエタノールCH3CH2OHよりも弱い酸なのです。次の表.2に、主な有機官能基の酸性度を示します。pKa値は酸の強さを表す指標であり、一般的に5以下のpKa値を持つ化合物は、強酸であるとみなされます。
表.2 主な有機官能基の酸性度
|
名称 |
化学式 |
pKa値 |
|
塩酸 |
HCl |
-7 |
|
硫酸 |
H2SO4 |
-3 |
|
ベンゼンスルホン酸 |
C6H5SO3H |
0〜2 |
|
酢酸 |
CH3COOH |
4.75 |
|
フェノール |
C6H5OH |
10 |
|
水 |
H2O |
15.7 |
|
エタノール |
CH3CH2OH |
15.9 |
|
アセチレン |
CH≡CH |
24 |
|
アンモニア |
NH3 |
33 |
|
エチレン |
CH2=CH2 |
44 |
|
メタン |
CH4 |
50 |
なぜ、アセチレンHC≡CHは、相対的に強い炭化水素酸なのでしょうか?その答えは、共役塩基の安定性を考えることで理解することができます。図.6の2つの共役塩基CH3- とHC≡C- について、非共有電子対の入っている軌道を考えてみましょう。
メチルアニオンCH3- の場合、この軌道はほぼsp3混成であり、約25%のs性を持ちます。一方で、アセチリドアニオンHC≡C- の場合、対応する軌道はsp混成であり、約50%のs性を持ちます。s軌道に入っている電子は、p軌道に入っている電子よりも、かなりエネルギーが低いです。したがって、軌道のs性が大きいほど、その軌道のエネルギーは低いということになります。つまり、アセチリドアニオンHC≡C- の非共有電子対は、メチルアニオンCH3- の非共有電子対より、ずっとエネルギーの低い軌道にあり、より安定であるということになります。したがって、プロトンH+ を引き抜いて、アセチリドアニオンHC≡C- を生成させるのは、比較的容易なのです。
「炭素陰イオンの安定性は混成が重要である」という仮説が正しいのならば、アルケンは、アルカンとアルキンの中間の酸性度を持つはずです。まさにその通りであって、アルケンは、アルカンより1010〜1012倍ほど酸性度が強く、アルキンより1018〜1020倍ほど酸性度が弱いです。
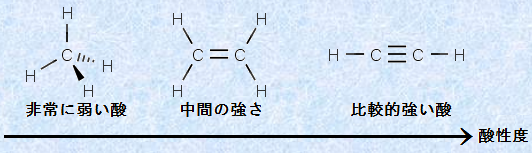
図.7 炭化水素の酸性度
(2) アルキンの反応
脂肪族炭化水素(アルケン)では、炭素-炭素二重結合に対する、種々の反応剤の付加反応について説明しました。アルキンは2つのπ結合を持っており、アルキンでも、アルケン同様の付加反応が起こります。アルケンへの付加反応について学んだことを思い出せば、アルキンへの付加反応についても、理解することは容易です。しかし、アルキンには2つのπ結合があるために、その反応機構は、複雑さが若干増します。例えば、アルキンでは、次の図.8のような反応が一般的に起こります。
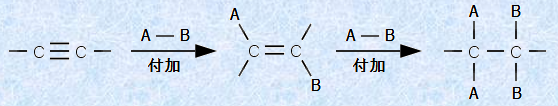
図.8 アルキンへの付加反応
アルキンの付加反応では、アルケンの付加反応と同様に、まず不安定なπ結合が開裂し、続いて、反応剤との間に新しいσ結合が生成されます。しかし、アルキンには2つのπ結合があるために、このような付加反応が2回起こるのです。
(i) ハロゲンの付加(ハロゲン化)
アルキンへのハロゲンの付加は、アルケンへの付加とよく似ています。アルキンは、臭素Br2や塩素Cl2の付加により、「ビシナル(1,2-)二ハロゲン化物」を与えます。ただし、この反応は、一般的に「トランス付加」であり、2つのハロゲノ基が、互いにトランスとなる生成物が優先的に得られます。そして、反応条件によっては、続いて2度目の付加が起こって、「四ハロゲン化物」を与えることもありえます。次の図.9に、アルキンに対するハロゲンの付加反応を示します。
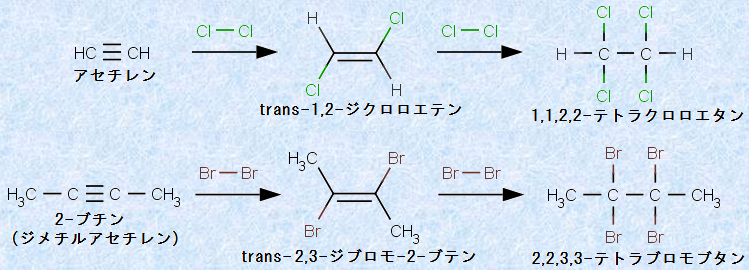
図.9 アルキンに対するハロゲンの付加反応
(ii) 水素の付加(水素化)
アルケンと同様に、アルキンも種々の触媒存在下において、水素化することができます。アルキンを水素化すると、最初にアルケンが生成してきますが、この条件では、さらに水素化が起きて、アルカンを与えます。次の図.10に、アルキンの水素化を示します。
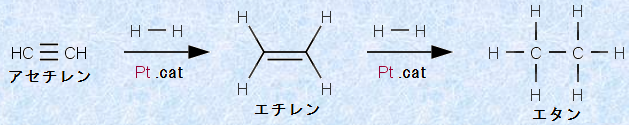
図.10 アルキンの水素化
アルキンの水素化は、アルカンまで一気に進んでしまうため、通常中間に生成するアルケンは、単離することができません。しかし、反応をアルケンの段階で停止することができれば、これは極めて有用なアルケン合成法となります。そのために、触媒作用を意図的に弱化させた(これを「被毒(poisoning)」といいます)、特殊な触媒が開発されています。最もよく用いられているのは、「リンドラー触媒(Lindlar's catalyst)」と呼ばれる、パラジウムPdを酢酸鉛(CH3COO)2Pbで部分的に被毒させた特殊なパラジウム触媒です。リンドラー触媒を用いて、アルキンの水素化を行うと、水素H2が1 molだけ付加するように反応を制御することができます。
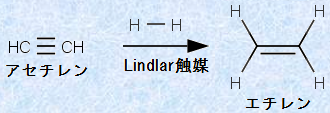
図.11 リンドラー触媒を用いたアルキンの水素化
(iii) 水の付加(水和反応)
アルケンと同様に、アルキンも水和することができます。ただし、アルキンの水和反応においては、酸触媒だけでなく、水銀(II)イオンHg2+ も必要になります。水銀(II)イオンHg2+ は、アルキンの三重結合と結合して水への溶解度を高め、付加反応に対するアルキンの反応活性を高めます。この反応は、アルケンの場合と似ていますが、最初の生成物である「エノール(enol)」は、直ちに異性化して「カルボニル化合物(carbonyl compound)」となります。次の図.12に、アセチレンC2H2の水和反応を示します。しかしながら、この反応で使われた水銀(II)イオンHg2+ が無処理で捨てられ、「水俣病」の悲劇を引き起こしたため、この方法は、現在では日本で全く行われていません。
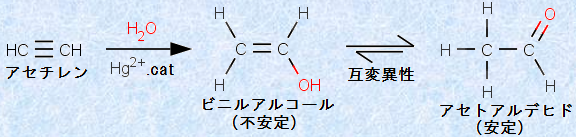
図.12 アセチレンC2H2の水和反応
アセチレンの水和反応の場合、最初の生成物である「ビニルアルコール」は不安定であるため、直ちに安定な「アセトアルデヒド」に異性化します。この異性化反応は、一般的に「ケト-エノール互変異性(keto-enol tautomerism)」と呼ばれ、炭素-酸素二重結合に隣接する炭素上に水素を有する「ケトン」および「アルデヒド」のほとんどすべては、その異性体である「エノール」との平衡状態にあります。どの程度のエノールが平衡として存在しているかは、その分子の構造に依存していますが、常にある程度の割合のエノールが存在しています。単純な化合物では、結合エネルギーの関係から、一般的に「ケト形」の方が圧倒的に有利です(有機反応機構(カルボニル化合物におけるα位の反応)を参照)。例えば、ビニルアルコールとアセトアルデヒドの平衡の場合、平衡定数は106程度であり、1 tのアセトアルデヒド中にわずか1 gのビニルアルコールが含まれる程度です。
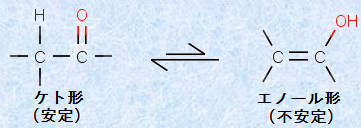
図.13 ケト-エノール互変異性
(iv) 酸の付加
アルケンと同様に、アルキンも種々の酸の付加を受けます。例えば、左右非対称なアルキンと酸との付加反応では、次の図.14に示すように、反応の各段階が「マルコフニコフ則」に従って進行します。したがって、最終的に与える付加生成物は、「ビシナル二ハロゲン化物」ではなく、「ジェミナル二ハロゲン化物」となります。ここで、「ビシナル(vicinal)」は「1,2-二置換」を意味し、「ジェミナル(geminal)」は「1,1-二置換」を意味します。アルキンに対する酸の付加反応では、このように最終生成物は、必ずジェミナル二ハロゲン化物を与えるようにして起こるのです。
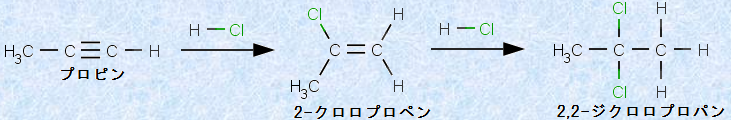
図.14 プロピンCH3C≡CHと塩化水素HClの付加反応
また、アセチレンC2H2に酸を付加させた生成物は、「ビニル化合物(vinyl compound)」と呼ばれます。例えば、アセチレンC2H2に酢酸CH3COOHやシアン化水素HCNを付加させると、「酢酸ビニル」や「アクリロニトリル」などのビニル化合物が得られます。これらのビニル化合物は、工業的に重要なものが多いです。
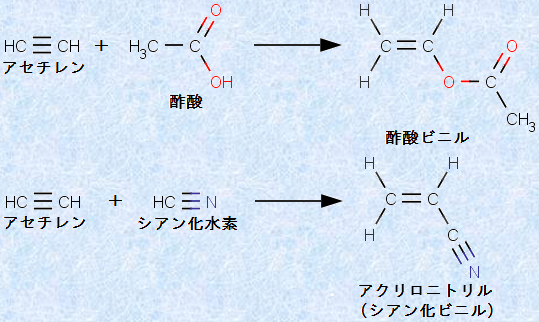
図.15 ビニル化合物の合成
酢酸ビニルを付加重合させると、合成高分子化合物の「ポリ酢酸ビニル」になります。ポリ酢酸ビニルは、合成繊維であるビニロンの原料になる他(合成高分子化合物を参照)、チューイングガムの原料にもなります。チューイングガムは、ポリ酢酸ビニルをベースとし、シロップや糖類、香料などを加えて、練って作ります。ポリ酢酸ビニルは、「ガラス転移点」が室温と人体の体温との間にあるので、噛むうちに軟らかくなるのです。高分子化合物は、油脂類に溶けやすいですから、油脂を含むチョコレートなどと一緒にガムを食べると、ガム中のポリ酢酸ビニルが溶けてしまいます。この現象は、脂の乗った大トロでも起こるといいますから、興味のある人は、ぜひ実験してみてはいかがでしょうか。
また、アクリロニトリルを付加重合させると、合成高分子化合物の「ポリアクリロニトリル」になります。ポリアクリロニトリルは、アクリロニトリル系合成繊維として知られ、柔軟で軽く、肌触りも羊毛に近いので、衣料や毛布、敷物、カーテンなどに用いられています。
(v) 重合反応
アセチレンC2H2は、「付加重合(addition polymerization)」をすることができ、2分子のアセチレンC2H2が重合すると、「ビニルアセチレンCH2=CH≡CH」になります。ビニルアセチレンCH2=CH≡CHは、合成ゴムの原料として利用されます。また、3分子のアセチレンC2H2が重合すると、「ベンゼンC6H6」になります。ベンゼンC6H6を得る場合、約500℃の赤熱した鉄管または石英管に、アセチレンガスを通す方法がよく使われます。そして、さらに重合を進めて得られる重合体が、「ポリアセチレン(CH=CH)n」です。ポリアセチレンにハロゲンを少量加えると、電気伝導性を示すようになります。「導電性ポリアセチレン」を発見した白川英樹は、2000年にノーベル化学賞を受賞しました(生活と高分子化合物を参照)。
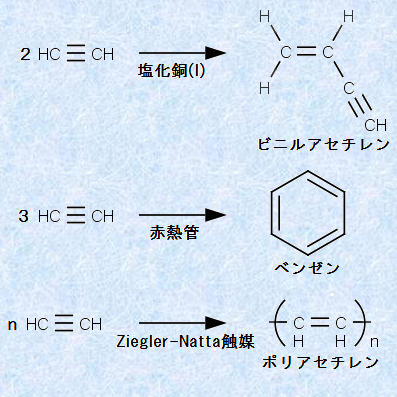
図.16 アセチレンC2H2の重合反応
(vi) 酸塩基反応
炭素-炭素三重結合に結合した水素は、他の炭化水素と比べて強い酸性を示すので、適切な強塩基によって、容易に引き抜かれます。例えば、アンモニアNH3は、アセチレンHC≡CHをアセチリドアニオンHC≡C- に変換します。次の図.17に、アセチレンHC≡CHとアンモニアNH3の酸塩基反応を示します。
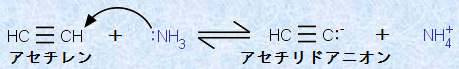
図.17 アセチレンC2H2とアンモニアNH3の酸塩基反応
そして、アンモニア性硝酸銀AgNO3水溶液にアセチレンガスを吹き込むと、アセチレンHC≡CHから放出された水素イオンH+と銀(I)イオンAg+が置換され、「銀アセチリドAgC≡CAg」の白色沈殿ができます。また、アセチレンガスをアンモニア性塩化銅(I) CuCl水溶液に作用させても、「銅(I)アセチリドCuC≡CCu」の赤色沈殿が生じます。この反応は、エチニル基(HC≡C-)の検出によく利用されます。重金属のアセチリドは、乾燥状態では激しい爆発性があるので、取り扱いには注意が必要です。
H-C≡C-H + 2Ag+ + 2NH3 → AgC≡CAg↓(白) + 2NH4+
H-C≡C-H + 2Cu+ + 2NH3 → CuC≡CCu↓(赤) + 2NH4+
(3) アセチレンの合成と利用
アセチレンC2H2は、最も簡単なアルキンであり、無色無臭の気体です。アルキンの中では、アセチレンC2H2は、工業的に最も有用な化合物です。アセチレンC2H2からエチレンC2H4の他、酢酸ビニルCH2=CHOCOCH3、塩化ビニルCH2=CHClなどが製造されます。
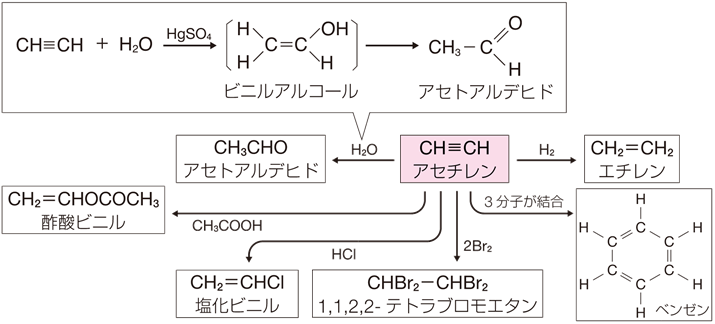
図.18 アセチレンC2H2の反応
実験室的には、アセチレンC2H2は「カーバイド法(calcium carbide method)」によって合成されます。これは、カルシウムカーバイド(炭化カルシウム)CaC2を加水分解する方法です。反応機構としては、先の酸塩基反応の逆反応と考えられます。表.2より、アセチレンC2H2は、水H2Oよりも酸性度が弱かったことを思い出して下さい。つまり、アセチリドアニオンHC≡C- は、水酸化物イオンOH- よりも塩基性が強いため、容易に水H2OからプロトンH+ を引き抜くことができるのです。
CaC2 + H2O → H-C≡C-H↑ + Ca(OH)2
(-C≡C- + 2H2O → H-C≡C-H + 2OH-)
実験室でアセチレンC2H2を発生させるときは、カルシウムカーバイドCaC2を細かい穴を空けたアルミホイルで包んで、水H2Oを入れた水槽に浸します。純粋なアセチレンC2H2は無臭ですが、通常はカルシウムカーバイドCaC2中の不純物が水H2Oと反応して、ホスフィンPH3や硫化水素H2Sなどを発生させるため、特有の不快臭があります。

図.19 アセチレンC2H2の製法
さらに、アセチレンC2H2は不安定で分解しやすい気体であり、燃焼するときに多量の燃焼熱を発生するので、バーナーの燃料として用いられます。アセチレンC2H2に十分な酸素O2を供給しながら完全燃焼させた炎は、「酸素アセチレン炎(oxyacetylene flame)」と呼ばれ、最高温度が約3,000℃に達するので、金属の溶接や切断に用いられます。アセチレンC2H2を燃焼させた際の発熱量が大きいのは、燃焼熱+1,309 kJ/molに分解熱+226 kJ/molが加わることと、燃焼生成物の熱容量が小さいことが原因とされています。
C2H2 + 5/2O2 → 2CO2 + H2O(液) ΔH =−1,309 kJ
C2H2 → 2C(黒鉛) + H2 ΔH =−226 kJ

図.20 溶接で用いられる酸素アセチレン炎
・参考文献
1) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
2) メートランド・ジョーンズ「ジョーンズ有機化学(上)」東京化学同人(2000年発行)
3) 卜部吉庸「化学の新研究」三省堂(2013年発行)
4) 船山信次「こわくない有機化合物超入門」技術評論社(2014年発行)