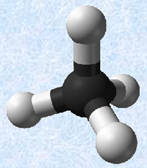
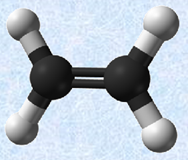
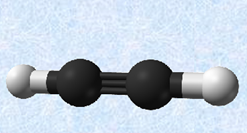
・混成軌道
【目次】
(1) 原子価と構造式
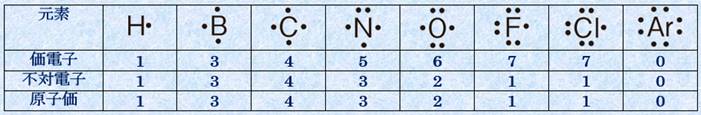
分子の中で、ある元素の原子が形成しうる共有結合の数を、その元素の「原子価(valence)」といいます。例えば、水素Hの原子価は1価なので、水素Hと化合する元素の原子価は、その原子と結合している水素原子の数と同じになります。例えば、炭素Cは水素Hと化合してCH4という分子を作るので、炭素Cの原子価は4価になります。通常、原子価は「その原子の原子価殻を満たすのに必要な電子の数」に等しいです。次の表.1に、代表的な元素の原子価を示します。
表.1 代表的な元素の原子価
原子価は、価電子の数とは異なることに注意してください。価電子は、化学結合や物性に深く関わる電子のことです。典型元素では、価電子は最外殻電子の数と等しいです(貴ガスは除く)。したがって、価電子の定義からは、まるで価電子の数だけ共有結合を作りそうなのですが、現実にはそのようなことはなく、価電子の中の不対電子のみが共有結合に参加します。ただし、非共有電子対を相手の原子の空軌道に提供して、新たな共有結合(配位結合)を形成する場合もあるので、この場合は、原子価よりも多くの共有結合を形成することができます(化学結合を参照)。また、表.1に示した原子価は、結合が二重結合や三重結合のような不飽和結合であっても適用されます。例として、次の図.1に簡単な分子の構造式を示します。不飽和結合があっても、炭素Cは4本の共有結合を形成していることが分かると思います。
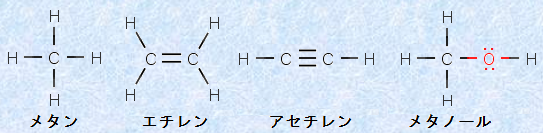
図.1 簡単な分子の構造式
構造式を書く際に、原子間の共有結合を示すために用いる線を「価標(bond)」といいます。価標は共有電子対を表しており、1本1本の価標は、それぞれ2個の電子で構成されています。構造式を書く際は、1つの原子の周囲に非共有電子対と価標(共有電子対)を合わせて、8個の電子が存在するようにします。これは、原子の最外殻電子が8個であると、多くの化合物やイオンが安定化するためです。このような経験則を「オクテット則(octet rule)」といいます。オクテット則は、ホウ素BやリンPを含む無機化合物を中心にいくつか例外が存在しますが、ほとんどの有機化合物に適用できるという点で、非常に便利な規則です。このオクテット則に従えば、配位結合を含む複雑な化合物の構造式も、簡単に書くことができるのです。次の図.2に、様々な化合物の構造式を示します。
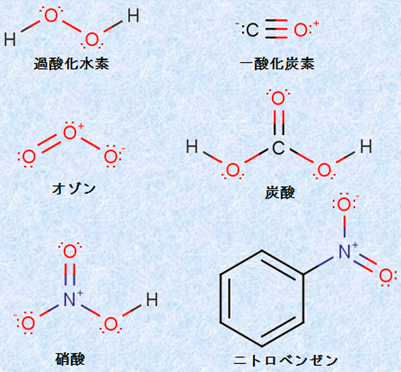
図.2 様々な化合物の構造式
図.2では、配位結合を含む化合物の構造式も示してあります。一酸化炭素CO・オゾンO3・硝酸HNO3・ニトロベンゼンC6H5NO2は、その構造に配位結合を含む化合物です。配位結合は、非共有電子対を利用して結合を形成するので、非共有電子対を提供する側の原子は、自身の周囲の電子密度が減少することになり、正の電荷を帯びることになります。また、逆に非共有電子対を受け取る側の原子は、自身の周囲の電子密度が増加することになるので、負の電荷を帯びることになるのです。つまり、配位結合を含む化合物の構造式は、正あるいは負に帯電した原子を構造式中にいくつか持つことになります。このような電荷は、その分子の化学反応や物性に影響を及ぼすことが多いので、構造式を見たときに電荷が存在する位置を瞬時に知ることが重要です。例として、水H2Oと水素イオンH+ の反応生成物である、ヒドロニウムイオンH3O+ の構造を考えてみましょう。

図.3 水H2Oと水素イオンH+ の反応
この反応は、水H2Oが自身の非共有電子対を水素イオンH+ の1s空軌道に提供して、配位結合を作る反応です。ヒドロニウムイオンH3O+ の酸素原子の周囲には、共有電子対の6電子と非共有電子対の2電子が存在しており、オクテット則を満足しています。しかし、もともと酸素原子に存在していた2つの非共有電子対のうちの1つを、水素イオンH+ との結合に使用している分だけ、酸素原子の周囲の電子密度が減少していることが分かると思います。このために、ヒドロニウムイオンH3O+ の酸素原子は、正電荷を帯びることになるのです。一般的にこのような電荷を「形式電荷(formal charge)」といい、形式電荷は次のように求めることができます。
形式電荷 = 中性原子における価電子数 − (非共有電子数 + 共有電子数の半分)
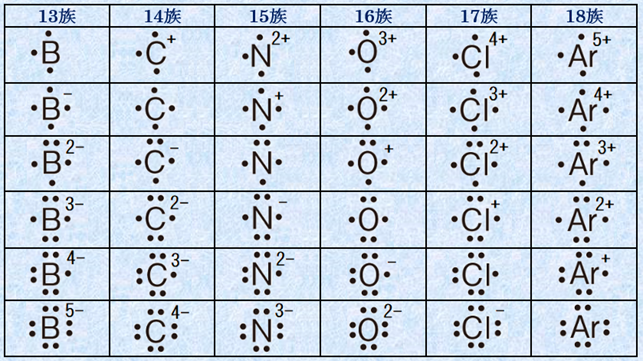
つまり、各原子上にある非共有電子は、そのすべてを所有していると考え、結合に使用している共有電子は、原子の電気陰性度に関係なく半分にして1電子ずつを所有していると考えるのです。似たような概念に「酸化数(oxidation number)」というものがありますが、酸化数は「対象原子の電子密度が単体であるときと比較してどの程度であるか」を知る目安の値のことです。酸化数を考える際には、各原子上にある非共有電子は、そのすべてを所有していると考え、結合に使用している共有電子は、電気陰性度が大きい方の原子がすべてを所有していると考えます (酸化還元を参照)。このように、形式電荷は「分子中の化学結合は本質的に共有結合である」と仮定して定義された概念であるのに対して、酸化数は「分子中の化学結合は本質的にイオン結合である」と仮定して定義された概念である、という違いがあります。次の表.2に、主な元素の周囲の電子数と形式電荷の関係を示します。中性原子における価電子数から所有している電子数を引いたものが、その原子の形式電荷になります。
表.2 主な元素の周囲の電子数と形式電荷の関係
(2) 混成軌道
原子番号6の炭素は、K殻に2電子とL殻に4電子を持ち、単独の炭素原子では、6個の電子は次の図.4のように配置されています。K殻にある1s軌道は満たされており、残りの4個の価電子は、L殻にある2s軌道と2個の2p軌道に収容されています。2p軌道にこのように電子が収容される理由は、電子自身のクーロン力の反発を最小限に抑えるためです。電子が同一のp軌道ではなく、別々のp軌道に収容されることで、電子間の反発が軽減されるのです。電子軌道に電子が収容されるとき、電子は許される限り、できるだけ多くの軌道に分布しようとする性質があります。この性質のことを、「フントの規則(Hund rules)」といいます。
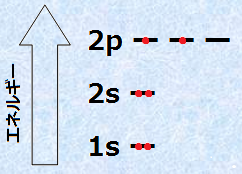
図.4 炭素原子の6個の電子配置
しかしながら、図.4の電子配置を見ると、炭素の結合に関して、誤った考え方を持つ恐れがあります。例えば、半分しか満たされていない2つの2p軌道を完成させようとして、炭素は2本の結合しか形成しないとか、配位結合によって空の2p軌道に電子を2個受け取って、炭素は最大3本の結合を形成できるとか・・・・・・。
しかし、私たちは経験的に、この考え方が誤りであるということが分かるはずです。炭素原子は通常4本の結合を形成して、メタンCH4のような等価な4本の結合を持つ化合物を作ることが多いからです。このように理論が事実と矛盾することを解消するために、「混成軌道(hybrid orbital)」という考え方を知る必要があります。
(i) sp3混成軌道
炭素原子が4本の等価な結合を持つためには、同じエネルギー準位の4個の不対電子を持たなければなりません。このような不対電子を4個作るために、炭素原子は2s軌道の電子1個を励起させ、空いている2p軌道に遷移させます。しかし、このままでは電子のエネルギー準位がバラバラであり、歪んだ結合となってしまうので、これらの4つの電子軌道を混成して、軌道を再編成するのです。

図.5 炭素のsp3混成軌道
このようにして4本の等価な結合を作る混成軌道を、「sp3混成軌道(sp3 hybrid orbital)」といいます。「sp3混成」というのは、1つのs軌道と3つのp軌道を混成したという意味です。このようにわざわざ電子を励起させてまで混成軌道を作る理由は、結合してオクテット則を満たすことにより、大きなエネルギー的安定性が得られるからです。はじめに出費しても、あとでたくさんの収入があって十分に採算が合うときは、そのことが可能になるのです。sp3混成軌道は、1/4のs軌道性と3/4のp軌道性を持ち、2p軌道と2s軌道の間のエネルギーを持ちます。
sp3混成軌道の形は、p軌道の形に似ていますが、その亜鈴形は片方に著しく偏っており、軌道胞の一方が大きくて、他方は小さくなっています。結合するときに大きい軌道胞を使うと、他の軌道との重なりが非常に上手くいくので、結合は大きい軌道胞で形成することになります。これは、軌道同士の重なりが良好であればあるほど、安定化が大きくなり、結合は強くなるからです。sp3混成軌道では、このようにほとんど無駄なく軌道を重ね合わせることができるので、非常に効率よく結合を形成することができるのです。
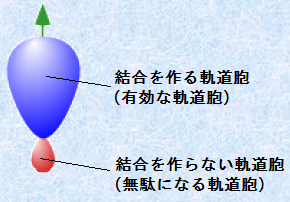
図.6 sp3混成軌道の1つ
sp3混成軌道は、1つの炭素原子上に4つの軌道胞を持ち、それぞれが正四面体の4つの頂点に向いています。このような独特な幾何学的配置により、各軌道は残り3つの軌道からできるだけ離れて存在できるので、すべての軌道が電子対で満たされたとき、軌道間の反発は最小になります。この4つのsp3混成軌道で作られる結合の角度は109.5°であり、これは正四面体の中心から、各頂点へ向かって引いた直線間の角度と等しいです。この角度は、自然界でも様々なところに現れ、「マラルディの角度(angle of Malardi)」という名前も付いています。
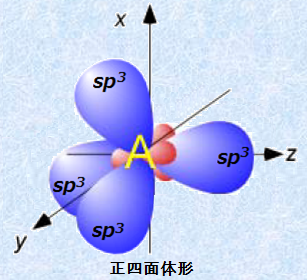
図.7 sp3混成軌道
sp3混成軌道は、他の混成軌道あるいは電子軌道と、大きい軌道胞を重ね合わせることによって結合を作ります。このような結合軸方向を向いた電子軌道同士の重なりによる結合を、「σ結合(sigma bond)」といいます。炭素原子は混成軌道を編成することによって、原子価状態で結合を形成する場合よりも軌道同士の重なりが良好になり、より安定なσ結合を作れるようになるのです。なお、高校レベルの化学では、σ結合は単結合とほぼ同じ意味で使われています。
(ii) sp2混成軌道
炭素原子は、単結合だけではなく、二重結合のような不飽和結合を形成することもできます。炭素原子が、エチレンC2H2やベンゼンC6H6のように3個の原子と結合を形成するとき、炭素原子は「sp2混成軌道(sp2 hybrid orbital)」を作ります。sp2混成軌道では、炭素原子は同じエネルギー準位の3個の不対電子を持ち、3本の等価な結合を作ることができます。このような不対電子を3個作るために、炭素原子は2s軌道の電子1個を励起させ、空いている2p軌道に遷移させます。ここまではsp3混成軌道と同じですが、sp2混成軌道では、2つの2p軌道だけを混成させます。「sp2混成」というのは、1つのs軌道と2つのp軌道を混成したという意味です。
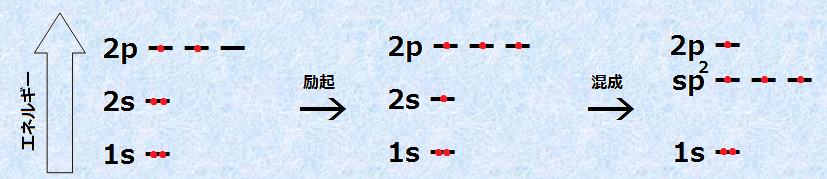
図.8 炭素のsp2混成軌道
sp2混成軌道は、1/3のs軌道性と2/3のp軌道性を持ち、同じエネルギー準位の3つのsp2混成軌道とエネルギー準位の高い1つのp軌道を持っています。したがって、sp2混成軌道では4個の不対電子が等価ではなく、エネルギー準位の低いsp2混成軌道で3個の原子と結合を作ることになるのです。
sp2混成軌道の形は、結合を形成する3つの軌道胞が軌道間の反発を最小にするために、ぞれぞれが正三角形の頂点に向かったような形をしています。これらの軌道胞は同一平面内にあり、各軌道間の角度は120°になります。
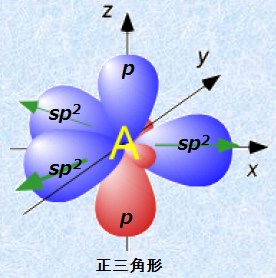
図.9 sp2混成軌道
なお、sp2混成軌道がこのような形になるのは、p軌道の反発の寄与をないものと考えるからです。もちろん、実際にはp軌道にも電子が存在しているので、多少の反発力は働きます。しかし、p軌道がsp2混成軌道の作る平面の上下に分布すること、sp2混成軌道と比べて原子核に遠いところを分布することにより、p軌道の反発の寄与を無視することができるのです。したがって、sp2混成軌道では、p軌道が混成軌道とは異なった挙動を示すことになり、σ結合とは性質の異なる結合を作ることになります。結合軸方向を向いた電子軌道同士の重なりによる結合をσ結合といいますが、sp2混成軌道では、結合軸に対して垂直に分布する2つのp軌道同士の重なりにより、「π結合(pi bond)」を形成します。
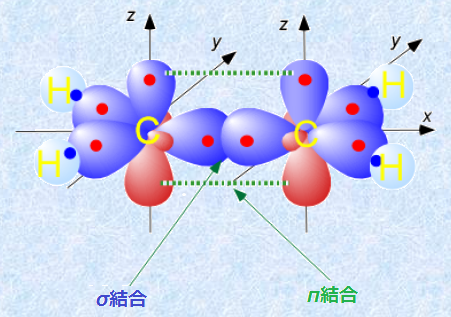
図.10 エチレンC2H4のσ結合とπ結合の形成
一般的には、σ結合とπ結合の2本の結合を合わせて、二重結合と呼んでいます。高校レベルの化学では、二重結合の2本の結合の性質について論じられることはほとんどありませんが、二重結合における2本の結合は等価ではなく、その結合はσ結合とπ結合によるものだったのです。また、図.10を見て分かるように、π結合はσ結合と比べて軌道の重なりが少ないため、結合の安定性はσ結合>π結合となります。したがって、π結合はσ結合よりも反応性が高く、種々の求電子剤の攻撃を受けやすくなるのです。例として、次の図.11にエチレンC2H4に対する塩素Cl2の付加反応を示します。このような付加反応はσ結合では進行せず、π結合を持つ化合物で見られる特有のものです。
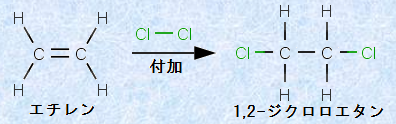
図.11 エチレンC2H4に対する塩素Cl2の付加反応
(iii) sp混成軌道
不飽和結合において、炭素原子は三重結合や連続した二重結合を作ることにより、2原子のみと結合することができます。このとき、炭素原子は「sp混成軌道(sp hybrid orbital)」を編成し、同じエネルギー準位の2個の不対電子を作り出しています。「sp混成」というのは、1つのs軌道と1つのp軌道を混成したという意味です。
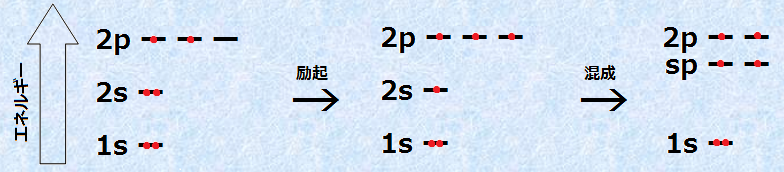
図.12 炭素のsp混成軌道
sp混成軌道は、1/2のs軌道性と1/2のp軌道性を半分ずつ持ち、同じエネルギー準位の2つのsp混成軌道とエネルギー準位の高い2つのp軌道を持っています。sp混成軌道の軌道胞は、炭素原子を中心として互いに逆の方向へ広がり、その軌道間の角度は180°になります。sp混成軌道がこのような形になる理由は、軌道間の角度を180°にすることで、2つのsp混成軌道に収容された電子間の反発を最小にできるからです。また、このとき残ったp軌道は、互いにsp混成軌道と直行するように広がっています。
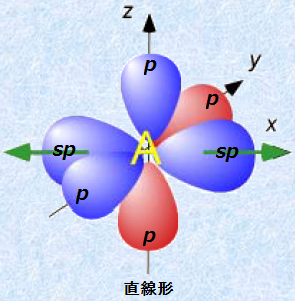
図.13 sp混成軌道
次の図.14には、2個のsp混成した炭素から、三重結合が作られる様子が示されています。2個のsp混成軌道の末端同士が重なり合って、炭素間にσ結合が形成され、さらにp軌道が互いに直交するような配置をとって重なることにより、2個のπ結合が形成されるのです。二重結合では、その結合はσ結合とπ結合によるものでしたが、三重結合では、その結合は1本のσ結合と2本のπ結合から作られることになります。
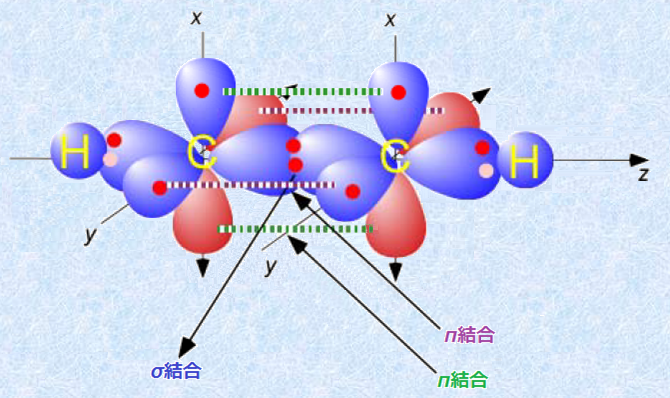
図.14 アセチレンC2H2のσ結合とπ結合の形成
sp混成軌道は、σ結合の結合角が180°なので、sp混成炭素を持つ化合物は、その結合部分に直線性を持つことになります。アセチレンC2H2や二酸化炭素CO2は、どちらもsp混成炭素を持つ簡単な構造の化合物です。図.15で示すように、アセチレンC2H2はsp混成炭素を2個持ち、二酸化炭素CO2はsp混成炭素を1個持ちます。この図.15を見れば、アセチレンC2H2や二酸化炭素CO2の分子の直線性が、よく理解できると思います。
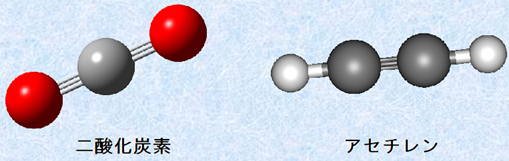
図.15 アセチレンC2H2と二酸化炭素CO2の分子モデル
(iv) 混成軌道のまとめ
混成軌道の仕組みを理解すれば、分子の形やp軌道の方向性などが分かるだけではなく、その分子の安定性なども推測することができます。例えば、シクロプロパンC3H6はsp3混成炭素を3個持つ化合物で、次の図.16で示されるような構造をしています。
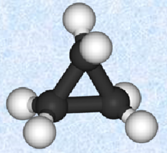
図.16 シクロプロパンC3H6の分子モデル
sp3混成軌道の結合角は、本来ならば4つの軌道胞の反発が最小になる109.5°のはずです。しかし、シクロプロパンC3H6の場合、炭素骨格が正三角形になるために、sp3混成炭素の正常な結合角である109.5°から大きくずれた60°で結合しているのです。このため、シクロプロパンC3H6は結合角の歪みで非常に不安定な構造になり、他のシクロアルカンに比べて、反応性が非常に大きくなります。このように混成軌道を理解することで、その化合物が安定に存在できるかどうかを、定性的に推測することが可能になります。
しかし、このような推測をするためには、ある化合物の構造を見て、混成を瞬時に理解できるような能力がなければなりません。これは、初学者にはなかなか難しいことです。混成軌道は単純ではなく、「単結合だからsp3混成軌道」、「二重結合だからsp2混成軌道」、「三重結合だからsp混成軌道」と簡単に決めることはできません。混成を見分けるためには、「結合の種類」ではなく、「その原子と結合している原子の数」で見分けるのが、実は一番良い方法です。次の図.17に、その例を示します。
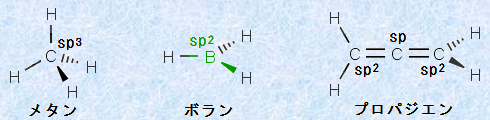
図.17 混成軌道の見分け方
例えば、メタンCH4の炭素原子はsp3混成ですが、その炭素原子は4個の水素原子と結合しています。また、ボランBH3のホウ素原子はsp2混成で、そのホウ素原子は3個の水素原子と結合しています。プロパジエンC3H4の中心の炭素原子はsp混成で、その炭素原子は2個の炭素原子と結合しています。つまり、ある原子の混成軌道を判断するとき、「4個の原子と結合しているならsp3混成軌道」、「3個の原子と結合しているならsp2混成軌道」、「2個の原子と結合しているならsp混成軌道」とすることができるのです。
ただし、この見分け方は簡易的なもので、この規則に従わない化合物も多いです。例えば、アンモアNH3は分子式から分かるように、窒素原子が3個の水素原子と結合しているので、アンモアNH3の窒素原子はsp2混成軌道だと判断してしまいがちです。しかし、実際にはアンモアNH3の窒素原子は、sp3混成に近い電子状態であることが分かっています。この理由は、アンモアNH3の窒素原子の非共有電子対が、σ結合を形成する共有電子対と同じような挙動をするからです。
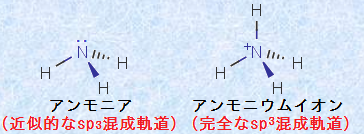
図.18 アンモアNH3とアンモニウムイオンNH4+の構造式
アンモアNH3の窒素原子は、非共有電子対を水素イオンH+ に与えて、配位結合を作ります。図.18には、アンモアNH3とアンモニウムイオンNH4+ の構造式を示しました。アンモニウムイオンNH4+ のσ結合はすべて等価な結合であり、アンモニウムイオンNH4+ の窒素原子は完全なsp3混成軌道です。一方で、アンモアNH3の窒素原子には、共有電子対と非共有電子対の両方が存在していて、電子の状態は完全に等価とはいえませんが、その分子の形はアンモニウムイオンNH4+ とほぼ同じで、近似的にsp3混成軌道と見なすことができるのです。つまり、混成軌道を見分けるときは、非共有電子対も結合した1個の原子分と考えます。
このように考えることで、水H2Oの酸素原子がsp混成ではなく、sp3混成に近い電子状態であるという事実も説明することができます。水H2Oの酸素原子は2個の原子としか結合を作っていませんが、結合を形成していない非共有電子対が2組あるため、合計4個の原子と結合していると近似的に考えることができるのです。それ故に、水H2Oはsp混成の直線形の分子ではなく、sp3混成の正四面体の2つの頂点に水素原子が配置した折れ線形の分子構造になるのです。
表.3 混成軌道のまとめ
|
|
sp3混成軌道 |
sp2混成軌道 |
sp混成軌道 |
|
結合の種類 |
4本のσ結合 |
3本のσ結合と1本のπ結合 |
2本のσ結合と2本のπ結合 |
|
結合角 |
109.5° |
120° |
180° |
|
見分け方 |
4個の原子と結合している |
3個の原子と結合している |
2個の原子と結合している |
|
分子の形状 |
メタンCH4 |
エチレンC2H4 |
アセチレンC2H2 |
混成軌道を考えることで、分子の形をある程度は推測することが可能になります。しかし、分子構造の細かい部分については、混成軌道の理論だけでは説明できません。例えば、アンモニアNH3分子の形は、近似的なsp3混成軌道として説明することができますが、H-N-H間の角度は理想的な角度である109.5°ではなく、107.5°と少し小さい角度になります。同様に、近似的なsp3混成軌道と考えられる水分子H2OのH-O-H間の角度も、104.5°と理想的な角度である109.5°より少し小さい角度になります。
このように、混成軌道だけでは説明できない分子の形を説明する理論として、「VSEPR理論(Valence Shell Electron Pair Repulsion rule)」というものがあります。この理論を最初に提唱したのは日本の槌田龍太郎ですが、槌田は1939年に日本でしか発行されない論文誌に発表しただけで、注目を集めることはありませんでした。これとは独立に、1940年にイギリスの化学者ネビル・シジウィックとハーバート・パウエルによって発表され、それが世界的に有名になりました。VSEPR理論とは、電子軌道上のσ結合性価電子は相互に反発し、電子対はその反発力が最も小さくなるように配置するという理論です。この理論によれば、電子対の種類によって反発力が異なり、その関係は次のようになります。
非共有電子対間の反発 > 非共有電子対と共有電子対間の反発 > 共有電子対間の反発
このような関係になるのは、非共有電子対間には、クーロン力による強い反発力が働くからです。共有結合を作る共有電子対は、結合原子間に束縛されるため、原子核よりも離れた位置に存在することになります。しかし、非共有電子対の場合、その電子対は強く原子核に束縛されることになり、距離の2乗に反比例するクーロン力により、強い反発力が働くことになるのです。したがって、電子対間の角度も、次のようになります。
非共有電子対間の角度 > 非共有電子対と共有電子対間の角度 > 共有電子対間の角度
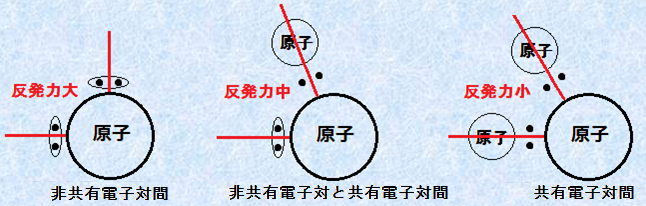
図.19 電子対の反発力の違い
これにより、アンモニアNH3と水H2Oの結合間の角度が、理想的な角度である109.5°よりも小さくなる理由が説明できます。アンモニアNH3と水H2Oは、それぞれ窒素原子と酸素原子に非共有電子対を持っており、非共有電子対軌道の強い反発の結果、共有電子対の作る共有結合の結合角が小さくなったと考えられるのです。
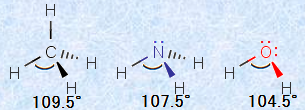
図.20 共有結合間の角度
また、このVSEPR理論を拡張すれば、メタンCH4の水素原子1個をフッ素原子に置換した、フルオロメタンCH3Fの形を説明することもできます。メタンCH4は完全なsp3混成軌道であり、その結合角はすべて理想的な109.5°となります。しかし、ほとんど同じ構造であるはずのフルオロメタンCH3Fの場合、その結合角は理想的な109.5°ではなく、F-C-H間の角度は108.2°となり、理想的な109.5°より少し小さくなるのです。この理由は、電気陰性度の違いにあります。
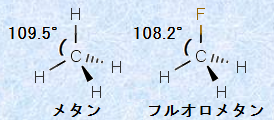
図.21 メタンCH4とフルオロメタンCH3Fの構造式
フッ素Fは、電気陰性度が最も大きい元素であり、炭素との結合は共有結合ですが、その共有電子対は強くフッ素原子に引き付けられることになります。すなわち、フルオロメタンCH3FのF-C結合では極性が生じることにより、F-C間とH-C間の共有結合は、等価ではなくなってしまうのです。電子対間の反発はクーロン力の強さに依存するため、F-C間の共有結合では、共有電子対は電気的に陰性なフッ素原子側に偏ることになります。このようにして、炭素原子近傍の電子密度が減少することにより、反発力の強さはH-C間>F-C間となり、結合角の大きさもH-C-H間>F-C-H間となるのです。
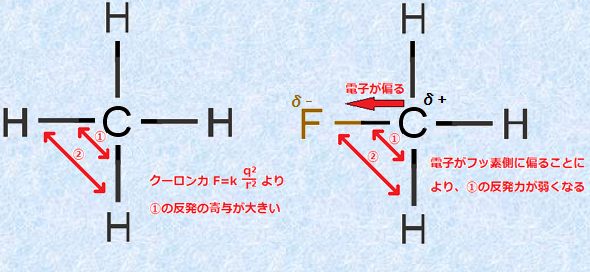
図.22 共有電子対間に働くクーロン力
同じ共有電子対間の反発でも、このように電気陰性度に差がある原子が置換している場合、共有電子対間で反発力に差が生じる場合があります。しかし、そのような場合にも、VSEPR理論を拡張して適用することにより、定性的な推測が可能になるのです。また、VSEPR理論の注意点として、p軌道の非共有電子対は、反発に寄与しないということがあげられます。ある有機化合物においては、非共有電子対を混成軌道にするより、エネルギーの高いp軌道に収容した方が、安定性が良くなる場合があるのです。このような有機化合物としては、非共有電子対をp軌道に収容することで、長い「共役系(conjugated system)」や「芳香族性(aromaticity)」を獲得できる有機化合物が該当します。このような場合は、非共有電子対でも反発に寄与しないので、分子の形を推測するときは、十分な注意が必要になります。
・参考文献
1) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
2) メートランド・ジョーンズ「ジョーンズ有機化学(上)」東京化学同人(2000年発行)