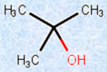
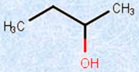
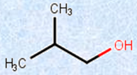
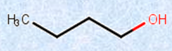
・アルコール
(1) アルコール
炭化水素の水素原子を、ヒドロキシ基(hydroxyl group, -OH)で置換した形の化合物を、「アルコール(alchol)」といいます。ちなみに、もともと「アルコール」という言葉は、アラビア語の「alkoh’l」に由来するもので、「al(アル)」は接頭語、「koh’l(コホル)」はアイシャドーに用いられた硫化アンチモンSb2S3の細かい粉末のことであったといいます。この粉末を得るためには、加熱と冷却の操作をする必要があり、これが蒸留の操作につながり、やがて「蒸留によって得られる液体」――すなわち「アルコール」に、この名が移ったと考えられています。アルコールは、一般的に化学式「ROH」で示されます。芳香族化合物であるフェノールも、同じ官能基(-OH)を持っていますが、一般的にアルコールとは区別されます(酸素を含む芳香族化合物を参照)。また、「チオール(thiol)」は、アルコールに似た構造を持っていますが、ヒドロキシ基(-OH)の酸素原子が、硫黄原子で置き換わったチオール基(-SH)を持つ点が異なります。
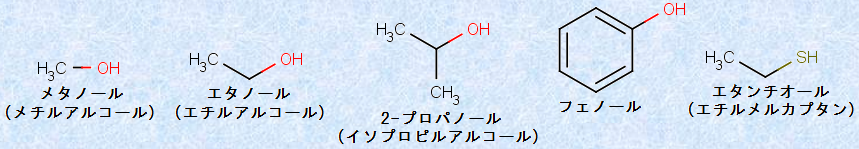
図.1 様々なアルコールとそれに類似した化合物
(i) アルコールの分類
アルコールは、ヒドロキシ基(-OH)の数によって、「1価アルコール」・「2価アルコール」・「3価アルコール」などに分類されます。
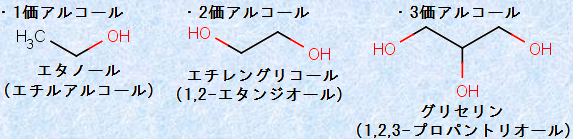
図.2 価数によるアルコールの分類
2価アルコールは、特に「グリコール」とも呼ばれ、「エチレングリコール」などの例があります。エチレングリコールは、甘味を持つ無色の液体で、ポリエチレンテレフタレート(PET)の原料となったり、自動車のエンジンの不凍液に使われたりします。エチレングリコールには毒性がありますが、これは、エチレングリコールが体内で代謝されるとシュウ酸H2C2O4となり、カルシウムと強く結合するためです。シュウ酸H2C2O4は、低カルシウム血症を引き起こし、臓器内にシュウ酸カルシウムCaC2O4の結晶が沈着することで、様々な障害を引き起こします。
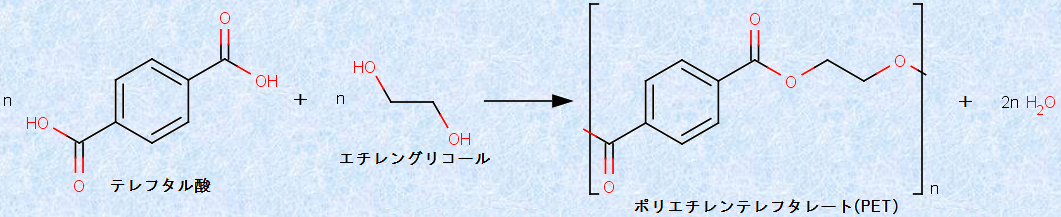
図.3 エチレングリコールは、ポリエチレンテレフタレートの原料になる
3価アルコールの代表的な化合物は、「グリセリン」です。グリセリンは甘味を持つ無色の液体で、油脂を加水分解することで得られます。グリセリンは吸湿性が強く、その保水性を生かして、化粧品や水彩絵具などにも利用されています。「鼻セレブ」や「ローションティシュー」などの高級ティッシュには、保湿成分としてグリセリンが添加されているので、口に含むと甘く感じます。熟成が進んだ上質なワインにもグリセリンが含まれており、ワインに上品な甘味と滑らかさを与えるといわれています。よくワインを飲むときに、グラスを回したりしますが、あれはワインの粘性を見て、どのくらいグリセリンが含まれているのかを確認しているのです。
1985年夏、ヨーロッパから輸入された「貴腐ワイン」に、「ジエチレングリコール」が混入しているものが発見されました。貴腐ワインとは、本来ならば、「ボトリティス・シネレア」という特殊な菌が寄生したブドウを原料にして醸造した、高級ワインのはずです。この事件は、「有毒ワイン事件」として、社会的に大問題になりました。ジエチレングリコールには、グリセリンに似た甘味と粘性があるので、貴腐ワインに類似の甘味と滑らかさのある飲料を偽造するのには、うってつけの化合物だったのです。しかし、ジエチレングリコールを大量に服用すると、吐き気や頭痛、ふらつき、腹痛、下痢などの症状が現れ、中枢神経系の抑制作用もあり、重度の場合は、痙攣、昏睡、肺水腫、心不全などが起きて、死に至ることもあります。ジエチレングリコールには、不快な味や臭いがないだけに、大量に服用してしまう可能性があるので、大変危険です。不注意に外に捨てたものを、ペットが口にして死亡した例もあるので、気を付けたいものです。
![]()
図.4 ジエチレングリコールは、2分子のエチレングリコールが脱水縮合した構造を持つ
また、グリセリンをニトロ化したものは、「ニロトグリセリン」と呼ばれ、加熱や摩擦によって爆発するため、ダイナマイトの原料となります。ニトログリセリンを服用すると、体内で分解されて一酸化窒素NOを生じ、血管拡張作用を示すため、狭心症の発作を鎮める治療薬としても用いられます。普通の人は頭に血が流れ過ぎて頭痛を起こしますが、狭心症は心臓の血管が狭まり心機能が低下する病気なので、狭心症の患者はニトログリセリンによって血が流れて胸の痛みが取れるのです。この効果は、偶然発見されたもので、狭心症を持病とする工員が、ニトログリセリン製造工場で働いていたのだそうです。ところが、この工員は家では発作を起こすのに、工場では発作を起こしたことがないというのです。そこで調べたところ、ニトログリセリンが、狭心症の発作を抑えていたという訳です。
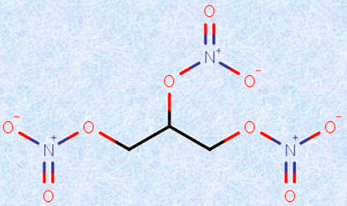
図.5 ニトログリセリンは、爆薬の一種であり、狭心症の治療薬としても使われる
さらにアルコールでは、ヒドロキシ基(-OH)が結合している炭素原子にアルキル基(-R)が1つ結合したものを「第一級アルコール」、2つ結合したものを「第二級アルコール」、3つ結合したものを「第三級アルコール」とそれぞれ呼んでいます。別の見方をすれば、炭素鎖の末端部にヒドロキシ基(-OH)が結合しているのが第一級アルコール、炭素鎖の途中にヒドロキシ基(-OH)が結合しているのが第二級アルコール、炭素鎖の枝分かれの部分にヒドロキシ基(-OH)が結合しているのが第三級アルコールとなります。
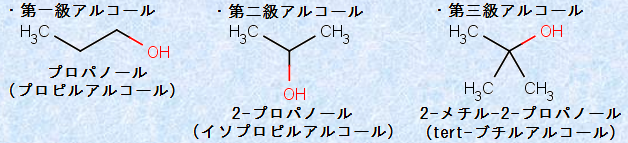
図.6 級数による分類
メタノールCH3OHは、正確にはこの定義にあてはまりませんが、一般的には第一級アルコールとみなします。この分類は、炭素陽イオンの分類方法とよく似ていますが、アルコールの反応性も、第一級・第二級・第三級の違いによって変わってきます。
(ii) アルコールの命名法
アルコールの慣用名は、ヒドロキシ基(-OH基)が結合しているアルキル基(-R)の名称をまず書き、それに「アルコール」という言葉を続けるのが一般的です。通常、慣用名は炭素数5以下のアルコールにしばしば使用され、さらに構造が複雑になると、体系的なIUPAC命名法が使用されます。IUPAC命名法では、アルコールの母体となるアルカンの語尾「e」を取り、接尾語「ol」を加えることによって命名します。次の図.7に、いくつかのIUPACシステムの適用例を示します。なお、慣用名も( )内に示しておきます。
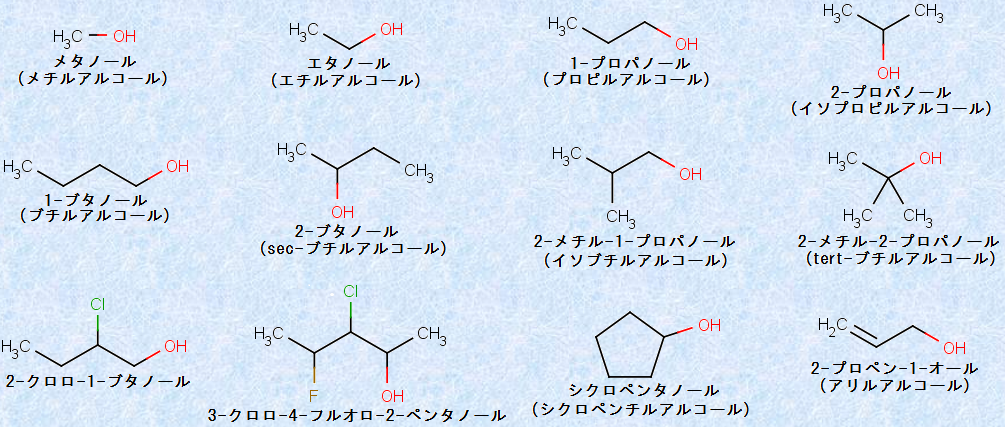
図.7 アルコールにおけるICPACシステムの適用例
不飽和アルコールの命名には、2種類の語尾が必要です。それらは、二重結合(C=C)または三重結合(C≡C)の位置とヒドロキシ基(-OH)の位置です。(図.7の2-プロペン-1-オールを参照)この場合、語尾の「オール」は末尾に付けますが、その位置を示す番号は、ヒドロキシ基(-OH)が不飽和結合よりも優先します。
(iii) アルコールの物理的性質
アルコールの沸点は、同程度の分子量を持つエーテルや炭化水素と比較すると、非常に高いです。低分子量のアルコールでも、室温で液体であり、特に多価アルコールでは、沸点が異常に高くなります。次の表.1に、沸点の比較を示します。
表.1 沸点の比較
|
名称 |
1-ブタノール |
ジエチルエーテル |
ペンタン |
エチレングリコール |
|
構造式 |
|
|
|
|
|
分子量 |
74 |
74 |
72 |
62 |
|
沸点 |
117℃ |
35℃ |
36℃ |
197℃ |
|
主な分子間力 |
水素結合 |
双極子相互作用 |
ファンデルワールス力 |
水素結合 |
アルコールがこのように高い沸点を持つ理由は、分子同士が水素結合を形成しているからです。ヒドロキシ基(-OH)の酸素-水素結合は、酸素原子の電気陰性度が大きいために、強く分極しています。この分極によって、水素原子は部分的に陽電荷を持ち、酸素原子は部分的に負電荷を持つようになります。そして、陽電荷を持った水素原子は、別の分子が持つ電気的に陰性な原子と強く引き合うようになります。このような結合を、一般的に「水素結合」と呼んでいます(化学結合を参照)。
また、アルコールの異性体の沸点については、級数が小さく、かつ枝分かれの少ないアルコールほど、沸点が高い傾向があります。この理由は、級数が小さいほど、ヒドロキシ基(-OH)周囲の立体障害が小さくて、水素結合を形成しやすいからです。すなわち、第一級アルコールでは、ヒドロキシ基(-OH)が分子の末端にあり、水素結合を形成する際の立体障害が小さくて沸点は高くなりますが、第三級アルコールでは、ヒドロキシ基(-OH)の周りが混み合っており、水素結合を形成する際の立体障害が大きくて沸点は低くなります。さらに、炭素鎖の枝分かれの少ないものほど、ファンデルワールス力が強く働くため、沸点は高くなります。
表.2 C4H9OHの沸点の比較
|
分類 |
第三級アルコール |
第二級アルコール |
第一級アルコール(枝) |
第一級アルコール(直鎖) |
|
構造式 |
|
|
|
|
|
沸点 |
82℃ |
100℃ |
108℃ |
117℃ |
水H2Oも、アルコールと同様に水素結合した液体です。その水素結合は網目状の構造をしていますが、その水分子1つを低分子量のアルコール分子で置き換えることは容易であるため、低分子量のアルコールは、水に完全に溶解できます。
表.3 アルコールの水への溶解性
|
名称 |
化学式 |
水への溶解性 (g/100 g, 20℃) |
|
メタノール |
CH3OH |
∞ |
|
エタノール |
CH3CH2OH |
∞ |
|
1-プロパノール |
CH3CH2CH2OH |
∞ |
|
1-ブタノール |
CH3CH2CH2CH2OH |
7.9 |
|
1-ペンタノール |
CH3CH2CH2CH2CH2OH |
2.7 |
|
1-ヘキサノール |
CH3CH2CH2CH2CH2CH2OH |
0.59 |
しかし、アルコールの炭化水素部分は疎水性であるため、アルキル鎖が長くなるほど、その性質はアルカンに近付き、水への溶解性はだんだん低下していきます。1価のアルコールのうち、メタノールCH3OH・エタノールCH3CH2OH・1-プロパノールCH3CH2CH2OHはよく水に溶けますが、これより炭素数が多くなると、水に溶けにくくなります。また、分子中のヒドロキシ基(-OH)の数が多くなるほど、分子の親水性が高くなり、水への溶解度も大きくなります。
(2) アルコールの酸や塩基としての挙動
(i) 酸としてのアルコール
アルコールは、水H2Oと同じように弱酸です。ヒドロキシ基(-OH)はプロトン供与体として働き、水H2Oと同様の解離反応が起こります。次の図.8に、メタノールCH3OHのプロトン解離反応を示します。
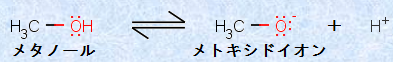
図.8 メタノールCH3OHのプロトン解離反応
アルコールROHからプトロンH+ を取った共役塩基RO- は、「アルコキシドイオン(alkoxide ion)」と呼ばれます。共役塩基は、もとの酸が弱い酸であればあるほど、強い塩基となります。アルコールは弱い酸なので、その共役塩基であるアルコキシドイオンRO- は、水酸化物イオンOH- と同様に強い塩基になります。
これらはイオン化合物であり、有機化学では、アルコキシドイオンRO- は、強塩基としてしばしば使用されます。その作り方は、アルコールと金属ナトリウム、金属カリウム、または金属水素化物との反応です。これらの反応では、生成物である水素H2が気体として抜けていくため、平衡がどんどん右にずれて不可逆的に進行し、金属アルコキシドが白色粉末として得られます。例として、次の図.9に、メトキシドイオンCH3O- の生成反応を示します。
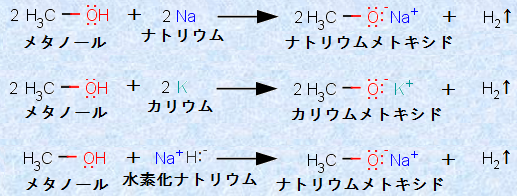
図.9 メトキシドイオンCH3O- の生成反応
この中でも特に代表的な反応は、金属ナトリウムとアルコールの反応です。金属ナトリウムをアルコールに加えると、反応して水素H2が発生します。この反応は、アルコールの異性体であるエーテルでは進行しないため、アルコールとエーテルを区別するために利用されることが多いです。つまり、アルコールかエーテルのどちらか分からない化合物に金属ナトリウムを加えて、反応すればアルコール、反応しなかったらエーテルということです。

図.10 アルコールとエーテルの金属ナトリウムとの反応性の比較
また注意として、アルコールを水酸化ナトリウムNaOHで処理しても、アルコキシドイオンRO- は生成しません。その理由は、生成してくるアルコキシドイオンRO- が、水酸化物イオンOH- よりも強い塩基であり、生成しても、逆向きの反応が有利になってしまうからです。例として、次の図.11に、メトキシドイオンCH3O- の加水分解反応を示します。
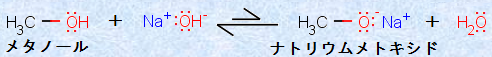
図.11 メトキシドイオンCH3O- の加水分解反応
(ii) 塩基としてのアルコール
アルコールは弱酸であると同時に、弱塩基でもあります。この理由は、ヒドロキシ基(-OH)の酸素原子上には非共有電子対が存在し、この非共有電子対が、プロトンH+ に対して親和性を持つからです。したがって、アルコールは強酸によって容易にプロトン化され、オキソニウムイオンH3O+ に類似のアルキルオキソニウムイオンROH2+ を生成します。例として、次の図.12に、メタノールCH3OHのプロトン化反応を示します。
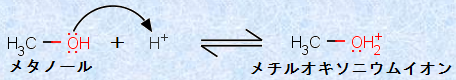
図.12 メタノールCH3OHのプロトン化反応
このアルキルオキソニウムイオンROH2+ は、その分子内に水H2Oの構造を含むため、これを加熱すると、分子内から水H2Oが抜けます。すなわち、アルコールを強酸とともに加熱すると、脱水反応が起こるのです。例えば、エタノールC2H5OHに少量の濃硫酸H2SO4を加えて180℃に熱すると、高収率でエチレンC2H4が生成します。
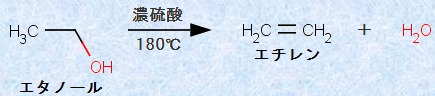
図.13 エタノールC2H5OHを用いたエチレンC2H4の合成反応
この反応はアルケンの水和反応の逆反応であり、アルケン類の合成反応として利用されています(脂肪族炭化水素(アルケン)を参照)。また、この反応は水H2Oの脱離反応であり、その第一段階は、ヒドロキシ基(-OH)のプロトン化です。ヒドロキシ基(-OH)をプロトン化することによって、分子内に水H2Oの構造ができ、脱離反応の進行が容易になるのです。例として、次の図.14に、エタノールC2H5OHの脱水反応を示します。
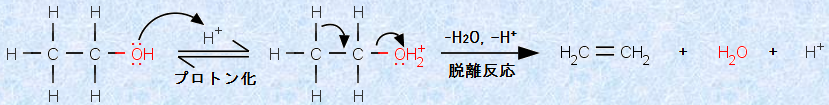
図.14 エタノールC2H5OHの脱水反応
また、1つのアルコールから2種類以上のアルケンが生成することがしばしばあります。その理由を反応機構から考えてみると、π結合の生成は、水H2OとプロトンH+ の脱離によって起こり、ヒドロキシ基(-OH)が結合した炭素に隣接する炭素上の水素なら、どれでも原則として脱離できるからです。例えば、2-ブタノールCH3CH(OH)CH2CH3からは、理論上2種類のアルケンが生成します。
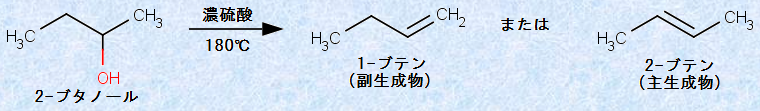
図.15 理論上2種類ある2-ブタノールCH3CH(OH)CH2CH3の脱水反応
しかし、一般的には置換基数の最も多い二重結合を持ったアルケンが安定であるため、より多置換のアルケンが優勢に生成してきます。この「置換基数の最も多い」の定義は、「二重結合を形成する2つの炭素に結合している置換基数が最も多い」という意味です。したがって、図.15の反応では、より多置換の2-ブテンCH3CH=CHCH3が主生成物になります。
この現象は、ロシアの化学者であるアレクサンドル・ザイツェフによって発見されたので、これを「ザイツェフ則(Zaitzev rule)」といいます。ザイツェフ則を簡単に覚えるときは、「より内側の水素が抜けて多置換のアルケンを生成する」としておけば、ほとんどの場合で対応できます(詳細は有機反応機構(求核置換反応と脱離反応)を参照)。
(3) アルコールの反応
(i) アルコールとハロゲン化水素の反応
アルコ−ルは、ハロゲン化水素(塩化水素HCl・臭化水素HBr・ヨウ化水素HI)と反応して、ハロゲン化アルキル(塩化アルキルRCl・臭化アルキルRBr・ヨウ化アルキルRI)を生成します。例として、次の図.16に、アルコールとハロゲン化水素の反応を示します。
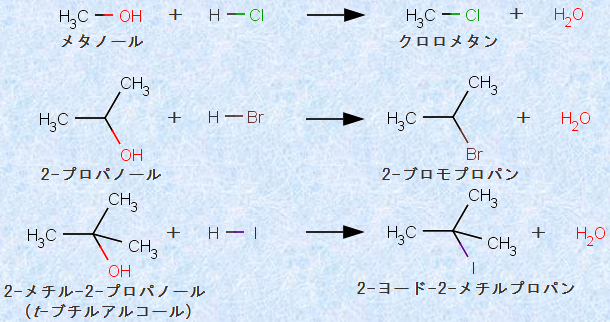
図.16 アルコールとハロゲン化水素の反応
この反応は置換反応であり、ハロゲン化アルキルの一般的な合成法として利用されています。ハロゲン化物イオンは良好な求核剤として働くので、この反応の主生成物は、脱水生成物ではなく置換生成物です。
反応速度と反応機構は、アルコールの構造(第三級アルコール・第二級アルコール・第一級アルコール)によって異なります(有機反応機構(求核置換反応と脱離反応)を参照)。この中で反応速度が最も速いのは、第三級アルコールです。例えば、2-メチル-2プロパノールを濃塩酸HClと混合し、室温で数分間撹拌するだけで、2-クロロ-2-メチルプロパンを得ることができます。

図.17 第三級アルコールと塩酸HClの反応
一方で、第一級アルコールの反応速度は最も遅く、1-ブタノールから1-クロロブタンを得るためには、アルコールを濃塩酸HClと触媒の混合物とともに、数時間加熱する必要があります。

図.18 第一級アルコールと塩酸HClの反応
いずれの反応も、反応の第一段階は、アルコールのプロトン化です。アルコールをプロトン化することによって、アルキルオキソニウムイオンROH2+ が生成し、分子内に水H2Oの構造ができるので、これがハロゲン化物イオンと置換しやすくなるのです。また、第二級アルコールの反応速度は、第三級アルコールと第一級アルコールの中間ぐらいです。このようにアルコールとハロゲン化水素の反応は、アルコールの級数によって反応性が異なるため、反応速度を比較することによって、アルコールの級数の違いを識別することもできます。
アルコールは、過マンガン酸カリウムKMnO4水溶液や二クロム酸カリウムK2Cr2O7水溶液によって、炭素骨格を壊さないように酸化することができます。この場合、アルコールの級数によって、変化の流れが異なります。そこで、これらの酸化反応によって、アルコールの級数を判断することができるのです。例えば、第一級アルコールからはアルデヒドが得られ、これをさらに酸化するとカルボン酸になります。第二級アルコールからはケトンが生成します。第三級アルコールは、ヒドロキシ基(-OH)のある炭素上に酸化を受ける水素を持たないので、このタイプの酸化反応は起こりません。
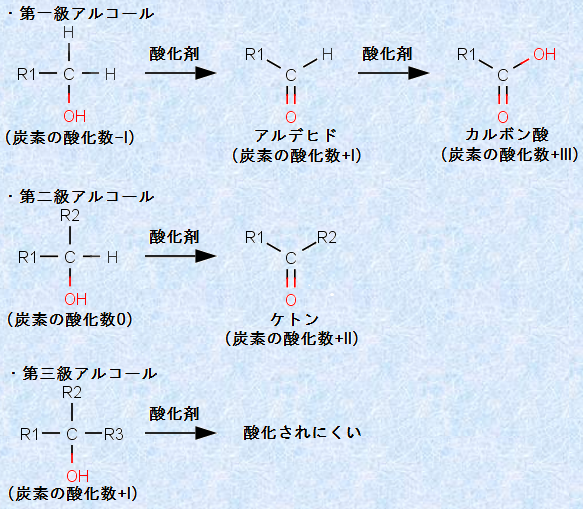
図.19 アルコールの酸化反応
「エーテル(ether)」とは、1つの酸素原子に有機基が2つ結合した化合物全般の総称であり、一般的に「ROR’」の化学式で表されます。有機基がアルキル基(-R)の場合は、不飽和度が0であり、対応するアルコールは、エーテルの構造異性体になります。RとR’は同じか、または異なる種類の有機基でもよく、2つの有機基をアルファベット順に並べたあとに、「エーテル」という言葉を続けて命名します。
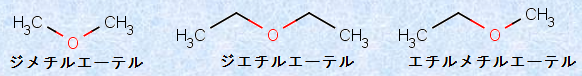
図.20 様々なエーテル
エーテルは、一般的に特有の芳香を持った無色の化合物です。その沸点は、対応するアルコールに比べると低く、むしろエーテルの酸素原子を-CH2-で置き換えた形の炭化水素の沸点に近いです。エーテルの沸点が対応するアルコールより低い理由は、エーテルがアルコールのように分子間で水素結合を形成することができないからです。「エーテル(ether)」の語源も、ギリシア語の「aither(天空)」に由来し、無色で揮発性が高いことから、「地上にあるべきでない天空の物質」と考えられていたことによります。当時の人たちには、手のひらに落とすと急速に蒸発するエーテルが、奇妙な物質に見えたのでしょう。「この物質はそもそも地上の物質ではない。エーテルは天空を満たしている物質であるから、空に還っていくのだ」と考えたのも無理はありません。
また、エーテルは比較的不活性な化合物であり、一般的に酸や塩基、酸化剤や還元剤とも反応しません。金属ナトリウムとも反応しないので、異性体であるアルコールと明確に区別できます。さらに、エーテルは全般的に反応不活性であるのと同時に、たいていの有機化合物を溶解し、水とは混ざらない性質があるので、有機反応用の優れた溶媒として使用されます。
表.4 エーテルの物理的性質
|
名称 |
化学式 |
融点 |
沸点 |
水への溶解性 (g/100 g, 20℃) |
|
ジメチルエーテル |
CH3OCH3 |
-141.5℃ |
-23.6℃ |
7.1 |
|
ジエチルエーテル |
CH3CH2OCH2CH3 |
-116℃ |
25℃ |
7.5 |
混合物から有機化合物を抽出するのに、エーテルを溶媒として用いることが多く、その中でもジエチルエーテルC2H5OC2H5が最もよく使われています。ジエチルエーテルC2H5OC2H5は、低沸点(b.p.25℃)で揮発性が大きいので、有機化合物をエーテルに溶かして単離し、そのあとにエーテルを除去することで、目的の有機化合物だけを取り出すことができるのです。単に「エーテル」というときは、このジエチルエーテルC2H5OC2H5を指す場合が多いです。
次の図.21に、有機化合物の抽出に用いる「分液ろうと」を示します。分液ろうとは、下線部にコックが、上部に栓が付いた球状のろうとです。図.21では、分液ろうと内の溶液が二層に分離していますが、上部にあるのがエーテル層、下部にあるのが水層です。エーテルの密度は0.713 g/mLで、水よりも軽いので、二層に分かれたときに上部にくるのがエーテル層です。水層の液を取り出したい場合は、下部のコックを回し、二層の境界面がコックの位置に来たところで、コックを閉じるようにします。エーテル層の液を取り出したい場合は、栓を取って、上口から別の容器に移すようにします。

図.21 抽出に用いる分液ろうと
ジエチルエーテルC2H5OC2H5は、すでに中世の頃から知られていたらしく、古くから神秘的な化合物として取り扱われてきました。「甘い硫酸」や「甘緑礬油(かんりょくばんゆ)」などと呼ばれていたのは、緑礬(硫酸鉄FeSO4)とアルコールを乾留することによって、エーテルを得る方法があったからです。13世紀ごろの化学書(錬金術の本)には、緑礬FeSO4を乾留して硫酸H2SO4を作り出す方法が書いてあり、そのため硫酸H2SO4が「緑礬油」と呼ばれたことが知られています。現在でも、実験室ではエタノールC2H5OHと濃硫酸H2SO4との反応で合成されています。130〜140℃に熱した濃硫酸H2SO4にエタノールC2H5OHを加えると、ジエチルエーテルC2H5OC2H5が得られます。
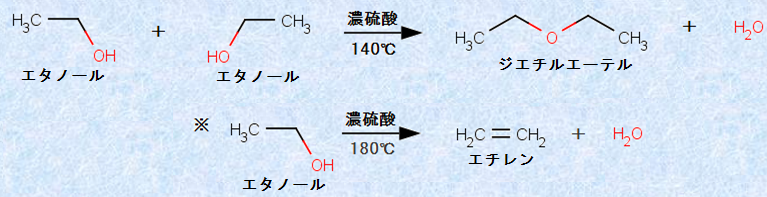

図.22 エタノールC2H5OHの分子間脱水(左)と分子内脱水(右)
エタノールC2H5OHは、濃硫酸H2SO4により脱水されて、エチレンC2H4あるいはジエチルエーテルC2H5OC2H5になりますが、それぞれを与える反応条件は異なっています。比較的低温では「分子間脱水」が起こり、比較的高温では「分子内脱水」が起こるのです。また、この反応は、他のエーテル合成にも適用できます。この反応は、第一級アルコールROHから「対象型エーテルROR」を合成する一般的な方法なのです。
2ROH → ROR + H2O
(ii) エーテルの麻酔作用
ジエチルエーテルC2H5OC2H5に麻酔効果があるのを19世紀初頭に発見したのは、電磁気学の分野への貢献で有名なマイケル・ファラデーです。それまでの外科手術といえば、手術前にウイスキーやブランデーなどの度数の強いアルコール飲料を患者に大量に飲ませ、意識が朦朧としたところでやるというような殺伐としたものでした。患者は麻酔薬なしで、脚の切断手術や胆石の除去手術に耐えなければなりませんでした。しかし、いくらアルコール飲料をがぶ飲みしたところで、患者は自分の脚がのこぎりで切断されるのを感じていたでしょう。外科手術とは、「計算された暴力」だったのです。13世紀のある医師は、アヘンやドクニンジン、マンドラゴラなどを調合して、「泡立つカクテル」を作りました。これを投与すると、「患者は深い眠りに陥り、メスを入れても、まるで死んでいるように何も感じなくなる」と彼は主張しています――恐らく、本当に患者は死んでいたのでしょう。

図.23 ファラデーは、電磁気学の分野への貢献で知られるが、化学者としてはベンゼンを発見するなど、化学への業績も多い
エーテルの登場は、外科手術の痛みに耐えかねていた患者にとって福音でした。痛みを克服することは、簡単なことではありません。「Anesthesia(麻酔)」の語源は、ギリシア語の「an+aesthesia」で、「感覚がない」という意味です。人類は、頭蓋骨に穴を開けるという手術を行って以来、感覚を麻痺させる方法を模索してきました。麻酔薬の登場によって、患者は外科手術の苦悶から解放されたのです。エーテルが初めて全身麻酔薬として使われたのは1846年10月16日のことで、ボストンにあるマサチューセッツ総合病院で、エーテル麻酔による顎の腫瘤の除去手術が行われました。結果は大成功で、執刀医は麻酔の効果を絶賛したといいます。この場所は、現在でも「エーテルドーム」といわれて残っています。エーテルは信頼性のある吸入麻酔薬であり、効き目は比較的遅く、吐気を催させることもありますが、高い治療指数と低価格、確実な麻酔維持能という特徴から、発展途上国では現在でも麻酔薬として好んで使われています。一方で先進国では、電子機器や電気メスから出るわずかな静電気でも火が点いてしまうほどの引火性の強さから、エーテルを麻酔薬として使うことはほとんどありません。しかし、引火性の部分を除けば、現在でも麻酔維持にはエーテルが最も優れているといえます。

図.24 1846年10月16日、ボストンのマサチューセッツ総合病院で、エーテル麻酔による公開手術が行われた
また、かつて禁酒運動によって、酒類の販売が打撃を受けていたころ、エーテルをアルコールの代わりに飲むことが、ヨーロッパの人々に流行していました。エーテルは体温で蒸発するので、この揮発性が劇的に効果を促進します。19世紀の医学雑誌編集者アーネスト・ハートは、「エーテル飲用の直接的効果はアルコールによるものに近いが、すべてが速く進行する。興奮、心的混乱、筋肉のコントロール喪失、意識喪失が短時間に連続して起こるため、各段階が明瞭に区別できないほどだ」と書いています。酩酊からの回復も早いです。路上でエーテルを飲んで警官に捕まっても、交番に着く頃には完全に醒めていることが多いし、二日酔いになることもありません。エーテルは工業的に大量生産されていたため、非常に安く手に入り、すぐに効果を発揮することから、最貧民層の人々にさえ、1日に何度も酔うことができたのです。エーテルの飲用習慣があまりにも当たり前になっていたため、町の商店主がおつかいに来た子供たちに、お駄賃の代わりに少量のエーテルを与えたりするほどでした。子供たちが登校すると、教師は子供たちの息を嗅いで、エーテルを飲んでいないか確かめていたといいます。
しかしながら、エーテルにはアルコールの数倍の経口毒性があります。エーテルの飲用は、1891年にイギリス政府がエーテルを毒物に指定し、販売と所持を厳しく取り取り締まって、その流通と使用を大きく制限するまで続きました。エーテルは安価で効き目が速く、二日酔いもありません。人気が出たのも頷けます。しかし、早速どこかでエーテルを手に入れようとお考えの方には、エーテルの欠点もお知らせしておいた方がいいでしょう。まず、臭いと味が酷いです。胃にエーテルが流れていくまでに、焼けるような感覚があります。加えて、真夏のセントバーナード並みによだれが垂れます。そして、半端ではないゲップとおならが出ます。ただのゲップやおならではありません。そこには、可燃性の気化エーテルがたっぷりと混じっています。もしあなたがエーテルを飲んでいる横でタバコを吸っている人がいたら、どうなるかお分かりでしょうか?口や肛門に大火傷というのは、当時ありふれた災難でした。
炭素数が4までの低級アルコールは、多量に工業生産されており、それ自体で広い用途を持つ一方で、重要な化学製品の製造原料にもなっています。以前はアルコールという場合には、「酒精」や「木精」という言い方がされ、それぞれ「酒」と「木」の最も根本的な物質であると考えられていました。ちなみに、「酒精」はエタノールC2H5OHのことであり、「木精」はメタノールCH3OHのことです。
メタノールCH3OHは、「メチルアルコール」または「木精」とも呼ばれており、最も簡単な構造の脂肪族アルコールです。木精という名は、木材を乾留した際に生じる「木酢」の蒸留から得られていたので、この名があります。メタノールCH3OHは、木材からの煙にも存在し、新鮮な果実やワインにも微量含まれていて、その芳香のもとになっています。
メタノールCH3OHは、水と任意の割合で溶け合う無色の液体で、工業的には酸化亜鉛ZnOを主体とする触媒を用いて、一酸化炭素COと水素H2から合成されています。メタノールCH3OHは重要な化学品であり、世界のメタノールCH3OH製造量は、年間でおよそ1,100万tにも達しています。そのほとんどは、ホルムアルデヒドHCHOなど化学薬品の製造原料として使用されますが、その他に溶媒や燃料としての用途もあります。

図.25 工業的なメタノールCH3OHの合成反応
メタノールCH3OHを飲むと初めは酔いますが、これには間接的な毒性があります。その毒性は、体内の「アルコールデヒドロゲナーゼ(アルコール脱水素酵素)」によって、メタノールCH3OHがホルムアルデヒドHCHOに代謝され、さらに「アルデヒドデヒドロゲナーゼ」によって、ホルムアルデヒドHCHOがギ酸HCOOHに代謝されることが主原因です。ホルムアルデヒドHCHOの体内半減期はおよそ1分であり、ホルムアルデヒドHCHOによる毒性はほとんど問題になりません。ホルムアルデヒドHCHOからギ酸HCOOHへの代謝は迅速に行われるため、メタノールCH3OHの毒性は、ギ酸HCOOHの毒性に起因するものです。
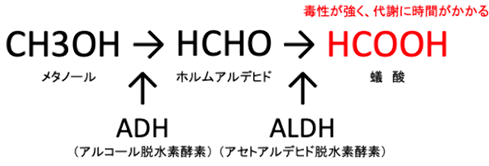
図.26 体内におけるメタノールCH3OHの代謝経路
ギ酸HCOOHは、網膜のガングリオン細胞を攻撃し、ミトコンドリアの電子伝達系に関わる「シトクロムオキシダーゼ」を阻害するため、視神経に毒性が現れます。また、ギ酸HCOOHは酸性を示すので、体内で体液のpHを下げる(代謝性アシドーシス)作用があり、これも毒作用の原因になります。なぜ目だけに症状が強く現れるのかというと、網膜にはビタミンAを酸化するための「アルコールデヒドロゲナーゼ」が豊富に存在しており、メタノールCH3OHを飲んだ場合には、網膜でホルムアルデヒドHCHOが大量に作られるためです。そして、体内のホルムアルデヒドHCHOは、速やかにギ酸HCOOHまで代謝されます。日本では、メタノールCH3OHは劇物の扱いであり、購入時の毒劇物譲受書への署名捺印を義務付けられています。致死量については様々な報告があり、個人差が大きいと考えられますが、メタノールCH3OHはエタノールC2H5OHの10倍以上の強い毒性があります。
第二次世界大戦後の混乱期に、メタノールCH3OHを含む工業用アルコールで嵩増しした粗悪な密造酒「カストリ酒」が闇市で出回り、これを飲んだ人の一部が失明したり、命を落としたりといった事件がありました。失明者が多く出たことから、別名の「メチルアルコール」にちなんで、当時は「目散るアルコール」と揶揄されたりしていました。成人がメタノールCH3OHを8〜20 g飲用すると失明し、30〜100 g飲用すると死亡するといわれています。

図.27 闇市で出回った粗悪な密造酒「カストリ酒」の多くは、材料と製法が不明だった
(ii) エタノールC2H5OH
エタノールC2H5OHは、「エチルアルコール」とも呼ばれ、単に「アルコール」といえば、エタノールC2H5OHを指す場合が多いです。無色の液体で、水と任意の割合で溶け合います。「酒精」という名が示すように、各種の酒類に含まれています。15世紀になって、酔いの原因であることが確かめられました。
エタノールC2H5OHを現在のように「酒精」あるいは「生命の水」として取り扱ったのは、中世の古い医学の殻を破り、「近代医学の父」と呼ばれたパラケルススです。「パラケルスス」とは「ケルススを超える人」という意味で、ケルススは古代ローマ時代の医学者です。パラケルススは、錬金術で得た化学の知識を医学に導入し、酸化鉄や水銀などの金属を初めて医薬品に採用したことで知られます。この頃には、ワインは恐らく不完全な形ではあったにせよ、すでに蒸留され、医薬として用いられていたと思われます。昔、ペストの流行に際して、蒸留されたワインが、効力を発揮したという記録もあります。アルコールは優れた溶媒でもあるので、薬草から有効成分を抽出するのに役立ちました。

図.28 パラケルススは、16世紀に活躍した化学者で、「悪魔使い」であったという伝承もある
エタノールC2H5OHは、ショ糖(スクロース)C12H22O11を生成するときに得られる「廃糖蜜」を発酵させて製造します。穀物デンプンやイモ類、米などからも、同じ発酵法でエタノールC2H5OHを製造することができ、これらを「穀物アルコール」と呼んでいます。また、このように微生物によって糖がアルコールに変換される過程を、「アルコール発酵(ethanol fermentation)」といいます。アルコール発酵は、アルコール濃度が約15%になるまで進行し、それ以上にはなりません。しかし、工場での発酵液中のアルコール濃度は一般に通常6〜8%ほどです。これを分留して、エタノールC2H5OHを濃縮していきます。
C12H22O11 + H2O → 4C2H5OH + 4CO2
エタノールC2H5OHは、発酵法以外にも、酸触媒水和反応によって、エチレンC2H4から製造されています。濃硫酸H2SO4などの酸触媒を用いて、エチレンC2H4から製造されているエタノールC2H5OHの年間生産量は、なんと100万tにも達しています。工業用の高純度のエタノールC2H5OHは、酒類の製造に転用される可能性があります。そこで、酒類に転用できないように、わざと毒性の強いメタノールCH3OHやベンゼンC6H6などを添加しています。そうすると、酒税の課税対象とならず、工業用のエタノールC2H5OHは安価になるのです。しかしながら、第二次世界大戦後の混乱期には、安価な工業用アルコールを密造酒に転用していたため、メタノール中毒がしばしば起きていました。

図.29 エチレンC2H4を用いたエタノールC2H5OHの合成反応
市販のアルコールは、エタノールC2H5OHが95.57%と水H2Oが4.43%からなる定沸点混合物(b.p.78.15℃)です。そのため、単純な蒸留だけでは、エタノールC2H5OHの濃度を、これ以上高めることはできません。残りの水分を除去して、純度が100%のエタノールC2H5OHを製造するためには、生石灰CaOなどの乾燥剤を加えます。生石灰CaOは、エタノールC2H5OHとは反応しませんが、水H2Oと反応して水酸化カルシウムCa(OH)2になり、結果的に水H2Oを除去することができるのです。生石灰CaOで乾燥させたエタノールC2H5OHを蒸留で精製すれば、水H2Oを含まない100%の無水エタノールC2H5OHが得られます。
CaO + H2O → Ca(OH)2
(iii) 人類と酒の歴史
人類と酒との付き合いは、恐らく今から1億3千万年前までさかのぼります。果実を付ける種子植物が登場した時代です。その頃の私たちの祖先は、まだ人類になっておらず、恐竜に怯えるリスのような初期哺乳類でした。そこに、「サッカロミセス・セレヴィシエ」という果実を好む酵母が現れました。この酵母は、酸素O2があまりないところでは、果実のフルクトースやグルコースなどの糖を取り込んで、生活のエネルギーを得ます。そのときに副産物として、アルコールと二酸化炭素CO2を外に排出します。アルコールを副産物としてエネルギーを得る方法は、酵母にとって効率はあまり良くありません。しかし、その代わりに、アルコールを毒とする他の微生物を寄せ付けない効果がありました。
C6H12O6 → 2C2H5OH + 2CO2
そして、果実を食べる哺乳類は、果実が成熟したかどうかをアルコールの匂いで知ることができる種が有利になりました。そのため、私たちの祖先は、「アルコール好き」の性質を持って進化してきたのでしょう。初めは、果実や蜂蜜などの自然発酵によって、酒ができたのだと思われます。酒を造る酵母は、自然界では糖分の多い環境に暮らしており、果実の皮などにも付着しています。そのため、果実を潰して容器に置けば、次第にアルコール発酵が進む場合が多いです。石や木などの凹みがあるところに果汁や蜂蜜を放置しておけば、自然界の野生酵母の胞子が入り込んで、アルコール発酵が始まります。いわば、自然にできあがった「お酒」です。
自然界でも、ヒト以外の動物が飲酒する例はいくつか知られています。例えば、スウェーデンでは、発酵したリンゴを食べて酔うヘラジカが観察されていますし、カリブ海のセントキッツでは、観光客のカクテルを盗み飲むサルがいます。野生動物が習慣的に飲酒をする例としては、ギニアでのオックスフォード・ブルックス大学の研究が有名です。野生のチンパンジーが潰してスポンジ状にした葉を使って、発酵したヤシの樹液の「ヤシ酒」を飲んでいる様子が観察されています。複数のチンパンジーが集まって「飲み会」をすることもあるようで、飲酒後は眠り込む、落ち着きがなくなるなどの酒酔いの行動兆候も見られたといいます。

図.30 葉を使ってヤシ酒を飲むチンパンジー
世界史上で酒が本格的に登場したのは、約1万年前だといわれています。ホモ・サピエンスが定住生活をし、農耕革命を起こしたときです。今のところ、年代が確認された最古のアルコール飲料の遺物は、中国のジアフー遺跡で発見された約9千年前のものです。2004年、この遺跡から発見された壺の内部に残っていたものを化学分析すると、「米・蜂蜜・ブドウ・サンザシ」が使われていることが分かりました。9千年前の人々は、これらの材料を混ぜた酒を味わっていたのでしょう。
古来より、人類は果汁やハチミツなどを原料にして、酒を造っていました。世界中の民族に酒があり、日本酒やビール、焼酎、ウイスキー、ワイン、コニャック、テキーラ、泡盛、紹興酒など、酒の種類は大変に多いです。酒に含まれるエタノールC2H5OHの含量は、ビールでは4〜6%、日本酒やワインでは13〜17%、蒸留酒であるウイスキーや焼酎では25〜50%ほどです。発酵によるアルコール度数は、酵母の種類にもよりますが、15%前後の濃度にまでしか達することはありません。それ以上になると、酵母自身がエタノールC2H5OHの影響で死滅してしまうからです。そのため、アルコール度数を高めるためには、何度か蒸留を行って、エタノールC2H5OHを濃縮する必要があります。人類最古の蒸留酒は紀元前4世紀頃で、メソポタミアの北部で簡単な蒸留器が出土しています。
表.5 主な酒のアルコール度数と原料
|
酒 |
度数 |
種類 |
原料 |
|
ビール |
4〜6% |
醸造酒 |
大麦やライ麦など |
|
マッコリ |
約7% |
醸造酒 |
米や麦 |
|
ワイン |
13〜15% |
醸造酒 |
ブドウ |
|
日本酒 |
15〜17% |
醸造酒 |
米 |
|
焼酎 |
20〜30% |
蒸留酒 |
芋や麦など |
|
ウイスキー |
40〜55% |
蒸留酒 |
大麦やライ麦など |
|
ブランデー |
40〜55% |
蒸留酒 |
ブドウやチェリーなど |
|
ウォッカ |
40%以上 |
蒸留酒 |
トウモロコシやジャガイモなど |
|
テキーラ |
40%以上 |
蒸留酒 |
アガベ |
蒸留を繰り返すことで、さらに高いアルコール度数を得ることが可能です。しかし、水(b.p.100℃)とエタノール(b.p.78.3℃)の混合物が沸騰する際、エタノールC2H5OHの濃度が96%に達すると共沸混合物となり、それ以上は度数を上げられなくなります。「スピリタス」というポーランドを原産地とするウォッカには、エタノールC2H5OHが95〜96%も含まれています。これは、70回以上もの蒸留を繰り返すことで、極限までアルコール度数を高めた蒸留酒です。現地ポーランドでは、スピリタスをそのまま飲む習慣はなく、カクテルのベースにしたり、家庭用消毒薬として使用したりするようです。

図.31 スピリタスは、アルコール度数が世界最高の酒として知られている
ワインはブドウから作られますが、ブドウは初めからアルコールを含んでいる訳ではありません。発酵によってアルコールを作り出すのです。まず、完全に熟したブドウを潰し、果柄を除き、発酵槽に入れて保存します。このブドウ汁は、ブドウの果皮に付着していた酵母菌の働きでワインになります。発酵の間に、果皮から色素(アントシアニン)が溶け出してきて、赤ワインができあがります。果皮を取り除き、果汁だけを絞って発酵させれば、白ワインができます。赤ワインは25℃の高めの温度で7〜10日間、白ワインは15℃のやや低めの温度で2〜3週間ほど発酵させます。澱(おり)を取り除いて酒樽に入れ、1〜3年間は保存します。そうすると、私たちが普段飲んでいるワインができあがります。

図.32 ワインは、極めて歴史の古い酒の一つであり、紀元前8,000年頃の新石器時代に醸造が始まったとされる
世界中の酒類の中で、最も多く飲まれているのがビールです。ビールの歴史は古く、紀元前4,000年頃にはメソポタミアを中心とした近東一帯、いわゆる肥沃な三日月地帯でビールが普及していました。ここでは穀物が豊富に採れるので、大量の穀物を原料とした酒として、ビールが誕生したのです。ビールの場合では、大麦を発芽させて、乾燥させた「麦芽」を粉砕して湯を加え、麦芽に含まれる酵素を使って発酵させます。この過程で、麦のデンプンが糖に、タンパク質がアミノ酸に分解されます。原料に大麦でなく麦芽を使う理由は、大麦の状態では休眠している酵素が、発芽させることによって活性が増加するからです。さらに、苦味と香気のためにホップの雌花を加え、ビール酵母を加えて発酵させます。5〜10℃で7〜10日ほど「主発酵」させると、糖分の多くがアルコールに変わります。主発酵が終わった若ビールは、0℃付近の低温で1〜3カ月かけて「後発酵」させ、若ビールの未熟な香りを消して香味を整えます。この間に生成した二酸化炭素CO2は、ビールの中に溶け込み、おいしいビールができあがります。
ところで、「ビールの泡」はビールなのでしょうか?そんなことを巡って、日本で裁判が起こったことがあります。1940年に「ビールに泡があるのは不当」だとして、東京都上野のビアホールが訴えられたのです。警察が「生ビールの仕入れ量より売り上げた量の方が異常に多い」として、法令違反の疑いから検察が起訴したのです。しかし、裁判で酒学の権威といわれた坂口謹一郎が、「ビールの泡はビールよりもアルコール濃度が高い」と証明したことから、1944年に「ビールの泡もビールと認める」という判決がなされました。戦時中に一体何をやっているんだと言いたくなりますが、まだビールが高価な時代のエピソードです。

図.33 ビールの歴史は古く、紀元前4,000年頃にメソポタミア文明のシュメール人により作られていたものが最古とされる
さて、日本酒では、米が原料となります。コウジ菌の働きで、米デンプンが徐々に糖化されます。この過程を、「麹作り」といいます。ここまでは、甘酒作りと同じです。この麹を米と混ぜ、水を加え、酒母といわれる「酛(もと)」、つまり日本酒酵母を加えて発酵させます。こうしてできるのが「醪(もろみ)」で、普通は25日くらいかかります。そして、その醪を搾ると、新酒ができます。新酒を夏の間に貯蔵すると、エタノール分子の周囲に水分子の層ができたり、微量成分が分解したり酸化したりして、口当たりや香り、味が変化していきます。こうした変化が落ち着くのが、夏の貯蔵を経た秋の酒だといわれています。秋の酒のことを「秋上がり」や「秋晴れ」などと呼ぶことがあります。日本酒を作るためには、このように米に含まれるデンプンを糖化するコウジ菌と、生成する糖をアルコール発酵する酵母を同時に働かせなければならず、非常に高度な技術を必要とします。このような醸造法を「複発酵」といい、特に日本酒の場合では、一つの容器でこれを行うので「並行複発酵」といいます。私たちの先祖が、実に上手くこのような微生物の働きを観察し、昔から利用していたことには、大変驚かされます。

図.34 日本酒は、ワインと異なり原料に糖分を含まないため、糖化という過程が必要になる
ワインもビールも日本酒も、すべて酵母の働きで糖をアルコールに変えていることに違いはありません。原料や方法、それに酵母の種類が少しずつ違うだけです。酵母は、菌類の中でも「サッカロミセス」に属し、いずれも様々な炭水化物を発酵させる能力を持ちます。ワイン酵母は「サッカロミセス・セレヴィシエ」の変種である「サッカロミセス・エリプソイディウス」、ビール酵母は「サッカロミセス・セレヴィシエ」、日本酒酵母は「サッカロミセス・サケ」のように、生化学的な性質の違いから分類されています。酵母は、アルコール醸造に欠かせない微生物であると同時に、ヒトと同じ真核生物であることから、モデル生物として古くから様々な研究がなされてきました。

図.35 自然界に酵母は、各種の果実や土壌、海、川など様々な場所に生育している
(iv) 飲酒による人体への影響
ところで、かのディオスコリデスも述べている「アルコールによる酩酊」とは、一体何なのでしょうか?なぜお酒は、人を酔わせるのでしょうか?経口より摂取されたエタノールC2H5OHは、20%が胃から、80%が小腸から吸収されて、血管に入ります。そして、中枢神経系を麻痺させ、脳内の神経伝達物質に作用し、脳の活動を抑えます。酔い初めは、「β -エンドルフィン」という快楽物質が脳内に放出されるため、不安感が取り除かれ、高揚感が得られます。これが、いわゆる「ほろ酔い」と呼ばれる状態です。適量のエタノールC2H5OHは、血行を良くし、精神をリラックスさせる効果があります。
また、エタノールC2H5OHは、体内で代謝されて「アセチルCoA」と呼ばれる化合物に変換され、これがエネルギー源にもなります。1 gでだいたい 7.1 kcal(29.8 kJ)の燃焼エネルギーを発生しますが、人体での利用率はせいぜい60〜70%程度といわれているので、実際のところは5 kcalぐらいです。エタノールC2H5OHは「エンプティカロリー」と呼ばれるように、体内で速やかに代謝されるため、脂肪になりにくいという特徴があります。ただし、太りにくいというのは、エタノールC2H5OHだけを摂取した場合であって、お酒と一緒におつまみを食べると当然太ります。エタノールC2H5OHは体内で代謝されると、最終的に二酸化炭素CO2と水H2Oになります。
C2H5OH(液) + 3O2(気) → 2CO2(気) + 3H2O(液) ΔH =−29.8 kJ
飲み方次第では、お酒も毒になることがあります。エタノールC2H5OHの量が増すと、理性や判断力の低下が目立つようになり、立ったり歩いたりが上手くできなくなります。さらに血中のアルコール濃度が高くなると、運動や呼吸に関する脳の中枢も抑制され、意識喪失が起こって、最悪の場合では呼吸不全から死ぬこともあります。「イッキ飲み」による急性アルコール中毒の死亡者は、呼吸不全がほとんどです。ただし、呼吸中枢麻痺というよりは、自分の吐瀉物が気管に詰まって窒息死することの方が多いようです。もし仲間が急性アルコール中毒になったら、仰向きではなく、横向きに寝かせるようにしましょう。そんなになるまで飲ませないことが、一番大切なのですが・・・。このように中毒性や依存性が強いことは、お酒の負の側面といえるでしょう。ちなみに、肝臓のアルコール処理能力は、個人差はありますが、1時間で日本酒1/3合程度しかありません。ということは、日本酒を4合飲んだ場合は、その処理には12時間程度かかり、翌朝までアルコールが残っていることになります。
表.6 血中アルコール濃度と主な症状
|
血中アルコール濃度 |
主な症状 |
|
0.01% |
軽い酩酊 |
|
0.05% |
軽い乱れ |
|
0.10% |
知覚能力低下、反応が鈍くなる |
|
0.15% |
感情が不安定になる |
|
0.20% |
千鳥足、嘔吐、精神錯乱 |
|
0.30% |
会話不明瞭、知覚喪失、視覚の乱れ |
|
0.40% |
低体温、低血糖、筋コントロール不全、痙攣、瞳孔拡大 |
|
0.70% |
意識障害、昏睡、呼吸不全、死亡 |
体内に摂取されたエタノールC2H5OHの最大8%までは、呼気や汗などとして体外へ排出されます。お酒を飲み続けると、文字通り体が「アルコール臭く」なるのはこのせいです。残りのエタノールC2H5OHのほとんどは肝臓で酸化されて、アセトアルデヒドCH3CHOになります。アセトアルデヒドCH3CHOは毒性が強く、頭痛や吐き気などを引き起こします。お酒を飲んで顔が赤くなるのも、アセトアルデヒドCH3CHOが血管を拡張させることによります。
エタノールC2H5OHが代謝されて生成するアセトアルデヒドCH3CHOは、悪酔いや二日酔いの原因物質です。本来、アセトアルデヒドCH3CHOは、「アセトアルデヒドデヒドロゲナーゼ(アセトアルデヒド脱水素酵素)」の働きによって、直ちに無害な酢酸CH3COOHに変わり、さらに二酸化炭素CO2と水H2Oに分解されます。しかし、お酒を飲み過ぎて、アセトアルデヒドCH3CHOの血中濃度が増加すると、とんでもない悪酔い状態が出現します。アセトアルデヒドCH3CHOの作用で、吐き気、頭痛、動悸、寒気、精神錯乱などが現れるのです。これが、いわゆる「二日酔い」の状態です。
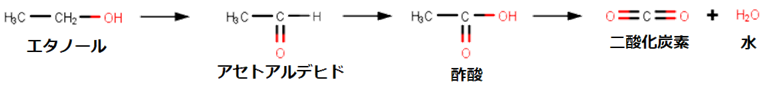
図.36 エタノールC2H5OHの代謝
「酒を嫌いにする薬」として知られる「アンタビュース(ジスルフィラム)」は、このアセトアルデヒドデヒドロゲナーゼの働きを阻害してしまう薬です。アンタビュースは、1954年にアメリカ食品医薬品局(FDA)の認可を受けたアルコール依存症の治療薬で、この薬を飲んだあとにアルコールを摂取すると、アセトアルデヒドCH3CHOの血中濃度が上昇し、気分が悪くなります。ただし、この薬はアルコールへの渇望を抑える訳ではないので、「アルコール依存症患者を注意深く監視できる環境」でのみ有効です。
ちなみに、人種によって、アセトアルデヒドデヒドロゲナーゼの酵素活性の強さが違います。白人と黒人では、ほぼ全員の酵素活性が強いのですが、黄色人種には、この酵素活性が遺伝的に弱い人が存在します。日本人では、アセトアルデヒドデヒドロゲナーゼの酵素活性が強い人は56%しかいなくて、活性が弱い人が40%、非常に弱い人が4%ほど存在しているといわれています。アセトアルデヒドデヒドロゲナーゼの酵素活性が弱いと、毒性のあるアセトアルデヒドを上手く処理できないので、少し飲んだだけで顔が真っ赤になり、頭が痛くなったり、気持ち悪くなったりします。欧米人に比べ、日本人が酒に弱い理由は、この酵素が不足していて、体質的に大量のアルコールが分解できないためです。居酒屋で「飲み放題」が成立するのは、日本にはアルコールに弱い人が一定数いるからでしょう。ヨーロッパやアフリカにはアルコールに弱い人がほとんどいないので、日本に来た外国人は「飲み放題」にビックリするといいます。欧米で同じことをやったら、たちまち飲み倒されて店が潰れてしまいます。
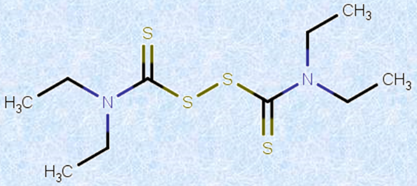
図.37 アンタビュースは、アルデヒドデヒドロゲナーゼを阻害する代表的な物質として知られる
また、飲み会が終わったあとに、締めとして食べたくなるのがラーメンですが、この現象にも科学的な理由があります。アルコールの分解には、大量の血糖が使われるので、アルコールを大量に飲むと、血糖値が低くなります。さらに、アルコールには利尿作用があるため、体中の水分が失われてしまいます。それ故に、飲み会のあとには、「汁気のある高カロリーの炭水化物」が食べたくなり、その条件を満たすのがラーメンであるという訳です。

図.38 飲み会のあとにラーメンを食べたくなるのには、科学的な理由がある
適度な飲酒は、心臓病と心臓発作のリスクを下げてくれることがよく知られています。「酒は百薬の長」といわれるように、飲酒は適量であれば、健康にとって良い効果があると考えられています。酒を一滴も口にしない人から、相当量を飲む人まで、飲酒の度合いでグループ分けして追跡調査すると、病気にかかるリスクは、酒量が極端に少ないか、あるいは多いグループほど高く、ほどほどに飲酒する人が最も低いという結果が得られます。飲酒量と死亡率の関係をグラフにすると、Jの字に似ているので、「Jカーブ効果」と呼ばれています。欧米の研究では、男性では1日平均19 g(ビール・酎ハイ500 mL、日本酒・ワイン180 mL、焼酎110 mL、ウイスキー60 mL)、女性では1日平均9 g(ビール・酎ハイ250 mL、日本酒・ワイン90 mL、焼酎50 mL、ウイスキー30 mL)のアルコール摂取が、死亡率が最も低かったと報告されています。
ロンドンで行われた疫学調査は、心臓病と酒量の関係を探るべく、ロンドン市の公務員1万人以上を対象に飲酒習慣を調べ、14年間に渡って健康状態を追跡したものです。この調査によると、アルコールを週に248 g(アルコール度数5%のビールなら約5.7 L)以上飲むグループと全く酒を飲まないグループは、アルコールの摂取量が週に248 g未満のグループに比べて、心臓病で死ぬリスクが2倍でした。飲酒頻度も調べたところ、毎日から週に1回のグループが、心臓病リスクが最も低かったといいます。頻度がそれ以上でもそれ以下でも、リスクは2倍になるのです。
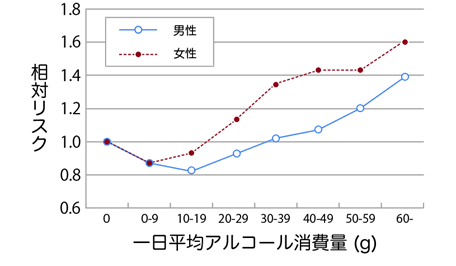
図.39 一日平均アルコール消費量(g)と死亡率の関係(厚生労働省 e−ヘルスネットより引用)
・参考文献
1) 卜部吉庸「化学の新研究」三省堂(2013年発行)
2) 左巻健男「絶対に面白い化学入門 世界史は化学でできている」三松堂(2021年発行)
3) ジョーシュワルツ「シュワルツ博士の化学はこんなに面白い」主婦の友社(2002年発行)
4) 竹内薫/丸山篤史(執筆協力)「まだ誰も解けていない科学の未解決問題」中経出版(2014年発行)
5) 東京理科大学サイエンス夢工房「楽しむ化学実験」朝倉書店(2003年発行)
6) 独立行政法人 酒類総合研究所「うまい酒の科学」ソフトバンククリエイティブ(2007年発行)
7) David J.Linden著/岩坂彰訳「報酬回路―なぜ気持ちいいのか なぜやめられないのか」河出書房新社(2012年発行)
8) トレヴァー・ノートン「世にも奇妙な人体実験の歴史」文藝春秋(2012年発行)
9) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
10) 船山信次「こわくない有機化合物超入門」技術評論社(2014年発行)
11) Peter W. Atkins著/千原秀昭・稲葉章訳「分子と人間」東京化学同人(1993年発行)
12) メートランド・ジョーンズ「ジョーンズ有機化学(上)」東京化学同人(2000年発行)
13) 山崎幹夫「新化学読本-化ける、変わるを学ぶ」白日社(2005年発行)
14) リチャード・スティーヴンズ著/藤井留美訳「悪癖の科学 その隠れた効用をめぐる実験」紀伊國屋書店(2016年発行)
15) リディア・ケイン/ネイト・ピーダーセン「世にも危険な医療の世界史」文藝春秋(2019年発行)