・芳香族炭化水素
【目次】
(1) 芳香族炭化水素
「芳香族炭化水素(aromatic hydrocarbon)」は、特有の芳香を持っているという共通点の他、水素原子Hの数に対して、炭素原子Cの数の割合が高い(全般に1:1に近い)という特徴がありました。酢酸がC2H4O2、砂糖がC12H22O11といったように、炭素原子Cより水素原子Hの数が多い物質がほとんどである中、芳香族炭化水素の炭素含有率の高さは際立っていました。芳香族炭化水素は、どうやら共通の部分構造を持っていると思われました。様々な実験から、これらは炭素原子Cが6個からなる「核」を持っていると考えられたのです。
こうした中、イギリスの化学者であるマイケル・ファラデーは、1825年に照明用の鯨油を熱分解し、新たな化合物を得て、分子式をC12H6と報告しました。一方で、ドイツの化学者であるアイルハルト・ミッチェルリッヒは、1834年に安息香酸(英名benzoic acid, 安息香という香料の成分)の分解によって得られた透明な液体を、「ベンジン(benzin)」と名付けています。やがて、この両者は同じ化合物であること、分子式はC6H6であることが判明し、名称は「ベンゼン(benzene)」に改められました。そして、このベンゼンこそが、芳香族炭化水素の最も基本的な「核」であることが分かってきたのです。

図.1 イギリスの化学者マイケル・ファラデーは、鯨油からベンゼンの単離に成功した
分子内にベンゼンの構造を持ついくつかの化合物が、特有の芳香を持つことから「芳香族(aromatic)」と名付けられたのですが、必ずしもベンゼンの構造を持つ化合物が「芳香(aroma)」を持つとは限りません。現在では、その特色ある化学物質とその化学的安定性を表す意味として、「芳香族」という言葉を使っています。すなわち、分子中にベンゼンの構造を持つ化合物は熱力学的に安定であり、その特別な安定性を一般的に「芳香族性(aromaticity)」と呼んでいます(有機反応機構(芳香族求電子置換反応)を参照)。
ベンゼンのことを、かつて「ベンゾール(benzol)」と呼んでいたことがあります。しかし、ベンゼンはヒドロキシ基(-OH)を持っていないので、アルコールではありません。今では「ベンゾール」は、粗製ベンゼンの名前になっています。初期には、石炭を熱分解して得られるタールの分留によって得られていましたが、現在は石油を熱分解するときの副産物として、トルエンやキシレンとともに大量に得られます。
(i) ベンゼンのケクレ構造式
ドイツの化学者であるフリードリッヒ・アウグスト・ケクレは、1829年にドイツのダルムシュタットで産まれました。1847年にルートヴィヒ・ゲオルクス・ギムナジウムを卒業し、建築家を志してギーセン大学に入学しました。しかし、1848年に「19世紀最大の化学者の1人」とも称されるユストゥス・フォン・リービッヒの有機化学の講義を聴講して感銘を受け、一度退学して、有機化学へと転向することを決心しました。そして、1849年にギーセン大学に再び入り、リービッヒの門下生となって、薫陶を受けました。その後、ケクレはフランスに行き、シャルル・ジェラールの下で研究を行ったあとに、1865年にボン大学の教授となりました。もともと建築家になろうとした人だけに、形に対する感覚も鋭かったのでしょうが、ケクレはまた夢見る人でもあったらしいです。
図.2 もともと建築家を志望していたケクレは、形に関する感性が優れていたのであろう
ケクレは1865年に、ベンゼンについて最初の妥当な構造式を提唱しました。ケクレは、ストーブの前でうたた寝をしていたときに、ヘビが自分の尻尾に噛み付きながら激しく回っている夢を見ました。ケクレは「これだ!」と思い、目覚めるやいなや、ベンゼンの構造をスケッチしました。ケクレは、6個の炭素原子がそれぞれ正六角形の頂点に位置し、それぞれに水素原子が1個結合していると考えたのです。さらに、ケクレは各炭素原子に4の原子価を与え、6員環の周囲が、単結合と二重結合とで交互に形成されていると考えました。次の図.3に、ベンゼンの「ケクレ構造式」を示します。
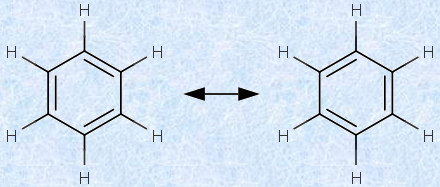
図.3 ベンゼンのケクレ構造式
この構造だけから予想すると、ベンゼンの不飽和度はU=4であるので、かなり不飽和な環状アルケンと同じような性質を持つはずです。ところが、実際には不飽和結合の検出反応(臭素の脱色反応や過マンガン酸塩テスト)に対して、ベンゼンは陰性を示すことが分かっています。ケクレはその説明として、6員環上の単結合と二重結合とが、「極めて迅速に入れ代わる」ために、ベンゼンではアルケン特有の反応が起こりにくいと考えたのです。
ベンゼンの構造に関して提唱された「ケクレモデル」は完璧なものではありませんでしたが、ほぼ正しいということができます。実際のベンゼンは、単結合と二重結合が入れ代わっている訳ではありません。2つのケクレ構造式は、電子配列が異なるだけで、どの構造でも、すべての原子の位置が変わっていないことに注目して欲しいです。これが意味することは、ベンゼンの2つのケクレ構造式は、「平衡」の関係にあるのではなく、「共鳴(resonance)」の関係にあるということです。つまり、ケクレ構造式は、ベンゼンの真の構造を表現するのに必要な、2つの等価な「共鳴構造式」を示していることになります。
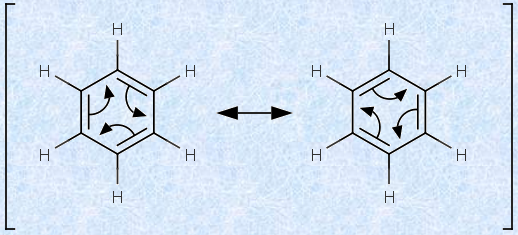
図.4 真のベンゼンの構造は、この2つの共鳴構造式の混成体である
図.4で示した2つの共鳴構造式は、いずれか1つが、他のものより真のベンゼンの構造をより適切に表現しているというものではありません。ベンゼンを「共鳴混成体」として表現する限り、真のベンゼンは、どの共鳴構造式よりも安定化されています。ベンゼンには、単結合も二重結合も存在しない代わりに、その中間の性質を持った、炭素-炭素単結合が1種類だけ存在しています。したがって、ベンゼンがアルケンと同じ化学反応挙動を示さないのは、当然なのです。
このベンゼンの構造が正しいことは、現在の物理学的手法による様々な測定結果により立証されています。アイルランドの結晶学者であるキャスリーン・ロンズデールのX線回折を用いた研究によると、ベンゼン分子は平面構造を持ち、炭素原子は正六角形の各頂点に位置していることが判明しています。また、すべての炭素-炭素結合の長さは等しく、その結合距離は0.139 nmであり、典型的な炭素-炭素単結合距離(0.154 nm)と二重結合距離(0.134 nm)の中間にあることが分かっています。
(ii) 芳香族化合物の命名法
系統的な化合物命名法が確立される以前から、それとは関係なく、芳香族の化学は相当に進んでいました。それ故に、歴史的な慣用名が多く適用されており、IUPACでもそれを受け入れています。例として、次の図.5に芳香族化合物の慣用名を示します。有機化学に通じるためには、この慣用名も覚えておく必要があります。
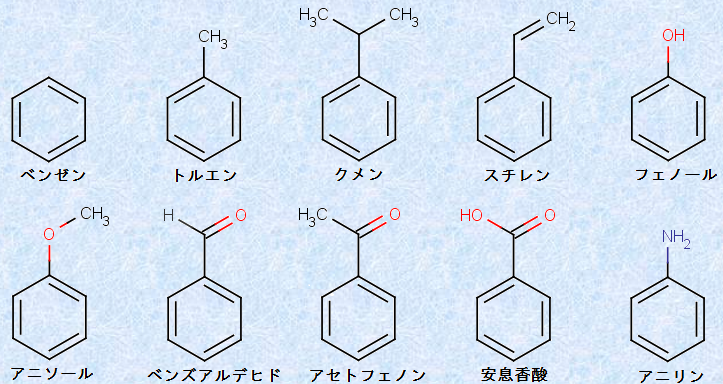
図.5 芳香族化合物の慣用名
置換基が1つ存在する「一置換ベンゼン」は、ベンゼンの誘導体として系統的に命名されます。次の図.6に、芳香族化合物におけるICPACシステムの適用例を示します。
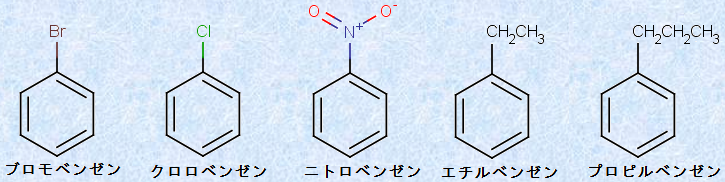
図.6 芳香族化合物におけるICPACシステムの適用例
置換基が2つ存在する「二置換ベンゼン」には、3つの構造異性体が書けます。それぞれは「オルト(ortho)」・「メタ(meta)」・「パラ(para)」という接頭語を付けて表され、あるいは「o -」・「m -」・「p -」の略号で示されることが多いです。オルトはギリシャ語で「正規の」、メタは「あとの」、パラは「反対側の」という意味を持ちます。また、置換基Xが存在する位置を炭素1とすると、それに対するo位は炭素2と炭素6、m位は炭素3と炭素5、p位は炭素4で表すこともできます。化合物の構造に慣用名を持つ構造が含まれている場合は、その慣用名を母体として命名します。サリチル酸のように、二置換ベンゼンそのものが慣用名で呼ばれる場合もあります。
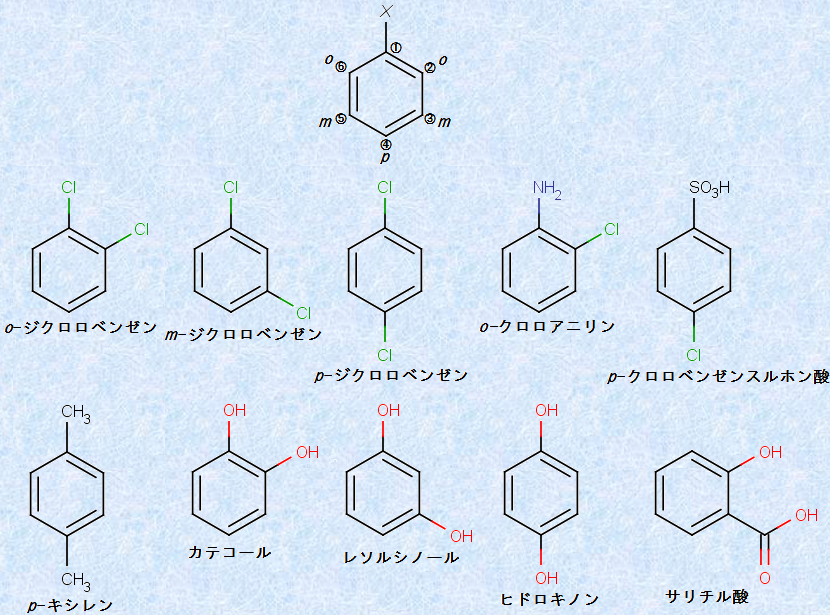
図.7 二置換ベンゼンにおけるICPACシステムの適用例
芳香族の置換基は「アリール(aryl)」と呼ばれ、アルキル基に記号「R」を使用するのと同じように、記号「Ar」を用いて表します。芳香族の置換基では、「フェニル基(phenyl group, Ph)」が最もよく使われ、ベンゼンから水素1個を取り去った-C6H5基(-Ph基)を表します。また、「ベンジル基(benzyl group, Bzl)」もよく使われ、-CH2C6H5基(-Bzl基)を表します。このような置換基名の使用例を、次の図.8に示します。
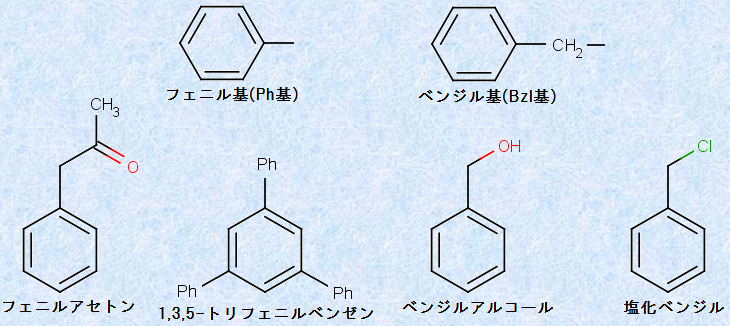
図.8 フェニル基とベンジル基
(iii) ベンゼンの共鳴エネルギー
ベンゼンが、共鳴安定化した特別な構造であることは、すでに説明しています。しかし、共鳴安定化により、どのくらい熱力学的に安定になるのかを、直感的に判断するのは難しいです。そこで、ベンゼンの二重結合を固定した仮想的な分子「1,3,5-シクロヘキサトリエン」をベンゼンと比較することで、ベンゼンが共鳴により、どのくらい安定になるのかを数値的に算出することができます。
一般的に、炭素-炭素二重結合の水素化反応は発熱的(ΔH<0)であり、反応エンタルピーは、二重結合1 mol当たりでおよそΔH =−110〜130 kJ/molです。反応エンタルピーの正確な値は、二重結合に置換している置換基の種類によっても変わりますが、シクロヘキセンの水素化エンタルピーは−120 kJ/molです。そこで、環内に二重結合を2つ持つ1,3-シクロヘキサジエンの水素化エンタルピーは、シクロヘキセンの水素化エンタルピーのちょうど2倍の値である、−240 kJ/molになるであろうと当然予想されます。実際にこの推測はほぼ正しく、1,3-シクロヘキサジエンの水素化エンタルピーは−232 kJ/molです。実測値−232 kJ/molと推測値−240 kJ/molのエンタルピー差は、1,3-シクロヘキサジエンの「共鳴効果(resonance effect)」が影響していると思われます。つまり、1,3-シクロヘキサジエンは共鳴により、8 kJ/molだけ予想よりも安定化しています。
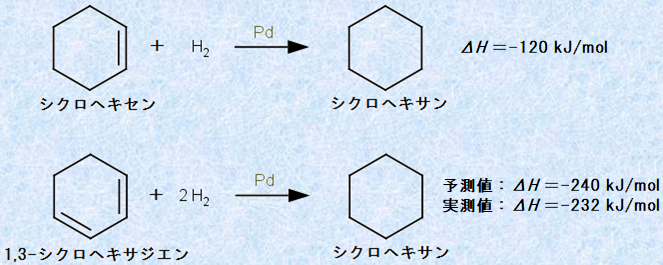
図.9 環状アルケンの水素化熱
次に、3つの二重結合を6員環に含む仮想分子「1,3,5-シクロヘキサトリエン」の水素化エンタルピーを予想してみましょう。まず、「1,3-シクロヘキサジエン」に3つ目の二重結合が増える場合にも、シクロヘキセンに2つ目の二重結合が増えた際と、同じ水素化エンタルピーの変化分(−232+120=−112 kJ/mol)があると仮定します。そうすると、「1,3,5-シクロヘキサトリエン」の水素化エンタルピーは、−232−112=−344 kJ/molと見積もられます。
ところが、実際にベンゼンを水素化して水素化エンタルピーを測定すると、たった206 kJ/molの発熱しか起こらないのです。これらの数値の関係を、次の図.10に示します。この図から、ベンゼンは仮想の「1,3,5-シクロヘキサトリエン」よりも、138 kJ/mol安定であることが分かります。これがベンゼンの特別な安定化によるエネルギーであり、このエネルギー差は、ベンゼンの「共鳴エネルギー(resonance energy)」と呼ばれます。
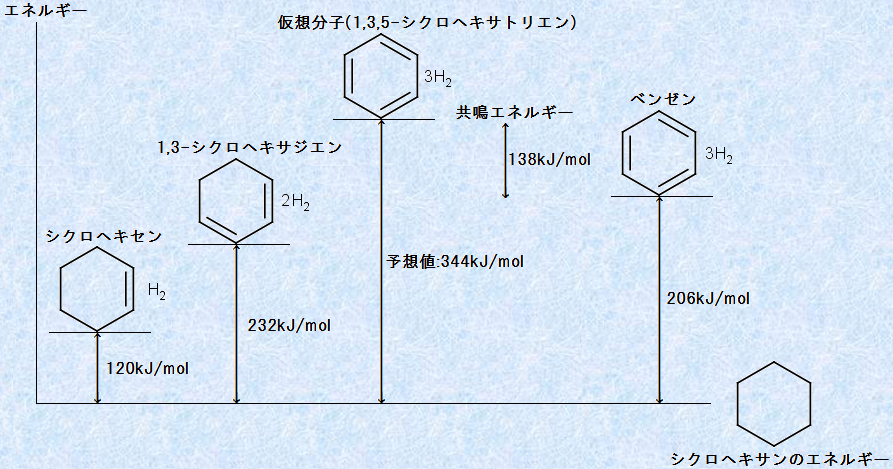
図.10 水素化熱データからの計算値と実測値の比較から求められたベンゼンの共鳴エネルギー
(2) ベンゼンの反応
ベンゼン環には、特別な安定性があります。したがって、様々な反応において、結果的に芳香族のベンゼン環を保ったまま、共鳴エネルギーを保持するように反応することが極めて多いです。つまり、芳香族化合物の最も一般的な反応は、ベンゼン環上の水素原子を、他の原子や基で置き換える「置換反応」です。しかし、場合によっては、「付加反応」などによって、芳香族性を失った生成物を与えることもあります。
(i) 付加反応
ベンゼン環が非常に安定であるため、ベンゼン環の不飽和結合は、アルケンなどの二重結合と比べて反応しにくいです。しかし、紫外線などの光を当てると、ベンゼンは塩素Cl2と付加反応を行い、「1,2,3,4,5,6-ヘキサクロロシクロヘキサン(ベンゼンヘキサクロリド)」が生成します。ベンゼンヘキサクロリドは「BHC」とも呼ばれ、強力な殺虫効果があるので、かつては農薬として広く使用されていました。しかし、ベンゼンヘキサクロリドは環境中で分解されにくく、人に対する毒性も強いため、現在は多くの国で使用が禁止されています。
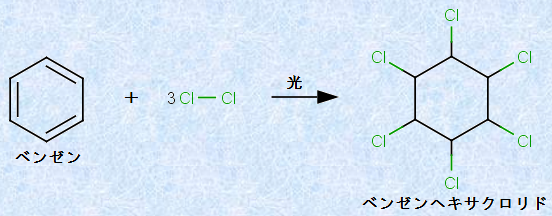
図.11 ベンゼンヘキサクロリドの生成反応
また、ベンゼンは、ニッケルNiあるいはパラジウムPdを触媒として、高温高圧で水素H2と付加反応し、「シクロヘキサン」を与えます。これには、200℃で10〜30気圧というかなり厳しい条件を必要とします。シクロヘキサンは、有機溶媒としても用いられ、洗浄液や接着剤などに含まれています。
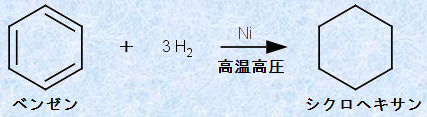
図.12 シクロヘキサンの生成反応
(ii) 酸化開裂反応
ベンゼン環は、非常に安定な構造であり、反応不活性です。しかし、五酸化二バナジウムV2O5を触媒として、高温で酸素O2と反応させると、二重結合の酸化開裂が起きて、最終的に「無水マレイン酸」を与えます。この反応は、「酸化開裂反応(oxidative cleavage reaction)」と呼ばれます。
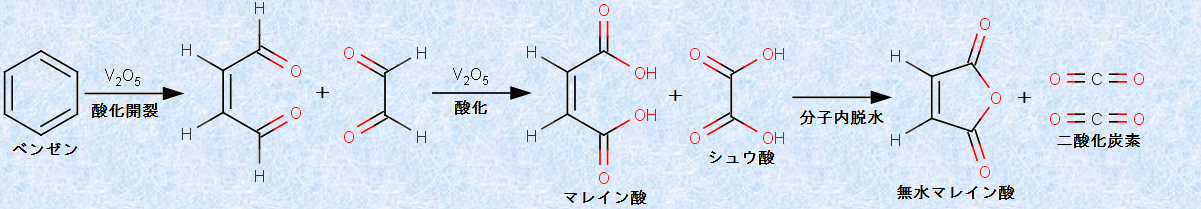
図.13 ベンゼンの酸化開裂反応
また、ベンゼン環を2つ持つナフタレンを酸化開裂すると、最終的に「無水フタル酸」を生成します。どちらも酸無水物が最終生成物になる理由は、反応条件が高温であるため、容易に脱水が起こるからです(カルボニル化合物(カルボン酸)を参照)。なお、フタル酸は英語で「phthalic acid」といい、ナフタレン(naphthalen)と同じ綴りを含みます。これは偶然ではなく、ナフタレンを五酸化二バナジウムV2O5の存在下で空気酸化して得られるものだからです。
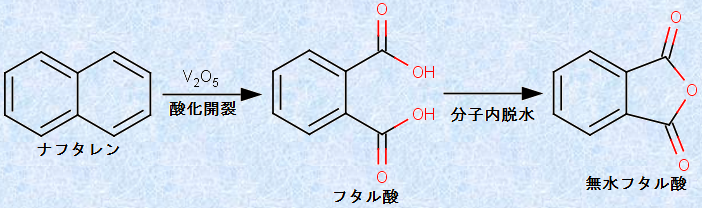
図.14 ナフタレンの酸化開裂反応
(iii) 芳香族求電子置換反応
ベンゼンは不飽和結合を持ちますが、ベンゼン環の共鳴エネルギーにより、熱力学的に大きく安定化しています。したがって、ベンゼン環を破壊するためには、非常に大きなエネルギーを必要とします。そのため、ベンゼンの反応では、ベンゼン環の構造を破壊する不飽和結合への「付加反応」よりも、ベンゼン環の構造が保存される「置換反応」の方が起こりやすいです。ベンゼンの代表的な置換反応のいくつかを、次の図.15に示します。
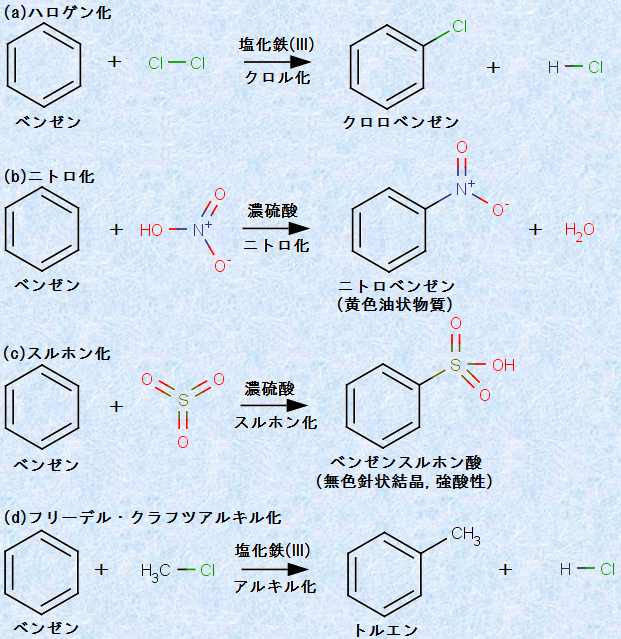
図.15 ベンゼンの置換反応
これら図.15で示したすべての反応が、ベンゼン環に対する強力な「求電子剤(electrophilic reagent)」の攻撃で始まることは、多くの証拠により分かっています。求電子剤とは、陽イオンや電子親和力の大きい空軌道を持つ分子のことで、強力な求電子剤は、電子豊富なベンゼン環と容易に反応することができます。
通常、塩素Cl2や硝酸HNO3、塩化メチルCH3Clなどの求電子性の弱い分子は、そのままではベンゼン環と反応することができません。しかし、適切な触媒を加えることで、これらの分子は強力な求電子剤に変化し、ベンゼン環の水素原子と置換反応を起こします(詳細は有機反応機構(芳香族求電子置換反応)を参照)。
(iv) 置換反応
ベンゼン環に置換している炭化水素基は、脂肪族炭化水素と同じように、光の存在下で塩素Cl2とフリーラジカル連鎖反応をします。塩素分子Cl2は、光のエネルギーにより反応性の高い塩素ラジカルClに解離して、これが炭化水素基の水素原子と反応して、炭化水素基を次々とクロロ化していきます。例として、次の図.16に光照射下におけるトルエンと塩素Cl2の「フリーラジカル連鎖反応」を示します。(脂肪族炭化水素(アルカン)を参照)
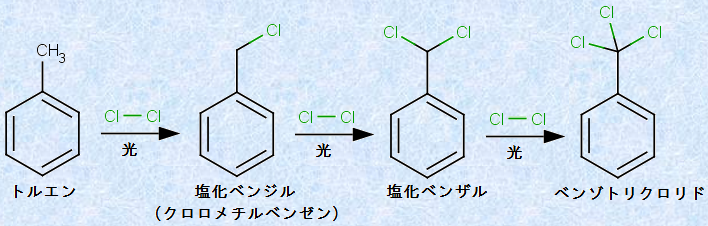
図.16 光照射下におけるトルエンと塩素Cl2のフリーラジカル連鎖反応
(3) ベンゼン環への置換反応の配向性
形式的に考えると、ベンゼンの一置換体をさらに置換して、二置換体に変化させるとき、次の図.17で示すような3種類の構造異性体が生成しそうです。これらの二置換体は、それぞれ「オルト体」・「メタ体」・「パラ体」と呼ばれます。
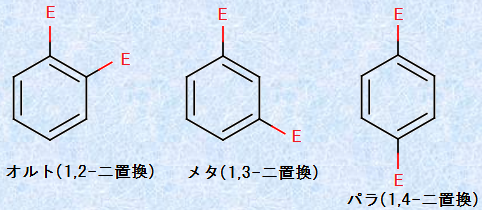
図.17 二置換ベンゼンには3種類がある
一置換ベンゼンにおいて、o位は2つ、m位は2つ、p位は1つあるので、生成する二置換ベンゼンのオルト体:メタ体:パラ体の異性体比は、2:2:1の統計的な分布になりそうです。しかし、実際はベンゼン環上の置換基の種類によって、生成する二置換ベンゼンの異性体比が大きく変わります。
多くの一置換ベンゼンの反応性を調べると、「オルトとパラ二置換体を主に与えるもの(オルト-パラ配向性)」と、「メタ二置換体を優先して与えるもの(メタ配向性)」に分類されます。また、新しく入ってくる置換基の位置と、その反応速度にも相関があります。すなわち、オルト体とパラ体を主に与える一置換ベンゼンは、ベンゼン自身に比べて反応速度が速いです。逆にメタ体を与える一置換ベンゼンは、ベンゼン自身に比べて反応速度が遅いです。
表.1 置換ベンゼンの「配向効果」と「活性化効果」
|
|
置換基の種類 |
置換基の名称 |
相対反応速度 |
|
|
H(ベンゼン) |
|
1 |
|
オルト-パラ配向性 |
-NH2、-NHR、-NR2 |
アミノ基 |
非常に速い |
|
-OH |
ヒドロキシ基 |
非常に速い |
|
|
-OR |
アルコキシ基 |
非常に速い |
|
|
-R |
アルキル基 |
速い |
|
|
-NHCOR |
アシルアミノ基 |
速い |
|
|
-F-、-Cl、-Br、-I |
ハロゲノ基 |
遅い |
|
|
メタ配向性 |
-COR |
アシル基 |
遅い |
|
-COOH |
カルボキシ基 |
遅い |
|
|
-CONH2 |
アミド |
遅い |
|
|
-COOR |
エステル |
遅い |
|
|
-SO3H |
スルホ基 |
遅い |
|
|
-C≡N |
シアノ基 |
遅い |
|
|
-NO2 |
ニトロ基 |
遅い |
表.1から分かることは、オルト-パラ配向性を示す-NH2・-OH・-OR・-NHCOR・-Clなどの置換基は、すべて芳香環に直結した原子上に非共有電子対を持っており、ベンゼン環に対して「電子供与的」です。一方で、メタ配向性を示す-COR・-COOH・-COOR・-NO2などの置換基は、芳香環に直結した原子に部分的な正電荷を持っており、ベンゼン環に対して「電子求引的」です。また、置換ベンゼンの置換反応も、基本的にはベンゼンの置換反応と同じ反応機構であることが分かっているので、ベンゼン環の電子密度を増加させる「電子供与基」は、ベンゼン環の反応を活性化させ、反応速度を大きくします。一方で、ベンゼン環の電子密度を低下させる「電子求引基」は、ベンゼン環の反応を不活性化させ、反応速度を小さくします。
表.1の中では、ハロゲノ基(-F・-Cl・-Br・-I)が若干特殊な置換基です。ハロゲノ基は非共有電子対を持つので、ベンゼン環に対して電子供与的であり、同時に電気陰性度が大きいので、ベンゼン環に対して電子求引的でもあります。ハロゲノ基では、これら2つの相反する効果が同時に作用するので、ハロゲノ基は、唯一の重要な例外です。すなわち、ハロゲノ基は強力な電子求引基であるため、ベンゼン環の反応性を低下させます。しかし、その一方で、ハロゲン原子上の共有電子対の存在により、オルト-パラ配向性を示します。
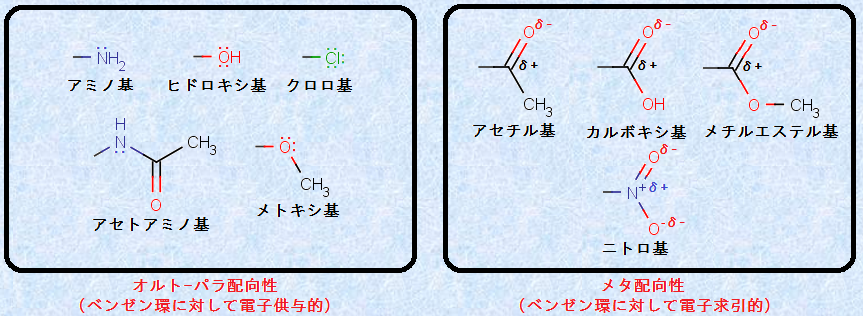
図.18 置換基の種類によって、置換ベンゼンの配向性が変化する
また、アルキル基は、炭素原子上に非共有電子対を持ちませんが、水素原子よりも電子供与的です。そのため、アルキル基は、オルト-パラ配向性を示す置換基です。例えば、次の図.19で示すように、トルエンと濃硝酸HNO3を硫酸酸性条件下で反応させると、ベンゼン環のニトロ化が起きて、「2,4,6-トリニトロトルエン(TNT)」が生成します。
TNTは、爆薬として有名であり、核兵器の威力は、一般的に同じエネルギーのTNTの質量に換算して表記されます。例えば、1 Mt(メガトン)の爆発エネルギーを持つ核兵器は、TNT火薬1 Mt=100万tの爆発エネルギーを示します。TNT火薬が爆発すると、爆風が秒速7,000 mもの速さで、周囲に高速で広がります。このように爆風が音速340 m/sを超える燃焼反応を「爆轟」といいます。爆轟は衝撃波を伴うため、たとえ爆炎を回避したとしても、無事では済みません。ちなみに、TNTをジョセフ・ウィルブランドが1863年に開発してから半世紀弱ほどは、TNTは「黄色の染料」として使われていて、「爆爆薬」としては認識されていなかったという逸話もあります。
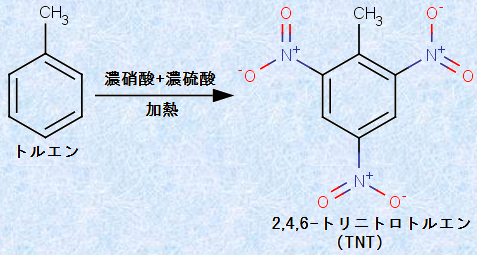
図.19 メチル基(-CH3)は、オルト-パラ配向性を示す置換基である
・参考文献
1) 佐藤健太郎「すごい分子 世界は六角形でできている」講談社(2019年発行)
2) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
3) メートランド・ジョーンズ「ジョーンズ有機化学(上)」東京化学同人(2000年発行)
4) Peter W. Atkins著/千原秀昭・稲葉章訳「分子と人間」東京化学同人(1993年発行)
5) 山崎幹夫「新化学読本-化ける、変わるを学ぶ」白日社(2005年発行)