・第14族元素(炭素族元素)
【目次】
(1) 第14族元素
周期表において、第14族に属する炭素C・ケイ素Si・ゲルマニウムGe・スズSn・鉛Pbなどの元素を、総称して「炭素族元素」といいます。炭素族元素の原子は、最外殻電子配置がns2np2である元素(n=2,3,4・・・)です。炭素族元素は、非金属元素(C, Si)と金属元素(Ge, Sn, Pb)に分けられ、炭素Cと鉛Pbとの間の元素(ケイ素Si・ゲルマニウムGe・スズSn)は、非金属と金属の両方の性質を兼ね揃えつつ、周期が大きくなるにつれて、金属的な性質が増大していきます。具体的には、炭素Cの単体(ダイヤモンド)は電気伝導性を持ちませんが、ケイ素SiやゲルマニウムGeの単体は半導体で、スズSnや鉛Pbになると良導体です。
第14族では、炭素Cとケイ素Siは、どちらも共有結合性化合物を作ります。炭素Cは、その単体が鎖構造として長く連なる性質を示すのに対して、ケイ素Siは、その単体よりもむしろ酸化物の方が鎖構造として長く連なる性質が強いです。この炭素Cの性質は、多様な炭素骨格を形成し、膨大な有機化合物を形成する要因の1つとなっています(基礎有機化学を参照)。一方で、ケイ素Siの酸化物の性質は、多様な岩石の特性となって現れ、工業的には「ケイ素樹脂」として利用されています(合成高分子化合物を参照)。また、第14族の中でもスズSnや鉛Pbは、精錬しやすい鉱石として産出することから、古くから金属資源として人類に活用されてきました。一方で、ゲルマニウムGeは、地殻中に広く分布し、有用な鉱石もないことから、利用されるようになったのは20世紀に入ってからです。
(2) 炭素
(i) 炭素C
「炭素(carbon)」は、生命にとって極めて重要な元素です。私たちは、穀物や肉類、糖類などの食品として、炭素化合物を毎日摂取しています。生命物質であるタンパク質、糖、核酸、アミノ酸、脂肪などの有機化合物は、すべて炭素化合物です。体の中では、炭素Cは酸素Oに次いで多く含まれ、体重70 kgの成人の体には、実に12.6 kgもの炭素Cが含まれています。
炭素Cの同素体には、「ダイヤモンド(diamond)」や「黒鉛(graphite)」、「フラーレン(fullerene)」、「カーボンナノチューブ(carbon nanotube)」、「グラフィン(graphene)」などがあり、炭素Cの共有結合の多様性を反映した様々な物質が知られています。

図.1 炭素Cの同素体
(i-1) ダイヤモンドと黒鉛
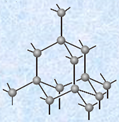
炭素Cの単体としては、互いに同素体の関係にある「ダイヤモンド(diamond)」と「黒鉛(graphite)」が知られています。ダイヤモンドの語源は、古代ギリシア語で「屈しない」を意味する「adamas」に由来し、驚異的な堅牢性(モース硬度10)を示す物質です。黒鉛は、化学的知識に乏しい時代に「鉛を含む物質」として「black lead(黒い鉛)」「plumbago(石墨)」などと呼ばれていましたが、炭素の単体と分かり、1789年にギリシア語の「graphein(書く)」をもとに現在の英語名である「graphite(グラファイト)」に改名されました。
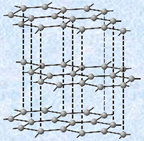
ダイヤモンドと黒鉛は、炭素原子の結合の仕方と結晶構造が異なるため、両者の性質には多くの相違点が現れます。例えば、ダイヤモンドの理想的な結晶は無色透明ですが、黒鉛は灰黒色の結晶です。 また、ダイヤモンドでは各炭素原子はsp3混成軌道を作り、混成軌道の性質である正四面体の対称性を保ちながら、互いに共有結合で結びついて、等方的なダイヤモンド構造の結晶を形成します。一方で、黒鉛では各炭素原子はsp2混成軌道と1つのp軌道を形成して、他の炭素原子と共有結合をします。この結果、平面の正六角形が繋がって、無限に広がった「ハニカム構造(honeycomb structure)」と呼ばれる2次元構造が形成され、重なり合った層間は、弱いファンデルワールス力によって結びつけられた異方性の強い構造となります。そのため、黒鉛の塊を紙に擦り付けると、ファンデルワールス力が切れて黒鉛の層の一部が紙に付着して残るので、紙に文字を書くことができます。
宝石として重宝されるダイヤモンドの光学的特長は、炭素原子間に強く結び付いている価電子が入射光の速度を下げるため、大きな屈折率を持つことです。そのため、ダイヤモンドの反射率は高く、鋭い光沢を伴います。このような光沢を「ダイヤモンド光沢(diamond luster)」と呼びます。また、文献にもよりますが、ダイヤモンドは4,700℃(1.2×1010 Pa)と極めて高い融点を持ちます。一方で、黒鉛の融点は4,700℃(1.2×107 Pa)とする文献もありますが、昇華点を約3,370℃とする文献もあります。ちなみに、ダイヤモンドは、空気中などの適当な酸化条件下では、1,000℃程度で燃焼させることができます。
表.1 ダイヤモンドと黒鉛の主な性質
|
|
ダイヤモンド |
黒鉛 |
|
軌道と結合 |
sp3混成軌道-σ結合 |
sp2混成軌道-σ結合 p軌道-π結合 |
|
構造と形 |
正四面体骨格の巨大分子
|
ハニカム構造の層状物質
|
|
電気伝導性 |
非常に小さい |
大きい |
|
熱伝導性 |
非常に大きい |
大きい |
|
硬さ |
非常に硬い |
面に沿ってずれやすい |
|
密度 |
3.52 g/cm3 |
2.25 g/cm3 |
|
用途 |
研磨剤、宝石など |
潤滑剤、鉛筆の芯、電極 |
ダイヤモンドと黒鉛の性質の顕著な差は、機械的性質や電気的性質に見ることができます。ダイヤモンドは、最も硬い物質の1つとして知られ、モース硬度が10の標準物質となっています。一方で、黒鉛は層間の結合がファンデルワールス力なので、ダイヤモンドよりも結合が弱く、モース硬度は1〜2と軟らかいです。また、ダイヤモンドが優れた電気絶縁体であるのに対して、黒鉛は高い電気伝導性を示します。特に、黒鉛の各層の同一平面内では、p軌道にあるπ電子の重なりが大きいので電気伝導率は高くなり、その温度依存性は金属的です。一方、黒鉛の各層の面に垂直な方向では、π電子の重なりが小さいので、電気伝導率は1/104 まで小さくなりますが、半導体的な振る舞いを示します。
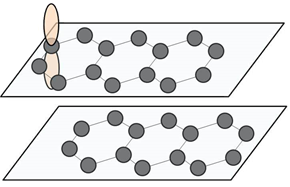
図.2 黒鉛は各層の同一平面では、電気伝導性は金属並みに高くなる
また、黒鉛から人工的にダイヤモンドを合成する技術は、1880年頃から取り組まれ、1953年にはスウェーデンで最初の再現可能な「高温高圧合成法」が確立しました。現在では、年間1億カラット(1カラット=0.2 g)以上の人工ダイヤモンドが生産されています。さらに、1990年代後半には、炭素原子を含む爆薬を使用し、爆轟(気体の熱膨張の速度が音速を超え、衝撃波を伴う燃焼のこと)による高温高圧によって、人工ダイヤモンドを合成する技術が開発されました。いずれの方法も、高温高圧(1,500℃・数万気圧)で黒鉛を強力に圧縮することで、炭素原子をsp2混成からsp3混成へと変換させています。そのような高温高圧下では、ダイヤモンドの方が黒鉛よりも安定になります。このようにして合成された人工ダイヤモンドは、工作機械や切削道具として工業的に用いられる他、不純物が少なく透明な人工ダイヤモンドは、宝石としても利用されています。
人工ダイヤモンドの製造技術は日進月歩であり、内包物が少なくて透明度の高いものが合成できるようになってきています。そこで、最近では「メモリアル・ダイヤモンド」というものを販売する会社も出てきました。これは、亡くなった方の遺灰や遺骨から抽出した炭素で、人工ダイヤモンドを作ってくれるサービスです。0.2カラットのもので、40万円ぐらいから作製が可能になっています。料金次第で、色やサイズなども選べるようです。

図.3 メモリアル・ダイヤモンドで作った指輪(写真は0.3カラットのダイヤモンドを使用)
(i-2) フラーレン
炭素Cの第三の同素体としては、「フラーレン(fullerene)」が知られています。フラーレンは、五員環12個と任意の数の六員環からなる多面体分子です。1980年代の中頃までは、炭素の同素体としては、ダイヤモンドと黒鉛の2つしか知られていませんでした。ところが1985年になって、イギリスの星間物質化学の専門家であるハロルド・クロトーとその共同研究者らは、偶然にも新しい炭素の同素体を発見したのです。彼らは、真空中で炭素棒に高エネルギーのパルスレーザー光を当てて、炭素原子を昇華させた際に、ある特定のフラグメント(断片)が多量に生成することを観測し、それが一体何であるのかを調べていました。彼らは、その主要なフラグメントを「サッカーボールの形をしたC60分子である」とイギリスの科学論文誌「Nature」で発表しましたが、当時はそれを疑問視する化学者が少なくありませんでした。しかし、やがてこの構造の正しさが証明されると、この球状分子は「フラーレン(fullerrene)」と命名され、注目を集めるようになります。ちなみに、この「フラーレン」という名称は、この化学構造がサッカーボールを半分に切った形に似ている「ジオデシック・ドーム」を設計したアメリカの建築家バックミンスター・フラーの名にちなんで名付けられたものです。

図.4 フラーによって考案されたジオデシック・ドーム
フラーレンは、ダイヤモンドや黒鉛に次ぐ第三の炭素同素体であり、C60・C70・C74・C76・C78などの様々な大きさのフラーレン分子が存在します。代表的なフラーレンは、五員環12個と六員環20個からなるC60分子です。フラーレンの見た目は、一見するとただの黒いススのようですが、通常のススと違うところは、芳香族性を持つためにベンゼンやトルエンなどの芳香族有機溶媒に溶けることです。例えば、C60分子をベンゼンに溶かすと、綺麗な赤色の溶液になります。
1990年には、炭素棒を高電圧によって昇華させ、発生する煙をゆっくり冷やすことで、フラーレンを大量に作り出す方法が発見されました。これが学会で発表されたとき、聴いていた研究者たちが、その方法を試すために慌てて帰ってしまい、次の講演の客席がガラガラになってしまったという逸話があります。これほど化学者を興奮させた物質は、そうないでしょう。フラーレンは、有機化学が好奇心をそそる新しい分子を次々に提供できる学問であるということを、改めて私たちに教えてくれました。フラーレンを発見した功績によって、1996年度のノーベル化学賞は、発見者であるハロルド・クロトー、リチャード・スモーリー、ロバート・カールの3名に贈られています。
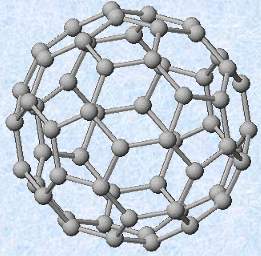
図.5 サッカーボールの形をしたC60フラーレン
ここで、フラーレンの五員環と六員環の数にどんな関係があるのか、簡単な計算をして調べてみましょう。一般に多面体の面の数f、辺の数e、頂点の数vの間には、次のような「オイラーの多面体定理(Polyhedron theorem of Euler)」が成り立ちます。
![]()
ここで、フラーレンの五員環の数がx個、六員環の数がy個あるとすると、次のような式が成り立ちます。辺の数や頂点の数を表すときに、2や3で割っているのは、辺や頂点が重複して数えられているためです。
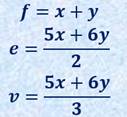
これを多面体定理の式に代入すると、x=12(yは任意)を得ます。この結果は、多面体が閉じるためには、五員環が12個あれば良いことを示しています。つまり、どのようなフラーレンであっても、五員環の数は12個と決まっているのです。仮に五員環が6個ならば半球状の形になり、五員環が5個ならば円錐状の構造になります。炭素原子の六員環を繋ぐだけでは、どこまで行ってもただの平面にしかなりません。炭素原子の繋がりに丸みを持たせるためには、五員環は不可欠な構造なのです。
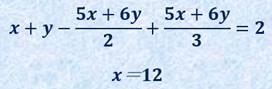
現在、注目を集めているのは、フラーレンの内部の隙間に金属原子を閉じ込めた「内包フラーレン(endohedral fullerene)」です。フラーレンと内包された金属原子は強く結合せず、神社の鈴の中に入っている石のようにガラガラと動いています。この内包フラーレンの種類も用途も、無限に存在しています。例えば、フラーレン内部に毒性のあるガドリニウムGdを閉じ込めたガドリニウム内包フラーレンは、「MRI(核磁気共鳴画像法)」の造影剤に利用できるのではないかと注目されています。内包することによって毒性による副作用がなくなり、MRIの解像度が高くなるという利点があります。この内包フラーレンをマウスに注射すると、内包フラーレンは、ガン細胞に集まってきます。これは、ガン細胞が急激に成長するために隙間が多く、その隙間と内包フラーレンが、ちょうど合致するからです。ガドリニウム内包フラーレンを多く含んだガン細胞は、MRIによって他の細胞との識別が容易になり、放射線治療の精度が向上すると考えられています。
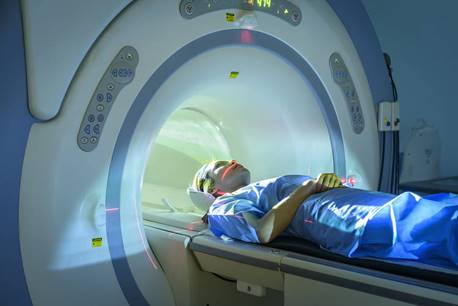
図.6 ガドリニウム内包フラーレンは、MRIの造影剤に利用されている
また、近年では、フラーレンの抗酸化力を生かした化粧品が人気になっています。フラーレン自体の見た目はただの真っ黒な粉ですが、昔から抗酸化力があることは分かっていました。ただし問題は、まったく水に溶けないことです。そこで、ポリビニルピロリドン(PVP)でフラーレンを包み込み、水に分散させる手法が発明されました。これにより、化粧品分野にフラーレンを幅広く使えるようになったのです。化粧品としてのフラーレンの特徴は、抗酸化力が強くて持続性があることです。同じ抗酸化剤として知られるビタミンCやビタミンEと比較すると、フラーレンは光が当たっても分解されにくく、様々な条件下でも抗酸化力を発揮することが確認されています。
(i-3) カーボンナノチューブ
炭素Cの六員環が繋がって、微小な円柱状の分子を形成する場合もあります。円柱の両端は、五員環によって閉じた構造をしています。これは、「カーボンナノチューブ(carbon nanotube)」と呼ばれる分子です。カーボンナノチューブは、日本電気株式会社の基礎研究所で研究していた飯島澄男が1991年にフラーレンを合成している途中、アーク放電した炭素電極の陰極側の堆積物中から発見しました。カーボンナノチューブの直径は、文字通り数nm程度、すなわち髪の毛の数万分の1という細さです。全体が安定性の高い芳香環でできているので、熱や薬品に強く、ほとんど劣化しません。比重はアルミニウムAlの半分程度という軽さながら、機械的強度は鋼鉄Feの約100倍にも及び、それでいてしなやかに曲がることもできます。もし傷や欠陥のない完璧なカーボンナノチューブが作れたら、直径1 cmのロープで、1,200 tもの重量を吊り上げられる計算になるといいます。カーボンナノチューブは、「理論上考えられる最強の素材」といっても過言ではなく、将来「宇宙エレベータ(space elevator)」を建造するときに、ケーブルの材料として使うことができるのではないかと期待されています。
図.7 カーボンナノチューブは、同じ質量の鋼鉄と比較すると、80倍の強度を持つ
宇宙エレベータは、宇宙空間への新たな進出手段として構想されているものです。地上から約36,000 kmの距離にある静止軌道まで伸びるロープに沿って、運搬機が上下することで、宇宙と地球間の物資を輸送できます。ケーブルの全長は約100,000 kmで、かつては必要な強度を持つ素材が存在しなかったために、宇宙エレベータはSF作品などの中で描かれる概念的な存在でしかありませんでした。しかし、20世紀末になって、高い強度を持つカーボンナノチューブが発見されたことにより、一気に現実味が帯びてきたのです。宇宙エレベータは、約200 km/hの速度でケーブルを上昇し、静止軌道までは約1週間かかります。現行のロケットでは、輸送コストが物資1 kg当たり100万円ほどかかりますが、宇宙エレベータでは、輸送コストは物資1 kg当たり1万円ぐらいにまで抑えられるといいます。
宇宙エレベータの建設費用は、1兆円から2兆円ほどと見積もられています。新東名高速道路の建設費用が4兆4千億円であることを考えると、このぐらいの金額は、安いような気もします。実際にこの金額で建設することができるのであれば、宇宙開発のコストが低くなることが望める他、様々な利点があると思うので、あっという間に利益を出すということは可能だと思われます。現在のところ、宇宙エレベータは、ユニバーサル・スタジオ・ジャパンや東京スカイツリーを竣工したことで有名な株式会社大林組が、2050年の完成を目指して研究開発をしています。しかし、現在の技術では、カーボンナノチューブの長さを数mm程度にするのが限度であり、宇宙エレベータの開発には課題も多くあります。

図.8 宇宙エレベータの想像図
さらに、カーボンナノチューブは、分子内の炭素原子の配列によって、よく電気を通す導電体にも、また半導体にもなりえます。後者を使えば、現在のシリコンを基本としたコンピュータよりもずっと低電力で、かつ1,000倍高速でも、正確に作動するものが作れるとされます。カーボンナノチューブを使った太陽電池や集積回路は、薄くて透明なので、人間の肌に直接貼り付けて使うことができます。人工知能技術と組み合わせれば、体温や心拍、汗の成分などを分析し、常時健康管理の実現が期待できます。
なお、カーボンナノチューブの欠点は、分子量が非常に大きいので、ほとんどの溶媒に全く溶けないということです。しかし、2007年に九州大学の中嶋直敏が、意外なものに溶けることを発見しました。それは、サントリー食品が販売している「伊右衛門 濃い目」です。緑茶には、渋味成分である「カテキン」が豊富に含まれています。カテキンは、多数の芳香環とヒドロキシ基(-OH)を持つポリフェノールで、分子内に疎水性の部分(芳香環)と親水性の部分(ヒドロキシ基)があります。すなわち、カテキンが界面活性剤のような役割をすることで、カーボンナノチューブは緑茶に分散するようになったと考えられています。
図.9 カテキンには、血圧上昇抑制作用や血中コレステロール調節作用などがあるとされている
(i-4) グラフィン
カーボンナノチューブに加えて、黒鉛の一層に対応する炭素原子の膜は、「グラフィン(graphene)」と呼ばれています。この物質は、2004年にその存在が証明された新しい炭素材料です。炭素原子がハニカム格子状に結合した2次元結晶であり、その厚みは炭素原子1個分からなります。電子の移動度が極めて高く、電子物性には2次元系の特徴と考えられる特異な現象も見られることから、多くの科学者に注目されています。グラフィンを世界で初めて単離して、その基礎物性を明らかにしたマンチェスター大学のアンドレ・ガイムとコンスタンチン・ノボセロフは、その先端的な研究の功績を称えられて、2010年のノーベル物理学賞を受賞しました。

図.10 グラフィンは、原子1個の厚さのsp2混成炭素原子のシートである
黒鉛は、このグラフィンの単層が多数積み重なった構造です。層同士は、ファンデルワールス力で弱く引き合っています。紙に鉛筆で文字を書くというのは、この黒鉛の層をセルロースに擦り付け、くっ付けていく作業です。黒鉛の層が剥がれやすいのは、古くから知られた身近な現象でした。しかし、この一層だけを剥がせるか、剥がしてみるとどうなるかを、試した者は長らくいませんでした。2004年に初めてこれをやってのけたのが、ガイムとノボセロフでした。グラフィンは、「セロハンテープ法」によって、黒鉛の層を少しずつ剥がしていくことによって得られます。これは、黒鉛をセロハンテープで剥離し、得られた薄膜の表面をさらにまた剥離するという、極めて単純な方法です。こうして得られた黒鉛の薄片の中に、一層だけのグラフィンが見つかったのです。
グラフィンは、炭素原子1個分の厚みしかないので、世界で最も薄い物質です。あまりにも薄いので、性質を変えることなく、曲げたり折ったりも自在に可能です。それでいて、引っ張りなどの機械的強度は高く、その強度は平面内ではダイヤモンドをも上回ります。可視光の透過率は単層で約97%もあり、光をよく透過するので透明ですが、大きなシート1枚あれば、計算上では数kgの猫を吊るすことも可能であるといわれています。熱伝導率や電気伝導率も、理論上あらゆる物質中で最大という夢の素材です。
(i-5) 無定形炭素
炭素Cの単体のうち、乱雑な構造を持ち、結晶構造を持たない石炭やコークス、木炭などを「無定形炭素(amorphous carbon)」といいます。無定形炭素は、ダイヤモンドや黒鉛などの複数の同素体の結合が混雑した状態であり、木炭や活性炭などの一般的な炭は、これに不純物が含まれたものです。
無定形炭素には、工業的に重要な「炭素繊維(carbon fiber)」も含まれます。ポリアクリロニトリル系の炭素繊維は、1959年に大阪工業技術試験所(現産業技術総合研究所)の近藤昭男が発明したものです。ポリアクリロニトリル繊維を、無酸素状態で低温(200〜350℃)ならび高温(1,000〜2,000℃)で、段階的に熱分解することで製造します。炭素繊維の密度は約1.8 g/cm3と軽く、鉄Feの7.8 g/cm3に比べて約1/4の密度です。アルミニウムAlの2.7 g/cm3あるいはガラス繊維の2.5 g/cm3と比べても優位に軽く、その上で重量当たりの強度は鉄Feの約10倍、硬さは約7倍にも達します。このため、プラスチックと混合して自動車などに使えば、安全性を高められる上に、燃費を大いに向上させることができます。プラスチックを母材にし、そこに炭素繊維を混ぜた「炭素繊維強化プラスチック(carbon fiber reinforced plastics)」は、最新鋭の航空機や宇宙船に欠かせない材料になっています。橋や建材にも広く用いられており、来るべき大災害から、多くの生命を守ってくれています。その他、炭素繊維は釣竿やゴルフクラブ、テニスラケットなどのレジャー用品にも、広く用いられています。

図.11 炭素繊維を用いた複合材料としては、炭素繊維強化プラスチックなどがある
(ii) 一酸化炭素CO
一酸化炭素COと二酸化炭素CO2は、いずれも有機化合物の燃焼によって発生する気体です。燃焼反応において酸素O2の供給量が十分でない場合、二酸化炭素CO2と一緒に一酸化炭素COも生成します。一酸化炭素COは無色無臭の気体であり、水には難溶です。高温では還元性が大きく、酸化物の還元剤として工業的に使用されます。例えば、鉄Feの製錬では、赤鉄鉱(主成分Fe2O3)などの鉄鉱石にコークスCを燃やして生成させた一酸化炭素COを反応させて、酸化鉄(III) Fe2O3を還元しています(遷移元素(クロム・マンガン・鉄・コバルト)を参照)。
Fe2O3 + 3CO → 2Fe + 3CO2
また、一酸化炭素COは人体には有毒な気体です。体内に入ると、血液中の赤血球に含まれる「ヘモグロビン」と結合して、その機能を阻害します。ヘモグロビン中の鉄(II)イオンFe2+ と酸素O2よりも約200倍も強く配位結合するので、一酸化炭素COと結合したヘモグロビンは酸素O2と結合できなくなり、体組織が酸欠状態になるのです。一酸化炭素COは、有毒ガスの中でも特に毒性が強いことが知られています。空気中に0.0035%でも含まれていると、頭痛や吐き気などの中毒症状を引き起こす恐れがあり、濃度が0.16%以上であると、生命の維持に支障をきたします。
ちなみに、人が息を止めたときに通常体験する「息をできない苦痛の感覚」は、実は酸素O2の欠乏が原因ではなく、血液中に蓄積した二酸化炭素CO2が原因です。一酸化炭素COのようなヘモグロビンに結合する有毒ガスが恐ろしく危険な理由はこれです。たとえ有毒な一酸化炭素COを吸っても、呼吸によって体外へ二酸化炭素CO2の排出ができている限り、血液中の二酸化炭素CO2の蓄積が起こらないため、意識を失うまで何もおかしいと気付かないのです。
表.2 空気中の一酸化炭素COの濃度と中毒症状
|
0.0035% |
8時間滞在する場合の最大許容濃度 |
|
0.02% |
2〜3時間内に軽い頭痛 |
|
0.04% |
1〜2時間で前頭痛、2.5〜3.5時間で後頭痛 |
|
0.08% |
45分で頭痛、めまい、吐気、2時間で失神 |
|
0.16% |
20分で頭痛、めまい、2時間で致死 |
|
0.32% |
5〜10分で頭痛、めまい、30分で致死 |
|
0.64% |
1〜2分で頭痛、めまい、10〜15分で致死 |
|
1.28% |
1〜3分で致死 |
一酸化炭素COは、工業的には「水性ガス」の反応によって得られます。水性ガスとは、コークスCと水蒸気H2Oを1,000℃以上の高温で反応させて得られる気体のことです。成分的には、一酸化炭素COと水素H2を主成分としています。一酸化炭素COと水素H2の組成比は、用いたコークスCの種類や反応条件などによって異なります。この水性ガスから、一酸化炭素COを分離して利用します。この反応は、工業的な水素H2の合成方法としても有用です(第1族元素(アルカリ金属など)を参照)。
C + H2O → CO + H2
また、実験室で一酸化炭素COを得る場合は、ギ酸HCOOHに濃硫酸H2SO4を加えて加熱し、脱水して作ります。一酸化炭素COは、水に溶けにくいので、水上置換法で捕集します。また、中性気体であり、酸にも塩基にも吸収されないので、中性乾燥剤はもとより、酸性乾燥剤や塩基性乾燥剤による乾燥も可能です。一酸化炭素COは、空気中で点火すると、青白い炎を上げて燃焼するので、これで一酸化炭素COの発生を確認できます。
HCOOH → H2O + CO

図.12 ギ酸HCOOHを濃硫酸H2SO4で脱水する
(iii) 二酸化炭素CO2
二酸化炭素CO2は、炭素Cを含む有機化合物が完全燃焼すると生成する気体です。大気中には約0.04%含まれ、呼吸(成人1人1日当たり1 kg)や発酵によって、生物も放出しています。二酸化炭素CO2の昇華点は-79℃であり、常温では気体です。二酸化炭素CO2を-79℃以下に冷却して固体状態にしたものは、一般的に「ドライアイス」と呼ばれます。「ドライアイス」という名称は、世界で初めて大量生産に成功したアメリカのドライアイス社が、固体の二酸化炭素CO2に「Dry ice」という商品名を付けたことに由来します。ニューヨークで初めて大量生産に成功したのは1925年のことで、その当時に発売されたアイスクリームを融かさずに運搬するための冷却材として利用されました。ドライアイスは、常温常圧では液体にならず、-79℃で昇華して直接気体になります。

図.13 ドライアイスは、二酸化炭素CO2の固体である
二酸化炭素CO2は、わずかに水に溶けて弱酸性を示します。水への溶解度は、25℃だと1気圧で1.45 g/Lほどです。なお、水溶液中では、次のような平衡が成立します。ここで、H2CO3は「炭酸」と呼ばれるオキソ酸で、遊離した分子としては存在せず、通常は水溶液中のみで存在する分子です。炭酸H2CO3は舌を刺激し、食欲増進剤となり、また弱い殺菌剤にもなります。炭酸H2CO3は、胃から腸への流れを良くする作用があるといわれており、恐らくそのために、シャンパンは酔いが回るのが速いのでしょう。
CO2 + H2O ⇄ H2CO3
H2CO3 ⇄ H+ + HCO3-
HCO3- ⇄ H+ + CO32-
また、炭酸風呂に入ると体がポカポカと温まりますが、これには科学的な理由があります。炭酸風呂に入ると、水中の二酸化炭素CO2が、皮膚の毛穴を通して血液中へ吸収されます。その結果、体が酸素O2不足になっていると脳が勘違いし、体組織に酸素O2を送り届けようと血管が拡張され、血行が促進されるという訳です。炭酸風呂は、冷え症やむくみなどの血流障害による症状の改善に効果があるといいます。

図.14 お湯1 Lに対して、二酸化炭素CO2が250ppm以上溶けているものを炭酸泉という
ちなみに、温泉には様々な種類がありますが、健康効果の科学的根拠が明確なのは、炭酸風呂だけです。1846年、日本の温泉療法に着目して、「体をお湯で温めると病気が治る」という理論を元に、アメリカのバージニア州ピーターズバーグで人体実験が行われました。実験を行ったのは、ウォルター・ジョーンズという博士です。ジョーンズは、腸チフスと肺炎の患者を集め、裸にしてベッドにうつ伏せにして縛り付けました。そして、きっちり4時間おきに背中に熱湯をかけるという、高度に訓練された変態以外には苦痛以外のなにものでもない治療法を試してみました。結局、患者は一人も治らなかったそうで、日本の温泉療法は原住民の迷信だということになりました。ジョーンズは、一度でも日本の温泉を見たことがあったのでしょうか。日本の温泉観光地の名誉のために、小一時間ほど問い詰めたい気分です。

図.15 ウォルター・ジョーンズの日誌には、腸チフスの治療法を発見するために行った実験が記録されている
大気中の二酸化炭素CO2が溶けて、飽和状態になったときの水溶液のpHは5.6です。このpH値は、酸性雨の基準値にもなっており、一般的に雨水のpHが5.6以下であるときに、「酸性雨(acid rain)」と呼んでいます。酸性雨の原因は、化石燃料の燃焼や火山活動などにより発生する硫黄酸化物SOxや、窒素肥料由来の窒素酸化物NOxなどです。これらが、大気中の水H2Oや酸素O2と反応することによって、硫酸H2SO4や硝酸HNO3などの強酸が生成し、雨水を通常よりも強い酸性にします。

図.16 酸性雨によって枯れてしまった森林
二酸化炭素CO2は、乾燥した空気の成分としては4番目に多く、その割合は約0.04%です。季節によって濃度には多少の変動があり、北半球が夏のときに低く、冬に高いことが知られています。この理由は、陸地の大半は北半球に存在するので、夏になって北半球の日射量が増加すれば、地球全体として光合成による二酸化炭素CO2の消費量が増加するからと考えられています。
二酸化炭素CO2は、人間や動物たちの呼吸、有機化合物の完全燃焼の他、微生物の発酵などでも放出されます。しかし、その一方で、植物の光合成や海洋への溶解などによって、二酸化炭素CO2は消費されます。近年までは、これら放出と消費のバランスがほぼ保たれていましたが、現在では石炭や石油といった化石燃料の大量消費や大規模な森林伐採などによって、そのバランスが崩れてしまっています。よく知られている通り、二酸化炭素CO2は温室効果ガスの1つであり、太陽熱を大気内に閉じ込めて、地球全体の温度を上げます。近代では、二酸化炭素CO2は増加傾向にあり、地球温暖化は国際的な緊急課題となっています(地球温暖化の科学を参照)。
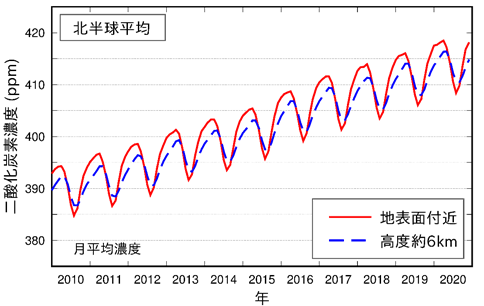
図.17 地球の二酸化炭素濃度は、夏に低くなって冬に高くなる(グラフは気象庁HPより引用)
しかしながら、地球には現在よりもはるかに二酸化炭素CO2の濃度が高い時代がありました。誕生直後の地球では、60気圧にも達する濃い二酸化炭素CO2が地表を覆っており、そのままでは海水が干上がりかねないほどの高温に達していました。しかし、海底火山などから噴出したカルシウムCaと、海に溶けた二酸化炭素CO2が結び付き、炭酸カルシウムCaCO3として海底に溜まっていく反応が起きました。これによって、大気中の二酸化炭素CO2は減少し、気温も低下していったのです。原始時代の地球の大部分の二酸化炭素CO2は、今では炭酸塩の岩石として、地球上に至る場所に存在しています。
金星は、地球の双子惑星ともいわれ、直径や質量は、両者ともほぼ同じです。また、かつては金星にも海があったことが分かっています。しかし、金星の位置が地球よりもやや太陽に近かったばかりに、多くの熱を受けて二酸化炭素CO2を吸収する前に海が完全に蒸発してしまいました。その結果として、金星の大気には90気圧もの二酸化炭素CO2が残り、その強烈な温室効果によって、気温は500℃にも達しています。一歩間違えば、地球もまたこのような灼熱の惑星になっていたかもしれないと考えると、地球の環境は奇跡的だと思わされます。今、我々が快適な温度で暮らしていられるのは、膨大な量の二酸化炭素CO2を封じ込めてくれた、炭酸カルシウムCaCO3のお陰なのです。

図.18 金星の大気の主成分は二酸化炭素CO2であり、温室効果により表面温度は500℃にも達する
二酸化炭素CO2は毒ガスではありませんが、濃度によっては、酸欠状態による窒息死を招きます。二酸化炭素CO2の濃度が20%を超えると、数回呼吸をしただけで意識を失い、ものの数分で死に至ります。二酸化炭素CO2による死亡事故として恐らく最大のものに、1986年8月21日にカメルーンのニオス湖で起きた「ガス噴出災害」があります。一夜にして、湖から10 kmも離れた3つの村で1,800人を超す死者を出し、周囲を壊滅状態にした大災害です。爆発音などの前触れはなく、突然、ニオス湖から発生した二酸化炭素CO2を多量に含むガスが、雲のように広がって村を襲ったといいます。様々な「毒ガス」が想定されましたが、調査団の報告を見ると、どうやら二酸化炭素CO2が原因のようでした。空気より重い二酸化炭素CO2が山の斜面を流れ、山間の低地にある3つの村に、音もなく侵入して来たのでしょう。現在もニオス湖では、二酸化炭素CO2が溜まり続けていますが、パイプを深度95 mまで差し込んで水を汲み上げることにより、深層にある水を噴出させ、人工脱ガスを行っています。

図.19 ニオス湖の底にはマグマ溜まりがあり、湖水中に二酸化炭素CO2を放出している
工業的には、二酸化炭素CO2は、石油化学プラントなどから排出されたものを回収し、洗浄と精製を繰り返すことで生産されています。炭酸飲料水で使用する二酸化炭素CO2も、元は石油由来のものが大半です。また、炭酸カルシウムCaCO3は、加熱すると約800℃で熱分解して、二酸化炭素CO2を発生させます。この反応は、酸化カルシウムCaOの工業的製法としても利用されています。
CaCO3 → CaO + CO2
実験室的には、炭酸塩や炭酸水素塩に強酸を作用させて得られます。具体的には、石灰石(主成分は炭酸カルシウムCaCO3)に希塩酸HClを加えると、塩化カルシウムCaCl2が生成し、二酸化炭素CO2が発生します。ただし、この反応で希硫酸H2SO4を希塩酸HClの代わりに用いることはできません。この理由は、難溶性の硫酸カルシウムCaSO4が生成し、石灰石の表面に被膜が形成され、反応が鈍くなるからです。また、炭酸水素ナトリウムNaHCO3を加熱することでも、二酸化炭素CO2が発生します。
二酸化炭素CO2は、水に少し溶けて空気よりも重いので、下方置換で捕集します。しかし、溶解度は25℃だと1.45 g/L程度なので、実験では水上置換で捕集することもあります。酸性気体であるため、ソーダ石灰(CaO+NaOH)などの塩基性乾燥剤による乾燥は適当ではありません、乾燥には、酸性乾燥剤もしくは中性乾燥剤が適当です。
CaCO3 + 2HCl → CaCl2 + H2O + CO2
2NaHCO3 → Na2CO3 + H2O + CO2

図.20 炭酸カルシウムCaCO3と希塩酸HClの反応
(3) ケイ素
(i) ケイ素Si
「ケイ素(silicon)」は、ラテン語の「silex(硬い石)」に由来する元素です。その名の由来通り、ケイ素Siは岩石の主要成分です。アメリカの地球化学者であるフランク・ウィグルスワース・クラークは、1883年から1924年まで米国地質調査所の化学主任を務め、その間に蓄積された膨大な数の岩石に関する化学分析の結果に基づいて、1924年に地表付近に存在する元素の割合を質量パーセントで発表しました。これを「クラーク数(Clarke number)」と名付けたのは、ロシアの地球化学者であるアレクサンドル・フェルスマンです。クラークの発表によると、ケイ素Siは岩石や鉱物の成分元素として、地殻中の約26%を占める元素であり、酸素Oに次いで多く含まれています。
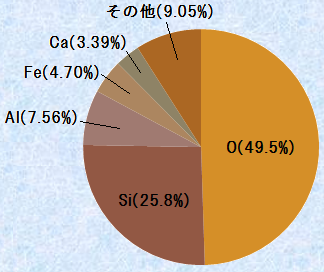
図.21 地殻中に含まれる元素の質量パーセント
地殻中にケイ素Siは豊富に含まれているのにも関わらず、ケイ素Siと生物との関係は薄いです。知られているのは、何種類かの生物が、二酸化ケイ素SiO2を骨格の成分として利用しているぐらいです。例えば、相模湾や駿河湾の水深1,000 mほどの深海には、カイロウドウケツと呼ばれる海綿の仲間が生息しています。海水中からメタケイ酸イオンSiO32⁻ などを取り込んで、二酸化ケイ素SiO2でできた美しい骨格を作ることから、「ガラス海綿」や「ヴィーナスの花籠」とも呼ばれます。カイロウドウケツの骨格の中には、雌雄一対のドウケツエビという小さなエビが棲んでいることがあります。「カイロウドウケツ」というのは、中国最古の詩集「詩経」にある「子と偕に老いん(偕老)」と「死すればすなわち穴を同じくせん(同穴)」という2つの誓いの言葉にちなんだ「偕老同穴(カイロウドウケツ)」に由来するのですが、これは2匹のドウケツエビが海綿の中で一生を過ごすことによります。

図.22 カイロウドウケツの骨片は、人間の髪の毛ほどの細さの繊維状ガラスであり、これが織り合わさって、網目状の骨格を為している
イネ科の植物も、葉を食べられにくくするために、二酸化ケイ素SiO2で葉を硬くしています。野原でススキの葉で指を切ってしまった経験を持つ人も多いでしょう。ススキの葉の周りは、のこぎりの刃のようなガラス質のトゲが並んでいます。イネ科の植物がケイ素Siを体内に蓄えるようになったのは、600万年ほど前のことだと考えられています。ケイ素Siは土の中に豊富にあるので、いくらでも利用することができたのです。驚くべきことに、イネ科の植物の出現によって、餌を食べることのできなくなった草食動物の多くが、絶滅したと考えられています。

図.23 イネ科のススキの葉には鋭いガラス質のトゲがある
ケイ素Siを基本構成元素とする生命体「ケイ素生物」がSFに登場し始めたのは、化学者が「すべての元素の中でケイ素Siが最も炭素Cに似ている」と指摘してからのことです。地球上の生命体は、すべて炭素Cを中心とした有機化合物で構成されています。この理由は、炭素Cの持つ原子価が4価であり、多様な結合が可能であるからです。SFの世界においては、炭素Cと同様に原子価が4価であり、生命体のようなものができうるのではないかという観点から、ケイ素Siが注目されてきました。例えば、アイザック・アシモフの「もの言う石」という小説では、ケイ素Siでできた岩石のような宇宙人が登場します。このようにSF小説には、頻繁にケイ素生物が登場し、「ケイ素Siを中心にできた体は岩石っぽくなるのではないか」、「原子量がかなり大きくなるから反応速度も格段に遅くなり、人間が見ていても生命活動していることに気が付かないくらいになる」、「二酸化ケイ素SiO2を気体として放出するのならば、高温の惑星上で生活するに違いない」などの想像がなされてきました。
しかしながら、C-C結合とは異なり、Si-Si結合には大きな欠点がありました。それは、ケイ素Siの原子半径が大きすぎるため、ケイ素Siではp軌道同士が離れてしまい、軌道の重なりが少なくなるので、安定なπ結合を形成することができないということです。つまり、ケイ素Siでは安定な二重結合や三重結合を形成することができないので、少なくとも地球と類似した環境の星では、ケイ素生物が存在するとは考えにくいのです。現実の生物の中にも、ケイ素Siを含むものはあります。しかし、それらは二酸化ケイ素SiO2の形でガラス質の骨格や殻を持つのみで、何らかの生物学的な活性を持っている訳ではありません。

図.24 映画「ガメラ2 レギオン襲来」で登場する宇宙怪獣レギオンは、ケイ素生物という設定であった
天然では、ケイ素Siの単体は全く存在しません。そのほとんどが、酸化物やケイ酸塩鉱物として存在しています。これには、Si-O-Si結合の多様性を反映した、様々な鉱物が含まれています。炭素Cと酸素Oの結合エネルギーが357 kJ/molであるのに対し、ケイ素Siと酸素Oの結合エネルギーは454 kJ/molとかなり大きいため、炭素化合物よりも安定な酸化物ができます。
純粋なケイ素Siの結晶は、銀色の光沢を放つ固体であり、一見すると金属のように見えます。しかし、各種の性質は金属とは異なる部分も多いため、ケイ素Siは「半金属(metalloid)」に分類されます。例えば、ケイ素Siは、電気を通す性質の金属と電気を通さない性質の非金属のほぼ中間の電気伝導性、いわゆる「半導体(semiconductor)」としての性質を持ちます。ケイ素Siが集積回路や太陽電池など、エレクトロニクス分野における花形の座を占めている大きな理由は、このどっちつかずな性質にあるのです。

図.25 純粋なケイ素Siの結晶は金属光沢を示す
SFの世界で考えられていたケイ素生物は、現代化学では存在が否定されました。しかし、もしケイ素生物がこの地球上に現れるとしたら、それはケイ素Siが分子鎖を作れるからではなく、半導体結晶を作れるからでしょう。半導体は、電気伝導性を周囲の電場や温度によって自由にコントロールすることができます。この優れた性質は、今日の電子機械にとって、非常に重要な意味を持ちます。コンピュータで「2進数」が主に使われている理由は、半導体に「電気を流す」または「電気を流さない」ということを表すのに、2進数がちょうどいいからです。
コンピュータチップは、砂浜にもあるようなケイ砂(主成分は二酸化ケイ素SiO2)からスタートし、これをコークスを用いて電気炉中で還元することで、最後には超高純度99.999999999%のケイ素Siの単結晶になります。結晶性の単体は、灰色がかった金属光沢のあるダイヤモンド構造の共有結合結晶です。精製された超高純度のケイ素Siの単結晶は、直径20〜30 cm、厚さ750 µm程度にスライシング後、鏡面研削などの高度な加工工程を経て、超平坦な「シリコンウェーハ」に仕上げられます。シリコンウェーハは、回路パターンの露光やダイシングなどの処理をされ、半導体チップとなります。
SiO2 + 2C → Si + 2CO

図.26 半導体の製造に用いられるケイ素Siは純度が99.999999999%である。”9”が11個並ぶことから「イレブンナイン」と呼ばれる
インテル社の創業者の一人であるゴードン・ムーアが、1965年に提唱した「ムーアの法則」というコンピュータ製造業界で用いられる経験則によると、コンピュータのトランジスタの数は、1年半から2年毎に倍加しており、これは過去40年以上に渡って成立してきました。仮にこのペースで、コンピュータが加速度的に性能を上げていった場合、2045年には「コンピュータが人間の知能を超えてしまうのではないか」といわれています。これは「2045年問題」といわれて、AI研究の世界的権威であるレイ・カールワイルが唱えた説です。
2045年問題が本当に起きたら、サルが人間のことを理解することができないように、人間はコンピュータのことを理解することができなくなり、様々な問題が生じるだろうといわれています。コンピュータが、人間に代わって発明や知的労働を行うようになるのでしょうか?コンピュータが、人間を管理する世の中になるのでしょうか?それとも、自我を持ったコンピュータが、人間を滅ぼそうとするのでしょうか?この2045年問題の世界を扱った作品が、映画「マトリックス」や「ターミネーター」であり、この問題をどのように解決するかが、現在議論されているところです。将来に人類の脅威になるのは、ケイ素生物ではなく、自我を持ったコンピュータかもしれません。
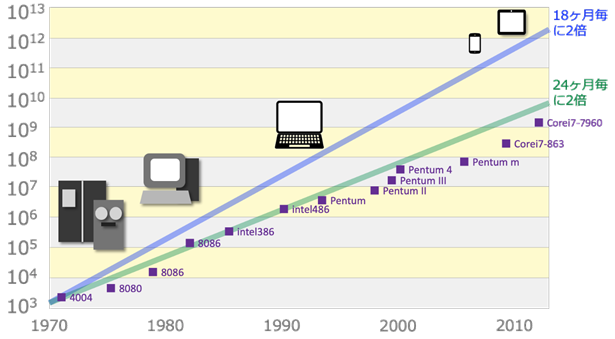
図.27 「ムーアの法則」によると、半導体の集積率は1年半から2年毎に倍加している
ちなみに、ケイ素Siの単体は融けて液体になると、密度が約8%増加して金属になります。一般に金属元素は融解により密度が減少しますが、ケイ素Siは密度が増加します。融解に際して、価電子の一部が自由電子的に振る舞うようになり、電気伝導性は増大します。その電気伝導性は、アルミニウムAlなどの自由電子を持つ通常の融解金属とほとんど変わらず、他の物性値も自由電子的な値を示すようになります。大型放射光施設「Spring-8」の放射光X線を用いた解析によれば、液体ケイ素Si中の結合の割合は、金属結合が約80%、共有結合の割合が約20%あることが分かりました。液体ケイ素Siの中では、金属結合と共有結合は、フェムト秒スケールで互いに生成消滅を繰り返していると考えられています。同じ物質の中で、金属結合と共有結合という、いわば対極にある結合状態が共存していることは、とても興味深いです。
(ii) 二酸化ケイ素SiO2
二酸化ケイ素SiO2は「シリカ(silica)」とも呼ばれ、地殻中に最も多量に含まれる物質です。二酸化ケイ素SiO2は、ケイ素Siを中心とする正四面体構造が、正四面体の各頂点に位置する酸素Oを介して無数に連なった共有結合結晶です。二酸化炭素CO2のように分子内に二重結合はなく、ケイ素Siと酸素Oは単結合で結合しています。硬くて融点も1,710℃と高く、電気絶縁性にも優れています。二酸化ケイ素SiO2は、主に石英として岩石中に存在し、大きな結晶の水晶や砂状のケイ砂としても産出します。ケイ砂は、セメントやガラスなどのケイ酸塩工業(窯業)の原料となります。

図.28 二酸化ケイ素SiO2は、六角柱状の綺麗な結晶を作り、中でも無色透明のものを水晶と呼ぶ
C-O結合の結合エネルギーが357 kJ/molであるのに対し、Si-O結合の結合エネルギーは454 kJ/molと大きいため、ケイ素Siでは炭素化合物よりも安定な酸化物ができます。ケイ素Siの化合物では、ケイ素Siはそのほとんどが正四面体の中心に位置し、その4つの頂点にある原子と結合した構造の化合物を作ります。ケイ素Siのオキソ酸としては、オルトケイ酸H4SiO4がありますが、この化合物は天然で単独で存在することは少なく、通常は混合体となって存在しています。オルトケイ酸H4SiO4には、1分子中に縮合しうるヒドロキシ基(-OH)が4つあるため、非常に多くの縮合酸が考えられます。そして、各種酸の塩の集合体が、岩石を作っています。これらは、地中のマグマが冷えたときに生じたものですが、そのときの圧力や温度、冷却速度、成分条件などによって、様々な塩や酸化物になります。
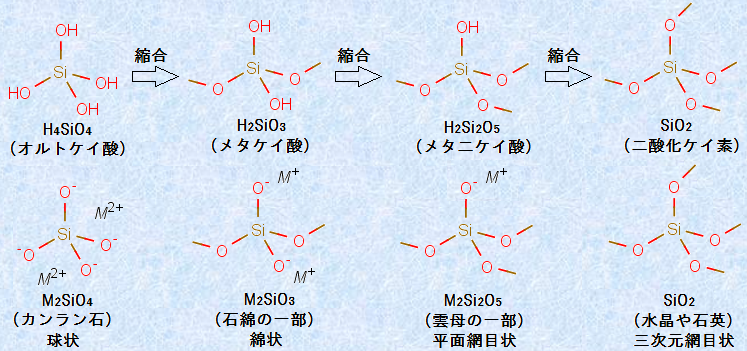
図.29 代表的なケイ酸およびケイ酸塩の構造
「セメント(cement)」は、水を加えると水和や重合により硬化する無機材料のことです。「セメント」という言葉自体の意味は幅広く、水によって固まるものなら、何でもセメントと呼ぶことができます。一般には石灰石CaCO3を主原料とし、これに粘土(主成分SiO2, Al2O3)やセッコウCaSO4・2H2Oなどの原料を混ぜたものを粉砕し、焼成したものをセメントといいます。また、セメントに砂や砂利を混ぜて嵩増しをして、製造コストを下げたものが「コンクリート(concrete)」です。
コンクリートは、圧縮強度は高くて堅牢なのですが、引っ張り強度はあまり高くありません。そのため、建築材料としては、引っ張り強度の強い鉄筋をコンクリートの内部に入れて、「鉄筋コンクリート(reinforced concrete)」として利用します。鉄筋である理由は、鉄Feとコンクリートの熱膨張率が近いため、温度変化によって歪んだり割れたりすることが起こりにくくなるからです。鉄Feは酸に弱く、酸性条件下ではすぐにボロボロに錆びてしまいます。しかし、鉄筋コンクリートでは、内部が材料中の炭酸カルシウムCaCO3や水酸化カルシウムCa(OH)2により、常に塩基性の状態で保たれるので、鉄筋が錆びにくくなるという利点があります。ただし、空気中の二酸化炭素CO2などの作用により、コンクリートは次第に中和されていき、そのため強度が次第に低下していきます。鉄筋を保護していたコンクリートが劣化すると、ひび割れによって水分が侵入するようになるので、内部の鉄筋も酸に腐食されやすくなります。そのため、鉄筋コンクリートには寿命があり、好条件のもとでは100年程度、沿岸部分等の悪条件下では50年程度といわれています(第2族元素(アルカリ土類金属など)を参照)。

図.30 鉄筋は、圧縮には弱いものの引っ張りには強く、コンクリートの弱点を補っている
(iii) ガラス
人類によって最初に作られた合成材料の1つである「ガラス(glass)」は、紀元前3,000〜2,000年の間に都市誕生の地であるメソポタミアで発明されました。ガラスは融けた砂(主成分は二酸化ケイ素SiO2)からできていますが、ただ砂を火の中に放り投げたところで、その火を消してしまう以外に何ら効果は得られません。ガラス製造の問題は、二酸化ケイ素SiO2の融点が1,710℃と非常に高いことです。これは、単純な窯の能力をはるかに超えており、ガラスの主要成分が分かるだけでは、それを実際に作る上では何の役に立ちません。
しかしながら、ガラスはときに自然に形成されます。運が良ければ、砂漠や砂浜で地面を掘ると、融合した二酸化ケイ素SiO2が細長い管状になったものが見つかるかもしれません。その多くは、複雑に枝分かれした木の根系に似た形状をしています。このような構造物は、「閃電岩(fulgurite)」と呼ばれ、雷が乾燥した砂に落ちたときに形成されるものです。電流が地下に勢いよく流れると、二酸化ケイ素SiO2の粒子を融合させて、ガラス管に変えるほどの高温となるのです。

図.31 閃電岩の形状は、雷が地面で拡散した際の経路をなぞったもので、「雷の化石」とも呼ばれる
しかし、雷の力は簡単には利用できないため、ガラスを製造するには、二酸化ケイ素SiO2の融点を適当な融剤を添加して、窯で到達できる温度内に下げなければなりません。最もよく使われるガラスは、主成分を二酸化ケイ素SiO2とするケイ砂に、炭酸ナトリウムNa2CO3や炭酸カルシウムCaCO3などの原料を加えて、それらを融解して得られる「ソーダ石灰ガラス」です。ソーダ石灰ガラスの融点は約1,000℃で、この温度なら窯で簡単に製造することができます。ソーダ石灰ガラスは、ケイ素Siと酸素Oが作る立体構造の中に、ナトリウムイオンNa+ やカルシウムイオンCa2+ などが入り込んだ構造をしています。構成粒子の配列が不規則となっているので、一定の融点を持ちません。ガラスのように不規則な構造を持ち、一定の融点を持たない物質を、「非結晶(noncrystalline)」あるいは「アモルファス(amorphous)」といいます。ソーダ石灰ガラスは、窓ガラスや瓶などに使われます。固まったものでも再度融解して成形できるので、飲料用の瓶などで、リサイクルが進められています。
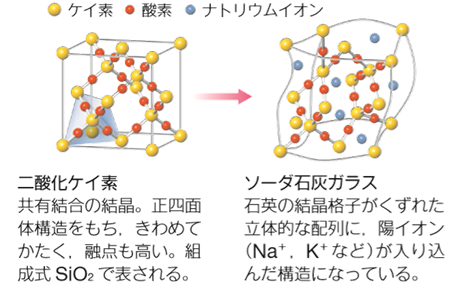
図.32 ソーダ石灰ガラスの融点は約1,000℃なので、加工が容易である
また、高純度の二酸化ケイ素SiO2を2,000℃以上の高温で融解後、急冷してできるガラスは、「石英ガラス」と呼ばれます。そして、これを繊維状に加工したものが「光ファイバー」です。光ファイバーは、胃カメラなどの内視鏡や装飾品、光通信などに使われます。ケイ砂とホウ砂Na2B4O7・10H2Oを原料にした「ホウケイ酸ガラス」は、熱膨張率が通常のガラスの3分の1程度で、急激な温度変化に比較的強く、ビーカーやフラスコなどの実験器具に使われます。ホウケイ酸ガラスは、アメリカの世界最大級のガラス製品メーカーであるコーニング社の商標から、「パイレックス」と呼ばれることも多いです。原料にケイ砂と炭酸ナトリウムNa2CO3、酸化鉛(II) PbOを用いた「鉛ガラス」は、屈折率が大きく、軟質で加工性が大きいことから、光学レンズから装飾用のクリスタルガラスまで、幅広く使用されています。鉛ガラスは比重が大きく、X線の吸収能が大きいため、放射線遮蔽窓などにも使われています。

図.33 光ファイバーは、金属線で電気信号を送るのに比べ、極めて大量の情報をより速く伝達できる
二酸化ケイ素SiO2は、熱に強く、化学的にも安定です。しかし、気体のフッ化水素HFやその水溶液のフッ化水素酸(フッ酸)とは反応し、それぞれ四フッ化ケイ素SiF4やヘキサフルオロケイ酸H2SiF6を生じて、溶けてしまいます。この反応は、ガラスに目盛りを刻んだり、くもりガラスの製造などに利用されています。
SiO2 + 4HF(気体) → SiF4 + 2H2O
SiO2 + 6HF(水溶液) → H2SiF6 + 2H2O
また、二酸化ケイ素SiO2は酸性酸化物なので、常温でも塩基とゆっくり反応します。そのため、水酸化ナトリウムNaOHなどの強塩基の水溶液をガラス瓶で保存するときに、すり付きのガラス栓を使用すると、ガラス栓が瓶に固着して、開かなくなることがあります。ガラスに含まれる二酸化ケイ素SiO2が、水酸化ナトリウムNaOHと反応するために起こる現象です(空気中の二酸化炭素CO2と反応して生成した炭酸ナトリウムNa2CO3による接着の効果も考えられます)。特にすりガラスの部分は、微細な凹凸があって表面積が非常に大きくなっており、反応が進みやすくなっています。強塩基の水溶液をガラス瓶に保存する際には、ゴム栓などの塩基と反応しにくい素材の栓を選択しなければなりません。

図.34 すり付きのガラス栓で、水酸化ナトリウム水溶液を保管してはならない
(iv) シリカゲルSiO2・nH2O(0<n<1)
常温では、二酸化ケイ素SiO2が塩基と反応する速度はゆっくりです。したがって、塩基と反応させたい場合は高温にします。二酸化ケイ素SiO2を固体の水酸化ナトリウムNaOHや炭酸ナトリウムNa2CO3などと共に高温に加熱して1,300℃程度で融解させると、Si-O-Si結合が徐々に加水分解されて、メタケイ酸ナトリウムNa2SiO3が生じます。メタケイ酸ナトリウムNa2SiO3は、粉末にすると水に溶けて一部が加水分解し、水溶液中でアルカリ性を示します。
SiO2 + 2NaOH → Na2SiO3 + H2O
SiO2 + Na2CO3 → Na2SiO3 + CO2
Na2SiO3 + 2H2O ⇄ H2SiO3 + 2NaOH
メタケイ酸ナトリウムNa2SiO3に水H2Oを加えて煮沸すると、徐々にヒドロキシ基(-OH)の一部が結合して、「水ガラス」と呼ばれる液体になります。水ガラスは、ケイ酸ナトリウムNa2SiO3の濃い水溶液で、主成分はNa2SiO3・nH2O(n=5, 9など)と考えられています。水ガラスは、広がった分子鎖が強く相互作用して、互いに動きを束縛するので、無機結晶の溶液でありながら、有機高分子溶液のような高い粘性を示します。また、空気中に放置すると二酸化ケイ素SiO2を析出して固まるの性質があるので、接合剤などとして利用されます。そして、水ガラスに希塩酸HClなどの強酸を加えると、半透明ゲル状のメタケイ酸H2SiO3の沈殿が生じ、この沈殿を加熱して脱水すると、ヒドロキシ基(-OH)の一部が縮合して、乾燥剤や吸着剤に使用される「シリカゲル(silica gel)」になります。
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
H2SiO3 → SiO2・nH2O + (1-n)H2O
シリカゲルは、化学式ではSiO2・nH2O(0<n<1)で表され、ちょうどメタケイ酸H2SiO3と二酸化ケイ素SiO2の中間の構造になります。シリカゲルは、固体表面に微細な凹凸のある多孔質構造を持ち、質量の割に表面積が非常に大きいという特徴を持ちます。シリカゲルは、固体表面にあるヒドロキシ基(-OH)が水素結合により水分子を多く吸着するので、乾燥剤や吸湿剤として利用されます。また、その表面積の大きさを利用して、触媒の担体として用いられることもあります。

図.35 シリカゲルは、メタケイ酸H2SiO3のゲルを脱水・乾燥させることで得られる
シリカゲルは、本来は無色透明ですが、塩化コバルト(II) CoCl2を配合させたものには色が付いています。塩化コバルト(II) CoCl2を添加したシリカゲルは、コバルト(II)イオンCo2+ により、乾燥時は青色、吸湿時は赤色になるので、水H2Oの吸着の程度を知ることができます。吸着反応は、発熱的であり可逆的でもあるので、高温にすると吸着した水H2Oが離れていきます。したがって、吸湿したものを電子レンジあるいはフライパンなどの加熱で乾燥させると、何度でも乾燥剤として使用できます。ただし、乾燥させるときに加熱しすぎると、脱水縮合が進行しすぎて、シリカゲルが劣化してしまう可能性があるので、注意が必要です。
CoCl2(青) + 6H2O → CoCl2・6H2O(赤)
SiO2・nH2O → SiO2 + nH2O
(4) スズ
(i) スズSn
「スズ(tin)」は、古代より知られている元素であり、その元素記号はラテン語の「stannum(スズ)」に由来しています。スズSnの融点は232℃で、鉄Fe(m.p.1,538℃)や銅Cu(m.p.1,085℃)よりもはるかに低く、鉛Pbのような毒性もほとんどありません。展延性に優れて加工しやすく、しかも適度な硬さもあり、錆びなどにも強いです。このため、古来より様々なスズ製品が作られてきました。スズ鉱石は、マレー半島の砂の中に大量にあり、酸化スズ(IV) SnO2として産出しました。容易に炭素Cによって還元されますが、現在ではマレー半島ではほとんど掘り尽くしたようです。
SnO2 + 2C → Sn + 2CO
スズSnの単体は、常温では「βスズ(白色スズ)」と呼ばれる比較的安定な銀白色の重金属です。しかし、極地方のような酷寒の環境においては、徐々に「αスズ(灰色スズ)」と呼ばれる灰色の非金属に転移します。αスズは、電気を通さない共有結合性の物質です。αスズへの転移では、展延性が失われ、同時に体積が大幅に増加します。そのため、スズ製品にこの現象が起こると、機械的な構造破壊が起こって、ボロボロになってしまいます。そして不思議なことに、αスズを普通のβスズに塗り付けておくと、その周りのβスズが急速にαスズに変化します。なお、αスズとβスズは、互いに同素体の関係であり、転移は化学変化ではなく、物理的な結晶構造の変化です。
この現象は、最初はスズ製品の一部分から始まり、やがて製品全体に伝染するように広がるため、人間の伝染病に例えて、「スズペスト(tin pest)」と呼ばれます。ただし、通常スズ製品には、各種の不純物が混ざっているため、実際に反応が進むのは-10℃の低温領域からであり、-45℃で反応速度が最大となります。しかし、それでもスズペストが1 mm進むのに、約500時間もかかるといわれています。かつて、冬の大寒波がヨーロッパを襲ったときにオルガンのパイプでこれが起こり、オルガンのパイプがボロボロになってしまったことがありました。

図.36 左側は銀白色のβスズ、右側は灰色のαスズ
スズペストは、歴史にも大きな影響を与えています。例えば、フランス革命期の軍人であるナポレオン・ボナパルトは、1812年に50万の大軍を率いてロシア遠征を企て、歴史的な大敗を喫しています。その原因の一つに、冬のロシアの極寒があげられているのです。ロシア軍は戦略的退去を繰り返して、フランス軍を内陸のモスクワへと誘導し、寒波の襲来を待ちます。冬のロシアでは、気温は-40℃まで下がり、怒り狂った風が巨大な雪の竜巻を吹き上げ、部隊は氷に包まれました。生きてフランスに帰国できた兵士は、2万人に満たなかったといいます。生存者の一人は、「我が軍は巨大な氷のシーツにすっぽり包まれた」と語っています。そしてこのとき、フランス軍兵士の軍服に付いていたスズ製のボタンがスズペストを起こし、極寒の中で服を閉じておくことができなくなったのです。これは、ロシア軍の妖術であるという噂と相まって、フランス軍兵士の士気を削ぎ、敗退を加速したといいます。この大戦は、ロシアの文豪トルストイが、著書である「戦争と平和」の中で書き尽くしています。ロシアの老元帥クトゥーゾフは、押し寄せるナポレオンの大軍を目の前にしても、何もしません――「ロシアはロシアが守る」。冬になると、若いナポレオン率いる血気はやるフランス軍は、ロシアの極寒の前になす術もなく、敗退していきました。この敗戦がもとで、ナポレオンは失脚することになります。

図.37 ナポレオンのロシア遠征は、フランス帝国とその同盟軍からなる侵攻軍の兵力を当初の2%未満に激減させた
さらに、1819年から1822年にかけて、イギリスの海軍将校であるジョン・フランクリンが北極探検を行いましたが、これも歴史的な失敗となり、多くの隊員を餓えや寒さで失いました。ほとんどの隊員は餓死しましたが、生存者は皮のブーツを食べて、飢えを凌いでいたといいます。この一因にあげられるのは、缶詰の蓋の溶接に用いたハンダの不備です。ハンダから鉛Pbが溶け出し、隊員が鉛中毒となって、精神状態に悪影響を及ぼしたということです。しかし、それとともに、缶がスズペストを起こし、缶詰が予期した保存期間に耐えられなかったことを指摘する説もあります。

図.38 フランクリンは命からがらに帰国し、「ブーツを食べた男」の名で呼ばれた
スズSnは、室温付近で湿った空気中に放置しても簡単には腐食されず、融点の低い比較的無害な金属材料であるため、古くから単体や合金の成分として広く用いられてきました。スズSnを含む合金としては、鉛Pbとの合金である「ハンダ」、銅Cuとの合金である「青銅(ブロンズ)」が代表的です。
青銅は、硬度が高いにも関わらず、容易に鋳造することができる性質を持ち、古代から用いられていた合金の1つです。メソポタミア・エジプトでは、紀元前3,500年頃から青銅が使われていました。青銅は、本来は茶色で艶のある金属ですが、錆びると緑青が出て青くなります。そのために、「青銅」という名が付いています。一般に含有率は銅Cuの方が多く、スズSnは下限で数%程度から、上限で30%前後程度まで様々です。古代では、スズ含量の少ないものは装身具に使い、中間の含量のものは剣や槍に、含量の多いものは矢じりや鏡に使用されました。なお、青銅は茶色といいましたが、それはスズSnの含有量のせいであり、スズSnの割合を増やすと金色になり、もっと増やすと遂には白色になります。

図.39 青銅は加工性に優れ、美術品などによく用いられる
スズSnの単体についても、適度な硬さがあり、加工も容易であるため、アルミニウムAlが安価に生産されるようになるまでは、食器などの日用品にも広く用いられてきました。今では、スズ製品は身の回りにほとんどありませんが、かつては、今よりもっと身近な金属でした。例えば、ブリキは、鉄板にスズSnをめっきしたものです。スズSnで全面を覆うことで、内部の鉄Feの酸化を防ぐことができ、はんだ付けも容易になります。ブリキは、缶詰や容器、玩具などに使われています。

図.40 ブリキの玩具
スズSnは、両性元素であり、酸とも強塩基とも反応して、水素H2を発生させます。また、スズ(II)イオンSn2+ を含む水溶液に、硫化水素H2Sを加えると、硫化スズ(II) SnSの褐色沈殿が生成します。この沈殿は、強酸性条件でも溶けません。硫化スズ(II) SnSは、太陽光を吸収する能力が高く、太陽電池の材料として期待されています。
Sn + 4HCl → SnCl4(無色) + 2H2
Sn + 4H2O + 2NaOH → Na2[Sn(OH)6](無色) + 2H2
Sn2+ + H2S → 2H+ + SnS↓(褐)
(ii) 塩化スズ(II)SnCl2
スズSnは、第14族元素であるから、基底状態では5s25p2の電子配置を持っています。そこで、同じ第14族の炭素Cやケイ素Siと同様に、sp3混成軌道を作って、共有結合性の強い4価の状態を作ることができます。しかし、その一方で、スズSnは2個の価電子を失って、イオン結合性の強い2価の状態も作ることができます。スズSnでは、どちらかというと共有結合性の強い4価になる傾向が強いです。例えば、塩化スズ(IV) SnCl4は常温では発煙性の液体であり、融点は-33℃、沸点は114℃です。その一方で、塩化スズ(II) SnCl2の融点が247℃、沸点が623℃であることを考えると、塩化スズ(IV) SnCl4の結合は、かなり共有結合性が強いことが分かります。
そのため、スズ(II)イオンSn2+ は容易に酸化されて、スズ(IV)イオンSn4+ になります。よって、酸化されやすい塩化スズ(II) SnCl2には還元作用があり、有機化合物の還元剤(ニトロ基をアミノ基に還元するなど)や分析試薬などとして用いられます。
SnCl2 + 2Cl- → SnCl4 + 2e-
(iii) 酸化スズ(IV)SnO2
スズSnの酸化物には、酸化スズ(II) SnOや酸化スズ(IV) SnO2などがあります。スズSnでは、酸化数が+4の方がより安定です。酸化スズ(II) SnOを空気中で加熱すると、酸化スズ(IV) SnO2が得られます。逆に酸化スズ(II) SnOを水素H2中で加熱すると、還元されてスズSnの単体となります。
2SnO + O2 → 2SnO2
SnO + H2 → Sn + H2O
酸化スズ(IV) SnO2は、電子が非常に動きやすいn型酸化物半導体であり、一酸化炭素COや硫化水素H2Sなどの還元性ガスのセンサーとして優れた性質を示します。このガスセンサーは、固体表面にガスが吸着するときの電気伝導率の変化を利用しています。通常は、表面に吸着した酸素O2に電子を取られ、表面の電気伝導率は低下しています。しかし、一酸化炭素COや硫化水素H2Sなどの還元性のガス中では、酸素O2が電子を放出し、電気伝導率が高くなります。これによって、ガスを検出できるのです。なお、酸化性のガス中では、逆に電気伝導率は低下します。
(5) 鉛
(i) 鉛Pb
「鉛(lead)」は、金Au・銀Ag・銅Cuなどと共に、古代から最もよく知られていた金属の1つです。古代エジプトでは紀元前3400年頃には、またインドや中国でも紀元前1000年頃には、すでに金属あるいは化合物として知られていました。元素記号の「Pb」は、ラテン語の「plumbum(鉛)」に由来しますが、その語源は明確ではありません。単体は比較的軟らかい青灰色の重金属で、紙や木などに摺り付けると、鉛Pbが削れて文字が書けます。古代ローマ人は、羊皮紙に鉛製の尖筆で線や文字を書いていたそうです。これが「鉛筆」の名称の起源となったといわれています。低融点(m.p.328℃)で軟らかく、加工しやすく、高比重であり、比較的製錬が容易であることから、鉛Pbは古代から広く利用されていました。

図.41 古代ローマでは、鉛製の尖筆を使っていた
鉛製の水道管は、ヴェスヴィオ火山の噴火で有名な「ボンペイの遺跡」からも発見されているように、意外に古い歴史を持っています。鉛Pbは水中でも腐食しにくいため、配管や貯水槽の素材に適しています。イタリアのローマでは、古代ローマ時代に造られた鉛製の下水管が、現在でも使われています。古代ローマ時代と同じタイプの下水管を使っているのではなく、2,000年前から同じ下水管をずっと使い続けているのです。鉛製の下水管の寿命は半永久的で、鉛Pbは下水管の材料としては理想的です。「配管」を意味する英語の「plumbihg」は、ラテン語の「plumbum(鉛)」に由来しています。

図.42 ポンペイ遺跡は、ヴェスヴィオ火山の噴火による火砕流によって、一夜にして消えた古代都市である
ただし、鉛Pbには強い毒性があり、酵素のチオール基(-SH)に対する親和性が強く、種々の酵素に対する阻害活性があります。特に造血組織において、ヘモグロビン合成を阻害するために、貧血症状を起こすことが典型例です。そのため、近年では鉛Pbの利用を避ける傾向が強いです。例えば、狩猟で使われる散弾銃の鉛弾によって傷付いた野鳥や動物が、体内に残留した鉛弾で鉛中毒になることがあります。さらに、その鉛中毒になった野鳥やその動物を餌とした肉食鳥が、鉛中毒になる可能性があります。そのため、現在では鉛弾を使った散弾銃そのものの規制や、タングステンWなどの他の素材への転換も議論されています。
鉛Pbによる急性中毒の症状は、嘔吐や腹痛などですが、慢性中毒では、貧血や食欲不振、高血圧、さらには精神に異常をきたすといわれています。皮膚は灰色に変色し、歯肉が青黒く腫れるのが特徴的です。また、血管や腸管を痙攣させることもあり、この症状を引き起こす「鉛疝痛」は、ギリシア時代から知られていました。神経が麻痺して、「鉛毒脳症」を起こすこともあります。
日本でも、江戸時代から明治時代にかけて、「鉛白」を含むおしろいによる鉛中毒がありました。鉛白とは、炭酸鉛(II) PbCO3と水酸化鉛(II) Pb(OH)2の2:1混合物のことです。紀元前4000年前のエジプトの時代から、装飾用顔料として使われていました。おしろいには、焼いた牡蠣の殻や真珠、チョークなども用いられたことがありましたが、少量で広い面積を覆うことができ、輝く白さを示す鉛白より、優れたおしろいはありませんでした。しかし、有害な鉛化合物を顔に塗るのだから、人体にとって良い影響があるはずはありません。特に毎日厚化粧をする歌舞伎役者や遊女たちが、鉛中毒になって命を落としていったことはよく知られています。日本では、1935年に鉛Pbを含むおしろいは販売禁止となり、現在では、安全な酸化亜鉛ZnOや二酸化チタンTiO2などのおしろいが使用されています。

図.43 おしろいに鉛白が使用されていた時代には、鉛中毒による死亡者が多かった
また、胎児期および出生後に血中の鉛レベルが高かった子供は、20代前半になると犯罪や暴力を起こしやすくなるという研究があります。アメリカでは、環境中の鉛レベルは、1950年代から1970年代にかけて上昇し、1970年代後半から1980年代前半に規制強化によって大きく改善しました。胎児期および出生後の鉛レベルの推移と、それから23年後の犯罪発生率との間には、極めて強い相関関係があることが知られています。母親の胎内で鉛Pbに暴露した胎児や、鉛Pbで汚染された母乳で育てられた乳児は、成人してから犯罪者になる可能性が高いのです。同様の関係は、イギリスやカナダ、フランス、オーストラリア、フィンランド、イタリア、西ドイツ、ニュージーランドで見出されており、世界各国で鉛レベルと成人後の犯罪件数を示すグラフの曲線は、ほぼ正確に一致しています。
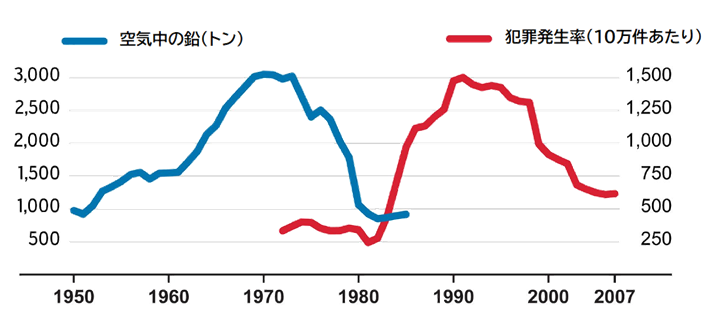
図.44 鉛汚染と犯罪発生率の傾向(米シカゴの調査)
鉛Pbは両性元素なので、酸とも強塩基とも反応して、水素H2を発生させます。しかし、塩酸HClや硫酸H2SO4に対しては、水に溶けにくい塩化鉛(II) PbCl2や硫酸鉛(II) PbSO4の酸化被膜が金属表面を覆うので、難溶になります。ただし、硝酸HNO3や酢酸CH3COOHとは、比較的反応しやすいです。鉛化合物は、塩化鉛(II) PbCl2や硫酸鉛(II) PbSO4、クロム酸鉛(II) PbCrO4、硫化鉛(II) PbSなど、水に難溶なものが多いです。しかし、硝酸鉛(II) Pb(NO3)2や酢酸鉛(CH3COO)2Pbなどは、水によく溶けます。また、塩化鉛(II) PbCl2も、熱湯には溶解度が大きくなって、少しだけ溶けます。
Pb + 2HCl → PbCl2↓(白) + H2
Pb + 2H2SO4 → PbSO4↓(白) + 2H2
Pb + 2H2O + 2NaOH → Na2[Pb(OH)4](無色) + H2

図.45 鉛(II)イオンPb2+ の反応
(ii) 酸化鉛(IV) PbO2
鉛Pbの酸化物には、酸化鉛(II) PbOや酸化鉛(IV) PbO2などがあります。ただし、鉛Pbの場合は、スズSnと異なって、イオン結合性の強い2価の状態の方が安定です。したがって、4価の酸化鉛(IV) PbO2には酸化作用があり、鉛蓄電池の正極として用いられます(電気化学(電池)を参照)。鉛蓄電池は、安価で大電流を放電させることが可能な二次電池です。19世紀から原型を保って、現代でも自動車のバッテリーなどに使われています。
PbO2 + 4H+ + 2e- + SO42- → PbSO4 + 2H2O
(iii) 酢酸鉛(CH3COO)2Pb
古代ローマにおいては、蜂蜜以外に手に入る甘味料は、大変に貴重な存在でした。そのため、酢酸菌などの作用で酸敗しかけたワインを、鉛製の鍋で煮ることによって得られる「サパ」と呼ばれるシロップが、甘味料として好んで使われていました。サパの甘味の正体は、鉛製の鍋の表面を覆っている酸化鉛(II) PbOが、酸敗したワインに含まれる酢酸CH3COOHと反応することによって生じる酢酸鉛 (CH3COO)2Pbです。サパには殺菌効果もあったことから、ワインの甘味付けや、果物の保存などにも一時的に使われていました。当時、鉛化合物に毒性があることはほとんど知られておらず、サパを添加したワインを好んでいた貴族たちの間で、鉛中毒者が続出したといわれています。
PbO + 2CH3COOH → (CH3COO)2Pb + H2O
酢酸鉛(CH3COO)2Pbは、見た目も味も砂糖C12H22O11とそっくりで、「鉛糖」あるいは「土の糖」とも称されます。しかし、他の鉛化合物と同様、強い毒性がある物質です。当時の人の遺骨を調べてみると、毛髪から高濃度の鉛Pbが検出されるといいます。サパを再現した現代の科学者たちは、ブドウ果汁1 g当たりに1 gの鉛Pbが含まれていると特定しました。ローマ人の平均寿命は20歳代前半に過ぎず、上流階級には不妊が多かったと聞きます。これには、サパなどによる、鉛Pbの毒性が影響しているのではないでしょうか。
この鉛中毒が、不妊や神経毒性を生じ、ローマ帝国の滅亡の一因になったという説さえあります。鉛中毒は精子数の低下をもたらすため、後期のローマ皇帝の多くが、子をなそうと多大な努力を払ったにも関わらず、不妊に苦しみました。また、西暦15〜225年にかけてのローマの支配者の多くは、鈍重かつ残忍で、身体的もしくは精神的に障害を負っていました。ローマ皇帝の中で、ネロのような異常性格者が出たのは、彼が鉛中毒になっていたから――と考えれば、納得できます。ネロは17歳でローマ帝国の第5代皇帝(37〜68年)に就き、減税や属州防衛に努めるなど、善政を強いてローマ市民に喜ばれていました。しかし、やがて人が変わったように残虐になり、母アグリッピナや妻オクタウィアらを次々と暗殺し、遂にはローマを焼き払った張本人として、歴史にその悪名を刻むことになりました。

図.46 ローマ帝国の第5代皇帝ネロは、鉛中毒によって暴君に豹変したという説がある
かの大作曲家ルートヴィヒ・ヴァン・ベートーヴェンも、慢性の鉛中毒であった可能性があるといいます。2000年、アメリカのアルゴンヌ国立研究所がベートーヴェンの遺髪を分析した結果、通常の100倍近い大量の鉛Pbを含んでいることが分かったのです。ベートーヴェンは、20歳代後半から持病の難聴が悪化し、30歳になる頃には、ほとんど耳が聞こえなくなっていました。ベートーヴェンがピアノに耳を当てて作曲していたという逸話は、誰しも聞いたことがあるでしょう。ベートーヴェンは、ワインの生前年代を指定して飲むほどの愛飲家として有名であり、晩年にベートーヴェンを苦しめた腹痛や神経系の不調からくる短気、難聴に悩まされた末の聴力喪失も、サパによる鉛中毒だったのでしょうか。ただし、鉛中毒が難聴を引き起こすメカニズムについてはよく分かっておらず、先天性梅毒や耳硬化症だったという説もあります。もしベートーヴェンが「ワイン好き」でなければ、未完の10番目の交響曲を書き上げることができたのかどうかは、誰にも分かりません。

図.47 偉大な作曲家であるベートーヴェンは、鉛中毒に悩まされていた可能性がある
・参考文献
1) 岡田純平「高校では習わないホウ素とケイ素の同素体―液体Bと液体Siの性質―」化学と教育70巻9号(2022年)
2) 倉原優「本当にあった医学論文2」中外医学社(2015年発行)
3) 齋藤勝裕「へんな金属すごい金属」技術評論社(2009年発行)
4) 齋藤理一郎「ナノカーボンの化学―21世紀に入ってからの進展と展望―」化学と教育66巻4号(2018年)
5) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
6) 桜井弘「元素118の新知識 引いて重宝、読んでおもしろい」講談社(2017年発行)
7) 佐藤健太郎『化学で「透明人間」になれますか?』光文社新書(2014年発行)
8) 佐藤健太郎「すごい分子 世界は六角形でできている」講談社(2019年発行)
9) 佐藤健太郎「世界史を変えた新素材」新潮社(2018年発行)
10) 佐藤健太郎「炭素文明論」新潮選書(2013年発行)
11) 左巻健男「面白くて眠れなくなる元素」PHP研究所 (2016年発行)
12) 鈴木勉「毒と薬【すべての毒は「薬」になる!?】」新星出版社(2015年発行)
13) セオドア・グレイ「世界で一番美しい元素図巻」創元社(2011年発行)
14) 橘玲「言ってはいけない 残酷すぎる真実」新潮新書(2016年発行)
15) 長沼毅「Dr.長沼の眠れないほど面白い科学のはなし」中経出版(2013年発行)
16) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)
17) Peter W. Atkins著/千原秀昭・稲葉章 訳「分子と人間」東京化学同人(1993年発行)
18) 船山信次「毒の科学―毒と人間のかかわり―」ナツメ社(2013年発行)
19) F・アッシュクロフト 著/矢葉野薫 訳「人間はどこまで耐えられるのか」河出書房新社(2008年発行)
20) 山北篤「現代知識チートマニュアル」新紀元社(2017年発行)