・電気化学(電池)
【目次】
(2) ボルタ電池・・・(-)Zn | H2SO4 | Cu(+)
(i) 起電力が下がるのは、逆起電力が原因ではなく、水素過電圧が原因である
(ii) 酸化剤を加えて起電力が回復するのは、酸化剤がH+ の代わりに反応するからである
(3) ダニエル電池・・・(-)Zn | ZnSO4 || CuSO4 | Cu(+)
(4) マンガン乾電池・・・(-)Zn | NH4Cl,ZnCl2 | MnO2(+)
(5) 鉛蓄電池・・・(-)Pb | H2SO4 | PbO2(+)
(i) H3PO4型・・・(-)Pt・H2 | H3PO4 | O2・Pt(+)
(ii) KOH型・・・(-)Pt・H2 | KOH | O2・Pt(+)
(1) 電池とは何か?
「電池(battery)」とは、化学反応によって、直流の電力を生み出す電力機器のことです。電池の発明は、1800年のイタリアの物理学者アレッサンドロ・ボルタによる「ボルタ電池(voltaic cell)」が最初です。紀元3〜7世紀頃のオーパーツに、「バグダッド電池(Baghdad battery)」と呼ばれる電池ではないかと考えられているものもありますが、実際に電池だったのかどうかは、大いに疑問視されています。
電流は、電子e− のような荷電粒子が移動するときに伴う電荷の流れなので、電池には電子移動反応、すなわち酸化還元反応が、密接に関わっています。酸化還元反応によってエネルギーを作り出すことができるのは、自発的に起こる酸化還元反応のほとんどが、外部にエネルギーを放出する発熱反応だからです。つまり、電池とは、自発的に起こる酸化還元反応に伴って放出されるエネルギーを、電気エネルギーとして取り出す装置のことなのです。

図.1 様々な電池
電池において、電子が流れ出る極板を「負極(anode)」といい、電子が流れ込む極板を「正極(cathode)」といいます。ただし、電流の流れと電子の流れは逆になるので、注意が必要になります。つまり、電流は正極から負極に向かって流れ、電子は負極から正極に向かって流れることになります。
このようなややこしい定義になっている理由は、電子が発見される以前に、「電流は正極から負極に流れる」と定義されていたからです。そして、そのあとに電子の移動する方向は、負極から正極であることが確かめられたのですが、「電流は正極から負極に流れる」ということは、すでに慣例となっていたため、電流と電子の流れは、逆であると定義されたのです。
また、電池の両極間に生じる電位差は、「電池の起電力(electromotive force)」と呼ばれます。この起電力が大きいほど、電池の電流を流す力が大きくなります。そして、このように電池から電流を取り出すことを、「放電(electric discharge)」といいます。一方で、外部電源を用いて、放電と逆向きの電流を流すことによって、放電とは逆の反応を起こし、起電力を回復させる操作を、「充電(charging)」といいます。また、あとに説明するボルタ電池やダニエル電池、マンガン乾電池のように、充電ができない電池を「一次電池(primary battery)」といい、鉛蓄電池のように、充電によって繰り返し使用できる電池を「二次電池(secondary battery)」といいます。
表.1 主な電池の分類
|
|
名称 |
起電力 |
利用例 |
|
一次電池 |
マンガン乾電池 |
1.5 V |
懐中電灯、ラジカセ、リモコン |
|
アルカリマンガン乾電池 |
1.5 V |
懐中電灯、ラジカセ、リモコン |
|
|
リチウム電池 |
3.0 V |
時計、カメラ、火災報知器 |
|
|
銀電池 |
1.55 V |
時計 |
|
|
空気電池 |
1.3 V |
補聴器 |
|
|
二次電池 |
鉛蓄電池 |
2.0 V |
自動車のバッテリー |
|
ニッケル-カドミウム蓄電池 |
1.3 V |
コードレス機器 |
|
|
ニッケル-水素池 |
1.35 V |
携帯電話、ハイブリット車 |
|
|
リチウムイオン電池 |
3.7 V |
携帯電話、ノートパソコン、電気自動車 |
|
|
燃料電池 |
リン酸型 |
1.2 V |
病院やホテルの非常用電源 |
電池とは、酸化還元反応によって、電気エネルギーを取り出す装置のことです。つまり、自発的に起こる酸化還元反応は、原理的にはすべて電池にすることができます。それ故に、電池というものは、事実上無限に作ることができます。したがって、電池を分析するときは、まずその電池で使われている、酸化剤と還元剤を確定することが重要になります。それさえ決まれば、各極の正負や各極で起こる反応も、すぐに決めることができます。そしてその上で、その電池で特に工夫されていることに注意を払えば、電池の理解はほぼ完璧になります。
実用電池の多くは、次の図.2のような構造をしていて、負極では還元剤が作用し、正極では酸化剤が作用しています。また、負極で酸化される還元剤を「負極活性物質(negative electrode active material)」といい、正極で還元される酸化剤を「正極活性物質(positive electrode active material)」といいます。
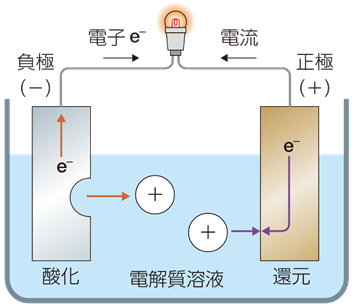
図.2 一般的な電池の構造
(2) ボルタ電池・・・(-)Zn | H2SO4 | Cu(+)
イタリアの解剖学者であるルイージ・ガルヴァーニが、死んだカエルの筋肉に金属のメスで触ると、ピクリと動くことがあると発見したのは、1780年頃のことでした。その後、ガルヴァーニは、カエルの足の痙攣と静電気との関係の研究を約10年続けました。そして、電気ウナギのように、カエルの体の中には電気(動物電気)があるのではないかと考え、1791年に「筋肉運動に対する電気の作用について」という論文を発表しました。この研究が広く関心を呼び、ヨーロッパ中の学者たちが、電気の研究を始めました。
これに対して、イタリアの物理学者であるアレッサンドロ・ボルタは、「カエルの筋肉に電気があるのではなく、二種類の金属が電解液と接触しているときに電気が発生する」ことを確かめました。ボルタは、カエルを用いてガルヴァーニの実験の再現を試みましたが、ある日、二種類の金属を食塩水に漬けるだけで電気が発生することを発見しました。カエルの足は、食塩水の役割を果たしていたに過ぎなかったのです。「ガルヴァーニ電池で見られる現象は、動物由来の電気ではない。二種類の金属をカエルの足に接触させたとき、気付かないうちに電池ができあがっていたのだ」という正しい原理を、ボルタは明らかにしました。

図.3 ボルタは、「動物電気」というガルヴァーニの説を反証し、正しい電池の原理を明らかにした
そして、ボルタは1794年に、銅板と亜鉛版の間に食塩水を含ませた布をはさみ、これを交互に積み重ねて、電流を取り出す装置を発明しました。微小電流ではあるものの、高電圧が得られるこの装置を、「ボルタ電堆(Voltaic power sedimentary)」といいます。ボルタはこの電堆を改良して、1800年に「ボルタ電池(voltaic cell)」を完成させました。この功績により、ボルタは勲章と伯爵の地位を得ました。電圧の単位である「V(ボルト)」も、ボルタの名から付けられたものです。19世紀初頭、種々の電解現象の研究や電気化学の基礎知識の解明が大いに進みましたが、これにはボルタ電池の開発が大きく関わっています。

図.4 ボルタが発明したボルタ電堆
ボルタ電池は、希硫酸に亜鉛版と銅板を浸して、導線でつないだものです。ボルタ電池は、現在の電池の原型ではあります。しかし、電池としては不完全であり、放電を続けると、徐々に起電力が低下していくので、実用的ではありません。実験してみると、銅板の表面に水素H2の細かい泡が付いて、やがて反応が止まります。
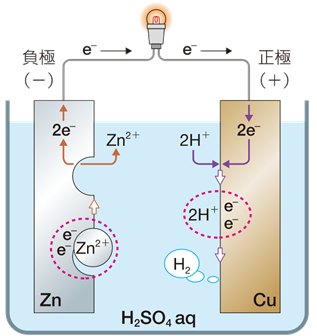
図.5 ボルタ電池
|
負極 |
Zn → Zn2+ + 2e− |
|
正極 |
2H+ + 2e− → H2 |
|
全体 |
Zn + 2H+ → Zn2+ + H2 |
ボルタ電池では、正極に銅板を使っていますが、これは何の化学反応も受けません。正極ではCu+2H+→Cu2++H2の反応が考えられますが、銅Cuは水素H2よりイオン化傾向が小さいので、この反応が自然に起こることはありえません。したがって、ボルタ電池では、銅板はただの電子導体として、働いているにすぎません。
また、M1|H2SO4|M2のような装置が、電池になるかどうかは、金属M1, M2のイオン化傾向によります。もしもボルタ電池のように、金属のイオン化傾向がM1>H2>M2ならば、負極では極板M1が酸化され、正極では水素イオンH+ が還元されることにより、M1とH2のイオン化傾向の差に対応する起電力が得られます。また、イオン化傾向がH2>M1,M2ならば、そもそも負極での酸化反応が起こらないので、電池になりません。それでは、イオン化傾向がM1>M2>H2の場合はどうでしょうか?これは、負極での還元剤として、M1, M2のどちらも作用することが考えられます。しかし、還元剤としての強さはM1>M2であるので、負極ではM1→M1n++ne− の反応の方が起こりやすいことが考えられます。つまり、この場合も結局のところ、M1とH2のイオン化傾向の差に対応する起電力が得られることになります。
要するに、ボルタ型の電池は、どのような金属板を用いても、M1とM2のイオン化傾向の差による起電力は得られず、得られるのはM1とH2のイオン化傾向の差による起電力なのです。ボルタ電池は、「亜鉛と銅の電池」と思われがちですが、実際は「亜鉛と水素の電池」なのです。したがって、ボルタ電池では、負極に亜鉛板を用いているので、亜鉛Znと水素H2のイオン化傾向の差に見合う起電力が得られると予想され、その理論起電力は約0.8 Vになります。
表.2 ボルタ型の電池で得られる理論起電力
|
イオン化傾向 |
負極 |
正極 |
理論起電力 |
|
M1>H2>M2 |
M1 |
M2 |
約0.8 V |
|
H2>M1,M2 |
− |
− |
− |
|
M1>M2>H2 |
M1 |
M2 |
約0.8 V |
ところが、実際のボルタ電池では、理論起電力よりも小さい0.4 V程度の起電力しか得られないのです。この理由は、銅板で2H++2e−→H2の反応を起こすのに、比較的大きな活性化エネルギーが必要であり、これを克服するためには余分な電圧が必要で、電池として使える電圧が少なくなるためです。この余分な電圧を、「水素過電圧(hydrogen overvoltage)」といいます。銅板上の水素過電圧は約0.4 Vなので、これが影響して、ボルタ電池の起電力は約0.4 Vまで下がります。ボルタ電池では、触媒効果の高い白金Ptを銅Cuの代わりに使うと、実際に得られる起電力は0.8 V程度になります。
表.3 主な金属の水素過電圧
|
|
Pt |
Au |
Ni |
Fe |
Cu |
Zn |
Hg |
|
水素過電圧 |
0.005 V |
0.02 V |
0.21 V |
0.3 V |
0.4〜0.6 V |
0.6〜0.7 V |
1.0〜1.3 V |
なお、ボルタ電池の起電力として、理論起電力である約0.8 Vではなく、1.1 Vと説明している文献が多く見られます。実際に実験をしてみても、放電の初期は、起電力が1.1 Vとなることが多いのです。これはなぜでしょうか?この理由は、ボルタ電池で使う銅板や亜鉛板の表面の一部は、空気中の酸素O2によって酸化されているため、放電の初期は、金属酸化物が水素イオンH+ で中和されて、銅(II)イオンCu2+ や亜鉛(II)イオンZn2+ が生じてくるからです。
CuO + 2H+ → Cu2+ + H2O
ZnO + 2H+ → Zn2+ + H2O
すなわち、放電の初期は、銅板表面に銅(II)イオンCu2+ が生じていて、水素イオンH+ の代わりに、銅(II)イオンCu2+ が酸化剤として作用することになるのです。つまり、放電の初期は、亜鉛Znと水素H2のイオン化傾向の差に見合う起電力ではなく、亜鉛Znと銅Cuのイオン化傾向の差に見合う起電力が、見かけ上の起電力になるため、起電力が1.1 Vと大きくなるのです。しかし、銅板表面の銅(II)イオンCu2+ はすぐに失われるため、やがて起電力は、亜鉛Znと水素H2のイオン化傾向の差に見合う0.8 Vとなります。
Zn2+ + 2e− = Zn (—0.763 V)
Cu2+ + 2e− = Cu (0.337 V)
2H+ + 2e− = H2 (0.000 V)
また、ボルタ電池でよくされる説明として、「ボルタ電池では、銅板に水素H2の泡ができると、水素H2が水素イオンH+ に戻ろうとして、逆起電力がかかり、また水素H2が水素イオンH+ の接近を妨げるので、減極剤として、過酸化水素H2O2や二クロム酸カリウムK2Cr2O7などの酸化剤を加えると、泡が消えて起電力が回復する」というような、「水素H2の泡が、起電力を下げるすべての悪の根源である」と説明する文献がよく見られます。しかし、これは次に示す2点で、誤解があります。
(i) 起電力が下がるのは、逆起電力が原因ではなく、水素過電圧が原因である
逆起電力とは、水素H2が水素イオンH+ に戻ろうとする反応のことです。逆の起電力が作用するということは、H2+Zn2+→2H++Znの反応が、電池全体で自然に起こるということになります。しかし、イオン化傾向はZn>H2であり、この反応は吸熱反応なので、この反応が自然に起こることは、絶対にありえないのです。
そもそも、銅板の代わりに白金板を使えば、たとえ水素H2の泡があっても、亜鉛Znと水素H2のイオン化傾向の差による起電力が得られるのだから、逆起電力による分極を起電力低下の理由にするのは、無理があるのです。ボルタ電池の起電力が、理論値よりも小さくなるのは、先にも説明した水素過電圧が原因です。
(ii) 酸化剤を加えて起電力が回復するのは、酸化剤がH+ の代わりに反応するからである
放電を続けると、水素H2が銅板の表面に付着するため、水素イオンH+ が銅板に近付きにくくなります。その結果、円滑な電子e− の受け渡しができなくなって、反応の遅れが生じるようになります。これが一種の内部抵抗になり、起電力が徐々に低下していくというのは、正しい説明です。ボルタ電池で、白金板を正極に用いた場合でも、発生する水素H2により、起電力は徐々に低下していきます。白金板を用いたボルタ電池が理論起電力を示すのは、飽くまでも水素H2の泡の影響がない放電の初期だけです。
そのため、多くの文献では、「水素H2の掃除機として、過酸化水素H2O2や二クロム酸カリウムK2Cr2O7などの酸化剤を加えると、起電力が回復する」というような説明がよくされます。起電力が回復するというのなら、ボルタ電池で起こっている酸化還元反応は、Zn+2H+→Zn2++H2であるので、回復しても0.8 V程度にしか戻らないはずです。しかし、実際に実験をしてみると、起電力は2 V程度まで上がってしまうのです。ここで注意すべきは、起電力は元に戻るだけでなく、それ以上になるということです。この理由は、水素イオンH+ よりも遥かに強い酸化力を持った過酸化水素H2O2や二クロム酸カリウムK2Cr2O7が酸化剤、亜鉛Znを還元剤とする、新たな電池が出来上がったからです。
(-)Zn | H+, H2O2 | Cu(+)
|
負極 |
Zn → Zn2+ + 2e− |
|
正極 |
H2O2 + 2H+ + 2e− → 2H2O |
|
全体 |
Zn + H2O2 + 2H+ → Zn2+ + 2H2O |
銅板に付着する水素H2が、邪魔者であるというのは事実です。しかし、「酸化剤を加えて水素H2が消えたから起電力が回復した」と単純に考えるのは、正確ではありません。これは、減極剤だと思って加えた酸化剤が、正極で水素イオンH+ の代わりに反応しているだけであり、そういう意味での減極剤というものは、そもそも存在しないのです。
(3) ダニエル電池・・・(-)Zn | ZnSO4 || CuSO4 | Cu(+)
ボルタ電池は、正極側で水素H2が発生して、それが一種の内部抵抗になり、また水素過電圧のために、起電力が低下するという欠点がありました。このように、ボルタ電池は課題が山積みで、とても実用に堪えうるものではありませんでした。しかし、1836年にイギリスの物理学者であるジョン・フレデリック・ダニエルは、「イオン化傾向の差を電気エネルギーとして取り出す」というボルタ電池の基本方針を引き継ぎ、ボルタ電池を改良した「ダニエル電池(Daniel cell)」を考案しました。ダニエル電池は、亜鉛板を浸した硫酸亜鉛ZnSO4水溶液と、銅板を浸した硫酸銅CuSO4水溶液を素焼き板で仕切り、両極の金属板を導線でつないだものです。
ダニエル電池はすぐに評判になり、当時、世界各地で設計され始めた電信機の電源として採用されました。1854年、日米和親条約締結のために来日したペリーが、将軍家に献上した電信機の電源にも、ダニエル電池が使われていました。その電信機の実験の様子を見聞した松代藩士の佐久間象山が、日本人として初めて、ダニエル電池を作ったといわれています。しかし、ダニエル電池は、自己放電による消耗が大きく、使用上も不便なので、現在では歴史的ないし教育的な意味しかありません。
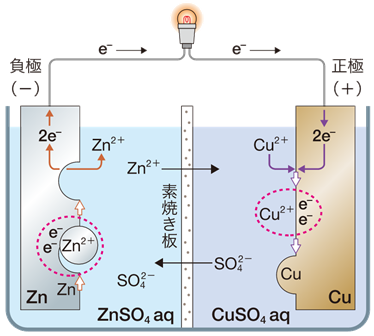
図.6 ダニエル電池
|
負極 |
Zn → Zn2+ + 2e− |
|
正極 |
Cu2+ + 2e− → Cu |
|
全体 |
Zn + Cu2+ → Zn2+ + Cu |
ダニエル電池の特徴は、正極室と負極室とが、隔壁によって分けられていることです。この隔壁には、素焼き板の他に、セロハンなどの半透膜やイオン交換膜、塩化カリウムKClなどの水溶液を寒天で固めた塩橋などが利用できます。これらの隔壁は、拡散による両極液の混合を防ぎつつも、イオンを通過させることで、負極室と正極室の電気的接続を保つ働きをしています。ただし、無限に時間が経てば、両液は完全に混ざり合うため、電池の機能を無くしてしまいます。なお、ダニエル電池では、正極側では銅(II)イオンCu2+ が消費され、負極側では亜鉛(II)イオンZn2+ が生産されることから、硫酸亜鉛ZnSO4水溶液の濃度を小さく、かつ硫酸銅CuSO4水溶液の濃度を大きくすると、電池が長持ちします。
また、このようなM1|M1n+||M2n+|M2で表される装置は、必ず電池となります。このときの金属のイオン化傾向をM1>M2とすると、負極では極板M1が酸化され、正極ではM2n+ が還元されることにより、M1とM2のイオン化傾向の差に見合う起電力が取り出せるのです。ちなみに、ダニエル電池では、亜鉛Znと銅Cuのイオン化傾向の差に見合う起電力が得られ、その理論起電力は1.1 Vになります。ただし、実際には素焼き板に起因する内部抵抗のため、作動時の電圧は約1.0 Vとなります(この電圧が「ボルトV」という単位を決める基準となりました)。以上のことをまとめると、ダニエル型電池については、一般的に次のようなことがいえます。
|
・イオン化傾向の異なる金属M1, M2を用いて電池を作った場合、イオン化傾向の大きい方の金属が負極になる。 ・金属M1, M2のイオン化傾向の差が大きいほど、起電力は大きい。 ・溶液中の負極側の金属イオン濃度が小さく、かつ正極側の金属イオン濃度が大きいほど、放電が持続する。 |
(4) マンガン乾電池・・・(-)Zn | NH4Cl,ZnCl2 | MnO2(+)
ボルタ電池やダニエル電池は、持ち運びが不自由であり、汎用性が高くありませんでした。そこで、電池の電解質をペースト状にし、水分をできるだけ抑えて、手軽に使えるように工夫した電池が、現在でも汎用されている「乾電池(battery)」です。乾電池には、マンガン乾電池やアルカリマンガン乾電池、ニッケルマンガン乾電池などがあります。ここでは、代表的な「マンガン乾電池(manganese dry cell)」を説明します。マンガン乾電池は、乾電池の中でも歴史が古く、世界で最も使用されている乾電池です。

図.7 マンガン乾電池
|
負極 |
Zn + 4NH4+ → [Zn(NH3)4]2+ + 4H+ + 2e− |
|
正極 |
MnO2 + H+ + e− → MnO(OH) |
マンガン乾電池では、持ち運びができるように、電解質液にデンプンなどを加え、溶液をペースト状にして、外部に漏れにくくしています。そのために、負極で生じる亜鉛(II)イオンZn2+ は、負極から拡散しにくく、これが反応を遅らせて、起電力を下げる原因となってしまいます。そこで、アンモニアNH3を加えて、錯イオンとして除くのですが、アンモニアNH3は気体なので、そのままでは利用することが困難です。そこで、アンモニアNH3の塩である塩化アンモニウムNH4Clを代わりに加えています。
Zn2+ + 4NH4+ → [Zn(NH3)4]2+ + 4H+
こうして生じた水素イオンH+ は、電気伝導性が亜鉛(II)イオンZn2+ と比べて非常に大きいので、電解質液で電気を運ぶのに大きな貢献をします。また、水素イオンH+ は、正極で二酸化マンガンMnO2が酸化剤として作用するときの手助けもします。なお、正極では、二酸化マンガンMnO2が還元される反応が起こります。正極の反応生成物は、オキシ水酸化マンガン(III) MnO(OH)とマンガン(II)イオンMn2+ の混合物となります。
MnO2 + H+ + e− → MnO(OH)
MnO(OH) + 3H+ + e− → Mn2+ + 2H2O
(5) 鉛蓄電池・・・(-)Pb | H2SO4 | PbO2(+)
「鉛蓄電池(lead storage battery)」とは、1859年にフランスのガストン・プランテが発明した電池のことです。鉛蓄電池の起電力は、約2.0 Vです。鉛蓄電池は、現代でも自動車のバッテリーや非常用電源などに用いられています。このような古典的な電池が、現代においても未だに使用されている理由は、鉛蓄電池が充電で繰り返し使用できる二次電池だからです。鉛蓄電池は、製造コストが安く、高電流に対しても耐えるという優れた性質があります。
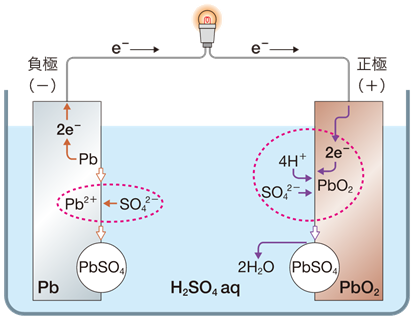
図.8 鉛蓄電池
|
負極 |
Pb + SO42− → PbSO4 + 2e− |
|
正極 |
PbO2 + 4H+ + 2e− + SO42− → PbSO4 + 2H2O |
|
全体 |
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O |
鉛Pbと酸化鉛(IV) PbO2は、どちらも鉛の元素を含んでいます。どちらが負極でどちらが正極なのか、混乱しやすいところです。しかし、電池においては、負極で酸化反応が起こり、正極で還元反応が起こることを踏まえておけば、簡単に判断することができます。その酸化数は、鉛Pbでは最低の0であり、酸化鉛(IV) PbO2では最高の+IVです。それ故に、高温で鉛Pbと酸化鉛(IV) PbO2を反応させると、鉛Pbでは酸化数が0→+IIとなり、酸化鉛(IV) PbO2では酸化数が+IV→+IIへと変化して、反応は均一化する方向へ進みます。したがって、鉛蓄電池においては、負極で鉛Pbが酸化され、正極で酸化鉛(IV) PbO2が還元される反応が起こるということが分かります。
Pb + PbO2 → 2PbO
酸化還元反応が進行すると、各極で生成した鉛(II)イオンPb2+ は、すぐに硫酸イオンSO42− と反応して、不溶性の硫酸鉛(II) PbSO4になります。しかし、極板表面は、複雑に入り組んだ加工が施してあるため、これは溶液中で沈殿とならずに、極板に付着します。そのため、放電した電池に逆の電圧をかけ、電流を逆向きに流すと、各極では逆反応が起こり、放電する前のもとの状態に戻ります。この操作を「充電(charge)」といいます。このように、鉛蓄電池は充電で繰り返し使えるという特徴を持っているのです。なお、鉛蓄電池は放電をすると、負極から正極へと電子が移動して、次のような反応が、全体で進行します。
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
上式の反応は、2 molの電子e− が移動するときに起こる反応です。つまり、鉛蓄電池においては、2 molの電子e− の放電につき、両電極ではPb+PbO2→2PbSO4の反応より質量が増加し、電解液では2H2SO4→2H2Oの反応より希硫酸H2SO4の濃度が減少するのです。
|
2 molの電子e−の放電当たり ・正極 1 mol PbO2 → 1 mol PbSO4(質量が64 g増加する) ・負極 1 mol Pb → 1 mol PbSO4(質量が96 g増加する) ・電解質 2 mol H2SO4 → 2 mol H2O(硫酸の濃度減少) |
希硫酸H2SO4の濃度変化については、次のように計算できます。例えば、25wt%(100 g)の鉛蓄電池の電解液は、0.1 molの電子e− を放電すると、溶質H2SO4が0.1 molだけ減り、溶媒H2Oが0.1 molだけ増える結果、電解液の硫酸H2SO4濃度が16.5wt%にまで減少します。
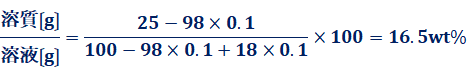
(6) 水素・酸素型燃料電池
水素や天然ガスなどの燃料を外部から供給し、その燃焼による熱エネルギーを電気エネルギーとして取り出す電池のことを、「燃料電池(fuel cell)」といいます。中でも「水素・酸素型燃料電池(hydrogen-oxygen fuel cell)」は、よく話題にされる代表的な燃料電池です。最近では、ノートパソコンや携帯電話用の小型のもの、自動車用などの様々な種類の燃料電池が開発されています。例えば、2014年12月15日にトヨタ自動車は、量産型として世界初のセダン型燃料電池自動車「MIRAI」を一般消費者向けに販売しました。エネルギー源はもちろん水素H2で、水素充填時間は3分、航続距離は約650 kmです。販売価格は720万円とかなり高価ですが、燃料電池自動車には、購入時に約200万円の補助金が出るといいます。

図.9 世界初のセダン型燃料電池自動車「MIRAI」
燃料電池の特徴は、酸化剤と還元剤が気体なので、外部から供給し続ければ、半永久的に発電ができることです。また、燃料として水素H2を用いた場合は、生成物として二酸化炭素CO2を排出しないので、クリーンなエネルギー源であることなどがあげられます(ただし、水素H2の製造過程で二酸化炭素CO2を生じる場合があるので、この場合は「グレー水素」と呼ばれます)。さらに、燃料電池は小規模でも運用可能なため、工場や住宅などの分散型の発電が可能で、高圧線による長距離送電のコストや電力のロスも少ないです。分散型発電の大きなメリットは、反応で発生する熱を暖房や給湯用のエネルギーとして活用できることです。電力とともに、発電時の排熱も利用できるように設計されたシステムを「コージェネレーションシステム(cogeneration)」といいます。電気だけを取り出して利用する従来型の発電システムのエネルギー効率は30〜40%程度ですが、燃料電池によるコージェネレーションは70〜85%以上のエネルギー効率が可能です。
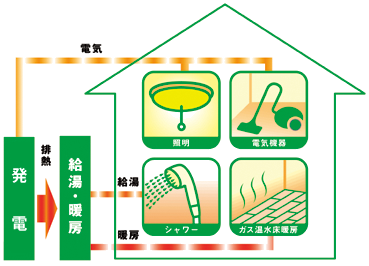
図.9 電力を生み出す際に生じる排熱を給湯や冷暖房に利用するシステムを「コージェネレーションシステム」という
ここまで説明すると、燃料電池は「夢の電池」のようですが、有効な電極触媒が安くできないため、まだ広く普及はしていません。燃料電池には、H—H結合を切断する触媒が必要であり、今のところ触媒になるのは、ほぼ白金Ptだけなのです。白金原子Ptは、水素分子H2の水素原子Hと結合しやすいです。H—H間は0.074 nm、Pt—Pt間の最小値は0.27 nmなので、二つのH—Pt結合(約0.27 nm)ができるとき、H—H結合はほぼ完全に切れてしまいます。このときの触媒として働く原子をMとすると、M—H結合が弱すぎると(M=Pb, Zn, Cuなど)、H—H結合は切断されず、逆にM—H結合が強すぎると(M=Ti, Wなど)、H—H結合が切れてもHがMと結合したままになり、以後の反応が進んでくれません。白金PtがH—H結合を切断する触媒になるのは、程よい強さで水素原子Hと結合するためなのです。
一般社団法人日本自動車工業会(JAMA)によると、2021年の日本の自動車の生産台数は785万台です。自動車用の燃料電池には、1台当たりで約100 gの白金Ptが必要となり、仮に燃料電池自動車を700万台作るとなると、700 tの白金Ptが必要となります。国内で1年間に使用する白金Ptは約30 tで、その1割を自動車製造に回せたとしても、年間で3万台分にしかなりません。白金触媒を使う限り、燃料電池の大規模利用はありえません。燃料電池の大規模利用には、安価な触媒の開発が急務であり、これからの大きな挑戦課題となるでしょう。
(i) H3PO4型・・・(-)Pt・H2 | H3PO4 | O2・Pt(+)
H3PO4型の水素・酸素型燃料電池は、電解液に95wt%濃リン酸H3PO4水溶液を用いた燃料電池です。早くから研究開発が進み、現在最も普及している燃料電池です。H3PO4型の起電力は約1.2 Vで、後述するKOH型と違って、空気中で二酸化炭素CO2に汚染される心配がないというメリットがあります。H3PO4型の燃料電池は、病院やホテルなどで発電機として実用化されており、排熱は給湯や冷暖房に利用されます。
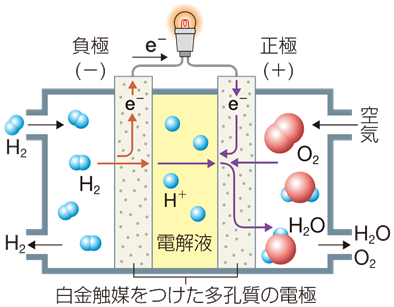
図.11 H3PO4型の水素・酸素燃料電池
|
負極 |
H2 → 2H+ + 2e− |
|
正極 |
O2 + 4H+ + 4e− → 2H2O |
|
全体 |
2H2 + O2 → 2H2O |
水素・酸素型燃料電池では、水素ガスが還元剤として、酸素ガスが酸化剤として作用します。負極に水素ガスを吹き付けると、一部は酸化されて水素イオンH+ となり、これが電解液に溶け込みます。
H2 → 2H+ + 2e−
一方で、正極では酸素ガスが吹き付けられており、一部は還元されて酸化物イオンO2− となり、これが電解液に溶け込みます。このときに電解液の水素イオンH+ と中和反応し、水H2Oが生成します。
O2 + 4e− → 2O2−
2O2− + 4H+ → 2H2O
(ii) KOH型・・・(-)Pt・H2 | KOH | O2・Pt(+)
KOH型(アルカリ型)の水素・酸素型燃料電池は、電解液には30〜45wt%水酸化カリウムKOH水溶液を用い、電極には正負のどちらにも、白金触媒を含む多孔質の金属膜を使います。この燃料電池では、負極板に水素ガス、正極板に酸素ガスを吹き付けて、酸化還元反応を起こします。KOH型の起電力は、約1.2 Vです。高出力を得られるため、当初からスペースシャトルなどの航空宇宙用に利用されてきました。KOH型の別名「アポロ型」は、NASAによる人類初の月への有人宇宙飛行計画(アポロ計画)で、有人宇宙船の電源として用いられ、このとき生成した水H2Oが、乗組員の飲料水に用いられたことから名付けられました。
|
負極 |
H2 + 2OH− → 2H2O + 2e− |
|
正極 |
O2 + 2H2O + 4e− → 4OH− |
|
全体 |
2H2 + O2 → 2H2O |
KOH型の反応は、H3PO4型とほとんど同じです。しかし、イオンが電解液に溶け込んでからの反応が、少しだけ違います。負極に水素ガスを吹き付けると、一部は酸化されて水素イオンH+ となり、これが電解液に溶け込みます。このときに電解液の水酸化物イオンOH− と中和反応し、水H2Oが生成します。
H2 → 2H+ + 2e−
2H+ + 2OH− → 2H2O
一方で、正極では酸素ガスが吹き付けられており、一部は還元されて酸化物イオンO2− となり、これが電解液に溶け込みます。このときに酸化物イオンO2− が電解液の水H2Oと反応し、電解液に水酸化物イオンOH− を供給する役割を果たすのです。
O2 + 4e− → 2O2−
2O2− + 2H2O → 4OH−
なお、KOH型では、空気中の二酸化炭素CO2によって、電解液が汚染される可能性があります。したがって、KOH型を空気中で運用するときは、空気と触れないような工夫をして、使用する必要があります。
2KOH + CO2 → K2CO3 + H2O
(iii) 水素・酸素型燃料電池のまとめ
H3PO4型とKOH型のいずれにしても、まとめると全体で2H2+O2→2H2Oの反応が、4 molの電子e− の移動で起こったことになります。各極の半反応式は、H3PO4型では電解液中に水素イオンH+ があること、KOH型では電解液中に水酸化物イオンOH− があることを踏まえておけば、簡単に式を作ることができると思います。すなわち、KOH型では電解液中に水酸化物イオンOH− があるので、H3PO4型の式に、水酸化物イオンOH− を加えた式となります。H3PO4型の式は次のようになりますが、KOH型では水酸化物イオンOH− による中和反応が起こるので、負極の両辺に+2OH− 、正極の両辺に+4OH− をします。
(-)Pt・H2 | H3PO4 | O2・Pt(+)
|
負極 |
H2 → 2H+ + 2e− |
|
正極 |
O2 + 4H+ + 4e− → 2H2O |
H2 + 2OH− → 2H+ + 2OH− + 2e−
O2 + 4H+ + 4OH− + 4e− → 2H2O + 4OH−
これを整理すると次のようになり、ちょうどKOH型の式を表していることが分かります。
(-)Pt・H2 | KOH | O2・Pt(+)
|
負極 |
H2 + 2OH− → 2H2O + 2e− |
|
正極 |
O2 + 2H2O + 4e− → 4OH− |
・参考文献
1) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
2) 石川正明「新理系の化学(下)」駿台文庫(2005年発行)
3) 渡辺正「電気化学のしくみ」化学と教育65巻12号(2017年)
4) 渡辺正/北條博彦 共著「高校で教わりたかった化学」日本評論社(2008年発行)