�E�J�ڌ��f(�N�����E�}���K���E�S�E�R�o���g)
�y�ڎ��z
(1) �J�ڌ��f
�����\�ɂ����āA��3�������12���Ɉʒu���錳�f���A���̂��āu�J�ڌ��f(transition element)�v�Ƃ����܂�(��12���͑J�ڌ��f�Ɋ܂߂Ȃ��ꍇ������܂�)�B�����̑J�ڌ��f�́A��������d�q�\���ɓ���������A�T�^���f�ƈقȂ��āAd�O�����邢��f�O���Ȃǂ̓��k���k�ɂȂ��Ă��܂���B�����āA���q�ԍ��̑����ɂ���ĕω�����̂́A��ɓ��k��d�O���Ȃ���f�O���d�q�ł���Ƃ��������������܂��B���Ȃ킿�A���q�ԍ�21�̃X�J���W�E��Sc���猴�q�ԍ�30�̈���Zn�܂ł͏���3d�O�����d�q�Ő�߂��Ă����A���q�ԍ�39�̃C�b�g���E��Y���猴�q�ԍ�48�̃J�h�~�E��Cd�܂ł�4d�O�����A���q�ԍ�72�̃n�t�j�E��Hf���猴�q�ԍ�80�̐���Hg�܂ł�5d�O�����A���ꂼ��d�q�ɂ���ď��ɐ�L����܂��B�����̑J�ڌ��f���u��J�ڌ��f(main-transition element)�v�Ƃ����܂��B��J�ڌ��f�́A�l�X�ȗz�C�I���ɂȂ�₷���Ad�O���̓d�q�z�u�̑��l���f���āA�����̎_���������܂��B
�܂��A���q�ԍ�57�̃����^��La���猴�q�ԍ�71�̃��e�`�E��Lu�܂ł͓d�q��4f�O�������ɐ�߁A���q�ԍ�89�̃A�N�`�E��Ac���猴�q�ԍ�103�̃��[�����V�E��Lr�܂ł�5f�O����d�q�����ɐ�߂Ă����܂��Bf�O�������ɐ�L�����J�ڌ��f���u�����J�ڌ��f(inner transition element)�v�Ƃ����܂��B���̂����A�����^��La���烋�e�`�E��Lu�܂ł̌��f���u�����^�m�C�h(lanthanoid)�v�Ƃ����A�A�N�`�E��Ac���烍�[�����V�E��Lr�܂ł̌��f���u�A�N�`�m�C�h(actinoid)�v�Ƃ����܂��B
�}.1 �J�ڌ��f�Ƃ́A�����\�ő�3�������12�����f�̊Ԃɑ��݂��錳�f�̑��̂ł���
�����^�m�C�h�́A�n�C�e�N���i�̍ޗ��Ƃ��ďd�����̂������ł��B�����^�m�C�h�ɃX�J���W�E��Sc�ƃC�b�g���E��Y�����������f�Q�́A���̂��āu��y�ތ��f(rare earth element)�v�ƌĂ�܂��B��y�ތ��f�ł́A�����ς��{3�̎_����Ԃ�����ł��B�܂��A�����̌��f�̒P�̂́A�퉷�툳�ł͋����̌����ł���A�����̂��͎̂����Łu�펥��(paramagnetism)�v���邢�́u������(ferromagnetism)�v�������܂��B�펥���Ƃ����̂́A�O���玥���ߕt����ƁA���̎��̏o�����͐��Ɠ��������ɁA���k�d�q�̎��C���[�����g�̐����������Ƃ��������ł��B����ŁA�������Ƃ����̂́A�O����ߕt�������̎��͐��Ɠ��������ɁA���k�d�q�̎��C���[�����g�̐����ꂢ�ɑ����Ƃ��������ł��B�������̂ɋ��͂Ȏ����ߕt����ƁA���̎�����苎���Ă��A���C���[�����g����������Ԃ��������܂��B�����Ȃ����������̂��A�u�i�v����(permanent magnet)�v�Ƃ����܂��B

�}.2 �����^�m�C�h�ɃX�J���W�E��Sc�ƃC�b�g���E��Y�����������f�Q�́A���̂��āu��y�ތ��f�v�ƌĂ��
��y�ތ��f�́A�u���A�A�[�X(rare earth)�v�ƌĂ�邱�Ƃ�����܂��B�u���A(rare)�v�͊Ƃ����Ӗ��ł����A�̂͏����Ɏ��o�����Ƃ�����������߁A�����ʂ����Ȃ����̂ƐM�����Ă������ƂɗR�����Ă��܂��B�������A���ۂɂ͒n�k���̑��ݗʂ��l����ƁA�����ď��Ȃ���ł͂���܂����B�ΐ��⒆�ł́A�R�o���gCo�∟��Zn�Ɠ������炢�܂܂�Ă��܂����A���Ȃ����̂ł���Au���Ag���������̂ŁA�����Ƃ��Ă͂ނ���L�x�ł��B���݂ł��u���A�A�[�X�v�̖��ŌĂ��̂́A���̌��f�ł͑�p�ł��Ȃ��@�\�������Ă�����̂������̂ŁA�u���A�v�Ƃ����C���[�W������ł��ʗp���邩��ł��傤�B
���A�A�[�X�̐��E���v�̖�90%�́A�������������Ă��܂��B�����̃��A�A�[�X�z���́A�����̍z���ƈقȂ�A�n���̃��A�A�[�X�������N�����o�ĔS�y�ɋz���������̂ł��B�E�������̕��ː����f�́A���N�̉J���ɗn���ė���o���Ă���̂ŁA���o������ȒP�ɂł���Ƃ������݂�����܂��B���̂��߁A���̍z�R���R�X�g�I�ɗL���ŁA�u�����ɂ͐Ζ����A�����ɂ̓��A�A�[�X������v�Ƃ����Ă��܂��B
�\.1 ���A�A�[�X�̍��ʖ�����(2010�N)
|
���� |
���Y��(��t) |
�䗦(%) |
|
���� |
3,600 |
36.4 |
|
���V�A |
1,900 |
19.2 |
|
�A�����J |
1,300 |
13.1 |
|
�I�[�X�g�����A |
540 |
5.5 |
|
�C���h |
310 |
3.1 |
|
�u���W�� |
4.8 |
0.05 |
|
�}���[�V�A |
3 |
0.03 |
|
���̑� |
2,200 |
22.2 |
���Ȃ݂ɁA���A�A�[�X�Ǝ������t�ɁA�u���A���^��(rare metal)�v�Ƃ������t������܂��B�������A���A���^���Ƃ����p��́A���ۓI�ɂ͒ʗp���Ȃ����{�Ǝ��̂��̂ŁA�o�ώY�ƏȂ̒�`�ɂ��A�u���A���^���͒n����̑��ݗʂ��H�ł��邩�A�Z�p�I�E�o�ϓI�ȗ��R�Œ��o����ȋ����̂����A���ݍH�Ɨp���v������A��������v��������̂ƁA����̋Z�p�v�V�ɔ����V���ȍH�Ɨp���v���\���������́v�ƒ�`����Ă��܂��B�܂�A���A���^���Ƃ͌��f�̕����I�E���w�I�����Ɋ�Â����ނł͂Ȃ��A�H�ƓI�Ȏ��_�ł̕��ނł��B�Y�����錳�f�́A���A�A�[�X��17���f�ł���̂ɑ��A���A���^����47��ނɂ����܂��B���A���A���́A�����̐��������������̂Ɏg���܂��B�����́A���ʂ̕s�����������邱�ƂŁA�������傫���ω����邱�Ƃ�����̂ł��B���A���^�����n�C�e�N�f�ނɏ��ʓY�����邾���ŁA����������I�Ɍ��シ�邽�߁A�u�Y�Ƃ̃r�^�~���v�Ƃ��Ă�Ă��܂��B��ȗp�r�Ƃ��ẮA�e���r��g�ѓd�b���͂��߂Ƃ����d�q�@�킪����܂��B

�}.3 �X�}�[�g�t�H���ɂ́A�j�b�P��Ni�E�N����Cr�E�l�I�W�E��Nd�E�C���W�E��In�E��Au�Ȃǂ̃��A���^�����g���Ă���
�����ŁA�J�ڌ��f�̐����ɂ������ʓI�ȌX����A�P�̂������ƂȂ��v�����f�̐����Ƃ̈Ⴂ���܂Ƃ߂Ă����܂��傤�B�J�ڌ��f�̃X�J���W�E��Sc���爟��Zn���u���n��v�A�C�b�g���E��Y����J�h�~�E��Cd���u���n��v�A�����^��La���琅��Hg�܂ł��u��O�n��v�Ɩ��t���܂��B���q��C�I���̑傫���́A����n����Ō���ƁA���̕\.2�̂悤�ɁA���q�ԍ��̑����ƂƂ��ɁA���������X���������܂��B����́A����n����ł́A�d�q�͓���d�O���ɓ���A������d�O���d�q�����q�j�̐��d�ׂ��Օ�������ʂ͂��܂�傫���Ȃ����߁A���q�ԍ��̑����ɔ������q�j�̐��d�ׂ̑����ɂ��A�ŊO�k�d�q�����q�j�ɋ��������t�����邽�߂ł��B
���̂悤�ȌX���́A���k�ɑ��݂���f�O���ɂ����Ă�茰���Ɍ����A�u�����^�m�C�h���k(lanthanoid contraction)�v��u�A�N�`�m�C�h���k(actinoid contraction)�v�Ƃ��Ēm���Ă��܂��B��O�n��̑J�ڌ��f�́A�����^�m�C�h���k�̉e�����܂��B���̂��߁A��O�n��̌��q���a��C�I�����a�́A���n��ƂقƂ�Ǔ������Ȃ�܂��B����́A�A���J��������A���J���y�ދ����ɂ͌����Ȃ����ۂł��B
�\.2 �������f�̋������a(�P�ʂ�pm)
�܂��A�J�ڌ��f�̒P�̗̂Z�_�́A��ʓI�ɍ������̂������āA�قƂ�ǂ̂��̂�1,000�����Ă��܂��B����́A�A���J��������A���J���y�ދ����Ȃǂ̎�v�����f�̋����̗Z�_���A���\�����琔�S���ł��邱�ƂƍD�ΏƂł��B�J�ڋ��������ɂ����錴�q�̑傫���́A�A���J��������A���J���y�ދ����ɔ�ׂ�Ə������A�J�ڌ��f�̏ꍇ�́Ad�O����f�O���̂悤�ɁA�O���ɍL�����z����d�q�����������ɎQ�����܂��B���̂��߁A�J�ڌ��f�ł͌��q�Ԍ����͂������Ȃ�A�Z�_�������Ȃ�ƍl�����Ă��܂��B�������̑J�ڌ��f���r����ƁA��O�͂�����̂́A���q�ԍ����傫�����f�̒P�̂قǁA�Z�_�͍����Ȃ�܂��B���ɑ�O�n��̃^���O�X�e��W��j�E��Re�́A3,000������Z�_�������܂��B����͑��̌��f�̒P�̂Ɣ�ׂāA�ۗ����č����l�ł��B
�\.3 ��ȋ������f�̗Z�_
|
�������f |
�Z�_�k���l |
���� |
|
�^���O�X�e��W |
3,410 |
�J�ڌ��f |
|
�SFe |
1,535 |
�J�ڌ��f |
|
��Cu |
1,083 |
�J�ڌ��f |
|
��Au |
1,064 |
�J�ڌ��f |
|
��Ag |
952 |
�J�ڌ��f |
|
�A���~�j�E��Al |
660 |
�T�^���f |
|
����Zn |
420 |
�T�^���f |
|
��Pb |
328 |
�T�^���f |
|
�i�g���E��Na |
98 |
�T�^���f |
|
����Hg |
-39 |
�T�^���f |
�J�ڌ��f�̃C�I�����G�l���M�[�́A��550�`900 kJ/mol�̊Ԃł��B����́A���`�E��Li��X�g�����`�E��Sr����A�z�E�fB���P�܂ł͈̔͂ɑ������܂��B���̂��Ƃ́A�J�ڌ��f�̍�鉻�w�������A�C�I�����������狤�L�������܂ŁA���l�ł��邱�Ƃ������Ă��܂��B�n��ԂŔ�r����ƁA���n��Ƒ��n��̃C�I�����G�l���M�[�̊Ԃɂ́A����قǍ����Ȃ����̂́A��O�n��̃C�I�����G�l���M�[�́A���̌n����傫���Ȃ��Ă��܂��B����́A��L�̌��q���a�ƊW���Ă��܂��B���Ȃ킿�A��O�n��́A���n��Ɣ�ׂČ��q���a������قǕς��Ȃ��̂ɂ�������炸�A���q�j�̐��d�ׂ͑����Ă��邽�߁A�C�I�����G�l���M�[�͑傫���Ȃ�̂ł��B
(2) �N����
(i) �N����Cr
�u�N����(chromium)�v�́A�┒�F�̌�������d�������ł��B�V�R�ł͗l�X�ȍz���Ɋ܂܂�Ă���A�G�������h�̗ΐF��r�[�̐ԐF�́A�s�����Ƃ��Ĕ��ʂɊ܂܂��N����Cr�̂��߂ł��B���f���̗R���́A�����鉖�ނ��e��̐F�ʂ������Ƃ���A�M���V�A��́uchroma(�F)�v�ɂ��Ȃ�ł��܂��B�N����Cr�̒P�̂́A��C���̎_�fO2�Ɖ������ĕ\�ʂɕs���Ԕ햌�����̂ŁA�퉷�ł͋�C�␅H2O�ɑ��Ĉ���ł��B���̔햌�̌�����1�`3 nm�قǂ�������܂��A�_�fO2�␅H2O�����������ɐN������̂�h���ł���܂��B�N����Cr�͎K�тɂ����̂ŁA�S���i�̂߂����Ƃ��ėp����ꂽ��A�SFe�ƍ����āu�X�e�����X�|�v�Ƃ��ėp����ꂽ�肵�܂��B�N����Cr�̕s���Ԕ햌�ɂ́u���ȏC���@�\�v�����邱�Ƃ��m���Ă���A�X�e�����X�|�̕\�ʂ����t���A�s���Ԕ햌���ꕔ�����Ȃ��Ă��A�|���̃N����Cr�������Ɏ_�fO2�ƌ������ĐV���ȕs���Ԕ햌�����̂ł��B��Ȃǂ̑f�ނƂ��āA�X�e�����X�|�𑍍��͂Œ�������͍̂��̂Ƃ��둶�݂��Ă��܂���B
�N����Cr�����_���̐��n�t�͗ΐF�ł���A����ɂ���ƁA���_���N����(III) Cr(OH)3�̊D�ΐF���a���܂��B�܂��A���̗n�t�ɐ��_���i�g���E��NaOH���n�t���\���ɉ�����ƁA�e�g���q�h���L�\�N����(III)�C�I��[Cr(OH)4]�| �ƂȂ��āA�ėn�����܂��B
Cr3+�@�{�@3OH�|�@���@Cr(OH)3��(�D��)
Cr(OH)3�@�{�@OH�|�@���@[Cr(OH)4]- (��)
(ii) �N����Cr�̉�����
�N����Cr�́A���ɑ����̎_����Ԃ����A�_������-2�����{6�܂ł̏�Ԃ��m�F����Ă��܂��B�_������-2�����{1�Ƃ�������_�����̏�Ԃ́A���̂ɂ����Č����܂��B�ł�����ȏ�Ԃ́A�_�����{3�̏�Ԃł���A�_�����{6�̉������́A�ɂ߂ēŐ��������ł��B�_�����{6���N����Cr���܂���N�����_�J���E��K2Cr2O7�̃q�g�ł̒v���ʂ́A0.5�`1 g�Ƃ����Ă��܂��B���ẮA�_�����{6�̉��������߂����p�r�Ŏg�����Ƃ����������̂ł����A�y�뉘�����N�����ȂǂŁA�����Ζ�莋����A���݂ł͎g���Ȃ��Ȃ��Ă��Ă��܂��B
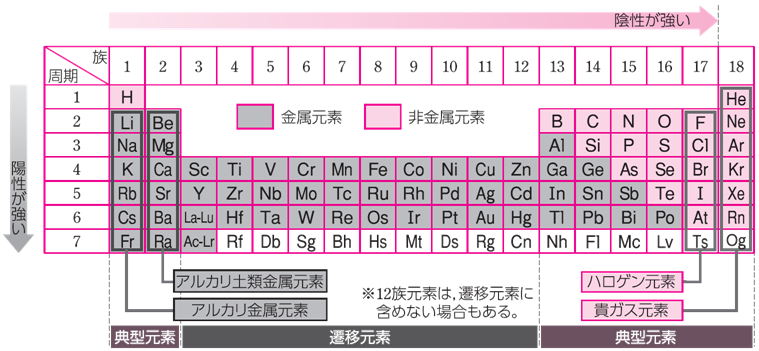
�_�����{3�̏�Ԃł���N����(III)�C�I��Cr3+ �́A���w�I�ɂ̓A���~�j�E���C�I��Al3+ �Ɠ����������������܂��B�N����(III)�C�I��Cr3+ ���܂ޑ�\�I�ȉ������́A�_���A���~�j�E��Al2O3�ƑS�������\���������_���N����(III) Cr2O3�ł��B�����̍��́A�݂��ΐF�����Ă��܂����A����͎_���N����(III) Cr2O3�̐F�ł��B�N����(IV)�C�I��Cr4+ �́A�_���N����(IV) CrO2�Ɋ܂܂�܂��B����́A�_�����ł͒������A�����ŋ����������������ł���A���C�L�^�p�e�[�v�ɗ��p���ꂽ���Ƃ�����܂��B�����_���������N����(VI)�C�I��Cr6+ �́A�I�L�\�_��I�L�\�_�C�I���A����уI�L�\�_�������܂��B����ɂ́A�N�����_�C�I��CrO42�| ����ѓ�N�����_�C�I��Cr2O72�| ���m���Ă���A�����͐��n�t���ł́A���̂悤�ȕ��t��Ԃɂ���܂��B
2CrO42�| (��)�@�{�@2H+�@⇄�@Cr2O72�| (�Ԟ�)�@�{�@H2O
Cr2O72�| (�Ԟ�)�@�{�@2OH-�@⇄�@2CrO42�| (��)�@�{�@H2O
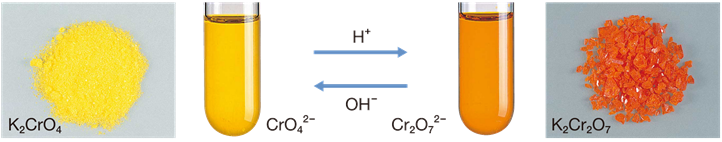
�}.4 �N�����_�C�I��CrO42�| �Ɠ�N�����_�C�I��Cr2O72�| �̉t����
��N�����_�C�I��Cr2O72�| �́A�_�����n�t���ň���ł���A�Ԟ�F��悵�܂��B����ŁA�N�����_�C�I��CrO42�| �́A������n�t���ň���ł���A���F��悵�܂��B�N�����_�C�I��CrO42�| �́A���n�t���ŋ�C�I��Ag+ �≔(II)�C�I��Pb2+�A�o���E���C�I��Ba2+ �Ɣ������A���ꂼ��N�����_��Ag2CrO4��N�����_��(II) PbCrO4�A�N�����_�o���E��BaCrO4�̓Ɠ��ȐF�����������a�����܂��B���̂��߁A�����̔����́A�����C�I���̒萫���͂␅�n�t���̃N����(VI)�C�I��Cr6+ �̊m�F�ɗp�����܂��B
Ba2+�@�{�@CrO42�|�@���@BaCrO4��(��)
Pb2+�@�{�@CrO42�|�@���@PbCrO4��(��)
2Ag+�@�{�@CrO42�|�@���@Ag2CrO4��(�Ԋ�)

�}.5 �N�����_��
�܂��A��N�����_�C�I��Cr2O72�| �̗��_�_�����n�t�́A�����_���܂ł���A��ꋉ�A���R�[�����A���f�q�h��J���{���_�ɕς��鑼�A��A���R�[�����P�g���ɕς��܂��B���Ăł́A���w�I�_�f�v����(COD)���v������ۂ̎���Ƃ��Ă��p�����܂��B
Cr2O72�| (�Ԟ�)�@�{�@14H+�@�{�@6e�|�@���@2Cr3+(��)�@�{�@7H2O
(3) �}���K��
(i) �}���K��Mn
�u�}���K��(manganese)�v�́A�n�k���ɔ�r�I�L�x�ɑ��݂���┒�F�̋����ł��B�}���K��Mn�̒P�̂́A�d���Ă��낢�����ł���A�Z�_��1,240���ƑJ�ڌ��f�̒��ł͔�r�I�Ⴂ���ł��B�}���K��Mn�́A�V�R�ŒP�̂Ƃ��Ă͎Y�o�����A��_���}���K��MnO2��Y�_�}���K��MnCO3�ȂǂƂ��ĎY�o���܂��B�}���K��Mn�̍����́A�������̐����Ɩ��ڂɊ֘A���Ă���A�u�}���K���|�v�͋��x�Ŋ���ɂ����̂ŁA�S���̒��œ��ɗ͂̂����郌�[�������̍ޗ��Ƃ��ėp�����܂��B�Ռ���������ƍd���Ȃ鐫��������A���@�B�̑��s�p�����O��(������L���^�s��)��@��p�̒܂Ȃǂɂ��g�p����܂��B

�}.6 �u�}���K���|�v�́A�S�����[�������ɗp������
�C��̉ΎR������M���������ǂŁA�C���ɗn���o�����}���K��Mn��SFe���A���_�����ɂȂ��ĊC��ɒ��a���A�W���K�C����̉�(��ʂɍ����F�ŁA�����͒��a1�`10 cm���x)�����܂��B������u�}���K���c��v�Ƃ����܂��B�听���̓}���K��Mn��SFe�ł����A���̑��ɗL�p�����Ƃ��ē�Cu�A�j�b�P��Ni�A�R�o���gCo�Ȃǂ��܂ނ��Ƃ���A�d�v�ȊC��z�������Ƃ��Ē��ڂ���Ă��܂��B�}���K���c��́A1873�N�ɃC�M���X�̊C�m�T���D�u�`�������W���[���v���A�A�����J�k�����݂̉����̐[�C��ŏ��߂Ĕ������܂����B�L�k�A�T���̎��A��Ȃǂ��j�ɂ��āA���\�N���琔�S���N�̍Ό��������āA�����������̂ƍl�����Ă��܂��B�c��̑��ʂ́A�����h���n�������ق̃A�����E�A�[�`���[�̌��ς���ɂ��A5,000��t�Ƃ���Ă��܂��B

�}.7 �}���K���c��̐����ɂ́A���\�N���琔�S���N������Ƃ����Ă���
(ii) �}���K��Mn�̉�����
�}���K��Mn���A�N����Cr�Ɠ��l�ɔ��ɑ����̎_����Ԃ����A�_������-3�����{7�܂ł̏�Ԃ��m���Ă��܂��B�_������-3,-1,0,�{1�̒�_�����̏�Ԃ́A��ɍ��̂Ō����܂��B�Ȃ��A�_����-2�̏�Ԃ́A�܂��m�F����Ă��܂���B�ł�����ȏ�Ԃ́A�_�����{2�̏�Ԃł���A�}���K��(II)�C�I��Mn2+ ���܂ޑ����̉��������m�F����Ă��܂��B�}���K��(III)�C�I��Mn3+ �͎_���}���K��(III) Mn2O3�ɂ����āA�}���K��(IV)�C�I��Mn4+ �͓�_���}���K��MnO2�ɂ����āA�}���K��(V)�C�I��Mn5+ �̓}���K��(V)�_�J���E��K3MnO4�ɂ����āA�}���K��(VII)�C�I��Mn7+ �͉߃}���K���_�J���E��KMnO4�ɂ����āA���ꂼ�ꑶ�݂��܂��B

�}.8 �}���K��Mn�̉�����
��_���}���K��MnO2�͍��F�̌ő̂ł���A�K�x�Ȏ_���͂����_���܂Ƃ��āA���d�r�̎_����(���Ɋ�������)�Ƃ��ė��p����܂��B�Z���_HCl�ƍ����ĉ��M����ƁA�������fHCl���_������ĒP�̂̉��fCl2�������܂��B���̔����͗�₷�Ǝ~�܂�̂ŁA���fCl2�̔����𐧌�ł�����S�ȕ��@�ł���A�����w�Z�ł̎����ɓK���Ă��܂�(��17�����f(�n���Q��)���Q��)�B���̑��A�ߎ_�����fH2O2�≖�f�_�J���E��KClO3����_�fO2�������閳�@�G�}�Ƃ��Ă����p����Ă��܂��B
MnO2�@�{�@4HCl�@���@MnCl2�@�{�@Cl2�@�{�@2H2O
2H2O2�@���@O2�@�{�@2H2O
2KClO3�@���@2KCl�@�{�@3O2
�}���K��(VI)�C�I��Mn6+ �ƃ}���K��(VII)�C�I��Mn7+ �́A�}���K��Mn�̑�\�I�ȃI�L�\�_�C�I���ł���}���K���_�C�I��MnO42�| �Ɖ߃}���K���_�C�I��MnO4�| �ɂ��ꂼ��܂܂�܂��B�����̉A�C�I���́A��������_���͂������ł��B���ɉ߃}���K���_�J���E��KMnO4�́A�_���Ҍ��H��ɗp������T�^�I�ȉ������ŁA���͂Ȏ_���܂Ƃ��č�p���܂����A�t���ɂ���Ĕ������قȂ�܂��B
(�_���n�t���ł�) MnO4�| (�Ԏ�)�@�{�@8H+�@�{�@5e�|�@���@Mn2+(�W��)�@�{�@H2O
(�����`����n�t���ł�) MnO4�| (�Ԏ�)�@�{�@2H2O�@�{�@3e�|�@���@MnO2(��)�@�{�@4OH�|

�}.9 �߃}���K���_�J���E��KMnO4���n�t�ɂ���_���Ҍ��H��
(4) �S
(i) �SFe
�u�S(iron)�v�́A����������̒��ōł��L�p�ȋ����ł��B���݁A�l�ނ����p���Ă���S������90%�͓SFe�ł��B�d�x������A���H�����₷���A�Y�f�ܗL�ʂȂǂ�ω������邱�Ƃŗl�X�Ȑ������������邱�Ƃ��ł���A�܂��Ɂu���\�̋����v�Ƃ����Ă������ł��B���̂��߁A���㕶���́A�SFe����{�Ƃ��č\�z����Ă��܂��B�u�S�͍��ƂȂ�v�́A19���I�Ƀh�C�c�͂œ��ꂵ���r�X�}���N�̉����ɗR�����錾�t���Ƃ����Ă��܂����A�܂��ɂ��̌��t�̒ʂ�A�ߑ㍑�Ƃ͓SFe���Ȃ���Ύn�܂�܂���B���Ȃ݂ɁA�p��́uiron�v�̌ꌹ�́A�M���V�A��́uieros(����)�v�ɗR�����܂��B���f�L���́uFe�v�́A���e����́uferrum(�S)�v�ɗR�����܂��B
�SFe�̔����́A�l�ނɂƂ��ĐV���Ȏ���̓������Ӗ����܂����B�S��́A�Ί�������D��Ă����̂ŁA�_�Ƃ�H�ƁA�푈�̕���Ɏg����悤�ɂȂ�܂����B�SFe���ŏ��Ɏg�����̂͌Ñ�G�W�v�g�l�ŁA�SFe�̐��B���s����悤�ɂȂ�͂邩�ȑO�́A������5,000�N�ȏ���O�̂��Ƃł����B�ނ�́u覐ΓS�v���g�����̂ł��B�����̐��B�Z�p���Ȃ��������゠�邢�͒n��ɂ����ẮA覐ΓS�́u�V����̋����v�Ƃ��Ă�A�Ñ��蒿�d����܂����B�l�H�I�ɍ��ꂽ�SFe�ɂ́A�j�b�P��Ni�͂قƂ�NJ܂܂�Ȃ��̂ł����A覐ΓS�̓j�b�P��Ni�̊ܗL�ʂ��������߁A������x�e�Ղɉ��H�ł���قǓ�炩���ł��B覐ΓS������ꂽ�Z�����A�c�^���J�[�����̕����i�̒����甭������Ă��܂��B

�}.10 覐ΓS�́u�V����̋����v�ƌĂ�Ñ��蒿�d���ꂽ
�SFe�̐��B���ŏ��ɍs��ꂽ�̂́A�I���O3000�N����I���O2700�N���̒����V���A���ƍl�����Ă��܂��B�SFe�́A�n����̂قƂ�ǂ̊�Β��ɁA�_�����◰�����A�܂��̓P�C�_���Ȃǂ̌`�Ŋ܂܂�Ă��܂�(��5%)�B�n�k���Ɋ܂܂��������f�Ƃ��ẮA�A���~�j�E��Al�̎��ɒn�k���ɑ������݂��A�z�Ƃ��č̎�\�Ȃ��͖̂�2,320��t����Ƃ����Ă��܂��B�ԓS�zFe2O3�⎥�S�zFe3O4�Ȃǂ̓S�z�͒n����̂ǂ��ł���ɓ������̂ŁA���@�����K���ł���A��ʂ̓SFe����邱�Ƃ��ł��܂����B
�\.4 �S�z�̎�ނƐ���
|
���� |
���w�� |
���� |
|
�ԓS�z |
Fe2O3 |
�n���ł͂���ӂꂽ�z���B�F�͍��E�D�E�Ԋ��E�ԂȂǗl�X�����A�����ɂ���Ƃ�������Ԋ��F�ɂȂ� |
|
���S�z |
FeO(OH)�nH2O |
�Ê��F�������͍��F�̍z���B���y�F�̊痿�Ƃ��Ă��p������ |
|
���S�z |
Fe3O4 |
�ΐ���Ɋ܂܂�A���F�̋���������B�������̂Ŏ��ɂ������B������ɂȂ������S�z�����S�ł��� |
|
���S�z |
FeS2 |
���F�̍z���B���������S�����낭����̂ŁA���S�ɂ͗p�����Ȃ��B���̐F����u���҂̉����v�Ƃ������� |
�I���O1500�N����I���O1200�N�̊Ԃɂ́A�A�i�g���A�n��(���݂̃g���R����)�ɋ������q�b�^�C�g�l�ɂ���āA��K�͂ȓSFe�̐��B���s���܂����B����ɂ���āA�l�ނ̓S�펞�オ�n�܂����̂ł��B�q�b�^�C�g�l�́A�l�ނŏ��߂ēS���̕���ƁA�n�Ɉ��������Ԃ����o���܂����B�����́A�������̂Ƃ��Ă��������ɂ����ẮA�ŐV���̌R�������ł��B�q�b�^�C�g�l�̓o�r���j�A��łڂ��A�G�W�v�g�̐V�����Ƃ����͂𑈂��܂����B�������A�ނ�̉h���͋I���O12���I�܂łł����B���n���C��Ŋ��Ă����u�C�̖��v�ɍU�ߍ��܂�āA�q�b�^�C�g�鍑���łт܂��B�������āA�q�b�^�C�g�l�̐��S�Z�p�́A���ӏ����Ɋg�U���Ă������Ƃ����܂��B����ȗ��A�SFe�͈�т��ĉ�X�̎Љ�Ɛ����̒��S�ɂ��葱���A�����̔��W�ɍv�����Ă��܂����B

�}.11 �q�b�^�C�g�鍑�́A�Ñ�ɐ��S�ɂ���ĉh����
�SFe�̒P�̂́A�����������┒�F�̋����ő��ł��B�_H2SO4��_HCl���ǂ̎_�Ɣ������āA���fH2�����Ȃ���W�ΐF�̓S(II)�C�I��Fe2+ �̗n�t�ƂȂ�܂��B���n�t���̓S(II)�C�I��Fe2+ �͎_������₷���A��C���ɕ��u����ƁA���n�t�̐F�͏��X�ɉ��F����ттĂ��܂��B����́A��C���̎_�fO2�␅�ɗn���Ă���_�fO2�����A�S(II)�C�I��Fe2+ �������F�̓S(III)�C�I��Fe3+ �܂Ŏ_������邽�߂ł��B
Fe�@�{�@2H+�@���@Fe2+(�W��)�@�{�@H2
4Fe2+�@�{�@2H2O�@�{�@O2�@���@4Fe3+(����)�@�{�@2OH-
�܂��A�SFe�������̐����C�Ƃ��ꕔ���������āA�l�_���O�SFe3O4�ƂȂ�܂��B����ŁA�SFe�́A�Z�Ɏ_HNO3�Ȃǂ̎_���͂̂���_�Ƃ͔������܂���B���̗��R�́A�Z�Ɏ_HNO3���ł́A�SFe�̕\�ʂɌ�����nm���x���k���ȍ\�������_���疌�������āA������������Ȃ�_��������}�����邽�߂ł��B���̂悤�ȏ�Ԃ́u�s����(passivity)�v�ƌĂ�A�SFe�̑��ɂ��A�N����Cr��A���~�j�E��Al�A�R�o���gCo�A�j�b�P��Ni�Ȃǂ̋����Ō����܂��B
3Fe�@�{�@4H2O�@⇄�@Fe3O4(��)�@�{�@4H2
�SFe�̃T�r�ɂ́A�u�ԃT�r�v�Ɓu���T�r�v������܂����A���T�r�͕s���Ԃł��B�ԃT�r�́A�SFe����������C���ɕ��u����Ɛ�����T�r�ł��B���߂��e���Ė������Ă��炸�A�T�r�̓������{���{���ɂ��A�SFe�͂₪�ċ����Ă��܂��܂��B����ɁA�̐�H2O��_�fO2���ǂ�ǂ�z�����āA�����܂ŃT�r���i�s����̂��t�ɏ����Ă��܂��܂��B����ŁA���T�r�́A�SFe��800�`1000�����x�ŋ��M�����Ƃ��ɐ�����T�r�ł��B�k���Ŗ��������ǂ��̂ŁA��C���̎_�fO2���T�r�̓����ɐN������̂�h���A�ԃT�r�̔�����}���܂��B�ԃT�r�̎听���́A�����ɂ���Ă��قȂ�܂����A�Ԋ��F�̎_���S(III)���a��Fe2O3�nH2O�ƍl�����Ă��܂�(n��1�ɑ�������g����FeO(OH)�ŕ\�L���邱�Ƃ�����܂�)�B����ŁA���T�r�̎听���́A���F���l�_���O�SFe3O4�ł��B

�}.12 �ԃT�r(��)�ƍ��T�r(�E)�̔�r
�C���h�̃f���[�s�x�O�ɂ���ɂ���u�`�����h���o���}���̓S���v�́A����6.9 m�A���a44 cm�A�d��6 t�����鋐��ȓS���ł��B�S���ɒ���ꂽ�T���X�N���b�g��̔蕶��S�����̑����l������A���悻1,500�N�O�Ƀ}�E���������̃A�V���J�����Â�ŁA���a�F���ړI�Ƃ��Đ��삳�ꂽ���̂Ɛ��肳��Ă��܂��B�����ׂ����Ƃ́A���̓S����1,500�N���̊ԁA�S���K�тĂ��Ȃ��Ƃ������Ƃł��B1,300�N�O�Ɍ��Ă�ꂽ�@�����ɂ��S�B���p�����Ă��܂����A���̓B�͌��݂ł����݂ł��B�u�`�����h���o���}���̓S���v��u�@�����̓S�B�v�́A�����\�ʂɕs���Ԃ��`������č��T�r�ƂȂ��Ă���A���H�������Ă���ƍl�����Ă��܂��B

�}.13 �C���h�̃f���[�s�x�O�ɂ���`�����h���o���}���̓S���́A1,500�N�̖\���J�ɔ�����Ȃ���K�тĂ��Ȃ�
�SFe�́A���͂��Ȃ�K�т₷�����ނ̋����ł��B�C�I�����X�����傫�����߁A��������C���ł́A�e�Ղ��T�r���āA��������A�����芌�F�ɂȂ����肵�܂��B����́A�S�ʏ�Ő������킸���ɈقȂ����������A�d�������n�t�ɕ����āA���ꂼ�ꂪ���ɂ܂��͕��ɂƂȂ�A���̓d�r���`�����Ĕ������邽�߂ł��B���̂悤�ȓd�r���u�Ǐ��d�r(local cell)�v�Ƃ����܂��B�S�ʏ�ŁA�T�r�̍����ӏ��ƍ����Ȃ��ӏ�������̂́A���̂��߂ł��B�������镔���Ȃǂł��A�SFe�̎_���������N����₷���Ȃ�̂ŁA���ɂɂȂ�܂��B����ŁA�_�fO2�ɐG��₷���ӏ��ł́A�_�fO2���_���܂Ƃ��ē����̂ŁA���ɂƂȂ�܂��B�Ȃ��A�S�T�r�̌`���ߒ��́A�ɂ߂ĕ��G�ł��邽�߁A���̐}.14�Ŏ����Ă��锽���́A�ق�̈��ł��B���_���S(II) Fe(OH)2�́A�ŏ��ɂł���T�r�ł��B���̃T�r���n���_�fO2�ɂ��_������Đ��_���S(III) Fe2O3�nH2O�ƂȂ�A�������琅��������n��1�̃I�L�V���_���S(III) FeO(OH)�ƂȂ�܂��B
���̂悤�Ȕ����������ŋN���镅�H���ۂ��A�u��C���H(atmospheric corrosion)�v�Ƃ����܂��B�����̌�����0.1 mm��蔖���Ȃ�ƁA�����\�ʂ���̎_�fO2�������x�������Ȃ�̂ŁA���H���x�͑傫���Ȃ�܂��B����ŁA�������ڂɌ����Ȃ��قǔ����Ȃ�ƁA�����\�ʂ��s���ԉ����Ă��܂��̂ŁA���H���x�͒ቺ���Ă��܂��܂��B����܂ł̌�������A�S�ʏ�̐����̌����������悻���\µm�̂Ƃ��ɁA���H���x���ő�ƂȂ邱�Ƃ�����Ă��܂��B���x�����H���x�ɉe�����܂����A��͂萅���̑��݂��d�v�ł���A��ԂɋC�����������āA�����\�ʂ���������G�ꂽ�Ƃ��ɁA�ł����H���i�s���₷���Ȃ�Ƃ���������܂��B
Fe �� Fe(OH)2 �� Fe2O3�nH2O �� FeO(OH)
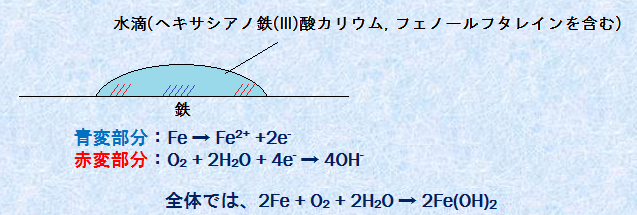
�}.14 �S�ʂ��K�т�d�g��
�܂��A���w�J�C�����A�SFe�̕��H�����𗘗p�������̂ł��B�SFe�̕��H�����͔��M�����ł���A�S�T�r�Ƃ��āA�I�L�V���_���S(III) FeO(OH)����������ƁA������1 mol�������419 kJ�̔��M������܂��B���w�J�C���̌����ɂ́A�S���E�����Y�E�H���E�ې��܂��܂܂�Ă��܂��B�S���⊈���Y��p���邱�ƂŁA�ڐG�ʐς���ѓSFe�̔����ʐς��傫���Ȃ�܂��B�����āA���̏�ɕې��܂���̐������L����A���̑S�̂ɔ����������`������܂��B�����Y�́A���̔��E�Ɏ_�fO2����������z���ێ��ł���̂ŁA�SFe�̕��H�𑣐i����_���܂Ƃ��Ă̎_�fO2�𑽐��������邱�Ƃ��ł��܂��B����ɉ����A�����Y�͓d�C�`������L���A���ɂƂȂ�SFe�ɑ��Đ��ɂƂ��č�p���A�S���݂̂̂Ƃ������_�fO2�̊Ҍ��������N����ʐς������邱�ƂŁA�SFe�̗n�x���������܂��B�������A�SFe�͎_�fO2��������������߂���ƁA�s���ԉ�����X��������̂ŁA�H��NaCl�������A�s���ԉ���j�Q���Ă��܂��B
Fe�@�{�@1/2H2O�@�{�@3/4O2�@=�@FeO(OH)�@�{�@419 kJ

�}.15 ���w�J�C���́A�S���̎_�������𗘗p�����J�C���ł���
�SFe�́A�Y�Ɨp�����̑㖼���Ƃ������鑶�݂ł��B�������A���́u�K�т₷���v�Ƃ����_�́A�SFe�̍ő�̗����x�ł���A���̑�̂��߁A���N����Ȕ�p���������Ă��܂��B�������Ȃ���A�SFe�͑��l�ȍ�������邱�Ƃ��ł��A�����̍����̐������A�����d�x������i�̈������苭�x����D�ꂽ�U���������܂ŁA���݂ɒ����ł���ȂǁA�R�قǂ̒���������܂��B�n���⒒���A�@�B���H�A�b���A��ԉ��H�A�Ă�����A�Ă��߂��A�Ă��Ȃ܂��A���L�Ȃǂ���������e�ՂŁA�ǂ�Ȍ`����ɂ��ł���Ƃ����_�ŁA�SFe�͑��̋����̒ǐ��������܂���B�u�S�v�͋����̂Łu�c�v�Ə����܂��B���{�̗L���ȓS�|�w�҂ł���{�������Y�́A���̊����ƓSFe�̗D�G���������āA�u���̉��Ȃ�Ɓv�ƕ]���܂����B�l�X�Ȍ��f�Ƒg�ݍ��킹�ėD�ꂽ�ޗ��ƂȂ�SFe�́A�܂��ɋ����ޗ��̉��̖��ɑ��������Ƃ�����ł��傤�B
�\.5 �l�X�ȓS�����Ǝ�ȗp�r
|
���� |
���� |
�p�r |
|
�| |
Fe�{C |
�\���ށA�n�� |
|
����| |
Fe�{S |
�����ԕ��i�A���v���i |
|
�}���K���| |
Fe�{Mn |
�L���^�s���A�y�؍H���p�@�� |
|
�C���o�[ |
Fe�{Ni |
���v���i�A�������u |
|
�N�����| |
Fe�{Cr |
�����ԕ��i |
|
�^���O�X�e���| |
Fe�{W |
�H��A�������H�p�@�� |
|
13�X�e�����X�| |
Fe�{Cr(13%) |
����A�n�� |
|
18-8�X�e�����X�| |
Fe�{Cr(18%)�{Cr(8%) |
������A�H��A�ԗ� |
|
�N���������u�f���| |
Fe�{Mo�{Cr |
�����ԕ��i�A�q��@���i |
|
KS�| |
Fe�{Co�{W�{Cr |
���ޗ� |
(ii) �����ƓSFe�̊W
�l�ƓSFe�Ƃ̊W�́A�Ñ�M���V�A���ォ�炷�łɂ������Ƃ���Ă��܂��B�����̓SFe�̎傽�錴���́A�F���������Ă���u覓S�v�ł����B���̂��߁A�SFe�͌Ñ�ɂ����ẮA��Au�ȏ�ɍ����ȋ����ł����B�Ñ�M���V�A�̃X�g���{���́u�n���w�v�ɂ́A��Au�ƓSFe��10�F1�̊����Ō������s��ꂽ�Ƃ����L�q������܂��B�u��w�̕��v�Ƃ�����Ñ�M���V�A�̃q�|�N���e�X�́A�u�n���͓S���R�ǂɂ����́v�ƍl���A���̎��ÂɓSFe��p���Ă��܂����B
�l�̌��t���珉�߂ēSFe�������̂́A�C�^���A�̈�t�ł��郔�B���`�F���c�H�E�����M�[�j�ł��B1746�N�A�����M�[�j�͌��t��R�₵�Ďc���������q�̒��ɁA���Ɉ����t�����鐬���Ƃ��ēSFe�������A���ꂪ�Ԍ����̑f�ɂȂ��Ă���ƍl���܂����B������18���I�Ȍ�A�SFe�͌��F�f�ł����u�w���O���r��(hemoglobin)�v�̍\�������ł��邱�Ƃ��A���w�I�ɖ��炩�ƂȂ�܂����B�̏d70 kg�̐��l�ɂ́A��6 g�̓SFe�����݂��A���̂����̖�70%�́A���t���Ɋ܂܂�Ă��܂��B�w���O���r���Ɋ܂܂��S���qFe�́A�����Ŏ_�fO2���^�ԑ����S���Ă��܂��B�w���O���r���̂������ŁA���t�̎_�f�ܗL�\�͂́A��H2O�̖�70�{�ɏ㏸���Ă��܂��B���̃w���O���r���́A�悭����2��ނ̃^���p�N����2���A���v4�ŏW�c������Ă��܂��B4�̃^���p�N���ɂ́A���ꂼ�ꓯ����\���������q����ݍ��܂�Ă���A���̕��q���u�w��(hem)�v�Ƃ����܂��B�w���́A�u�|���t�B����(porphyrin)�v�Ƃ����L�@�������ƁA���S�̋�����������ł��Ă���A�w���O���r���̏ꍇ�́A���S���SFe�ƂȂ��Ă��܂��B
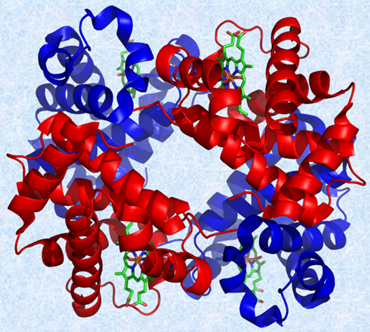
�}.16 �w���O���r��1���q�ɂ́A4�̓S(II)�C�I��Fe2+ ���܂܂��
�@�A���̑̓��ł��A�|���t�B�����̍��i�́A�������Ȃ��������Ă��܂��B�A���Ɋ܂܂��u�N�����t�B��(�t�Αf)�v�́A�|���t�B�����Ɏ������i�̒��S�Ƀ}�O�l�V�E��Mg�����������\���ł��B���̕������z���������̃G�l���M�[���A�������ɗp�����Ă��܂��B�����āA���̃N�����t�B���́A�ԐF�ƐF�̌����z�����A�ΐF�̌��˂��邽�߁A�A���͗ΐF�Ɍ����܂��B�A���͌������ɂ���đ̂����A�����͂����H�ׂăG�l���M�[���Ƃ��Ă��邱�Ƃ��v���A���̃N�����t�B���������A�n�����u�����̘f���v���炵�߂Ă��镨���Ƃ�����ł��傤�B

�}.17 �A�����ΐF�Ɍ����闝�R�́A�N�����t�B�����ΐF�̌��˂��邽�߂ł���
�@�C�m�ɓSFe���U�z���邱�Ƃ��A�n�����g���Ɏ��~�߂������錈�ߎ�ɂȂ邩������Ȃ��Ǝ咣���Ă��錤���҂����܂��B�A�����J�̃��X�E�����f�B���O�C�m�������̊C�m�w�҃W�����E�}�[�e�B���́A��ɊC�⑾���m�̐ԓ��t�߁A����ɖk�����m�̈����ђn��ł́A�v�����N�g�����s���R�ɏ��Ȃ����ƂɋC�t���܂����B�v�����N�g���������Ă������߂ɕs���ȏɎ_���Ȃǂ̑��̐����͖L�x�ȊC�悾�����̂ŁA�}�[�e�B���́u�SFe���s�����Ă��邱�Ɓv���v�����N�g���̑����Ȃ����R���ƍl���A�SFe�����U�z����v�����N�g���͑�����͂����Ƃ����������A1988�N�ɔ��\�����̂ł��B�����ă}�[�e�B���̎���A�����ɂ���Ă��̉����͎�����܂����B
�@�v�����N�g���Ȃǂ̔����Ȑ����ɂƂ��Ă��A�SFe�͐������ŕs���Ȍ��f�ł��B�C�m�́u�S�엀���v���i�߂A�v�����N�g���͑��B���Ă���܂��B�������v�����N�g���͊C���Ō�����������̂ŁA��C���̓�_���Y�fCO2���z�����Ă����Ƃ�����ł��B����ł͐X�т̔��̂��i�݁A�A���ɂ��������͌����������ł����A�n���̕\�ʂ�7�����߂�C�m�Ō�������������A����������_���Y�fCO2������Ă����\���������ł��B�������A�S�엀�����C�m���Ԍn�ɂ����炷�e���́A���̂Ƃ���悭�������Ă��炸�A�l�X�ȕ��c�������Ă���̂�����ł��B

�}.18 �C�m�ɓSFe���U�z����ƃv�����N�g����������
�ŕ��ɂ́A�u�ċz�Łv�Ƃ�������̂�����܂��B����́A�ċz��W���邱�Ƃœō�p�����������ŁA�_�J��KCN���_���Y�fCO�A�������fH2S�Ȃǂ��T�^�ł��B�����̓ŕ��́A�w���O���r�����̓SFe�ƕs�t�I�Ɍ������邱�ƂŁA�Ő��������܂��B���Ȃ킿�A�����̓ŕ�����x�SFe�ƌ�������ƁA��������Ȃ��Ȃ��Ă��܂��̂ł��B���̂��߁A�SFe�͎_�f�^�����s�����Ƃ��ł��Ȃ��Ȃ�A�זE�͌ċz���ł��Ȃ��Ȃ��āA���Ɏ��邱�ƂɂȂ�܂��B
�������̌��t���Ԃ��̂́A�w���O���r���̂����ł��B�l���������fH2S�ŖS���Ȃ�ƁA�SFe���������fH2S�ƌ������A�u�����w���O���r��(hemoglobin sulfide)�v�ƂȂ�܂��B���̂��߁A���t�����ۂ��Ȃ��āA��̂����s�F��тт�Ƃ����܂��B�Ȃ��A�ċz�ɊW��������́A�SFe�����ł͂���܂���B�^�R��C�J�Ȃǂ̓�̓����ł́A�u�w���V�A�j��(hemocyanin)�v�Ƃ��������Ɋ܂܂�铺Cu���A�_�fO2�̉^�������Ă��܂��B��̓����̌��t�����̂́A��(II)�C�I��Cu2+ �̐F�ɂ����̂ł��B

�}.19 �^�R�̌��t�Ɋ܂܂��w���V�A�j���́A��(II)�C�I��Cu2+ �R���̐F�����Ă���
�@2015�N12��25���A�����Ȋw�Ȃ́A�������ɂ���H�i�̉h�{�������܂Ƃ߂��u���{�H�i�W�������\�v�̉����ł\���܂����B���̉����ɂ��A�u�S���̉��l�v�Ƃ��Ă�Ă����q�W�L�̓S�����A100 g������55 mg����6.2 mg�ւƁA��1/9�̗ʂɕύX����܂����B����́A���ʂ��Ă���q�W�L�̐����Ɏg�����̑������A�S������X�e�����X���ɕς�������߂ɁA�q�W�L�Ɋ܂܂��S�����啝�Ɍ����������炾�ƍl�����Ă��܂��B�花���卪���A�X�e�����X���̕�̕��y���A100 g������̓S�����A9.7 mg����3.1 mg�ւƕύX����܂����B
�@���ہA�S���̒��������g�����ƂŁA�������̓S���͑����܂��B���̌��ۂ𗘗p���āA�J���{�W�A�ł́A�����̍ۂɓS���̋��u���b�L�[�A�C�A���t�B�b�V���v���ɓ���邻���ł��B�J���{�W�A��K�ꂽ�J�i�_�̈�t���A���n�̐l�̓S���s���̌����ڂ̓�����ɂ��A���Ƃ�����������ł��Ȃ����ƍl���Ă����Ƃ��ɁA���̂��Ƃ��v���t�����Ƃ����܂��B�ŏ��́A�S������̂܂ܓ�ɓ���邱�Ƃ��Ă��܂������A�S��𗿗��ɓ���邱�Ƃɓ���݂̂Ȃ������J���{�W�A�̐l�X�́A����𒆁X����邱�Ƃ��ł��Ȃ����������ł��B�����ŁA���n�ōK�^�̏ے��Ƃ��Đe���܂�Ă���u���v���^����āA�S���̋��u���b�L�[�A�C�A���t�B�b�V���v������Ă݂��Ƃ���A��C�ɍL�܂����̂��Ƃ��B���Ƃ����j�[�N�ȗ��b�ł��B

�}.20 ���b�L�[�A�C�A���t�B�b�V�����ɓ���ė��������邾���ŁA�S���̐ێ�ʂ�������
(iii) �SFe�̐��@
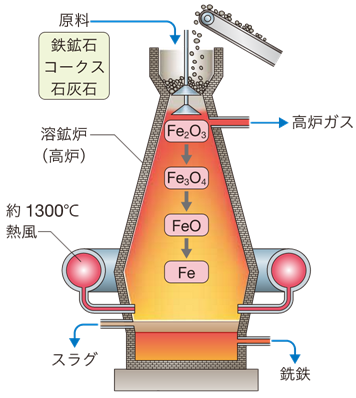
�����S�̍H�ƓI�Ȑ����ɂ́A�ԓS�zFe2O3�⎥�S�zFe3O4�������Ƃ��ėp�����܂��B���{�Ő��S���n�܂����̂́A�퐶����̌㔼���疖�������Ɛ��肳��Ă��܂��B�L�����̏��ۈ�Ղł́A�W���ɒ��a50 cm�A�[��25 cm�̐��B�F�̐ՂƎv���錊����������Ă��܂��B���S�̊�{�́A�Y�fC��R�Ă����Ĉ�_���Y�fCO�����A��_���Y�fCO�̋��͂ȊҌ���p�ɂ���āA�_���S���Ҍ����邱�Ƃł��B�ŏ����̐��S�́A�S�z�ƖؒY��w��ɏd�˂āA�������C�ɔR�Ă����邱�Ƃōs���܂����B���̂��߁A���S�ɂ͖c��ȗʂ̖ؒY��d���K�v�ƂȂ�A���R�̕���l�͂܂��͐��͂ő������Ă��܂����B
Fe2O3�@�{�@3CO�@���@2Fe�@�{�@3CO2
Fe3O4�@�{�@4CO�@���@3Fe�@�{�@4CO2
���{�ł́A�F���ɍ��S�ƖؒY�����ĉ�t���A���ݔ��g���Ăӂ������瑗�����A�Η͂����߂Đ��B����u�^�^�����S�v�����W���܂����B���E�̐��S�Z�p�̒��ŁA���S���g���Đ��S���s���Ă����͓̂��{�����ł��B�^�^�����S�́A�{��x�ē̒��҃A�j���[�V�����f��u���̂̂��P�v�ł��o�ꂵ���̂ŁA�����m�̕��������Ǝv���܂��B�x���Ƃ�8���I���ɂ́A�����n���𒆐S�Ƀ^�^�����S���s���Ă����Ƃ����܂��B�F���ɋ�C�𑗂�Ƃ��́A�u�Ԏq�v�ƌĂ���ƈ����A��l�ŋ��͂��Ăӂ����݂܂����B�Ԏq��1���Ԍ��ōs�����̂Łu�����v�A���������݂ɓ��ނ̂Łu��������ӂށv�Ƃ������t�����܂�܂����B1��̃^�^�����ƂɕK�v�ȖؒY�̗ʂ͖�12 t�ŁA����͐X�іʐςɂ����104 m2�Ƃ���܂��B���E�I�Ɍ��Ă��A�^�^�����S�Ɠ��l�̕��@�͂���ӂꂽ���̂ł������A���{�ł͖ؒY���Y�̂��߂̐X�ю������L�x�ł��邱�ƁA�����n���ō̂��ǎ��ȍ��S�̑��݂Ȃǂ̗v���ɂ��A�^�^�����S�͋ߑ�̏����܂ō������S�̂قڂ��ׂĂ�S���܂����B

�}.21 �f��u���̂̂��P�v�ł��o�ꂵ���u�^�^�����S�v
�������疾�������ɂ́A�^�^�����S�͍Ő������}���܂������A�c��ȘJ�͂������邽�߁A�吳�����ɂ͎p�������܂����B�����ŋ߂ɂȂ��āA�`���Z�p�ۑ��̂��߂ɁA���{�������p�ۑ�����̐s�͂ŁA�������m���S���c���Ń^�^�����S���s����悤�ɂȂ�܂����B�ωΔS�y�ł����C�̂悤�Ȍ`�̃^�^���F�����A���ʂ̍��S�ƖؒY�����݂ɓ���āA���������C�𑗂荞�݂Ȃ�����M���A�S��Z�����̂����B��x������ƁA�O���ԋx�݂Ȃ���Ƃ��������܂��B�F�͍Ō�ɂ͎����̂ŁA��Ƃɍ�蒼����܂��B�ł����u��(�P��)�v�ƌĂ��S��ɂ́A�ǎ��̍|���܂܂�Ă��܂��B
�^�^���t�Ƃ́A�^�^���F�𑀂��ēS�����Z�p�҂������̂ł����A����ł͂ق�̐��l�������Ȃ��Ȃ����悤�ł��B�������m���S���c���ł́A�����ȓ��{���̑f�ނ̂��߂ɁA�^�^�����S�ɂ���č��i�����|�S�ł���u�ʍ|�v����������Ă��܂��B�f��u���̂̂��P�v�ɓo�ꂷ��_�C�_���{�b�`�́A�^�^�����S�̐��S�҂̖��O�ɗR������Ƃ������鋐�l�̗d���ł���A�e�n�̖��b��̘b�ł́A���ʂ��ĎR���A�Ȃǂ̒n�`��������Ƃ����Ă��܂��B�L���Ȃ��̂ł́A�x�m�R����邽�߂ɋߍ]�̓y���@��A���̌@�����Ւn���A���i�ɂȂ����Ƃ������̂�����܂��B

�}.22 ���������c���ł́A���݂ł��^�^�����S���s���Ă���
�����āA��������㔼�ɂ́A�����ȗA���|�ނ̗����A����э����ł̗m�����S�̐L���ɂ��A�^�^�����S�͗n�z�F��p�����m�����S�@�Ɏ���đ����܂����B�n�z�F�͐��\���[�g�����̍���������̂ŁA�u���F�v�Ƃ��Ă�܂��B�n�z�F�ɃR�[�N�X�ƓS�z�����āA������M���𐁂�����œS�z���Ҍ����܂��B�n�z�F�̍����������قǁA�S�z�̊Ҍ����Ԃ������Ȃ�̂ŁA�ǎ��̓SFe�ɂȂ�܂��B�܂��A���ݔ��g���������͏��C�@�ւɎ���đ���A�F���̉��x����荂���ł���悤�ɂȂ�܂����B��x�������ꂽ�n�z�F�͏�ɉғ�����āA���N�Ɉ�x�̘F���ǂ̏C�����̂Ƃ��ȊO�ɂ͒�~����邱�Ƃ͂���܂���B�n�z�F��p���邱�ƂŁA�SFe�͑�ʐ��Y�̐��Ɉڂ����̂ł��B����̗n�z�F�́A1���ň�����1��t�ȏ�̓SFe�����o���܂��B2015�N�̐��E�̑e�|���Y�ʂ�16��2,280��t�ŁA����͓���23��S���30 cm�߂������ŕ����Ă��܂���ʂɑ������܂��B���ׂĂ̋��������킹�����Y����9���ȏ���A�SFe����߂Ă���̂ł��B
�}.23 �n�z�F���g�����Ƃɂ���āA�SFe���ʐ��Y�ł���悤�ɂȂ���
�n�z�F�@�ł́A�ΒY�Ɋ܂܂�闰�������SFe�����낭����̂ŁA�ΒY�����̂܂ܐ��S�ɗp���邱�Ƃ͂ł��܂���B���̖��́A����������菜�����߂ɐΒY��1,000���߂��̍����ŏ����Ă��ɂ��A���E���́u�R�[�N�X�v�ɂ��邱�Ƃō�������܂����B�������A�S�z���R�[�N�X���Z�����ɂ������߁A���������ĉ��M���邾���ł́A�_���S(III) Fe2O3�̊��������͋N����܂���B�����ŁA�n�z�F�̉���������1,300���ɉ��M������C�𐁂�����ŁA�R�[�N�X��R�₵�܂��B�R�[�N�X���R����ƈ�_���Y�fCO���������A���̈�_���Y�fCO��S�z�ɏՓ˂����邱�ƂŁA�S�z���Ҍ����Ă��܂��B�܂��A��_���P�C�fSiO2�Ȃǂ̃P�C�_�����i��ΐ����j�́A�ΊD��CaCO3���M��������Ɛ�����_���J���V�E��CaO�Ɣ��������A�P�C�_�J���V�E��CaSiO3�ɂ��ď����܂��B
Fe2O3�@�{�@3CO�@���@2Fe�@�{�@3CO2
CaCO3�@���@CaO�@�{�@CO2
SiO2�@�{�@CaO�@���@CaSiO3
�������A���ۂɂ́A�㎮�̂悤�Ɏ_���S(III) Fe2O3���SFe�ɒ��ڊҌ�������ł͂���܂���B�܂��_���S(III) Fe2O3���l�_���O�SFe3O4�ɊҌ�����A���ꂩ��_���S(II) FeO�ƂȂ�A�Ō�ɓSFe�ɊҌ�����܂��B�����̔�������{(i)�{(ii)�~2�{(iii)�~6}��3�̂悤�ɂ��Ă܂Ƃ߂�ƁAFe2O3�{3CO �� 2Fe�{3CO2 �̔������������܂��B
3Fe2O3�@�{�@CO�@���@2Fe3O4�@�{�@CO2 �c(i)
Fe3O4�@�{�@CO�@���@3FeO�@�{�@CO2 �c(ii)
FeO�@�{�@CO�@���@Fe�@�{�@CO2 �c(iii)

�}.24 ��_���Y�fCO�̊Ҍ���p�ɂ��A�����S�̎_�������Ҍ�����Ă���
���̂悤�ɂ��Đ������SFe��P�C�_�J���V�E��CaSiO3�́A�n�z�F���̉��x�i��1,300���j���͂ǂ�����t�̂Ȃ̂ŁA�����֗��ꗎ���܂��B�����āA��d�̑傫���SFe�����w�A�P�C�_�J���V�E��CaSiO3����w�ɂȂ��āA�F���ɂ��܂��Ă��܂��B���̂Ƃ��A�P�C�_�J���V�E��CaSiO3�̓X���O(���V��)�ƂȂ��āA�Z�������SFe�̏㕔�����ƂŁA����ꂽ�SFe���Ăю_������̂�h�����������܂��B���̂悤�ɂ��ē���ꂽ�SFe�ɂ́A3�`4%���x�̒Y�fC�Ɣ��ʂ̃P�C�fSi���P�A����S�Ȃǂ��܂܂�Ă���A�Ìœ_�~���ɂ��Z�_��1,200���O��ɉ�����܂�(�����������S��m.p.1538��)�B
�t�̉����������S�́A�n�z�F�̒ꂩ�瓱�ǂ�`���ė���o�āA���ɕ��ԃC���S�b�g�̒��^�̒��ŗ�₳��āA�u�L�S(pig iron)�v�������܂��B�p�ꖼ�upig iron�v�̗R���́A���̒��^���������ސ��܂ꂽ�Ă̎q�Ɏ��Ă���ƁA�����̐��B���̍�ƈ����v�������Ƃɂ��܂��B�L�S�́A�d���͂�����̂́A���낭�čӂ��₷���Ƃ�������������܂��B���Ȃ₩�����Ȃ��̂ŁA�Ռ�����������Ƃ��ɗ͂����Ƃ��ł����A��_�Ŏ~�߂Ċ���₷���ł��B�������A�Z���鉷�x���Ⴂ���Ƃ���A�^�ɗ�������Ő��`���₷���Ƃ�������������܂��B���ł������ł́A�I���O5���I������L�S�����p�����Ă����Ƃ����L�^���c���Ă��܂��B

�}.25 �L�S�͒Y�f�ܗL������3�`4%�ƍ����A�Z�_�����Ⴂ
�Z�_�̒Ⴂ�L�S���Ăїn�����āA�M���X�̂悤�ɒ��^�ɗ�������Ōł߂�ƁA�u�����v�������܂��B�L�S�͗Z�_���Ⴍ�A�Z���t�̗��������ǂ��̂ŁA�����p�̓��p�C�v�A�@�B���i�Ȃǂ̐��i���葁����������̂ɂ͎��ɕ֗��ł���A�Y�Ɗv�����̃��B�N�g���A������̐l�X�́A�L�S���ʂɗ��p���܂����B���̎���̃C�M���X�ł́A�����̋����L�S�ō���Ă��܂����B�������A�L�S�ɂ͂��낭�čӂ��₷���Ƃ������_������A�����̋��̑����́A���˂̔M�c���łЂт�����A���łɕ��ꗎ���Ă��܂��Ă��܂��B���݂ł������c���Ă���L�S�̋���1�ɁA1779�N�Ɍ��z���ꂽ�u�A�C�A���u���b�W�v�Ƃ�����������܂��B���݂ł��l�����Ƃ��ė��p����Ă���A���E��Y�ɓo�^����Ă��܂��B

�}.26 ���E��Y�ɓo�^����Ă���u�A�C�A���u���b�W�v
����ɂ����S�������SFe�邽�߂ɂ́A�]�F(�]���F)���g���ĒY�f�����K�v������܂��B�Z�������L�S���_�fO2�𑗂荞��ŁA�L�S�����Y�fC�₻�̑��̕s�������_�����ď����������l�����̂́A�C�M���X�̔����Ƃł���w�����[�E�x�b�Z�}�[�ł�(1855�N�ɓ������擾)�B�Y�fC�̔R�ĂŔM���Ȃ�̂őL�S�͗Z�����܂܂ł���A���M���u������Ȃ��ȒP�ȑ��u�Ŋ�������A��ʐ��Y���\�Ȏ�@�ł����B���̑��������ƁA�Y�fC�̊�������0.1�`2%�ȉ��ɂȂ��������S�邱�Ƃ��ł��܂��B���̋����S�́A���낳�����Ȃ��ĉ�����W���ɕx�݁A���z�ޗ����͂��߂Ƃ��āA�l�X�ȗp�r�Ɏg���܂��B���̂悤�ȋ����S���u�|�S(steel)�v�Ƃ����܂��B�|�S�ɃN����Cr��j�b�P��Ni�Ȃǂ�������ƁA�K�тɂ����u�X�e�����X�|�v���ł��܂��B����18-8�X�e�����X�|(Cr�F18%�ANi�F8%)�͑ϐH���ɗD��A���������t���Ȃ��Ƃ�������������܂��B
�\.6 �Y�f�ܗL�ʂɂ������S�̕���
|
���� |
�Y�f�ܗL�� |
���� |
|
�L�S |
3�`4% |
���F�Ő��������Y�f�𑽂��܂ޓS�B1,200�����x�ŗZ�����邪�A�d���Ă��낢���߂ɑf�ނƂ��Ă͎g���ɂ��� |
|
���S(���イ�Ă�) |
2�`2.5% |
�|�S�ɔ�ׂĎア���A�n���₷���������₷���B���C��؍�ɋ��� |
|
�|�S |
0.1�`2% |
�|�S�̒��ł��A�Y�f�ʂ̑������̂𒒓S�A���Ȃ����̂��S�Ƃ������Ƃ�����B���S�͍H���n���Ȃǂ̍d�����́A��S�̓o�l��S�Ȃǂ̕ό`������̂ɗp���� |
|
��S |
0.02%�ȉ� |
��炩���ēW���������̂ŁA�d���C�ޗ��ɗp����B�������A�Z�_�͍ł����� |
(iv) �SFe�̗��p
�@���{���́A����Ƃ��Ă̖����Ƌ��ɁA�������p���ے��I�ȈӖ��������Ă���A���p�i�Ƃ��Ă��]���̍������̂������ł��B���{���́A�u�܂ꂸ�E�Ȃ��炸�E�悭�a���v�Ƃ��������������Ă��܂����A����͑L�S��|�S�̐�������肭���p���Ă��邩��ł��B�SFe�́A�Y�f�ܗL�ʂƉ��H���x�ɂ���āA���̌����\�����ω����邽�߁A���������S�̕��@�ɂ���ĈقȂ��Ă��܂��B���{���̐���ł́A�Y�f�Z�x�������d�߂̑L�S�𓁐g�̊O���ɁA�Y�f�Z�x���Ⴍ���x�ȍ|�S�𓁐g�̓����ɂ��邱�ƂŁA�����̐�������ɍ��������œ����Ɏ��������Ă���̂ł��B
����ɁA�n����Β�����950���܂ŏĂ��Đ��ŋ}�₷��u�ē���v�����邱�Ƃɂ���A�Y�f���qC���g�D���ɐN�����āA�SFe�̌����\�����u�}���e���T�C�g(martensite)�v�Ƃ����g�D�ɕω����܂��B�ʏ�A�Ă�����O�̓S���qFe�̏�Ԃ́A�u�t�F���C�g(ferrite)�v�ƌĂ��̐S�����i�q�̌����\�������Ă��܂��B���̂܂܂ł́A�Y�f���qC�͓S���qFe�̌��Ԃɓ��荞�߂܂���B�������A�����ɂȂ��727���ȏ���SFe�́u�I�[�X�e�i�C�g(austenite)�v�ƌĂ��ʐS�����i�q�̌����\���ɕω����A�Y�f���qC���S���qFe�̌��Ԃɓ��荞�݂܂��B�����āA���̏�Ԃŋ}�₷��ƁA�Y�f���qC���Z�����܂c���̑̐S�����i�q�ɕω����܂��B���̍\�����u�}���e���T�C�g�v�ŁA�}���e���T�C�g���̒Y�f�ʂ������Ȃ�قǁA�����\���͏c���ɂȂ�܂��B�}���e���T�C�g�̍d�x�́A�Ă�����O��3�`4�{�قǂɒB���A���ɍd���Đn�̐ꖡ�������܂��B�}���e���T�C�g�ɂȂ�Ƒ̐ς��c�����邽�߁A�n�摤�������Ȃ�܂��B���{���̔���́A�������Đ��܂ꂽ���̂ł��B�n�悪���邱�Ƃɂ���āA���̐c�͈��k����A�܂�ɂ����Ȃ�܂��B�܂��A�ē��ꂵ������180�`210�����ĉ��M���ċ}�₷�邱�Ƃ��A�u�Ă��߂��v�Ƃ����܂��B�Ă��߂����s���ƁA�����̘c�݂�s����ȍ\�������艻���A�K�x�Ȑx���������܂��B���̂悤�ɂ��āA�d���Ɛx���̗�����������܂�ɂ������x�ȓ����d�オ��܂��B
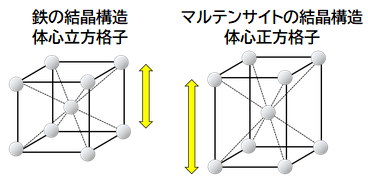
�}.27 �}���e���T�C�g�̌����\���́A�c���̑̐S�����i�q�ł���
�܂��A�S�ɂ߂������{�����u�g�^���v�Ɓu�u���L�v�̈Ⴂ�ɂ��Ă��������Ă����܂��傤�B�g�^���́A����Zn�ł߂��������S�̂��Ƃł���A��Ɍ��z���ނȂǂƂ��ė��p����Ă��܂��B����Zn�́A�SFe�����C�I�����X�����傫�����߁A�O���̈���Zn���D�悵�Ď_������邱�ƂŁA�����̓SFe�̎_����h�����ʂ�����܂��B�g�^���̂߂������@�Ƃ��ẮA�ʔ������̂�����܂��B�e��Ɉ���Zn�����A���M���ėZ������̂ł��B�����ɓS�����Ĉ����グ��ƁA�S�̕\�ʂɈ���Zn���t�����܂��B������܂��A�����߂������ꂽ�g�^���ɂȂ�܂��B���̕��@���A�ƊE�ł́u�V�Ղ�߂����v�Ƃ��������ł��B
����ŁA�u���L�́A�X�YFe�ł߂��������S�̂��Ƃł���A�ʋl��o�P�c�Ȃǂɗ��p����Ă��܂��B�X�YSn�́A�SFe�����C�I�����X�������������߁A�X�YSn�őS�ʂ����ƂŁA�����̓SFe�̎_����h�����Ƃ��ł��܂��B�������A�g�^���ƈقȂ�A�ꕔ�ł������̓SFe���I�o����ƁA���̉ӏ�����SFe�̎_�����L����̂����_�ł��B�Ȃ��A�C�I�����X�����SFe���������������̂����ŁA�X�YSn���߂����Ƃ��ė��p����Ă���̂ɂ́A���R������܂��B�X�YSn�́A�l�̂⓮���ɂ͗e�Ղɋz�����ꂸ�A�Q�̏��Ȃ������ł��邽�߂ł��B

�}.28 �g�^���ƃu���L
(v) �SFe�̉�����
�SFe�ɂ́A�_�������{2���{3�̉�����������A�S(II)�C�I��Fe2+ ���܂ޗ��_�S(II) FeSO4���n�t�́A�W�ΐF�����Ă��܂��B���_�S(II) FeSO4���n�t�ɉ����������ƁA�W�ΐF�̐��_���S(II) Fe(OH)2�����a���܂��B�܂��A�t���������`����̏������ŁA�������fH2S�𐁂����ނƁA���F�̗����S(II) FeS�����a���܂��B�܂��A�S(II)�C�I��Fe2+ ���܂ސ��n�t�ɁA�w�L�T�V�A�j�h�S(III)�_�J���E��(�t�F���V�A�����J���E��)K3[Fe(CN)6]�̐��n�t��������ƁA�Z�F���a���܂��B����́A���n�t����KFeIIFeIII(CN)6�̍\�������Z�F���a�����������߂ł��B
Fe2+�@�{�@2OH�|�@���@Fe(OH)2��(�W��)
Fe2+�@�{�@H2S�@���@FeS��(��)
Fe2+�@�{�@K3[Fe(CN)6]�@���@KFeIIFeIII(CN)6��(�Z��) �@�{�@2K+
�S(III)�C�I��Fe3+ ���܂މ����S(III) FeCl3���n�t�́A�����F�����Ă��܂��B�������ɉ����S(III) FeCl3���n�t��������ƁA���̔����ɂ��A�Ԋ��F�̐��_���S(III)�R���C�h�n�t���쐬�ł��܂��B���̃R���C�h�́A�\�ʂ�-OH��v���g���������-OH2+ ��ƂȂ��Ă���̂ŁA�\�ʂ����ɑѓd�����a���R���C�h�ł��B�������R���C�h�n�t���A�������ł���Z���n���܂ɓ���āA�������ɐZ���ē��͂��s���܂��B����ƁA���f�C�I��H+ �≖�����C�I��Cl�| �́A�g�U�̌����ɏ]���āA�Z���n������ʉ߂��ďo�Ă����܂��B�������A���_���S(III)�̃R���C�h���q�́A���a���傫�����߂ɔ�������ʉ߂ł����A�Z���n�������ɗ��܂邱�ƂɂȂ�܂��B���̑���ɂ���āA���_���S(III)�̃R���C�h���A�Z���n���ܒ��ɐ����ł���̂ł��B���_���S(III)�́A���w���ł�Fe2O3�nH2O�ƕ\����An��1��FeO(OH)��n��3��Fe(OH)3�Ȃǂ̍������ł��B���w�������Ƃ��ẮA���̔�����������₷���ł��B(�R���C�h���w���Q��)�B
FeCl3�@�{�@3H2O�@���@Fe(OH)3(�Ԋ�)�@�{�@3HCl
�܂��A�S(III)�C�I��Fe3+ ���܂ސ��n�t�ɁA�w�L�T�V�A�j�h�S(II)�_�J���E��(�t�F���V�A�����J���E��)K4[Fe(CN)6]�̐��n�t��������ƁA�Z�F���a���܂��B����́A���n�t����KFeIIFeIII(CN)6�̍\�������Z�F���a�����������߂ł��B���̐F�������́A1704�N�Ƀh�C�c�̃x�������ɂ����āA�����Ǝ҂̃f�B�[�X�o�b�n�ɂ���Ĕ�������܂����B���@�́A�����̓����ƌ��t�A�S�����Ȃǂ����M�����ۂɓ���ꂽ�Ɠ`�����Ă��܂��B�����̐F�����͍����Ȃ��̂������A���̈����ȐF�f�i�x�������u���[�j�͏u���Ԃɕ��y���܂����B�̐�L�d�⊋���k�ւ̕����G��i�Ɉ�ۓI�ɗp����ꂽ���Ƃ���A�u�L�d�u���[�v��u�k�փu���[�v�Ƃ��Ă�Ă��܂��B�S(III)�C�I��Fe3+ �̌��o�ɂ́A�`�I�V�A���_�J���E��KSCN���n�t���悭�p�����܂��B�`�I�V�A�������C�I��SCN- �́A�S(III)�C�I��Fe3+ ��[Fe(SCN)(H2O)5]2+ �̍\���������C�I�����`�����A���ԐF�̗n�t�ƂȂ�܂��B
Fe3+�@�{�@K4[Fe(CN)6]�@���@KFeIIFeIII(CN)6��(�Z��) �@�{�@3K+
�\.7 �S(II)�C�I��Fe2+ �ƓS(III)�C�I��Fe3+ �̌��o
|
|
�{ K4[Fe(CN)6]aq �w�L�T�V�A�j�h�S(II)�_�J���E�� |
�{ K3[Fe(CN)6]aq �w�L�T�V�A�j�h�S(III)�_�J���E�� |
�{ KSCNaq �`�I�V�A���_�J���E�� |
|
Fe2+ (�W��) |
�\ |
KFeIIFeIII(CN)6��(�Z��) |
�ω��Ȃ� |
|
Fe3+ (����) |
KFeIIFeIII(CN)6��(�Z��) |
�\ |
[Fe(SCN)(H2O)5]2+ (����) |

�}.29 �S(II)�C�I��Fe2+ �ƓS(III)�C�I��Fe3+ �̔���
�l�_���O�SFe3O4�͍��F�̌ő̂ŁA�SFe�̎_�����̈��ł��B�������������A�z���̎��S�z�⍻�S�̎听���Ƃ��ēV�R�ɎY�o���鑼�A�SFe��800�`1000�����x�ŋ��M���Ă������܂��B�l�_���O�SFe3O4�́A�����鍕�T�r�̐����ł��B�l�_���O�SFe3O4�́AFe2+�FFe3+�FO2�|��1�F2�F4�̊����Ō������Ă���A�ʖ��Ƃ��āu�_���S(III)�S(II) FeO�Fe2O3�v�Ƃ��Ă�܂��B�암�S��́A�S���ؒY�ŏĂ��Ă��̕\�ʂɎ_���햌��t�������̂ŁA���T�r���_�����������ی삷�邱�Ƃ����p�������̂ł��B
�܂��A�_���S(III) Fe2O3�́A�Ԋ��F�̏펥�������ő̂ł��B���R�E�ł́A�z���̐ԓS�z�Ɋ܂܂�Ă��܂��B�_���S(III) Fe2O3�́A��������T�r�̐����ł�(���m�ɂ��_���S(III)���a��Fe2O3�nH2O���听��)�B�_���S(III) Fe2O3�̕����́A�u�x���K��(�ٕ�)�v�Ƃ��Ă�A�ԐF�痿��K���X�̌����܂Ƃ��ėp�����Ă��܂��B�_���S(III) Fe2O3�́A���_���S(III) Fe2O3�nH2O�̉��M�ɂ�萶���܂��B
Fe2O3�nH2O�@���@Fe2O3(�Ԋ�)�@�{�@nH2O
�܂��A�S(III)�C�I��Fe3+ �̉��Ƃ��āA�����S(III) �Z���a��FeCl3�6H2O������܂��B�����S(III) FeCl3���n�t���琅�����������A�����n�t��Z�k����Ɠ����܂��B�����F�`���F�̌ő̂ł���A���𐫂�����܂��B�����S(III) FeCl3�́A�t�F�m�[���ނɉ�����Ǝ��F�n���̒�F���������߁A�����̌��o�ɗp�����܂�(�_�f���܂ޖF�������������Q��)�B
(5) �R�o���g
(i) �R�o���gCo
�u�R�o���g(cobalt)�v�́A1737�N�ɃX�E�F�[�f���̉��w�҂ł���C�F�I���E�u�����g���A���F�X�g�}�������h�̍z�R����̌@���ꂽ�z���番���������f�ł��B���f���̗R���͖����ł͂���܂��A�h�C�c�̃U�N�Z���n���̍z�v�������A��z�ɂ悭�����z�����Ag����낤�Ƃ������������Ȃ��������߁A���b�ɏo�Ă���R�̈���u�R�{���g(Kobold)�v�̎d�Ƃƍl���A���̍z���u�R�{���g�v�ƌĂ�ł��܂����B�u�R�{���g�v�Ƌ�����Ă����z�̒�����A�K���X�Ɨn�����킷�Ɣ������F��^���錳�f���������A���ꂪ�₪�āu�R�o���g�v�ƌĂ��悤�ɂȂ����炵���ł��B
�R�o���gCo�́A�����������┒�F�̋����ő̂ł���A�R���s���[�^�Ȃǂ̃n�[�h�f�B�X�N�̎��C�w�b�h��A���`�E���C�I���d�r�̓d�ɍޗ��Ȃǂɗ��p����܂��B�K���X�������D���Ȑl�Ȃ�A�[���F�́u�R�o���g�K���X�v���������ł��傤�B���̃K���X�ɂ́A�r����≏�̂܂ŁA�l�X�ȗp�r������܂��B�������R�o���g�K���X�̐F�́A�K���X�ɓY�����ꂽ���ʂ̃R�o���g�������ɂ����̂ł��B

�}.30 �R�o���g�K���X�̗e��
�@�R�o���gCo�͊ȃ��A���^���ŁA���`�E���C�I���d�r�̏d�v�ȍޗ��ł�����܂��B���{�̐Ζ��V�R�K�X�E�����z�������@�\(JOGMEC)�́A2021�N�ɐ��E�ŏ��߂āu�R�o���g���b�`�N���X�g�v�̌@�펎���ɐ������܂����B�u�}���K���N���X�g�v�͐��[800�`2,400 m�ɑ��݂���A�X�t�@���g��̎_�����ł��B�}���K���N���X�g�́A�}���K��Mn�E��Cu�E�j�b�P��Ni�E�R�o���gCo�Ȃǂ̗L�p�ȋ������܂݁A�}���K���N���X�g�̒��ł����ɃR�o���gCo�𑽂��܂ނ��̂��u�R�o���g���b�`�N���X�g�v�ł��B�R�o���g���b�`�N���X�g�́A�����E�������m�ɂ���C�R�̎R��������Ζʕ�(���[800�`2,500 m)�ɂ����đ����������Ă��܂��B�R�o���g���b�`�N���X�g�̃R�o���g�ܗL���͖�0.9%�ŁA���̊ܗL���̓}���K���c��ɔ�ׂĖ�3�`5�{�����A�n��ŎY�o����R�o���g�ܗL�z�Ɣ�ׂĂ����F����܂���B�܂��A�R�o���g���b�`�N���X�g�ɂ́A���A���^���̔���Pt��A�A�[�X�Ȃǂ��܂܂�܂��B���{�͔r���I�o�ϐ�����܂߂�Ɛ��E��6�Ԗڂ̖ʐς������ł���A�n�����玑����Z�p���J���ł���A�����卑�ɂȂ�\��������܂��B

�}.31 �u�R�o���g���b�`�N���X�g�v�́A�R�o���gCo�̗L�]�Ȏ����Ƃ��Ē��ڂ���Ă���
(ii) �R�o���gCo�̉�����
�R�o���gCo�́A�_������-1��0�̂悤�Ȓ�_������Ԃ���A�{4�܂ł̎_����Ԃ����܂��B��_�����̏�Ԃ́A��ɍ��̂ɂ����Č����܂��B�ł����ʂ̎_�����̏�Ԃ̃C�I���́A�R�o���g(II)�C�I��Co2+ �ƃR�o���g(III)�C�I��Co3+ �ł��B�Ⴆ�A�_���R�o���g(II) CoO��l�_���O�R�o���gCo3O4�̂悤�Ȏ_�����A�����R�o���g(II) CoCl2��L���R�o���g(II) CoBr2�̂悤�ȃn���Q�����������݂��܂��B�����R�o���g(II) CoCl2�̖������͐F�ł����A��H2O���z������ƁA�ԐF�̉����R�o���g(II)�Z���a��CoCl2�6H2O�ƂȂ�܂��B���̐F�ω��́A�����̌��o�ɗ��p�ł��A�V���J�Q�����ɍ�������A�뎆�ɂ��ݍ��܂����肵�āA�����̎w����Ƃ��ėp�����܂��B
CoCl2(��)�@�{�@6H2O�@���@CoCl2�6H2O(��)
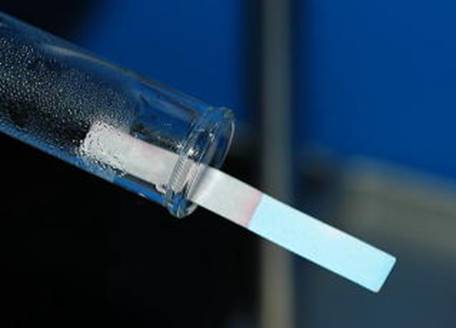
�}.32 �����R�o���g���́A�����̌��o�ɗp������
�R�o���g(III)�C�I��Co3+ �ɁA�A�����j�ANH3�≖�����C�I��Cl�| ���z�ʂ������� [CoClx(NH3)y]Clz �͔�r�I����ł���A�l�X�Ȃ��̂�����܂��B�����̍����ł́A�z�ʂ��錴�q�̎�ނ␔�ɂ���č����̐������قȂ�A�݂��ɍ\���ِ��̂̊W�ƂȂ�܂��B���̍����́A���ɗn�����Ǝ��̂悤�ɓd�����܂��B�Ȃ��A���̍����ł́A�ux�{y��6�v����сux�{z��3�v�̊W���������܂��B
[CoClx(NH3)y]Clz�@���@[CoClx(NH3)y]z+�@�{�@zCl�|
���̍����̂����A�e�g���A���~���W�N�����R�o���g(III)�C�I��[CoCl2(NH3)4]+ �ɂ́A�u�V�X�`�v�Ɓu�g�����X�`�v�ƌĂ�闧�ِ̈��̂�����܂��B�V�X�`�͎��F�A�g�����X�`�͗ΐF��悵�܂��B����2�̗��ِ̈��̂́A�����ʑ̌^���C�I���ɂِ͊��̂����邱�Ƃ����������ŏ��̎���ł��B
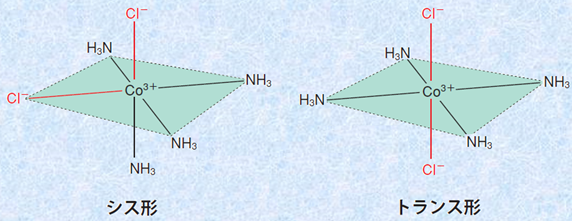
�}.33 �V�X�`�ƃg�����X�`�̃e�g���A���~���W�N�����R�o���g(III)�C�I��[CoCl2(NH3)4]+
���Ȃ݂ɁA1 mol�̃e�g���A���~���W�N�����R�o���g(III)������[CoCl2(NH3)4]Cl�ɁA�Ɏ_��AgNO3���n�t���ߏ�ʉ�����ƁA������AgCl��1 mol���������܂���B�������A�ގ��̍\�������w�L�T���A���~���R�o���g(III)������[Co(NH3)6]Cl3�ɁA�Ɏ_��AgNO3���n�t���ߏ�ʉ�����ƁA������AgCl��3 mol���������܂��B����́A�z�ʌ����ƃC�I�������̉������C�I��Cl- �̐����ɈႢ�����邩��ł��B���Ȃ킿�A���w�����ɂ́A�C�I�������̉������C�I��Cl�| �����g���Ȃ��Ƃ������Ƃ������Ă��܂��B
[CoCl2(NH3)4]Cl�@�{�@AgNO3�@���@[CoCl2(NH3)4]NO3�@�{�@AgCl��
[Co(NH3)6]Cl3�@�{�@3AgNO3�@���@[Co(NH3)6](NO3)3�@�{�@3AgCl��
(iii) �����ƃR�o���gCo�̊W
�����ɂƂ����R�o���gCo���K�{���f�ł��邱�Ƃ́A�E�V��q�c�W���n���ƂȂ�A�₪�Ď���ł��܂����Ƃ��猤�����n�߂��A1935�N�ɂ����̓����̐������q�ł��邱�Ƃ��ؖ�����܂����B�����́A�H�a���ɃR�o���gCo���s�����Ă������Ƃɂ���܂����B���̂悤�ȏꍇ�A�ƒ{�����⓮���������r�߂ɗ��鉖���A���邢�͉��w�엿�Ȃǂɏ��ʂ̃R�o���g�������������Ă����ƁA�E�V��q�c�W�́u�₹�a�v�̂悤�ȏd���a�C�����\�h���邱�Ƃ��ł��܂��B
�n����h���ɂ́A�H���ɓK�ʂ̓SFe���܂܂�Ă���Ƃ��ł����A���ʂ̃R�o���gCo���K�v�ł��邱�Ƃ����炩�ɂ���A1948�N�́u�r�^�~��B12(�V�A�m�R�o���~��)�v�̔����ւƌq����܂����B�r�^�~��B12�́A�̑�����R�����n�����q�Ƃ��ĒP������܂����B�r�^�~��B12�́A�̂̂��ׂĂ̍זE�̑�ӂɊ֗^���Ă���A����DNA�����ƒ����ɉ����A���b�_�̍����ƃG�l���M�[���Y�Ɋ֗^���Ă��܂��B�r�^�~��B12�����R����ƁA�l�̂ɑ��āA�[�����s�t�I�ȑ�����^����\��������܂��B�r�^�~��B12�́A�l�̂ɂƂ��ċɔ��ʂȂ�����A���̌��f�ł͑�ւ̗����Ȃ��K�{�����Ȃ̂ł��B�����āA1961�N�ɂ�X���\����͂ɂ��A�r�^�~��B12�̎O�����\�������炩�ɂ���܂����B�r�^�~��B12�̍\���͂ƂĂ����G�ŁA�l�H�����͕s�\�ƍl�����Ă��܂������A1973�N�ɃA�����J�̗L�@���w�҂ł��郍�o�[�g�E�o�[���Y�E�E�b�h���[�h���A11�N���̍Ό��������đS�����Ɍ����������܂����B
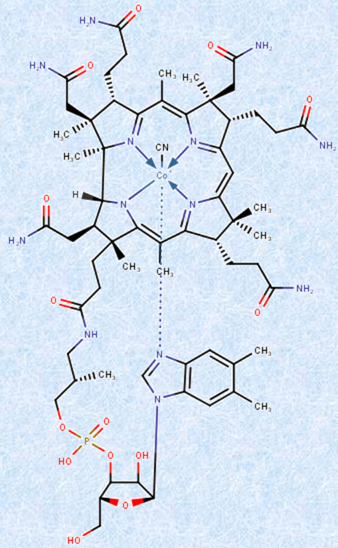
�}.34 �r�^�~��B12�́A�l�̂ɂƂ��ċɔ��ʂȂ�����A���̌��f�ł͑�ւ̗����Ȃ��K�{�����ł���
�E�b�h���[�h�́A�r�^�~��B12�̑��ɂ��L�j�[�l�A�X�g���L�j�[�l�A�R���X�e���[���A�N�����t�B���Ȃǂ̑S�����ɐ������A�����V�R���̍��������ɂ��A1965�N�Ƀm�[�x�����w�܂���܂��Ă��܂��B�܂��A�E�b�h���[�h�̓A�����J�̉��w�҂ł��郍�A���h�E�z�t�}���Ƌ��ɁA�u�E�b�h���[�h�E�z�t�}�����v�Ƃ������_�ɂ���āA������x�m�[�x�����w�܂���܂����͂��ł����B���ۂɁA�z�t�}����1981�N�Ƀm�[�x�����w�܂���܂��Ă��܂��B�������A�c�O�Ȃ���E�b�h���[�h��1979�N�Ɏ����������߁A2�x�ڂ̎�܂͂Ȃ�܂���ł����B�����E�b�h���[�h��������������A�����w�܂Ɖ��w�܂̃L�����[�v�l�A���w�܂ƕ��a�܂̃��C�i�X�E�|�[�����O�Ɏ�����3�l�ځA�������A���ꕔ��ł̃_�u����܂ƂȂ�Ƃ���ł����B

�}.35 �E�b�h���[�h�́A�r�^�~��B12�̑S������B�����A�u20���I�ő�̗L�@���w�ҁv�ƕ]����Ă���
�@�R�o���gCo�́A�q�g���n�߂Ƃ��āA�����̐����ɂƂ��ĕK�{���f�ł��B�̏d70 kg�̐��l�̑̂̒��ɂ́A��1.5 mg�̃R�o���gCo�����݂��܂��B�H����ʂ��āA1����0.05�`1.8 mg�̃R�o���gCo���A�̓��Ɏ�荞�܂�Ă��܂��B�R�o���gCo�́A���ǂ���悭�z������܂��B�SFe�����R����ƁA�R�o���gCo�ƓSFe�̉��w�I�������悭���Ă��邽�߁A����ɂ悭�z������܂��B��荞�܂ꂽ�R�o���gCo�́A��ɍ����X���A�̑��ɒ~�ς��܂��B
�������A�R�o���gCo���ߏ�ɐێ悷��ƁA�����a��b��B������邱�Ƃ�����܂��B1960�N��̃A�����J��J�i�_�ȂǂŁA�r�[���̖A�����肳���邽�߂ɁA1.2�`1.5ppm�̃R�o���g���������r�[���ɓY�����ꂽ���Ƃ�����܂����B�����āA���̃r�[���̏����20���ȏオ�A�S���a��b��B�ُ�Ŏ��S���鎖�����N���܂����B
�E�Q�l����
1) ���c���Y/��ۑ��/������ �ďC�u�n���̃T�C�G���X �������E�����Ȃ��E���тȂ��\�ō��̐ꖡ�����߂āvNewton 2026�N1����(2026�N���s)
2) �m���g�f����w�̐V������O�ȓ�(2013�N���s)
3) �哌�F�i�u�v���O�}�e�B�b�N���w�v�͍��o��(2017�N���s)
4) ��{���u�P�~�X�g���[���E�j ���̎��A���w�������ς����I�vPHP������(2022�N���s)
5) ���f�w����/�������j�ҁw�g�߂ɂ��ӂ��u���f�v��3���Ԃł킩��{�x�������o�Ŏ�(2021�N���s)
6) �ē����T�u�ŋ��́u�ŕ��v�͂ǂꂾ�H�v�Z�p�]�_��(2014�N���s)
7) �V�����T�u�ւ�ȋ��������������v�Z�p�]�_��(2009�N���s)
8) ꎓ���/������/�R�{����/��19���u���w�v�[�ъ�(2012�N���s)
9) ����O�u���f118�̐V�m�� �����ďd��A�ǂ�ł������낢�v�u�k��(2017�N���s)
10) ���������Y�u���w�Łu�����l�ԁv�ɂȂ�܂����H�v�����АV��(2014�N���s)
11) ���������Y�u���E�j��ς����V�f�ށv�V����(2018�N���s)
12) �������j�u�ʔ����Ė���Ȃ��Ȃ錳�f�vPHP������(2016�N���s)
13) �������j�u��ɖʔ������w���� ���E�j�͉��w�łł��Ă���v�O����(2021�N���s)
14) �Z�I�h�A��O���C�u���E�ň�Ԕ��������f�}���v�n����(2011�N���s)
15) ���c�p�i/������ �����u�����̕��H�̂����݁v���w�Ƌ���65��12��(2017�N)
16) �i�c�a�G�u�Ñ㐻�S�Z�p�̗��j�v���w�Ƌ���72��7��(2024�N)
17) ������V/�c�����v/������ �����u���@���w�v�������w���l(2013�N���s)
18) -�u���f���߂�����Ƌ��� �A�X�e�J�̉�������S�b�z�̊G��܂Łk��l�v���쏑�[(2017�N���s)
19) �R�k�āu����m���`�[�g�}�j���A���v�V�I����(2017�N���s)
20) �R���K�v�u���Ȃ��������낭����12�b�v��g���X(2001�N���s)