・第2族元素(アルカリ土類金属など)
【目次】
(1) 第2族元素
周期表において、第2族に属するベリリウムBe・マグネシウムMg・カルシウムCa・ストロンチウムSr・バリウムBa・ラジウムRaなどの元素を、総称して「第2族元素」といいます。第2族元素は、一般に「アルカリ土類金属(alkali earth metals)」といい、互いによく似た性質を示します。名称に「土」が付く理由は、その酸化物が水に溶けにくく、熱にも強い性質を持つためです。
第2族元素は、いずれも最外殻の電子配置がns2である元素(n=2,3,4・・・)です。第2族元素の原子は、この2個の電子を失って、18族の貴ガスと同じ電子配置を取って安定化します。そのため、第2族元素の金属イオンでは、酸化数が+2となる状態が一般的です。また、ベリリウムBeとマグネシウムMgを除くアルカリ土類金属は、アルカリ金属と同様に炎色反応において、各元素に特徴的な発色を示します。単体の製法についても、アルカリ金属と同様に、化合物の溶融塩電解を行います。
表.1 主な第2族元素の単体の性質
|
化学式 |
融点 (℃) |
密度 (g/cm3) |
炎色反応 |
水との反応 |
第一イオン化エネルギー (kJ/mol) |
|
Be |
1,282 |
1.85 |
無 |
しにくい |
899.5 |
|
Mg |
649 |
1.74 |
無 |
熱水と反応 |
737.7 |
|
Ca |
839 |
1.55 |
橙色 |
冷水と反応 |
598.8 |
|
Sr |
769 |
2.54 |
紅色 |
冷水と反応 |
549.5 |
|
Ba |
729 |
3.59 |
黄緑色 |
冷水と反応 |
502.9 |
第2族元素では、自由電子が2個になっているため、アルカリ金属よりも金属結合が強く、このことが単体の密度や融点の増加をもたらしています。また、第2族元素の単体は、空気中の酸素O2や水H2Oと容易に反応するので、それらを避けるために灯油中に保存します(ベリリウムBeとマグネシウムMgは空気中で保存できます)。しかし、その反応性は、アルカリ金属ほど高くはありません。さらに、イオン化エネルギーについても、アルカリ金属よりも一般に大きくなります。この理由は、第2族元素では、アルカリ金属よりも原子核の正電荷が大きい分だけ、最外殻電子をより強く引き付けているからです。
Ca + 2H2O → Ca(OH)2 + H2
2Mg + O2 → 2MgO
(2) ベリリウム
アルカリ土類金属において、「ベリリウム(beryllinm)」は、アルカリ金属におけるリチウムLiと同様に、同族元素と比較して特異性を示します(第1族元素(アルカリ金属など)を参照)。これは、主にベリリウムBeの原子半径およびイオン半径が、他の第2族元素と比べて、非常に小さいことに起因します。ベリリウムBeの最外殻電子は、強く原子核に引き付けられており、ベリリウムBeの関与する化学結合では、電子対はベリリウムBeにかなりの割合で引き寄せられることになります。そのため、ベリリウムBeは金属性が低く、化学結合は共有結合性を帯びます。それ故に、ベリリウムBeの化学的性質は、他の第2族元素よりも、むしろ第13族元素であるアルミニウムAlに類似しています。
ベリリウムBeの単体は、常温常圧では、銀白色の金属固体として存在します。ベリリウムBeの密度は1.85 g/cm3で、分類上は軽金属です。リチウムLiの密度(0.53 g/cm3)の約3.5倍の重さがありますが、それでもアルミニウムAlの密度(2.70 g/cm3)よりずっと低いです。リチウムLiが軟らかくて融点が低く、反応性が高いのに対して、ベリリウムBeは強度があって高融点(m.p.1,278℃)の金属です。同質量当たりの強度では、鋼鉄をしのぐ程であり、金属疲労も起こりにくいです。また、表面に酸化被膜を生じて不働態化するので、耐食性があります。

図.1 ベリリウムBeの化学的性質は、他の第2族元素よりも、むしろ第13族元素であるアルミニウムAlに類似している
ベリリウムBeとその化合物(BeOやBeCl2など)には、甘味があることが知られています。しかし、わずかな量で死に至る強い毒性もあるので、甘味料には使えません。ベリリウムBeの利用が始まった1950年代後半に、ベリリウムBeを分離・加工・利用する工場の従業員に、「ベリリウム症」と呼ばれる慢性および急性の食欲不振、呼吸困難、肉腫などが見られました。生体分子中にあるリン酸塩の部位に結合して、その機能を変えたためと考えられています。様々な安全対策の結果、現在ではベリリウム症の罹患率は激減しましたが、加工作業での取り扱いには、十分な慎重さが要求されます。
ベリリウムBeは高価で毒性がありますが、軽量で高い強度があるので、極めて特殊な製品、例えば、ミサイルやロケットなどの軍事産業や、航空宇宙産業における構造部材として用いられます。それならば、コストや毒性は問われず、軽量で強靭であることが至上命題となるからです。例えば、NASAが中心となって開発を行っているジェイムズ・ウェッブ宇宙望遠鏡の反射鏡には、大量のベリリウムBeが使われています。この反射鏡の大きさは、ハッブル宇宙望遠鏡の2.5倍もあり、非常に高い観測性能が期待されています。

図.2 ジェームズ・ウェッブ宇宙望遠鏡のベリリウムミラー
他に変わった用途としては、ベリリウムBeはX線を通しやすいので、X線装置や粒子物理学の試験におけるX線透過窓として用いられます。これは、ベリリウムBeが低密度かつ原子量が小さいために、X線を透過させる性質があるからです。それに加えて、ベリリウムBeには内部を完全な真空に保てる強度があり、微弱なX線も透過できる薄さに加工できる性質があるため、打って付けの素材といえます。
また、金属銅に数パーセントのベリリウムBeを混ぜた「ベリリウム銅合金」は、金属銅よりもはるかに高強度で、純銅に近い良好な電気伝導性があります。ベリリウム銅合金は、叩いても火花が出ないため、油田や可燃性ガス関連産業で使う工具の材料になります。火気厳禁の場所で、鉄合金の工具から火花が飛び散ったら、大惨事になりますからね。鉄合金で火花が出るのは、熱伝導率が小さくて、摩擦により微小部分が高温になり飛び散るからです。ベリリウム銅合金製のヘッドを付けたゴルフクラブもあります。「ハイテク素材なら、ボールを思った場所に飛ばせるのではないか」という風潮に乗った製品です。しかし、このクラブを使ったからといって、特別にスコアが良くなる訳ではありません。

図.3 ベリリウム銅合金でできた工具
(3) マグネシウム
(i) マグネシウムMg
「マグネシウム(magnesium)」の単体は、密度が1.74 g/cm3の軽くて軟らかい金属です。軽いイメージのあるアルミニウムAlでも、密度は2.70 g/cm3ですから、どれだけマグネシウムMgが軽いかが分かると思います。マグネシウムMgは、単体として天然には産出しませんが、塩類や岩石の成分として、自然界に多量に分布しています。地殻の金属元素としては、7番目に大きいです。海水や動植物にも含まれます。主要鉱物には、滑石Mg3Si4O10、苦灰石CaMg(CO3)2、菱苦土石MgCO3などがあります。
マグネシウムMgには、手頃な価格、強さと軽さ、加工しやすさが揃っています。しかしながら、マグネシウムMgには可燃性があり、そのことが唯一の欠点です。酸素O2と化合しやすく、強い還元性を持つため、空気中で放置すると、表面が酸化されて灰色を帯びてしまいます。また、二酸化炭素CO2や水H2Oとも反応しますが、いずれも表面に酸化被膜が生じ、反応は内部まで進行しません。そのため、アルカリ金属やアルカリ土類金属と異なり、灯油中で保存する必要はありません。
2Mg + O2 → 2MgO
Mg + CO2 → 2MgO + C
Mg + 2H2O → Mg(OH)2 + H2
マグネシウムMgは、非常に軽い軽合金材料として重要です。様々な合金の第一金属(合金の基本となる金属)や、添加剤として利用されています。身近なところでは、航空機、自動車、船舶、農業機械、工具、精密機械、スポーツ用具、携帯電話、医療機器、宇宙船、兵器などの様々な分野で用いられています。特に、重量節約が問題となる輸送機関の機体やエンジン材料として、マグネシウムMgは重要です。ドイツのフォルクスワーゲン社が販売している小型自動車「ビートル」には、20 kgのマグネシウム合金がエンジン部分に使われています。ビートルは、週刊少年サンデーで連載されている「名探偵コナン」で登場する阿笠博士の愛車としても有名です。

図.4 阿笠博士は、少年探偵団の引率役として、彼らをビートルに乗せて様々な所に出かけている
アルカリ土類金属の硫酸塩は、水に対して難溶性であるのに対して、マグネシウムMgの硫酸塩MgSO4は水溶性です。硫酸マグネシウムMgSO4は、その溶解度の高さを利用して、肥料などとして用いられます。特に有機合成の分野では、硫酸マグネシウムMgSO4の無水物が、乾燥剤として汎用されます。
また、炭酸塩についても、マグネシウムMgは例外的な性質を示します。炭酸カルシウムCaCO3や炭酸ストロンチウムSrCO3、炭酸バリウムBaCO3の室温(25℃)での溶解度積が10-10 から10-9 のオーダーであるのに対して、炭酸マグネシウムMgCO3の溶解度積は1.0×10-5 (mol/L)2と比較的大きな値となります。
表.2 第2族元素の炭酸塩の溶解度積
|
化学式 |
溶解度積の値Ksp(25℃) |
|
MgCO3 |
1.0×10-5 |
|
CaCO3 |
4.8×10-9 |
|
SrCO3 |
7.0×10-10 |
|
BaCO3 |
2.6×10-9 |
酸化物や水酸化物に関しても、マグネシウムMgは比較的に難溶性です。水酸化カルシウムCa(OH)2や水酸化ストロンチウムSr(OH)2、水酸化バリウムBa(OH)2は、水に溶けると強塩基となりますが、水酸化マグネシウムMg(OH)2は、ほとんど溶けずに弱塩基性を示します。
表.3 第2族元素の水酸化物塩の溶解度積と飽和水溶液のpH
|
化学式 |
溶解度積の値Ksp(25℃) |
飽和水溶液のpH |
|
Mg(OH)2 |
1.2×10-11 |
10.5 |
|
Ca(OH)2 |
5.5×10-6 |
12.4 |
|
Sr(OH)2 |
5.6×10-4 |
13.2 |
|
Ba(OH)2 |
3.5×10-2 |
13.8 |
(ii) 硫酸マグネシウムMgSO4
硫酸マグネシウム七水和物MgSO4・7H2Oは「エプソム塩」の別名もあり、下剤や解毒剤として、17世紀初頭に発見されました。イングランドのサリー州エプソムで、干ばつの際にも牛が水を飲みたがらない泉があり、不思議に思った旅人が飲んだところ、医療上の効果が発見されたといいます。効果は評判を呼び、「万能薬」との噂が立ち、王侯貴族も治療のために訪問する名所になりました。ホテルや劇場が立ち並んで、寒村は大きな発見を遂げたのです。
現在でも、「水に溶かした硫酸マグネシウム七水和物MgSO4・7H2Oとオリーブオイルを数回に分けて飲むと、肝臓内の毒素が体外に排出されて肝臓が洗浄される」とする民間療法が存在します。しかし、この民間療法には、医学的な根拠はありません。硫酸マグネシウム七水和物MgSO4・7H2Oを大量に摂取すると、マグネシウムイオンMg2+ が消化管内の水が外に出るのを妨害するので、単に下痢を起こしているだけという説もあります。

図.5 硫酸マグネシウム七水和物MgSO4・7H2Oは、イングランドのサリー州エプソムで発見された
(iii) 塩化マグネシウムMgCl2
塩化マグネシウムMgCl2は、水溶性で潮解性があり、海水中に濃度0.13%の割合で含まれています。水溶液にすると水中で加水分解され、弱酸性を示します。塩化カルシウムCaCl2は凍結防止剤として用いられますが、不純物として塩化マグネシウムMgCl2が含まれていました。塩化カルシウムCaCl2の純度が低かった時代には、不純物として含まれる塩化マグネシウムMgCl2の弱酸性により、高速道路の橋などのサビが進行しやすかったといいます。現在では、塩化カルシウムCaCl2の中からマグネシウムイオンMg2+ を排除することが可能になり、そのような心配は無用になりました。
MgCl2 + 2H2O ⇄ Mg(OH)2 + 2HCl
塩化マグネシウムMgCl2を主成分とする水溶液は、強い苦味を持つので「にがり」と呼ばれています。市販されているにがりは、海水を煮詰めて最初に結晶化する塩化ナトリウムNaClをまず除き、さらに加熱して結晶化した塩化マグネシウムMgCl2を遠心分離で取り出して製造しています。海水を濃縮した「本にがり」の液は大変苦く、そのまま一滴舐めるだけでも、苦痛で吐き気を生じることもあります。マグネシウムMgの許容上限摂取量は約700 mg/日といわれており、過剰摂取すると、下痢や意識障害などの悪影響が出る場合があります。実際に2004年には、神奈川県の知的障害者更生施設で、職員が誤ってにがりの原液400 mLを飲ませ、女性入所者が死亡する事件が起こっています。
にがりは、主に豆腐の伝統製法において、豆乳を塩析させて豆腐に変える凝固剤として使用されます。豆乳のタンパク質表面には、グルタミン酸由来のカルボキシ基が負に帯電(-COO—)しています。ここに二価の陽イオンであるマグネシウムイオンMg2+ が添加されると、塩析が起こってタンパク質による網目状構造が形成されます。現在では、豆腐の凝固剤として塩化マグネシウムMgCl2だけでなく、硫酸カルシウムCaSO4、グルコノデルタラクトン、塩化カルシウムCaCl2、硫酸マグネシウムMgSO4など、様々な物質が使用されます。しかし、にがりを用いる方が、しっかりとした豆腐(食感が硬めの豆腐)ができやすいといいます。近年では、伝統的なにがりで作られた豆腐の味が見直され始め、スーパーマーケットなどで、にがりを使った豆腐が容易に入手できるようになりました。

図.6 にがりは、豆乳を豆腐に変える凝固剤として使用される
(iv) 二ホウ化マグネシウムMgB2
マグネシウムMgのホウ化物である二ホウ化マグネシウムMgB2は、21世紀に入って早々に、最も注目を浴びた無機化合物です。2001年1月、青山学院大学の秋光純らの研究チームが、ごくありふれた物質として市販もされていた二ホウ化マグネシウムMgB2が、実は39 Kで「超伝導相(superconducting phase)」に転移することが見出されたためです。二ホウ化マグネシウムMgB2は、超伝導リニア用コイルとして研究が進み、二ホウ化マグネシウムMgB2の超伝導コイルが開発されています。

図.7 二ホウ化マグネシウムMgB2は、39 Kで超伝導を示す
(v) グリニャール試薬RMgX
これまでの無機化合物とは趣の異なる物質として、有機合成化学の分野で重要な有機化合物の1つである、「グリニャール試薬(Grignard reagent, R-MgX)」についても触れておきましょう。これは、一般的にRMgXの化学式で表される、マグネシウムMgを含んだ有機化合物です。Rはメチル基(-CH3)やフェニル基(-C6H5)などを表し、Xはハロゲンを表します。この化合物は、完全に水を除去したジエチルエーテルなどの有機溶媒中で、金属マグネシウムをハロゲン化アルキルなどと反応されることにより得られます。
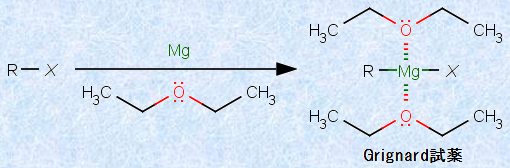
図.8 グリニャール試薬の調製
この反応は、マグネシウムMgとアルカリ土類金属との相違点を表すものです。マグネシウムMgには、ベリリウムBeほどの共有結合性はないものの、若干の共有結合性があることを示しています。このため、グリニャール試薬は、カルボニル化合物などに対して「炭素型の求核剤」として作用し、カルボニル炭素との間に、新たな炭素-炭素共有結合を形成します。それ故に、グリニャール試薬は、有機合成分野において重要な試薬として用いられています。グリニャール試薬を発見した功績により、フランスの化学者であるヴィクトル・グリニャールとポール・サバティエは、1912年にノーベル化学賞を受賞しました(詳細は有機反応機構(カルボニル基に対する求核付加反応)を参照)。
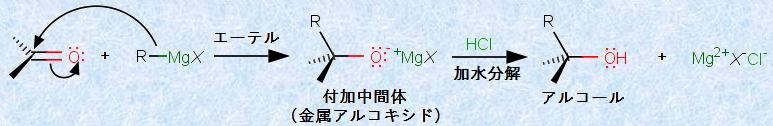
図.9 グリニャール試薬とカルボニル化合物の反応
(4) カルシウム
(i) カルシウムCa
「カルシウム(calcium)」は、1808年にイギリスの化学者であるハンフリー・デービーにより、塩化カルシウムCaCl2の融解塩電解で初めて遊離された金属です。カルシウムCaの語源は、石灰岩の主成分が炭酸カルシウムCaCO3であったことから、ラテン語の「calx(石灰岩)」に由来します。意外なことに、英語の「calculate(計算する)」も同語源で、こちらは数を数えるのに用いた小石に由来します。「カルシウム」と聞くと、多くの人は「白色」をイメージするかもしれません。しかし、白色なのはカルシウムの化合物であり、単体のカルシウムCaは、銀白色で密度1.55 g/cm3の非常に軟らかい金属です。

図.10 単体のカルシウムCaは、銀白色の非常に軟らかい金属である
皆さんが金属のカルシウムCaを見る機会は、めったにありません。その理由は、カルシウムCaの単体は、空気中では非常に不安定であり、直ちに空気中の酸素O2や水H2O、二酸化炭素CO2などと反応して、水酸化カルシウムCa(OH)2や炭酸カルシウムCaCO3などに変化するからです。そのため、金属ベリリウムや金属マグネシウムとは異なり、金属カルシウムは、灯油中で保存する必要があります。
2Ca + O2 → 2CaO
Ca + 2H2O → Ca(OH)2 + H2
成人は、1人1日当たり食物から600〜1,400 mgのカルシウムCaを摂取しています。体重70 kgの成人の体の中には、約1.05 kgのカルシウムCaが含まれます。筋肉には140〜700ppm、血液には61 mg/mLが存在します。脊椎動物の骨には、フッ化カルシウムCaF2、炭酸カルシウムCaCO3、ヒドロキシアパタイトCa5(PO4)3(OH)などとして含まれます。下等な動物では、カルシウムCaの部分がマグネシウムMgである場合もあります。これは、生物は太古の昔には、海水中に比較的多いマグネシウムMgを用いていましたが、陸上に上がると、より強い骨格を作れるカルシウムCaを利用し始めたためではないかと推定されています。
(ii) 酸化カルシウムCaO
酸化カルシウムCaOは、水H2Oと反応させると、かなりの熱を放出して水酸化カルシウムCa(OH)2となります。そのため、酸化カルシウムCaOは、慣用名で「生石灰(quick lime)」呼ばれます。「quick」とは、「生命力がある」という意味です。この反応は、身近な所でも応用されており、乾燥剤や殺虫剤などに酸化カルシウムCaOが用いられています。他にも、弁当を温めるために酸化カルシウムCaOと水H2Oを袋詰めにし、紐を引くと両者が混合して、発熱するようにしたものもあります。この反応は、火も使わず煙も出ないため、火を使えない状況や、火に弱い素材で包装された食品を温める用途に使われることが多いです。
CaO(固) + H2O(液) → Ca(OH)2(固) ΔH =−65.2 kJ
(iii) 水酸化カルシウムCa(OH)2
水酸化カルシウムCa(OH)2は、「消石灰(slaked lime)」とも呼ばれる白色固体です。水に少し溶けて強塩基性を示すので、酸性化した河川や土壌の中和剤として使われます。また、かつてはグラウンドなどに白線を引くラインパウダーとして使われていましたが、傷口や目に入ると危険であり、現在では主に炭酸カルシムCaCO3の粉末が使われています。
水酸化カルシウムCa(OH)2の溶解度は、25℃で0.17 g/100 mLと水にやや溶けにくいですが、その水溶液は「石灰水(lime water)」と呼ばれます。一般に固体が水に溶解する反応は吸熱反応(ΔH>0)ですが、水酸化カルシウムCa(OH)2が水に溶解する反応は発熱反応(ΔH<0)です。その溶解度は、温度の上昇とともに減少する珍しい物質です。また、石灰水に二酸化炭素CO2を吹き込むと白く濁るので、石灰水は二酸化炭素CO2の検出に用いられます。白濁する理由は、二酸化炭素CO2と反応して生成する炭酸カルシウムCaCO3が、水に難溶であるためです。
Ca(OH)2(固) + aq → Ca2+ aq + 2OH- aq ΔH =−16.7 kJ
Ca(OH)2 + CO2 → CaCO3↓ + H2O
(iv) 炭酸カルシウムCaCO3
炭酸カルシウムCaCO3は、水に難溶な白色固体であり、貝殻やサンゴの骨格、鶏卵の殻、石灰岩、大理石などの主成分です。「月のしずく」や「人魚の涙」と呼ばれる真珠も、炭酸カルシウムCaCO3とタンパク質の層が、交互に積層されて形成される生体鉱物です。「日本は資源が乏しい」とよくいわれますが、実は石灰岩だけは豊富に存在します。観光地として有名な秋吉台や四国カルストは、石灰岩が点々と地表に露出した場所ですし、地下深くの石灰岩が地下水で溶けてできた鍾乳洞も、日本各地に点在しています。
炭酸カルシウムCaCO3の用途も様々で、学校の教室で使われるチョークは、身近にある炭酸カルシウムCaCO3の塊の1つです。粉にすると研磨力があるので、歯磨き粉や消しゴムにも含まれているし、陶器の材料にもなります。また、紙に炭酸カルシウムCaCO3を漉き込むと、白くなって透けにくくなるので、製紙業にも大変重要です。紙の種類にもよりますが、紙には重量比で10〜25%ほどの炭酸カルシウムCaCO3が含まれています。

図.11 チョークの主成分は炭酸カルシウムCaCO3であり、ホタテ貝殻や卵殻がリサイクル原料として用いられている
炭酸カルシウムCaCO3は、彫刻や建材にも欠かせません。石灰の粉を水と顔料で着色し、乾き切っていない漆喰の上に絵を描く技法は、「フレスコ画」と呼ばれます。システィーナ礼拝堂にある、ミケランジェロの「最後の審判」が代表的な例です。また、人類最古の芸術作品として知られるラスコー洞窟の壁画も、石灰岩の上に書かれた一種のフレスコ画です。長年に渡って変質・摩耗しない石灰岩だからこそ、壁画は15,000年もの歳月を生き延びて、我々の目に触れることができました。芸術の世界において、炭酸カルシウムCaCO3が我々にもたらした恩恵は、極めて大きいといえます。

図.12 フランスにあるラスコー洞窟は、先史時代の洞窟壁画で有名である
現在市販されているカルシウム錠剤の有効成分は、炭酸カルシウムCaCO3です。実は、カルシウムCaを摂取すると、犯罪発生率が下がるかもしれないという研究があります。研究によれば、血中の鉛レベルが高いと、殺人や暴行、強盗を犯しやすいのだそうです。特に胎児期および出生後に血中の鉛レベルが高かった子供は、20代前半になったときに犯罪や暴力を起こしやすくなるといいます。ある研究によると、胎児期における血中の鉛レベルが5 µg増えるごとに、逮捕の可能性は40%上昇しました。カルシウムCaの摂取量が不十分であると、鉛Pbが脳に吸収されやすくなることが分かっています。胎児の脳に悪影響を与える重金属には、鉛Pb以外にもカドミウムCd、マンガンMn、水銀Hgなど様々なものがあります。

図.13 市販されているカルシウム錠剤
雨が降ったあと、炭酸カルシウムCaCO3を含むブロック塀やコンクリート壁に、カタツムリがたくさん現れるところを見ることがあります。これは、カタツムリがコンクリートに含まれるカルシウムCaを摂取するために集まっている現象です。カタツムリの殻の主成分も、コンクリートと同様に炭酸カルシウムCaCO3です。成長とともに殻も大きくなるので、不足するカルシウム分を、コンクリートから摂取しているのです。

図.14 カタツムリは、殻を形成するのに必要なカルシウムCaを摂取するために、コンクリートを食べる
炭酸カルシウムCaCO3は、中性の水にはほとんど溶けません。しかし、希塩酸HClなどの強酸性の水溶液には溶けて、二酸化炭素CO2を発生します。また、炭酸カルシウムCaCO3を1,100℃程度で加熱すると、酸化カルシウムCaOと二酸化炭素CO2に分解します。この反応は、酸化カルシウムCaOの工業的製法として利用されています。このような炭酸塩の分解反応は、他のアルカリ土類金属でも起こります。熱分解が起こる温度は、原子番号の小さいものほど低いです。例えば、炭酸カルシウムCaCO3を熱分解するのには898℃以上の温度が必要ですが、炭酸ストロンチウムSrCO3では1,250℃以上の温度が必要です。
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CaCO3 → CaO + CO2

図.15 炭酸カルシウムCaCO3と塩酸HClの反応
(iv-1) ローマ帝国の栄華を支えたセメント
何より大きな炭酸カルシウムCaCO3の用途は、「セメント(cement)」の原料です。セメントは、水を加えると水和や重合により硬化する無機材料のことです。一般的には、土木工事や建築工事などで使われる「ポルトランドセメント(イギリスのポートランド島で生産される石材に似ていることに由来する)」のことを指すことが多いです。炭酸カルシウムCaCO3が7〜8割に対し、ケイ酸質粘土(SiO2とAl2O3を含む)やセッコウCaSO4・2H2Oなどを2〜3割程度の割合で加え、粉砕機で細かくして混合します。これを1,500℃程度の高温で焼くと、炭酸カルシウムCaCO3から二酸化炭素CO2が抜けて、酸化カルシウムCaOとなります。そして、生成した酸化カルシウムCaOが、粘土の成分である二酸化ケイ素SiO2や酸化アルミニウムAl2O3と反応して、ケイ酸カルシウムCaSiO3やアルミン酸三カルシウムAl2Ca3O6(3CaO・Al2O3)などの焼結体となります。これを冷却し、再び粉砕して得られるのが、いわゆるセメントです。これを水で練って放置しておくと、水和や重合により硬化していきます。なお、完全に硬化したあとのセメントは、空気中の二酸化炭素CO2を吸収して、炭酸カルシウムCaCO3となっています。
CaO + SiO2 → CaSiO3
3CaO + Al2O3 → Al2Ca3O6
Al2Ca3O6 + 3CO2 → Al2O3 + 3CaCO3
硬化したあとの炭酸カルシウムCaCO3だけでも十分強度はあるのですが、これでは余りに高額になってしまうので、通常はこれに砂や砂利を加えてコストダウンを図っています。このようにして、砂利と砂の隙間をセメントで埋めて作ったものを「コンクリート(concrete)」といい、安価で機械的強度が高いので、広く利用されています。コンクリートは、容積比で砂利:砂:セメント=6:3:1くらいが標準とされていますが、強度が必要な場合にはセメントの配合比を高めて、砂利:砂:セメント=4:2:1くらいにすることもあります。似たようなものに「モルタル(mortar)」というのもありますが、これはセメントペーストに砂だけを加え、砂利を入れていないものをいいいます。このため、何かの表面に塗るのに向いています。
コンクリートは優れた素材ですが、硬化時間が比較的長いのが難点です。表面が固まってそっと歩いても凹まなくなるくらいまでに24時間、叩いても傷が付かないくらいまでに1週間、上で馬が走っても平気になるのに2週間、家を建てても平気になるのは4週間くらいかかります。残念ながら、木下藤吉郎(後の豊臣秀吉)が建てたような「墨俣一夜城」などには使えません。

図.16 セメントに水を加えて練ると、水和や重合が進んで硬化する
セメントは自由に成形できる上、固まれば石のように固くなるので、建材として非常に優れています。この画期的な材料が使われ始めたのは、約9,000年も前の石器時代に遡るというから、昔から発明家はいたのだなと思わされます。エジプトでは、ピラミッドの建築に使われたし、中国でも、約5,000年前から使われています。しかし、セメントを最も有効に利用して見せたのは、古代ローマの人々でした。古代ローマの時代に使われたセメントは、現代でもその成分や製法などは明確に分かっていません。しかし、一部の機能においては現代のセメントを上回り、再現できないものかと研究がなされています。現代のコンクリートと異なるのは、中性であることです(現代のコンクリートは塩基性)。そのため、空気中の二酸化炭素CO2を吸収して強度が低下するということが起こりません。古代ローマを代表とする建築家ウィトルウィウスの10巻におよぶ記録「建築十書」によると、「ヴェスビオス火山の火山灰から生じた凝灰岩に消石灰を混ぜると、優れたセメントができる」とされています。
紀元前753年にイタリア半島中部に建国された古代ローマは、様々な変転を重ねつつ、地中海世界を制覇し、驚くべき文化の花を咲かせました。体格にも地理的条件にも決して恵まれなかった彼らが、数々の戦いを勝ち抜き、1,000年以上もその国家を維持して見せたのは、まさしく「世界史の奇跡」という他ありません。これを支えたのが、道路や水道、港などの護岸や堤防、大浴場や大殿堂などの各種建造物といった、ローマのインフラ整備の力でした。「すべての道はローマに通ず」のことわざ通り、ローマの道路整備は徹底していました。ローマ街道の総延長は約15万kmと、ほぼ地球4周分にも及んでいます。そのかなりの部分が、2,000年後の現在まで残っており、現役の自動車道路として使われているところさえあるというから、その堅牢さには驚く他ありません。

図.17 現在にも残るローマ街道
標準的なローマ街道は、2台の馬車がすれ違える幅4 mが確保され、その両脇に幅3 mの歩道がありました。車道は最大深さ2 mまで掘り下げられ、そこに三層構造の石造りの路盤が造り上げられました。表面には、大きな分厚い石を敷き詰め、セメントでこれを固めました。山にはトンネル、川には橋が架けられ、いずれも大型投石器などの軍事機械が通過できる規格でした。この整備された街道のお陰で、ローマ時代の旅人は徒歩でも1日25〜30 kmを、馬車なら35〜40 kmを旅することができました。領土全体に張り巡らされたこの街道のお陰で、いつどこで戦乱が起きても、ローマ軍は素早く駆け付けることができました。あの巨大な領土をわずか30万の兵士で守ることができたのは、この素晴らしい街道のお陰であり、堅固なセメントの威力によるものでした。もちろん、コロッセオや大浴場をはじめとする建造物群、各地から首都へ清潔な水を運んだ水道など、ローマのインフラには、みなセメントが活用されていました。この材料なくして、ローマ帝国の栄華はなかったと思われます。
(v) 炭酸水素カルシウムCa(HCO3)2
水酸化カルシウムCa(OH)2の水溶液である石灰水に、二酸化炭素CO2を吹き込むと、炭酸カルシウムCaCO3の白色沈殿が生じます。しかし、さらに過剰の二酸化炭素CO2を吹き込むと、炭酸カルシウムCaCO3は炭酸水素カルシウムCa(HCO3)2となって、水に溶けるようになります。
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCO3 + H2O + CO2 ⇄ Ca(HCO3)2
また、炭酸水素カルシウムCa(HCO3)2を含んだ水溶液を加熱すると、二酸化炭素CO2の溶解度が小さくなり、水溶液中の二酸化炭素CO2の減少により、平衡が左へ移動します。そして、炭酸カルシウムCaCO3の微粒子が再び析出し、これが水中に分散したコロイドとなります。

図.18 水酸化カルシウムCa(OH)2の反応
この平衡反応は、鍾乳洞形成の原理となっています。すなわち、二酸化炭素CO2を含む弱酸性の雨水により、炭酸カルシウムCaCO3を主成分とする石灰岩が浸食され、このような浸食によって、石灰岩体の内部に多くの空洞が生じます。そして、石灰岩中の微細な割れ目などを満たした雨水が洞窟内に滲出すると、洞窟内の二酸化炭素CO2の分圧が土中より低く、二酸化炭素CO2を含む雨水と炭酸カルシウムCaCO3との化学反応が可逆的であることから、洞窟内で二酸化炭素CO2が抜けて、炭酸カルシウムCaCO3が方解石として晶出し始めます。それが長い年月をかけて沈積して、鍾乳洞などの洞窟生成物が形成されるのです。このような反応が繰り返し起こることで、鍾乳石は200年間で約1 cm成長するといわれています。コンクリートの古い建物の軒先から、小さい鍾乳石が伸びていることがありますが、これも同様の原理です。ただし、最近は酸性雨のせいで、鍾乳石の成長速度が大きくなっているようです。

図.19 山口県にある秋芳洞
(vi) 硫酸カルシウムCaSO4
ベリリウムBeとマグネシウムMg以外の第2族元素の硫酸塩は、水に溶けにくいです。硫酸カルシウムCaSO4は、「セッコウ(plaster)」の主成分です。硫酸カルシウムCaSO4の固体には、無水物の他にも、1/2水和物および二水和物が存在します。硫酸カルシウム無水物CaSO4は「硬セッコウ」、硫酸カルシウム1/2水和物CaSO4・1/2H2Oは「焼きセッコウ」、硫酸カルシウム二水和物CaSO4・2H2Oは「セッコウ」と呼ばれます。
セッコウCaSO4・2H2Oを約130℃で焼くと、脱水して焼きセッコウCaSO4・1/2H2Oになります。焼きセッコウCaSO4・1/2H2Oは、適当な水と混ぜると、発熱しながら硬化して体積が少し増え、二水和物のセッコウCaSO4・2H2Oになります。この性質を利用して、硫酸カルシウムCaSO4は、壁の塗装や陶磁器の型、塑像やギプスに使用されます。
CaSO4・2H2O ⇄ CaSO4・1/2H2O + 3/2H2O
(vii) 塩化カルシウムCaCl2
第2族元素の塩化物は、水によく溶け、無水塩は吸湿性が強いです。塩化カルシウムCaCl2は、乾燥剤や路面の凍結防止剤として利用されています。ただし、塩化カルシウムCaCl2を乾燥剤として用いる際には、アンモニアNH3の乾燥には使えません。アンモニアNH3と反応してCaCl2・8NH3を作るので、アンモニアNH3の乾燥には不適なのです。工業的には、塩化カルシウムCaCl2は、炭酸ナトリウムNa2CO3を生成するアンモニアソーダ法の副生成物として得られます(無機工業化学を参照)。また、実験室的には、水酸化カルシウムCa(OH)2と希塩酸HClの中和反応で生成します。
2NaCl + CaCO3 → CaCl2 + Na2CO3
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
(viii) カルシウムカーバイドCaC2
カルシウムカーバイド(炭化カルシウム)CaC2は、酸化カルシウムCaOとコークスCの混合物を電気炉で約2,000℃に加熱することによって生成する、灰色がかった白色固体です。主にアセチレンガスの簡便な発生源として利用されます。アセチレンC2H2は、水素イオンH+ を電離する酸として見た場合には、水H2Oよりも108倍以上も弱い酸です(C2H2はpKa=24、H2OはpKa=15.7)。カルシウムカーバイドCaC2に水H2Oを作用させる反応は、「弱酸であるアセチレンC2H2の遊離反応」とも見ることができます (脂肪族炭化水素(アルキン)を参照)。
CaC2 + H2O → C2H2↑ + Ca(OH)2
CaO + 3C → CaC2↑ + CO
(ix) ヒドロキシアパタイトCa5(PO4)3(OH)
人体の構成成分として、カルシウムCaは主に骨や歯に、ヒドロキシアパタイトCa5(PO4)3(OH)の形で存在します。ヒドロキシアパタイトCa5(PO4)3(OH)は、人間を始めとする脊椎動物の骨や歯といった硬組織の主要構成成分となっています。ただし、海綿動物の中には、カイロウドウケツのようにガラス繊維の二酸化ケイ素SiO2の骨格を持つ生物もいます。そのため、人体における骨や歯も、物理的にはガラスなど他の材料でも作れると考えられています(第14族元素(炭素族元素)を参照)。

図.20 カイロウドウケツの骨片は、人間の髪の毛ほどの細さの繊維状ガラスであり、これが織り合わさって、網目状の骨格を為している
しかしながら、細胞内におけるカルシウムイオンCa2+ の生化学的な働きは、代替が効きません。例えば、筋肉の収縮には、カルシウムイオンCa2+ が「トロポニン」というタンパク質に結合することが不可欠であり、カルシウムCaが不足すると、足がつるなどの症状が出やすくなります。また、カルシウムイオンCa2+ は、生体において神経伝達物質として働いており、視神経などで重要な働きをしています。脳の活動を促す働きもあり、カルシウムCaが不足すると、イライラするなどとよくいわれることです。このように、生体におけるカルシウムCaの働きがあまりにも重要なので、カルシウムイオンCa2+ の血中濃度が下がると、体は骨からカルシウムCaを溶け出させて、濃度を維持しようとします。骨は進化の過程で、「最初はカルシウムCaの貯蔵庫として作られ、あとから構造材になった」とする説もあるくらいです。
(5) ストロンチウム
「ストロンチウム(strontium)」は、銀白色の軟らかいアルカリ土類金属です。化学反応性が非常に高いため、金属ストロンチウムは灯油中に保存されます。ストロンチウムSrの同位体には、放射性同位体であるストロンチウム90Sr(ストロンチウム90)があります。このストロンチウム90のせいで、世間におけるストロンチウムSrのイメージは最悪です。普通のストロンチウムSrには放射能はなく、「死の灰」だといって非難されるいわれは全くありません。ストロンチウム90は、周期表ですぐ上にあるカルシウムCaと化学的性質が似ているために、骨に蓄積されやすいという性質があります。そのため、生物学的半減期が非常に長くなって、人体に対する毒性が非常に強くなります。
ストロンチウムSrの代表的な用途の1つに、夜行塗料があります。夜光塗料の中には放射能を持つものもあるので、イメージ改善には役立たず、それどころかここでも妙な連想のせいで、「放射線を出すのではないか」と誤解される始末です。アルミン酸ストロンチウムSrAl2O4を利用した際立って明るい塗料は、確かに暗闇でも光ります。けれども、それはラジウム化合物入り塗料のような原子核崩壊による発光ではありません。周囲の光をよく吸収し、そのあとで数十分ないし数時間かけて、吸収したエネルギーを光として放出しているからです。このような性質を「蓄光(phosphorescence)」といいます。

図.21 アルミン酸ストロンチウムSrAl2O4入りの蓄光塗料
(6) バリウム
(i) バリウムBa
「バリウム(barium)」は、銀白色の軟らかいアルカリ土類金属です。他のアルカリ土類金属元素と類似した性質を示しますが、カルシウムCaやストロンチウムSrと比べると、その化学的反応性は高いです。この理由は、バリウムBaのイオン化エネルギーが小さく、電子を失いやすいからです。アルカリ土類金属としては、密度が3.51 g/cm3と大きく重いため、ギリシア語での「barys(重い)」にちなんで命名されました。ただし、実際の金属バリウムが、他の金属と比べて特別に重いという訳ではありません。分類としては、バリウムBaは軽金属に分類されます。純粋な金属バリウムはそれほど重くないのに、その化合物の大半が重いのが特徴的です。
バリウムBaは、歴史的に重要な発見の一翼を担った元素でもあります。1938年にドイツの化学者であるオット・ハーンは、ウランUに中性子を照射すると、ウランUよりはるかに原子番号の小さいバリウムBaが検出されることを発見しました。この発見が、「原子核分裂(nuclear fission)」を証明することとなり、原子力エネルギー利用への道を開くこととなりました。ハーンはこの功績により、1944年にノーベル化学賞を受賞しています。

図.22 オット・ハーンは「原子核分裂」を発見し、ノーベル化学賞を受賞した
純粋な金属バリウムは、酸素ガスと反応して、酸化バリウムBaOに変化します。この反応を利用して、金属バリウムは、微量の酸素ガスを取り除く「ゲッター(getter)」として用いられます。旧式の真空管はほとんどの場合、ガラス管の内側に銀白色の金属バリウムを蒸着させてあります。微量の酸素ガスやその他の気体が、製造時に真空管内に残っていたり、年月とともにガラスの接合部から潜り込んだりしたとしても、金属バリウムがすぐに反応して、それを除去してくれます。同様のバリウムゲッターは、真空を利用する各種装置や電球の中でも、酸素ガスや水蒸気を完全除去するために働いています。
2Ba + O2 → 2BaO

図.23 真空管の内側には、金属バリウムが蒸着させてある
しかしながら、ゲッターとしての用途は、真空管を使わない液晶テレビやプラズマテレビの普及によって、徐々に姿を消しつつあります。真空管が時代遅れになった今、バリウム化合物の花形の用途は、イットリウム系超伝導体YBa2Cu3O7です。これは、構成する元素の頭文字を取って、「YBCO」とも呼ばれます。液体窒素温度(77 K)を超える転移温度の初めての超伝導体であり、イットリウム系超伝導体YBa2Cu3O7の発見以後、超伝導の研究が盛んに行われるようになりました。
(ii) 硫酸バリウムBaSO4
バリウム化合物の用途の多くは、バリウム化合物の懸濁液の密度の大きさを利用します。その代表例が、油井(ゆせい)の掘削です。ドリルで地面を掘削しながら、硫酸バリウムBaSO4の懸濁液を穴に注入していきます。硫酸バリウムBaSO4の密度は4.5 g/cm3もあり、一般的な岩石の密度2.5〜3.5 g/cm3よりも十分大きいです。破砕した岩石屑を、それより比重が大きいこの懸濁液で浮き上がらせ、穴から取り除く訳です。

図.24 油井の採掘に硫酸バリウムBaSO4が使われている
また、硫酸バリウムBaSO4は、塩酸HClなどの酸と反応せず、X線を透過させないという性質を利用して、医学検査の造影剤として利用されます。消化管のどこを撮影するかによって、口から飲むか、肛門から注入されるかします。この状態でX線を使って撮影すれば、消化管のくびれや曲がりが、はっきりと見えるようになります。
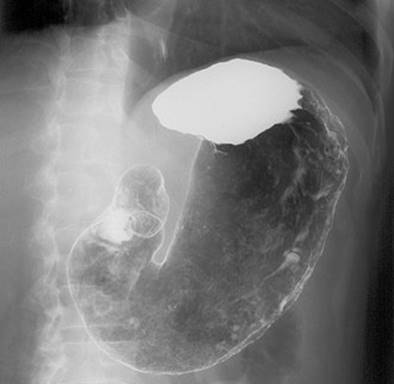
図.25 胃のX線造影に硫酸バリウムBaSO4が使われている
自然界では、積極的に硫酸バリウムBaSO4を利用している生物がいます。例えば、チリモ科のある藻類は、幼生時に水底へ潜って捕食者から逃れるための重りとして、またある種の繊毛虫は、重力センサーとして、硫酸バリウムBaSO4を体内に取り込んで利用しているといわれています。なぜ硫酸バリウムBaSO4を使うのか、はっきりとした理由は分かっていませんが、硫酸バリウムBaSO4が重いこと、また地殻中に比較的多量に含まれることから、進化の過程で利用しやすかったためだと考えられています。
・参考文献
1) 大東孝司「プラグマティック化学」河合出版(2017年発行)
2) 齋藤勝裕「へんな金属すごい金属」技術評論社(2009年発行)
3) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
4) 桜井弘「元素118の新知識 引いて重宝、読んでおもしろい」講談社(2017年発行)
5) 佐藤健太郎「世界史を変えた新素材」新潮社(2018年発行)
6) 左巻健男「面白くて眠れなくなる元素」PHP研究所 (2016年発行)
7) ジョーシュワルツ「シュワルツ博士の化学はこんなに面白い」主婦の友社(2002年発行)
8) セオドア・グレイ「世界で一番美しい元素図巻」創元社(2011年発行)
9) 橘玲「言ってはいけない 残酷すぎる真実」新潮新書(2016年発行)
10) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)
11) 山北篤「現代知識チートマニュアル」新紀元社(2017年発行)