・第1族元素(アルカリ金属など)
【目次】
(1) 第1族元素
周期表において、第1族に属する水素H・リチウムLi・ナトリウムNa・カリウムK・ルビジウムRb・セシウムCsなどの元素を総称して、「第1族元素」といいます。このうち、常温常圧で単体が気体である水素Hを除いた第1族元素を、「アルカリ金属(alkali metals)」といいます。第1族元素の電子構造の特徴は、最外殻が1個の電子に占められたns軌道(n=1,2,3・・・)からなることです。ここで、nは「主量子数(principal quantum number)」と呼ばれる値で、電子殻の大きさに対応しています。例えば、n=1ならK殻、n=2ならL殻、n=3ならM殻・・・というようになります。
なお、第1族元素において、水素の単体H2だけが、常温常圧では気体です。しかし、25万気圧以上の超高圧下では、水素原子は電子を保持できなくなり、金属化することが知られています。このような「金属水素(metallic hydrogen)」では、電子が原子核に束縛されずに、金属における自由電子のように振る舞います。木星は、厚さ2万kmの液体水素で覆われており、その海底は、300万気圧以上もの超高圧になっています。そのため、木星の海底には、金属水素が豊富に存在しているのではないかと考えられています。

図.1 木星の海底には、金属水素が存在すると考えられている
金属の単体を得るときは、その金属のイオンを含む水溶液を電気分解すると、陰極で還元反応が起きて、その金属の単体が得られます。しかし、アルカリ金属は、イオン化傾向が大きいので、そのイオンを含む水溶液を電気分解しても、単体は得られません。そこで、アルカリ金属の化合物を高温で熱して融解し、その融解液を溶融塩電解することで得られます。
例えば、ナトリウムNaの単体を得る場合は、融点801℃の塩化ナトリウムNaClを溶融塩電解します。すると、陰極でナトリウムNaが得られ、陽極で塩素Cl2が得られます。生成したナトリウムNaの単体は、溶融状態での密度がNa<NaClで浮かび上がってくるので、それを回収します。なお、ナトリウムNaの単体は、水酸化ナトリウムNaOHの溶融塩電解でも得られますが、工業的には塩化ナトリウムNaClの溶融塩電解が行われています。
陰極(C):Na+ + e- → Na
陽極(Fe):2Cl- → Cl2 + 2e-
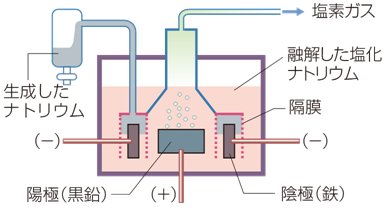
図.2 ナトリウムNaの製法
アルカリ金属の単体は、常温で空気中の酸素O2や水H2Oと反応するので、それらを避けるために、灯油中に保存されます。ただし、リチウムLiは固体状態の単体の中では最も軽い物質で、灯油よりも軽くて浮いてしまうため、表面にワセリンを塗って保存します。アルカリ金属を空気中で放置すると、反応熱により自然発火することもあるので、取り扱いには十分注意する必要があります。アルカリ金属は、いずれも密度の小さい銀白色の軽金属であり、比較的軟らかく、融点も低いです。また、各元素に特有の炎色反応を示します。
表.1 アルカリ金属の単体の性質
|
化学式 |
融点 (℃) |
密度 (g/cm3) |
炎色反応 |
第一イオン化エネルギー (kJ/mol) |
|
Li |
181 |
0.53 |
赤 |
520 |
|
Na |
98 |
0.97 |
黄 |
496 |
|
K |
64 |
0.86 |
紫 |
419 |
|
Rb |
39 |
1.53 |
赤紫 |
403 |
|
Cs |
28 |
1.87 |
青 |
376 |
アルカリ金属は、他の金属元素と比べて融点がかなり低いです。融点が低い理由は、アルカリ金属の原子半径が大きく、金属結合に関与する自由電子が1個しかないからです。原子半径が大きくなるほど、単位面積当たりの自由電子の数が少なくなるので、結果的に金属結合が弱くなって、アルカリ金属では融点が低くなるのです。アルカリ金属の中でも、原子半径が大きいセシウムCsの融点は28℃であり、これは夏場の室温では融解して液体になってしまいます。
また、アルカリ金属の単体は、反応性に富むものが多いです。原子番号の大きい元素ほど金属結合が弱くなって、結晶エネルギーが低減するので、原子番号の大きい元素ほど激しく反応する傾向が見られます。アルカリ金属はいずれも還元性が強く、室温では酸素O2や塩素Cl2と直ちに化合します。そのため、空気中では速やかに酸化されて、金属光沢を失います。また、冷水とも激しく反応して、水素H2を発生し、水酸化物を生じます。例として、次にナトリウムNaの各種の反応を示します。
4Na + O2 → 2Na2O
2Na + Cl2 → 2NaCl
2Na + 2H2O → 2NaOH + H2

図.3 アルカリ金属の性質
(2) 水素
(i) 水素H2
周期表の第1番目に位置する「水素(hydrogen)」は、宇宙に存在する原子の約92%を占め、全元素中でその存在割合が最も大きい元素です。英語名「hydrogen」の由来は、ギリシア語の「hydro(水)」と「gen(つくるもの)」によります。名前の通り、水H2Oに含まれる元素です。ビッグバンのあと、宇宙で最初に生成された元素は水素Hであり、その後の恒星中の核融合反応により、ヘリウムHeから鉄Feまでの元素が生成されました。鉄Feより重い元素は、超新星の爆発によって生成したものと考えられています。
水素Hの単体は、二原子分子H2からなります。室温では、無色無臭の気体であり、重さは空気のわずか1/14と、すべての気体の中で最も密度が小さいです。1 Lの水素H2を風船に詰めると、1.2 gの浮遊力が得られます。20世紀初頭には、巨大飛行船の浮遊用ガスに使われていましたが、引火しやすい性質によって爆発事故が何度か起きたため、後に不燃性のヘリウムHeに取って代わられました。ちなみに、1783年に史上初めて水素気球で空中飛行した人物は、フランスの物理学者であるジャック・シャルルです。シャルルは、高校化学では1787年に「シャルルの法則(Charles's law)」を見出したことで有名です(理想気体の状態方程式を参照)。ライト兄弟が初めて有人動力飛行に成功したのが1903年ですから、それより100年以上も早い偉業です。

図.4 1783年12月1日、シャルルは有人気球の初飛行を行い、2時間5分で36 kmを飛行した
気体分子の速さは、気体のモル質量の平方根に反比例します。そのため、モル質量の小さい水素分子H2は、非常に速く熱運動をすることになります。その速度は、地球の重力圏を振り切るのに必要な「第二宇宙速度(escape velocity)」を優に超えるため、水素分子H2は大気中で生成しても、すぐに宇宙に拡散してしまいます。空気の組成で、水素H2の割合が約0.00005%と極めて小さいのはこのためです。現在、地球からは1秒当たりで、水素H2が約3 kg宇宙へと拡散しています。拡散がこのペースで続くと、30億年後には、地球の水分はほとんどなくなっている計算になります。
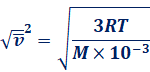
ちなみに、1766年に初めて水素H2を分離し発見したイギリスの化学者ヘンリー・キャベンディッシュは、「変人すぎて教科書に載らなかった天才化学者」といわれています。両親がイギリスの上流貴族だったので、「国王に次ぐ金持ち」といわれるほどの資産を持っていましたが、金銭には全く関心がなく、趣味の物理や化学の研究に没頭していました。性格も「超」が付くほどの恥ずかしがり屋で、家には何人もの女性のメイドがいましたが、メイドと会うのを極力避けて生活していました。ドアの外に食事の時間をメモして置いておくと、メイドが食事をドアの外に置いていきます。それを一人で食べて、食器をドアの外に出しておくという引きこもりのような生活でした。運悪く「廊下ですれ違った」という理由で、解雇されてしまったメイドもいたといいます。
しかし、キャベンディッシュには優れた自然科学の才能があり、水素H2の発見の他にも、ヒ素AsやアルゴンArの発見、地球の密度の測定、さらに独自にオームの法則やクーロン法則、シャルルの法則を考案していたというのだから驚きです。その発見の多くを世間に発表しなかったのは、キャベンディッシュが誰とも交流を持たず、病的な恥ずかしがり屋だったからでしょう。世間に発表したのは、水素H2の発見を含むいくつかの論文だけで、それ以外は自分の実験ノートに書き残すだけで満足していたのです。「歴史にifはない」といいますが、もしキャベンディッシュが「恥ずかしがり屋」でなかったら、化学はもっと早く進展していたかもしれません。

図.5 水素Hを発見したキャベンディッシュは、「変人すぎて教科書に載らなかった天才化学者」と呼ばれている
水素原子は、1個の陽子からなる原子核と、その周囲を運動する1個の電子とから構成されます。1個の電子は、基底状態で1s軌道を占めます。この観点からすれば、最外殻としてns軌道に1個の電子を持つアルカリ金属原子と、電子配置はよく似ています。実際に水素では、+1のイオン価の状態が安定に存在します。ただし、水素イオンH+ は、アルカリ金属を含む他の元素のイオンとは大きく異なり、電子が存在せずに、陽子がむき出しの状態です。化学が対象とする場において、陽子が単独で存在することはまれであり、例えば水溶液中では、水素イオンH+ は水H2Oと結合して、オキソニウムイオンH3O+ の形で存在します。一方で、水素の1s軌道は、さらに1個の電子を受け入れて、満たされた最外殻軌道としても安定化することができます。このため、水素はハロゲンと同様の-1のイオン価を取り、水素化物イオンH- としても存在します。このように水素は、アルカリ金属やハロゲンと似たような性質を示すものの、このことは逆に水素の特異性を表しているのであって、水素をアルカリ金属やハロゲンと同族と考えることは、むしろ誤りです。
H+ + H2O → H3O+
水素の原子核としては、陽子1個からなるものの他、1個の陽子と1個の中性子から構成されるもの(質量数2)、および1個の陽子と2個の中性子から構成されるもの(質量数3)が知られています。前者を「重水素」または「ジュウテリウム(deuterium)」、後者を「三重水素」または「トリチウム(tritium)」と呼び、それぞれをD(あるいは2H)、T(あるいは3H)の化学記号で表します。質量数が1の水素1Hを、「軽水素」または「プロチウム(protium)」と呼ぶこともあります。自然界におけるこれらの同位体の存在比は、1Hが99.985%、Dが0.015%、Tが10-17%程度です。
また、これらの同位体は、互いの質量が2倍ないし3倍と大きく異なります。これはもちろん、水素の原子核を構成する陽子と中性子の数が、他の元素と比べて極端に少ないからです。この結果、水素では「同位体効果(isotope effect)」が、他の元素と比べて非常に大きくなります。たとえ原子番号が同じでも、質量が2倍以上も違うと、分子の電気的中心と力学的中心に差が生じるのです。この性質を利用して、重水素Dや三重水素Tは、水素が関与する化学反応の追跡などのための「トレーサー(tracer)」として用いられることがあります。
表.2 水素Hの同位体
|
|
1H |
2H |
3H |
|
陽子数 |
1 |
1 |
1 |
|
中性子数 |
0 |
1 |
2 |
|
質量数 |
1 |
2 |
3 |
|
存在比 |
99.985% |
0.015% |
10-17% |
|
呼称 |
軽水素 |
重水素 |
三重水素 |
原子核同士が反応した結果、反応前よりも重い原子核が生成される反応を「核融合反応(nuclear fusion)」といい、「核分裂(nuclear fission)」とは反対の反応です。太陽や恒星などが放出している巨大なエネルギーは、この核融合反応によります。主に1H核、2H核、3H核などが4He核や3He核になる反応が中心であり、軽い原子核が核融合反応によって、より安定な重い原子核になります。例えば、次の(I)〜(III)ような核融合反応がよく知られています。ここで、1 Vの電位差がある空間で電子1個が得るエネルギーを1 eVといい、1 eV=1.6021765×10−19 J、1 MeV=1.6021765×10−13 Jです。
41H → 4He + 26.2 MeV ・・・(I)
2H + 3H → 4He + 1n + 17.8 MeV ・・・(II)
2H + 2H → 3He + 1n + 3.27 MeV ・・・(III)
太陽の中心部では、主に(I)の核融合反応が生じています。太陽だけでも、毎秒6億tの1H核を消費して、毎秒5億9,600万tの4He核を生産しています。反応で失われた400万tの質量は、ドイツの物理学者アルベルト・アインシュタインが発表した![]() の式に従って、エネルギーに変換されたのです。太陽からは、毎秒400万tのうち、毎秒1.6 kg分のエネルギーが地球にやってきて、夜明けの薄明かりや夏の午後の日差し、黄昏の空の色を生み出しています。たった毎秒1.6 kgの質量でも、地球を照らす膨大なエネルギー量になるのは、光の速さが30万km/sという膨大な値だからです(
の式に従って、エネルギーに変換されたのです。太陽からは、毎秒400万tのうち、毎秒1.6 kg分のエネルギーが地球にやってきて、夜明けの薄明かりや夏の午後の日差し、黄昏の空の色を生み出しています。たった毎秒1.6 kgの質量でも、地球を照らす膨大なエネルギー量になるのは、光の速さが30万km/sという膨大な値だからです(![]() )。そのため、核融合によって放出されるエネルギーは、同じ原子数で比べると、化石燃料の約100万倍にもなります。なお、地球でも原料となる2H核が海水中に大量に存在しているため、未来のエネルギー源になる可能性があるとして期待されています。
)。そのため、核融合によって放出されるエネルギーは、同じ原子数で比べると、化石燃料の約100万倍にもなります。なお、地球でも原料となる2H核が海水中に大量に存在しているため、未来のエネルギー源になる可能性があるとして期待されています。

図.6 美しい夕焼けは、太陽の核融合反応が生み出している
(ii) 水素H2の製法
最近、水素H2の利用が、地球温暖化やエネルギー問題と絡めて注目を集めています。その理由は、水素H2を燃焼させると大きな熱エネルギーが得られるにも関わらず、その生成物は水H2Oだけで、二酸化炭素CO2を発生しないためです。現在、人類が消費しているエネルギーの8割以上は、石油や石炭、天然ガスなどの化石資源です。これらは、燃焼させると大きな熱エネルギーが得られますが、それと同時に水H2Oと二酸化炭素CO2を発生し、その二酸化炭素CO2が地球温暖化の大きな原因となっています。
水素H2そのものは、燃焼しても二酸化炭素CO2を排出しないエネルギー源ですが、注意すべきことは、「水素エネルギー」はいわゆる一次エネルギーではないということです。地球上のどこを掘っても、天然ガスのように水素H2が出てくる場所はありません。したがって、水素H2を製造するためには、ある原料を用いて、何らかの一次エネルギーを投入する必要があります。そのため、水素H2自体は二酸化炭素CO2を発生しないクリーンなエネルギー源ですが、その製造過程では二酸化炭素CO2が発生することに注意が必要です。天然ガスや石炭などの化石資源をもとに製造した水素H2は、製造過程で二酸化炭素CO2を排出するので、このような水素H2を「グレー水素」といいます。また、発生した二酸化炭素CO2を捕集して、大気中への放出を極力抑えて製造される水素H2を「ブルー水素」といいます。理想的なのは、二酸化炭素CO2を排出しない太陽光や風力などの再生可能エネルギーをもとにして水素H2を製造することであり、このような水素H2を「グリーン水素」といいます(エネルギー源を原子力とする場合は、放射性廃棄物が発生するため「イエロー水素」といいます)。
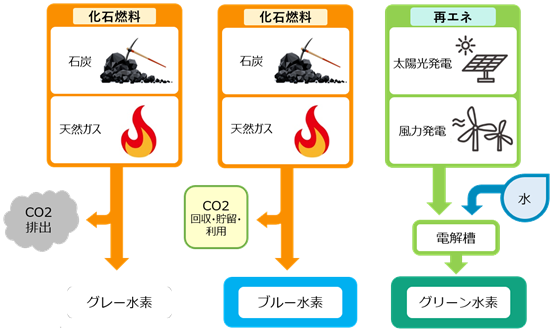
図.7 化石燃料を用いて製造される水素H2は「グレー水素」と呼ばれる
現在、工業分野で広く利用されている水素H2の製法は、石油や天然ガスの変成、水性ガスの反応です。水H2Oの電気分解で製造することもできますが、電気分解はコスト競争力がなく、現在ではほとんど行われていません。石油や天然ガスなどに含まれる炭化水素の変成では、次に示すような反応が利用されます。この反応は、「水蒸気改質(steam reforming)」と呼ばれています。この反応は大きな吸熱反応(約200 kJ/mol)であり、ニッケルNiなどを触媒として、700℃以上の高温で進行します。現在の世界中の水素ガス製造の9割以上は、この水蒸気改質で作られています。
CH4 + H2O → CO + 3H2 ・・・(I)
この反応で得られた一酸化炭素COは、式(II)のような「水性ガスシフト反応(water gas shift reaction)」により、一酸化炭素COをさらに水H2Oと反応させることで、水素H2にすることができます。式(II)の反応は、酸化鉄(III) Fe2O3などの触媒存在下で、450℃ほどの高温で進行します。ちなみに、「水性ガス(water gas)」というのは、式(III)のようにコークスCと水蒸気H2Oを1,000℃以上の高温で反応させて得られる、一酸化炭素COと水素H2を主成分とした混合気体のことです。
CO + H2O → CO2 + H2 ・・・(II)
C + H2O → CO + H2 ・・・(III)
この反応で得られた水性ガスは、「フィッシャー・トロプシュ合成(Fischer-Tropsch process)」によって炭化水素へと転換され、工業的に利用されています。触媒としては、鉄FeやコバルトCoの化合物が一般的です。この方法の主な目的は、石油の代替品となる合成油や合成燃料を作り出すことです。
nCO + (2n+1)H2 → CnH2n+2 + nH2O
式(I)および式(II)を組み合わせたものが式(IV)であり、この反応が水素H2製造の総括反応になります。この反応から分かるように、1 molのメタンCH4からは、4 molの水素H2と1 molの二酸化炭素CO2が発生します。また、通常は触媒層を700℃以上に加熱するために、メタンCH4などを燃やして加熱しており、さらに多くの二酸化炭素CO2が発生することになります。
CH4 + 2H2O → CO2 + 4H2 ・・・(IV)
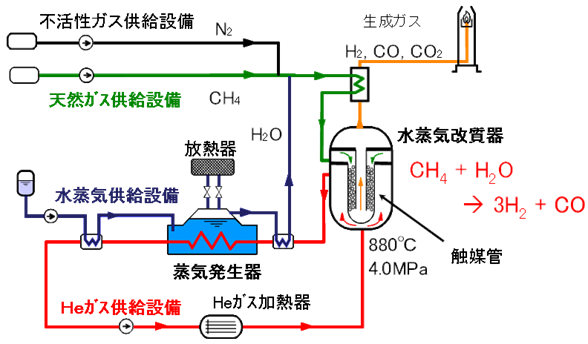
図.8 水素ガス製造の9割以上は水蒸気改質で作られている
なお、実験室的には、水素H2は亜鉛ZnやアルミニウムAlなどの金属に、塩酸HClあるいは希硫酸H2SO4を反応させて、発生させることができます。水素H2は水に溶けにくいので、水上置換で捕集します。例えば、亜鉛Znと塩酸HClとの反応は、次のようになります。
Zn + 2HCl → ZnCl2 + H2
(iii) 水素H2の反応と水素化物
常温では、水素H2は酸化力の強いフッ素F2以外の単体とは反応しません。しかし、光の照射下では、塩素Cl2と激しく反応します。また、電気花火があれば、酸素O2とも爆発的に反応します。さらに、高温高圧下で触媒があれば、安定な構造を持つ窒素N2とも反応して、アンモニアNH3を生成します。この反応の触媒には、四酸化三鉄Fe3O4を主成分とする物質が用いられます。この反応は、工業的にアンモニアNH3を合成する「ハーバー・ボッシュ法(Haber–Bosch process)」として知られています(無機工業化学を参照)。
H2 + Cl2 → 2HCl
2H2 + O2 → 2H2O
N2 + 3H2 → 2NH3
さらに、水素H2は、無公害のエネルギー源としても注目されています。「燃料電池(fuel cell)」は、その1つです。水素H2を用いた燃料電池では、水H2Oの電気分解の逆反応が起こり、この化学反応におけるエネルギー変化が、直接電気エネルギーに変換されます。燃料電池のエネルギー変換効率は約80%と高く、水素H2の燃焼熱は286 kJ/molなので、約230 kJ(286×0.80=228.8)のエネルギーが得られる計算になります (電気化学(電池)を参照)。
H2 + 1/2O2 = H2O(液) + 286 kJ
また、構造中に水素原子を含む化合物(水素化物)は、数多く存在します。水素化物のうち、イオン価が+1である水素を含む化合物は、枚挙に暇がありません。塩酸HClや硫酸H2SO4、硝酸HNO3などの強酸では、水素よりも電気陰性度の大きな原子との結合が分子内に存在するため、水素原子の1s電子は、結合を形成する相手の原子に引き付けられています。そのため、化合物中の水素は、水素イオンH+ に近い形で存在しています。実際、これらの酸が水に溶解すると、水素イオンH+ が放出されます。ただし、化合物中で水素原子は完全にイオン化して、分子内でイオン結合を形成している訳ではありません。例えば、塩酸HClにおいては、水素Hと塩素Clの間には、ある程度の割合で共有結合が働いています。HClの双極子モーメントを3.70×10−30 C・m、H−Cl結合の距離を1.28×10−10 m、電気素量を1.602×10−19 Cとして、塩酸HClのH−Cl結合のイオン結合性を計算すると、共有結合性が82%あって、イオン結合性は18%しかないことが分かります。
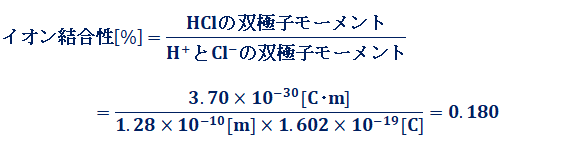
一方で、水素よりも電気陰性度の小さい原子との結合では、水素は共有電子対を引き付けて水素化物イオンH- として振る舞います。この例は、水素化リチウムLiHや水素化ナトリウムNaH、水素化カリウムKH、水素化カルシウムCaH2などのような、アルカリ金属およびアルカリ土類金属の水素化物に見ることができます。これらの水素化物は、水H2Oと激しく反応して、水素H2を発生させます。例えば、水素化ナトリウムNaHと水H2Oの反応は、次のように進行します。
NaH + H2O → NaOH + H2
この性質を利用して、水素化ナトリウムNaHなどの金属水素化物は、溶媒に存在する不純物の水H2Oを取り除くための乾燥剤として用いられたり、有機合成において強塩基として用いられたりします。次の表.3に、代表的な水素化物を示します。
表.3 代表的な水素化物
|
|
1族 |
2族 |
14族 |
15族 |
16族 |
17族 |
|
第2周期 |
LiH 水素化リチウム |
BeH2 水素化ベリリウム |
CH4 メタン |
NH3 アンモニア |
H2O 水 |
HF フッ化水素 |
|
第3周期 |
NaH 水素化ナトリウム |
MgH2 水素化マグネシウム |
SiH4 シラン |
PH3 ホスフィン |
H2S 硫化水素 |
HCl 塩化水素 |
|
第4周期 |
KH 水素化カリウム |
CaH2 水素化カルシウム |
GeH4 ゲルマン |
AsH3 アルシン |
H2Se セレン化水素 |
HBr 臭化水素 |
|
第5周期 |
RbH 水素化ルビジウム |
SrH2 水素化ストロンチウム |
SnH4 スタンナン |
SbH3 スチビン |
H2Te テルル化水素 |
HI ヨウ化水素 |
(3) リチウム
(i) リチウムLi
スウェーデンの化学者であるヨアン・オーガスト・アルフェドソンは、1817年にペタル石LiAlSi4O10という鉱石の中から、新元素としてリチウムLiを発見しました。当時、ナトリウムNaやカリウムKが、動植物界に広く分布することは知られていました。鉱物界から発見された初めての1族元素として、アルフェドソンはギリシア語の「lithos(石)」にちなんで、この新元素を「リチウム(lithium)」と命名しました。

図.9 無色のペタル石LiAlSi4O10は、しばしば宝石として利用される
アルカリ金属元素のうち、リチウムLiには、他の元素にはない特異な性質が多く見られます。これは、主にリチウムLiの原子半径およびイオン半径が、他のアルカリ金属と比べて、非常に小さいことに起因します。例えば、リチウムLiの融点は181℃なのに対し、その他のアルカリ金属の融点はいずれも100℃以下です(Naは98℃、Kは64℃など)。物理的な性質以外にも、水酸化物の水に対する溶解度(水酸化リチウムLiOH以外は溶解度が大きい)や水H2Oとの反応性(リチウムLi以外は激しく反応する)などで違いが見られます。それ故、リチウムLiの化学的性質は、他のアルカリ金属元素よりも、むしろアルカリ土類金属に類似しています。
リチウムLiの単体は、常温常圧で銀白色の金属固体として存在します。リチウムLiの密度は0.53 g/cm3で、金属・非金属を問わず、固体状態の単体の中では最も軽い物質です。水H2Oの密度は1/0 g/cm3なので、水に浮かばせることができます。水に浮く金属は、リチウムLiの他には、密度が0.97 g/cm3のナトリウムNaと、密度が0.86 g/cm3のカリウムKだけです。水面にリチウムLiを浮かべると、比較的穏やかに水H2Oと反応して、水素ガスを発生させます。他のアルカリ金属と比べると、水素ガスの発生は穏やかなので、爆発する危険性は低いです。
2Li + 2H2O → 2LiOH + H2
リチウムLiは、地球上に広く分布しています。しかし、単体は高い反応性を持つため、単体としては存在していません。地殻中では、25番目(0.002%)に多く存在する元素であり、火成岩や塩湖かん水中に多く含まれます。リチウムLiの埋蔵量の多くは、アンデス山脈沿いに偏在しています。ボリビアにあるウユニ塩湖は、世界最大のリチウム埋蔵量であり、世界の半分を占めると推定されています。電気自動車のリチウムイオン電池など、リチウムLiの需要は将来的に高まると予想され、今後私たちはボリビアから目が離せなくなるでしょう。

図.10 世界最大のリチウム埋蔵量を有すると想定されているボリビアのウユニ塩湖
(ii) リチウムイオン電池
リチウムLiはイオン化エネルギーが小さく、電子を他の元素に渡しやすいという、電池の材料として最適な性質を持ちます。また、リチウム原子のサイズが小さくて軽いため、電池を小型化・軽量化できるのもメリットになります。このようにリチウムLiは電池材料として優れた性質を持っており、電池の材料として盛んに研究されています。
リチウムイオン電池は、1991年にソニーが世界で初めて量産化に成功した新型二次電池です。小型軽量化が可能なためにエネルギー密度が高く、電解液に水溶液を使用していないため、氷点下の使用にも適しているなどの特徴を持ちます。さらに、電解液が水溶液である電池は、起電力が1.2〜1.5 Vを超えると水H2Oが電気分解されてしまいますが、リチウムイオン電池は有機溶媒を用いた非水系の電池なので、起電力が3.7 Vもあります。このような特徴を生かして、スマートフォンやデジタルカメラなど、ポータブル機器用電源として不可欠なものになっています。また、放電し切らないままの充電を繰り返すことによって、電池の放電容量が少なくなる「メモリー効果(memory effect)」が起こりにくく、スマートフォンやデジタルオーディオプレーヤーなど、継ぎ足し充電をする電子機器に適しています。最近では、ハイブリッド車や電気自動車などにも用いられています。リチウムイオン電池の基本概念を確立した電気化学者の吉野彰には、2019年のノーベル化学賞が贈られています。

図.11 スマートフォンには、リチウムイオン電池が使われている
リチウムイオン電池は正極、負極、イオンの通り道となる電解液、電極同士が触れないようにするセパレータから構成されます。正極にはコバルト酸リチウムLiCoO2、ニッケル酸リチウムLiNiO2、マンガン酸リチウムLiMn2O4などのリチウム化合物が使われ、負極にはリチウムイオンLi+ を取り込むことができる黒鉛Cなどが使われます。電池を使用するときは、負極から正極に向かって導線内を電子が流れ、電解液中をリチウムイオンLi+ が移動します。充電するときは逆の反応が起き、リチウムイオンLi+ が正極から負極へ移動し、リチウムLiとなります。
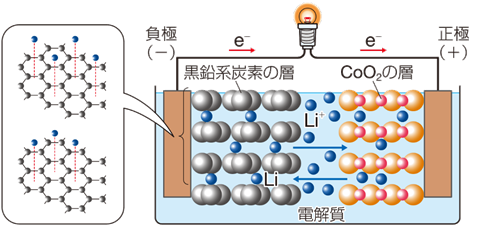
図.12 リチウムイオン電池の仕組み
(iii) 炭酸リチウムLi2CO3
炭酸リチウムLi2CO3は、リチウム塩の熱濃水溶液に、炭酸アルカリを加えると得られます。白色の固体で、ガラスやセラミックスなどの材料の他、電池用基材、圧電材などに用いられます。また、医薬品として用いられることもあり、無機化合物である炭酸リチウムLi2CO3が、躁鬱病の治療薬として用いられていると聞くと、驚く人も多いでしょう。
2Li+ + CO32- → Li2CO3
オーストラリアの精神科医であるジョン・ケイドは、1948年に炭酸リチウムLi2CO3に気分の異常な高揚を抑える効果があることを偶然に発見しました。ケイドは、最初は「尿酸が躁鬱病に効果があるのではないか」と考え、尿酸単体では水溶性に乏しいので、水に溶けやすいリチウム塩にして、モルモットに投与してみました。結果、「尿酸のリチウム塩」に鎮静効果があることが分かったので、確認実験として、「別の化合物のリチウム塩」を投与したところ、これも鎮痛効果を示しました。つまり、鎮静効果を示していたのは、「尿酸」ではなく「リチウムイオンLi+ 」だったのです。その結果は追試され、現在ではリチウムLiの酢酸塩、クエン酸塩、硫酸塩も躁鬱病の治療薬として認められています。リチウムLiは、神経細胞内で「イノシトール三リン酸」と呼ばれる物質の生成を妨げ、カルシウムイオンCa2+ の遊離を抑えることで、神経細胞の興奮を鎮め、躁鬱病に効くと考えられています。
しかし、リチウム化合物は過剰摂取すると、腎臓障害や昏睡を経て、死に至る毒物でもあります。これは、リチウムイオンLi+ がナトリウムイオンNa+ やカリウムイオンK+ などと置換して、機能障害をもたらすためと考えられています。致死量と治療効果のある投与量が近いため、リチウム化合物を投与するときは、定期的に血中濃度を確認しながら、慎重に投与する方法が取られています。
(4) ナトリウム
(i) ナトリウムNa
「ナトリウム(sodium)」は、銀白色の軽い金属です。1807年、イギリスの化学者であるハンフリー・デービーが、水酸化ナトリウムNaOHの融解塩電解をすることで、初めてナトリウムNaの単体を遊離しました。反応性が非常に高く、単体のナトリウムNaの塊を水中に投げ込むと、急激に水素ガスが発生します。そして、数秒後には、その水素ガスが発火して大爆発が起こり、燃えるナトリウム片が四方八方に飛び散ります。このような映像は、世界中の動画サイトにアップロードされており、ナトリウムNaは、世界中の悪戯好きに好まれる金属でもあります。しかし、ナトリウムNaを扱うこの実験は、危険が伴う上に後処理も難しいため、くれぐれも真似はしないようにして下さい。
2Na + 2H2O → 2NaOH + H2

図.13 ナトリウムNaの塊を水中に投げ込むと大爆発が起こる
ナトリウムNaは、生体にとって重要な電解質の1つでもあります。ヒトでは、その大部分が細胞外液に分布しています。神経細胞や心筋細胞などの電気的興奮性細胞の興奮には、細胞内外のナトリウムイオンNa+ の濃度差が不可欠です。そのため、ヒトはナトリウムNa不足にならないように、塩化ナトリウムNaClを「塩味」として感知できるようになっています。運動をして汗をかいたあとに、塩味の強いものを食べたくなるのはこのためです。
塩化ナトリウムNaClの結晶は、天然では「岩塩」として存在しています。岩塩の多くは、海底が地殻変動のために隆起して、海水が地上に閉じ込められ、水分蒸発により塩分が濃縮し、結晶化したものです。一般的に岩塩は、無色または白色に近い淡い色をしていますが、産地によっては黄色から赤色のものがあります。こうした岩塩の結晶の色は、ミネラルや有機物の混入、または地層中で長期間に渡って放射線を受けることによって、結晶格子に歪が生じたことによる一種の構造色です。そのため、色素を含んでいる訳ではないので、有色の岩塩を水に溶かしても水溶液は無色なのです。

図.14 有色の岩塩を水に溶かしても無色である
アルカリ金属の塩化物としては、他のアルカリ金属も比較的似たような塩味がします。しかし、塩化ナトリウムNaClが一番おいしいです。減塩食塩として、よく塩化カリウムKClが使用されますが、塩化ナトリウムNaClと比べると苦味があって、あまりおいしくはありません。塩化ルビジウムRbClと塩化セシウムCsClは、塩味が薄くて金属味が強いです。塩化リチウムLiClは、舌が焼けるような感じのあとに、油っぽい金属味が口に残ります。
ちなみに、塩化ナトリウムNaClの半数致死量LD50値は3.5 g/kgです。これは、体重60 kgのヒトが210 gの塩化ナトリウムNaClを一度に摂取すると、半数が死に至るという意味です。戦時中、日本では病気になって徴兵を逃れようと、塩分を含む醤油を大量に飲んだ人が多くいたそうです。市販の醤油の標準的な塩分濃度は15〜17%で、密度は1.2 g/cm3ほどなので、ちょうど1 Lの醤油を一気に飲み干すと、半数致死量に達する計算になります。醤油を大量に飲んだ症例は少ないですが、日本では60歳の女性が12年間精神病で苦しんだ末、醤油を1 L飲んで自殺したという報告があります。

図.15 塩化カリウムKClが含まれている減塩食塩
純粋なナトリウムNaの単体は、化学工業で還元剤として大量に使われます。また、軽くて熱伝導率が良く、高温でも液体で存在するため、ナトリウムNaの単体は、「高速増殖炉」の冷却材として用いられます。高速増殖炉とは、高速の中性子を用いて、核分裂を起こさないウラン238をプルトニウム239に変換する装置です。決して、高速で増殖反応する訳ではありません。ただし、冷却材のナトリウムNaが漏れてしまうと、原子炉が暴走する危険性があります。アメリカ、イギリス、フランス、日本を始めとする各国とも、小さな事故の続発により、商業炉の稼働を断念した状態にあります。日本では、1995年に福井県敦賀市の「高速増殖炉もんじゅ」で、ナトリウムNa漏洩による火災事故が起こったことで話題になりました。

図.16 高速増殖炉もんじゅは、2016年に廃炉が正式決定された
ナトリウムNaの最も身近な利用例としては、黄色の光を出す「ナトリウムランプ」があります。高速道路のトンネル内で見られる黄色光は、ナトリウムランプによるものです。発光が長波長のため、霧や粉塵などの微粒子による光散乱を受けにくく、落下物の存在に気付きやすいという特徴があります。また、単位電力当たりの発光効率が、どんなランプよりも優れているため、排気ガスが残留しやすいトンネル内で、交換頻度の少ない経済的なランプとして用いられています。近年は排ガス規制で煙が少なくなり、白色LEDに切り替わりつつありますが、雪国ではあえて橙色LEDを使うケースもあります。

図.17 トンネル内に設置されたナトリウムランプ
(ii) 水酸化ナトリウムNaOH
水酸化ナトリウムNaOHは、「苛性ソーダ」とも呼ばれます。強塩基として一般的に広く用いられ、化学工業的に非常に重要な基礎原料の1つです。水酸化ナトリウムNaOHは、常温では無色半透明の固体です。「潮解性(deliquescence)」が強く、空気中に放置すると、徐々に吸湿して溶液状になります。実験室的には、強塩基として用いる他、潮解性を利用して、乾燥剤としての用途もあります。

図.18 水酸化ナトリウムNaOHの潮解性
工業的には、塩化ナトリウムNaCl水溶液の電気分解で製造されます(無機工業化学を参照)。次の化学反応式の係数比より、発生する塩素Cl2の2倍量が得られます。最近では、塩素Cl2の需要が多くなっており、水酸化ナトリウムNaOHの需要には限りがあるので、水酸化ナトリウムNaOHの生産量は過剰気味です。
2NaCl + 2H2O → 2NaOH + H2 + Cl2
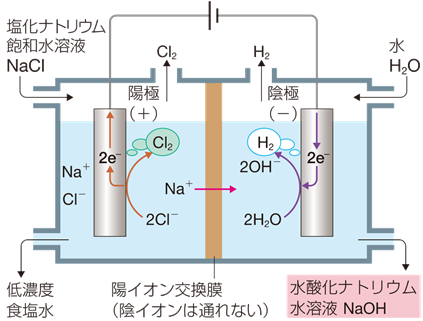
図.19 水酸化ナトリウムNaOHの工業的製法
強塩基は、タンパク質のペプチド結合を加水分解するので、タンパク質を腐食する作用を持ちます。したがって、水酸化ナトリウムNaOHが皮膚などに付着したまま放置すると、皮膚に火傷のような症状を起こします。水酸化ナトリウムNaOHの「苛性ソーダ」という別名は、この性質に由来する名称です。水酸化ナトリウムNaOHが皮膚などに付着した場合は、即座に流水で十分に洗い流さなければなりません。また、ナトリウムNaの単体を素手で触るのも危険です。これは、ナトリウムNaが手に付いている水分と反応して、水酸化ナトリウムNaOHに化学変化するためです。
2Na + 2H2O → 2NaOH + H2
(iii) 炭酸ナトリウムNa2CO3
炭酸ナトリウムNa2CO3は、「炭酸ソーダ」や「ソーダ灰」とも呼ばれる白色固体です。「ソーダ(soda)」というのは、もともと炭酸ナトリウムNa2CO3は植物を燃やして灰にすることで作られていたのですが、その際に燃やされた塩生植物がアラビア語で「suwaydāʔ」と呼ばれていたのが、「soda」の由来だという説があります。英語でナトリウムNaのことは「sodium」といいますが、これは1807年にナトリウムNaを単離したイギリスの化学者ハンフリー・デービーが、「soda」をもとに名付けたものです。つまり、ナトリウムNaの語源は、炭酸ナトリウムNa2CO3にあります。
水によく溶け、水溶液は加水分解により、pH=11程度の塩基性を示します。炭酸ナトリウムNa2CO3は、水酸化ナトリウムNaOHに二酸化炭素CO2を反応させるか、炭酸水素ナトリウムNaHCO3を加熱すると得られます。
CO32- + H2O ⇄ HCO3- + OH-
2NaOH + CO2 → Na2CO3 + H2O
2NaHCO3 → Na2CO3 + CO2 + H2O
工業的には、塩化ナトリウムNaClと炭酸カルシウムCaCO3から、「アンモニアソーダ法(ammonia soda process)」により製造されます(無機工業化学を参照)。1863年にベルギーの化学者であるエルネスト・ソルベーが考案して工業化したので、「ソルベー法」とも呼ばれます。工程中で発生する二酸化炭素CO2とアンモニアNH3を回収し、再利用している点が特徴です。
ただし、1938年に炭酸ナトリウムNa2CO3の大規模な天然鉱床(トロナ鉱)が米ワイオミング州グリーンリバーで発見され、炭酸ナトリウムNa2CO3を安価に得ることができる現在では、アンモニアソーダ法はかなり衰退しました。現在では、市場の大半が安価な天然品です。100円均一ショップやホームセンターで販売されている「セスキ炭酸ソーダ」はトロナ鉱を加工したもので、その成分は炭酸ナトリウムNa2CO3と炭酸水素ナトリウムNaHCO3の複塩Na2CO3・NaHCO3・2H2Oです。ワイオミング州の埋蔵量は1,000億tと推定され、これは人類が5万年使い続けられる量です。
2NaCl + CaCO3 → CaCl2 + Na2CO3
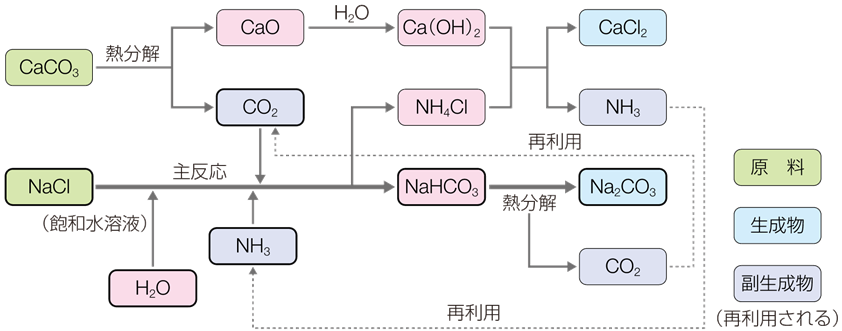
図.20 アンモニアソーダ法
炭酸ナトリウムNa2CO3水溶液を濃縮して水分を減らしていくと、無色の炭酸ナトリウム十水和物Na2CO3・10H2Oの結晶が析出します。このように、結晶中にある一定の割合で結合している水分子を、「水和水(hydrated water)」といいます。炭酸ナトリウム十水和物Na2CO3・10H2Oの結晶は、空気中で放置すると、水和水の大部分を失って、粉末状の炭酸ナトリウム一水和物Na2CO3・H2Oになります。このように、結晶が自然に水和水を失う現象を、「風解(efflorescence)」といいます。
Na2CO3・10H2O → Na2CO3・H2O + 9H2O
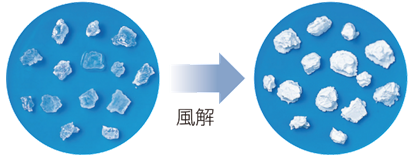
図.21 炭酸ナトリウム十水和物Na2CO3・10H2Oの風解
炭酸ナトリウム十水和物Na2CO3・10H2Oから無水物の炭酸ナトリウムNa2CO3を得るには、100℃で十水和物を加熱します。炭酸ナトリウムNa2CO3は熱に安定で、加熱しても容易には分解しません。炭酸ナトリウムNa2CO3は、ガラスやセッケンの製造原料として用いられる他、和紙や染料や医療工業品でも利用されています。
Na2CO3・10H2O → Na2CO3 + 10H2O
(iv) 炭酸水素ナトリウムNaHCO3
炭酸水素ナトリウムNaHCO3は、「重曹」あるいは「重炭酸ソーダ」と呼ばれる白色粉末です。名前に「重」と付くのは、炭酸ナトリウム十水和物Na2CO3・10H2Oよりも比重が大きいからです(炭酸水素ナトリウムNaHCO3の比重は2.20、炭酸ナトリウム十水和物Na2CO3・10H2Oの比重は1.46)。水への溶解度は、炭酸ナトリウムNa2CO3ほど大きくはなく、水に少し溶けて、加水分解によりpH=8程度の塩基性を示します。炭酸水素ナトリウムNaHCO3は、濃度にもよりますが、フェノールフタレイン(変色域のpH=8〜9.8)を加えても変色しない程度の弱い塩基性です。
HCO3- + H2O ⇄ H2CO3 + OH-
炭酸水素ナトリウムNaHCO3は、加熱したり強酸を加えたりすると、二酸化炭素CO2を発生します。試験管で炭酸水素ナトリウムNaHCO3の熱分解を行う場合は、次の図.22のように試験管の口をやや下に向けて加熱します。これは、生成した水H2Oが加熱部に流れて、試験管が割れることを防ぐためです。炭酸水素ナトリウムNaHCO3は、ベーキングパウダーや入浴剤として使われる他、医薬品として主に内服用胃腸薬にも利用されています。
2NaHCO3 → Na2CO3 + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2 + H2O

図.22 炭酸水素ナトリウムNaHCO3の熱分解
なお、炭酸飲料のことを「ソーダ」とか「ソーダ水」ということがあります。この名称には、炭酸水素ナトリウムNaHCO3が関係しています。炭酸水を作るのに、炭酸水素ナトリウム(重炭酸ソーダ)NaHCO3を使っていたことの名残です。昔は、炭酸水素ナトリウムNaHCO3にレモンの酸性成分であるクエン酸を反応させることで、二酸化炭素CO2を発生させていたのです。「重炭酸ソーダ」を溶かして作ったので、そこから炭酸水は「ソーダ」と呼ばれるようになり、それに味付けをした炭酸飲料も、同じ名前になったという訳です。
(5) カリウム
「カリウム(Potassium)」は、1807年にイギリスの化学者であるハンフリー・デービーにより、水酸化カリウムKOHの融解塩電解で初めて遊離された元素です。「植物の灰(ash)」を「鍋(pot)」で煮て得られる炭酸カリウムK2CO3は、古くから「ポタシュ(potash)」として知られており、これを元に命名されました。元素記号の方は、「アルカリ」の語源である「kali」の頭文字を取ったもので、アラビア語で「植物の灰」を意味する「al-qily」に由来します。植物の灰を「草木灰」といいますが、これを水で抽出すると炭酸カリウムK2CO3が得られます。炭酸カリウムK2CO3は、人類が長年使い続けてきた塩基です。古くから、油汚れが付いた衣服をこの水溶液で煮ると、けん化が起こって油汚れが落ちやすくなることが知られていました。19世紀後半にセッケンが本格的に普及するまでの約5000年の間、一般市民の主な洗浄剤として使用されていました。
アルカリ金属の反応性は、原子番号が大きくなるほど高くなります。これは、原子番号が大きいほどイオン化エネルギーが小さくなり、電子を失いやすくなるからです。そのため、カリウムKは、同族のリチウムLiやナトリウムNaよりも反応性が高いです。カリウムKは、電子を1個失ってカリウムイオンK+ になりやすく、自然界では単体の形で存在せず、イオンの形でのみ存在します。
カリウムイオンK+ が存在すると、固体の燃焼が促進されます。黒鉛の小片をガスバーナーで加熱しても、ほとんど燃える気配がありませんが、炭酸カリウムK2CO3などのカリウムイオンK+ を含む水溶液を塗って加熱すると、少しずつ燃えていきます。タバコの灰を塗った角砂糖がマッチの火で点火できるのも、カリウムイオンK+ のおかげです。木炭や石炭のような固体がよく燃えるのも、カリウムイオンK+ が含まれているからです。このような働きを「助燃触媒」といいます。マッチなどは一度水で濡らしてしまうと、カリウムイオンK+ が溶けてなくなり、燃えなくなります。

図.23 植物の灰は炭酸カリウムK2CO3を含み、助燃触媒として働く
工業原料としてのカリウム資源は、ほぼ塩化カリウムKClの形で採取されます。カリウムKは、植物の生長に必須の成分であり、主に根の発育と細胞内の浸透圧調整に重要な役割を果たしています。塩化カリウムKClの90%以上は、そのまま使われるか、もしくは硫酸カリウムK2SO4の形で、カリ肥料として用いられます。残りは各種の加工を経て、別の化合物として、食物添加物や火薬など、様々な用途に使用されます。また、カリウムKは、人体にとっても不可欠の電解質であり、脳および神経などにおけるニューロンの情報伝達に、ナトリウムNaと並んで重要な役割を果たしています。

図.24 カリウムKは、植物の生長に重要な役割を果たしている
質量数40の40Kは、不安定な「放射性同位体(radioactive isotope)」であり、放射線(γ線)を出します。天然カリウムの0.0117%、すなわち1万分の1は、この放射性カリウム40Kです。地球上のほとんどの物質は、わずかに放射性物質を含んでおり、私たちは日常的に放射線による内部被曝を受けています。そのうちのかなりの割合が、この微量に存在する40Kによるものです。例えば、体重50 kgの人の体内には、10 mgほどの40Kが含まれています。この40Kが、毎秒4,000本ほどのγ線を出しています。どれだけ気を付けていても、被曝する放射線量をゼロにすることはできません。
40Kの半減期は、およそ12.8億年もあります。40Kの誕生が60億年前だったとしても、当初の約1%がまだ残っているし、今後1万年で0.0005%しか減りません。40Kの放射線量は、地球誕生以来何十億年もかけて、徐々に減ってきました。アメリカの生化学者であるアイザック・アシモフは、ある時点での放射能レベルが、知的生命体の発展へと扉を開く鍵になったのではないかと考えています。初期の地球では、放射性同位体の40Kが多すぎて、傷付きやすい長いゲノムは、形成されにくい環境にありました。「長い年月が経って40Kが減ってくると、徐々に突然変異の出現確率が低くなり、最終的には高度な知的生命体に落ち着くだろう」というのが彼の説です。もちろん、これは純粋な理論上の考察ですが、放射線による大きな突然変異がなければ、今の人類は存在しなかったという考え方は、非常に興味深いです。

図.25 アイザック・アシモフは、SF作家としても知られており、その著作は500冊以上である
・参考文献
1) 遠藤瑞己「化学と歴史のネタ帳 I. 酸とアルカリ」文彩堂出版(2024年発行)
2) 大東孝司「プラグマティック化学」河合出版(2017年発行)
3) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
4) 桜井弘「元素118の新知識 引いて重宝、読んでおもしろい」講談社(2017年発行)
5) 左巻健男「面白くて眠れなくなる元素」PHP研究所 (2016年発行)
6) セオドア・グレイ「世界で一番美しい元素図巻」創元社(2011年発行)
7) 堂免一成「グリーン水素の製造法とその利用」化学と教育70巻9号(2022年)
8) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)