・有機反応機構(カルボニル基に対する求核付加反応)
【目次】
(1) カルボニル基
有機化学における最も重要な官能基は、一体何でしょうか?恐らく多くの有機化学者の答えは、「カルボニル基(carbonyl group)」で一致します。カルボニル基(-CO-)は、合成化学の要となる重要な官能基です。カルボニル化合物は、工業的にもまた生物学的過程においても、重要な役割を果たしているものが多いです。
図.1 カルボニル基
カルボニル基(-CO-)のようなC=O結合を持つ分子は、その分子内に複数の反応点を持っています。この多様さが、カルボニル化合物が合成化学に広く用いられる要因となっています。カルボニル基(-CO-)は、アルデヒドやケトン、カルボン酸、エステル、その他いくつもの種類の化合物中に存在しています。ここでは、カルボニル基(-CO-)に対する様々な有機反応を扱っていくつもりです。
カルボニル基(-CO-)のC=O結合は、σ結合1つとπ結合1つから構成されています。カルボニル基(-CO-)のπ結合は、隣り合った炭素原子と酸素原子の2p軌道が相互作用して形成されます。カルボニル基(-CO-)の炭素原子はsp2混成なので、カルボニル炭素に結合した3個の原子は120°の結合角を持ち、そのすべてが同一平面内に存在しています。また、酸素原子には、結合に関与していない非共有電子対が2組存在し、その軌道は、カルボニル炭素とそれに結合した原子3個が作る平面と同一平面に存在しています。したがって、カルボニル酸素も、カルボニル炭素と同様にsp2混成に近い電子状態であるということができます。カルボニル基(-CO-)のC=O結合の距離は0.124 nmであり、アルコールやエーテルのC-O結合距離(0.143 nm)に比べると、短くて強固です。
また、酸素原子は、炭素原子よりもはるかに電気陰性度が大きいです。したがって、C=O結合の電子は、電気的に陽性な炭素原子の近傍よりも、電気陰性度の大きい酸素原子の近傍に存在する確率が高いです。この電子の偏りは、カルボニル化合物が非常に極性の高い化合物であることの要因となっています。共鳴の概念を用いると、このような極性の効果は、π電子に対して顕著に表れ、次の図.2のように表すことができます。この図から、カルボニル炭素がルイス酸性を示すことが分かります。
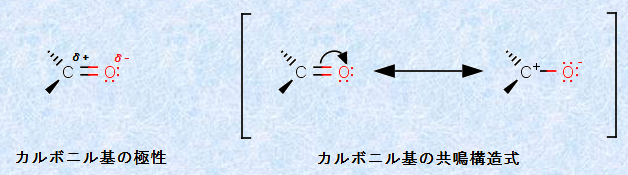
図.2 カルボニル基(-CO-)の極性と共鳴構造式
カルボニル炭素は、このようにルイス酸性を示すので、カルボニル化合物の有機反応では、カルボニル炭素上へ求核攻撃が起こり、そのあと負電荷を帯びた酸素へ、プロトン付加が起こるタイプの有機反応が数多く知られています。
さらに、カルボニル基(-CO-)のC=O結合の極性は、反応性に対して大きな効果を現すだけでなく、カルボニル化合物の物理的な性質にも大きな影響を及ぼしています。例えば、カルボニル化合物は、同程度の分子量を持つ脂肪族炭化水素と比べて高い沸点を持ちますが、対応するアルコールよりは沸点が低いです。
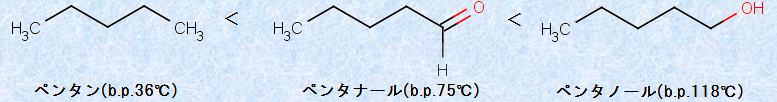
図.3 有機化合物の沸点
有機化合物の沸点がこのような順になるのは、脂肪族炭化水素が一時的にしか分極できないのに対して、カルボニル化合物は永久分極しているC=O結合を持ち、より強く引き合って会合する性質があるからです。このようなカルボニル化合物で見られるファンデルワールス力は、特に「双極子相互作用」と呼ばれます。この双極子相互作用は、無極性分子同士に働くファンデルワールス力の大部分を占める「ロンドン分散力」より強いものの、「水素結合」ほど強くありません。したがって、カルボニル化合物は、双極子相互作用により、脂肪族炭化水素のような無極性分子よりも強く引き合いますが、アルコールとは異なり水素結合ができないので、沸点の順序は、脂肪族炭化水素<カルボニル化合物<アルコールとなるのです(化学結合を参照)。
また、カルボニル基(-CO-)の極性は、アルデヒドやケトンの溶解性にも影響を与えます。例えば、低分子量の炭化水素部分の割合が小さいカルボニル化合物は、水溶性で水によく溶けます。この理由は、カルボニル化合物同士では、水素結合を形成できませんが、OHまたはNH結合を持つ他の化合物とは、水素結合を形成できるからです。カルボニル基(-CO-)のような親水基1個あたりに3個の炭素までぐらいなら、一般的に水に溶ける力の方が強いです。
表.1 主なアルデヒドやケトンの物理的性質
|
化学式 |
名称 |
沸点(℃) |
融点(℃) |
密度(g/mL) |
|
HCHO |
ホルムアルデヒド |
-21 |
-92 |
0.815 |
|
CH3CHO |
アセトアルデヒド |
20.8 |
-121 |
0.783 |
|
C6H5CHO |
ベンズアルデヒド |
178.6 |
-26 |
1.04 |
|
CH3COCH3 |
アセトン |
56.2 |
-95.4 |
0.789 |
|
CH3COC2H5 |
ブタノン |
79.6 |
-86.3 |
0.805 |
|
C6H10O |
シクロヘキサノン |
155.6 |
-16.4 |
0.948 |
|
C6H5COCH3 |
アセトフェノン |
202.6 |
20.5 |
1.03 |
|
C6H5COC6H5 |
ベンゾフェノン |
305.9 |
48.1 |
1.15 |
(2) カルボニル基(-CO-)に対する求核付加反応
カルボニル基(-CO-)において、炭素原子は部分的に正電荷を帯びているので、電子豊富な求核剤は、この炭素原子を攻撃します。その結果、C=O結合のπ電子は酸素原子上に移動し、酸素原子は形式負電荷を帯びることになります。これらの反応を、水H2Oやアルコールなどのヒドロキシ基(-OH)を持った溶媒中で行えば、通常この負電荷にプロトンH+ が付加して、反応が完結します。反応全体で見れば、カルボニル基(-CO-)のπ結合に、求核剤とプロトンH+ が付加したことになります。このような反応を、「求核付加反応(nucleophilic addition)」といいます。
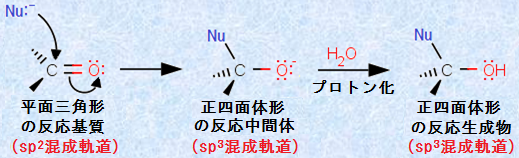
図.4 カルボニル基(-CO-)に対する求核付加反応
アルデヒドやケトンのカルボニル炭素は、平面三角形でsp2混成ですが、反応中間体や反応生成物では、正四面体形でsp3混成となります。また、カルボニル酸素は非共有電子対を持つので、弱いルイス塩基の性質を持ち、プロトンH+ を受け取ることができます。したがって、酸を用いてカルボニル酸素へプロトンH+ を付加することにより、「弱い求核剤がカルボニル化合物へ付加する反応」を触媒することができます。
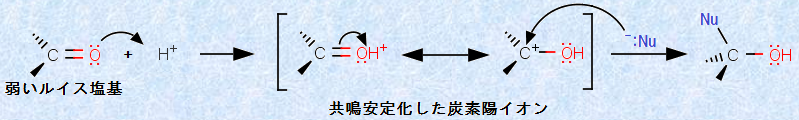
図.5 酸を用いた求核付加反応
つまり、プロトンH+ の付加により、カルボニル化合物は炭素陽イオンに変換され、カルボニル炭素のルイス酸性が強くなるので、求核剤の攻撃を受けやすくなるのです。また、カルボニル基(-CO-)に対する求核付加反応は、酸性条件下だけでなく、塩基性条件下でも進行します。ここでは、求核剤が水酸化物イオンOH- やアルコキシドイオンRO- などの強塩基であり、これらの不安定な活性種は強力な求核剤となって、カルボニル炭素を求核攻撃します。すなわち、カルボニル基(-CO-)に対する求核付加反応には、「酸性条件下でルイス酸であるカルボニル化合物を強くする方法」と、「塩基性条件下で強力な求核剤を用いる方法」の2つがあるのです。したがって、カルボニル化合物の求核付加反応を見るときは、反応溶媒の液性にも、十分な注意を払う必要があります。
表.2 液性の違いにおける求核付加反応の比較
|
|
酸性 |
塩基性 |
|
求核剤 |
弱い求核剤でも反応 |
強い求核剤が必要 |
|
脱水反応 |
脱水反応が起こりやすい |
脱水反応は起こりにくい |
さらに、カルボニル化合物の反応性については、一般的にケトンよりもアルデヒドの方が、求核剤に対する反応性が高いです。この反応性の差は、主に次の2つの理由によります。まずは立体的な理由です。アルキル基を2つ持つケトンのカルボニル炭素は、アルデヒドのカルボニル炭素よりも、かなり立体的に混み合っています。そこへ求核付加反応が起こると、これらの置換基は、互いにさらに接近することになります。これは、反応中間体を経由するときに、カルボニル炭素の混成がsp2からsp3へと変化して、結合角が120°から109.5°に減少するからです(図.4を参照)。置換基の1つが小さな水素原子であるアルデヒドへの付加の方が、ケトンよりも生じる歪みが少なくて有利なのです。
そして、もう1つは電子的な理由です。基本的にアルキル基は水素よりも電子供与的な置換基であり、カルボニル化合物では、アルキル基が炭素上の部分正電荷を中和することにより、求核剤に対する反応性が減少してしまうのです。ケトンにはこのようなアルキル基が2つあり、アルデヒドには1つだけあります。したがって、カルボニル化合物の求核剤に対する反応性は、ケトン<アルデヒドの順となるのです。また、置換基がハロゲンのような強い電子吸引基である場合は、逆の効果が働き、求核剤に対するカルボニル化合物の反応性は増大します。
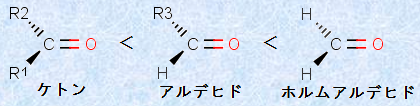
図.6 カルボニル化合物の求核剤に対する反応性
(i) アルコールの付加(アセタール化)
アルコールは酸素系の求核剤であり、酸性条件下あるいは塩基性条件下で、カルボニル基(-CO-)に付加して、「ヘミアセタール(hemiacetal)」を与えます。この反応は、酸性条件下では少し複雑になりますが、塩基性条件下では比較的単純です。次の図.7に、塩基性条件下における「ヘミアセタール生成反応」を示します。
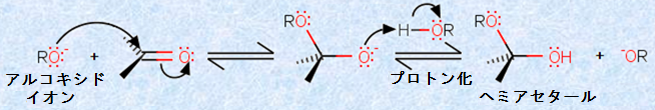
図.7 塩基性条件下におけるヘミアセタール生成反応
塩基性条件下では、強力な求核剤であるアルコキシドイオンRO- が、ルイス酸性のカルボニル炭素を攻撃します。この反応は、連続する平衡反応により成り立っており、通常は、ヘミアセタールの生成が不安定で、平衡状態では不利です。しかし、強い電子吸引性基を持つカルボニル化合物をアルコール溶媒に溶解した場合には、ヘミアセタールが安定に生成することがあります。
さて、酸性条件下では、どのようにしてヘミアセタールが生成するのでしょうか?酸性条件下では、比較的弱い求核剤であるアルコールが、カルボニル炭素を攻撃するので、反応を加速するために酸触媒が通常必要となります。次の図.8に、酸性条件下における「ヘミアセタール生成反応」を示します。
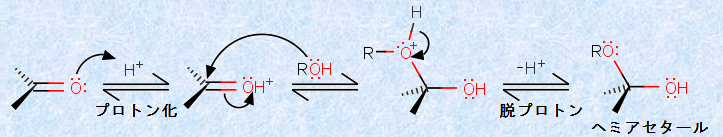
図.8 酸性条件下におけるヘミアセタール生成反応
酸性条件下では、まずカルボニル酸素が、酸触媒によりプロトン化されます。これによって、共鳴安定化した炭素陽イオンが生じるので、カルボニル化合物のルイス酸性が強くなり、比較的弱い求核剤であるアルコールでも、カルボニル炭素を攻撃することができるようになります。アルコールが求核付加すると、アルコールの酸素原子上に新たに正電荷が生じますが、引き続いて、この酸素からプロトンH+ が脱離します。このような複雑なプロセスによって、ヘミアセタールが生成するのです。ちなみに、反応の各段階は可逆的であり、触媒であるプロトンH+ も、反応の前後で増えたり減ったりしていないことが分かると思います。
さらに、酸性条件下では、塩基性条件下とは異なり、過剰のアルコールが存在すると、第二のアルコール付加が起こります。すなわち、ヘミアセタールのヒドロキシ基(-OH)が、もう1つのアルコキシ基(-OR)で置換されるのです。このように生成した物質は、「アセタール(acetal)」と呼ばれます。次の図.9に、酸性条件下における「アセタール生成反応」を示しました。図.9からも分るように、アセタールは同一炭素上に、2つのエーテル官能基を持っています。
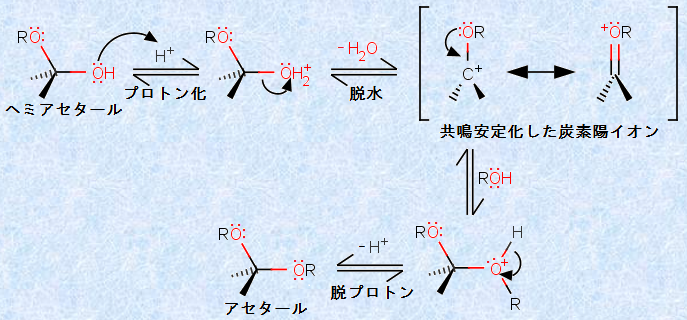
図.9 酸性条件下におけるアセタール生成反応
酸性溶液中でヘミアセタールが生成すると、ヘミアセタールの2つの酸素(-OR, -OH)のどちらか一方がプロトン化されます。ORの酸素原子がプロトン化された場合は、図.8の逆反応が起こります。すなわち、ヘミアセタールが、出発反応物であるカルボニル化合物に戻ってしまいます。先にも述べたように、この反応は可逆的なので、当然ながら、生成物が反応物に戻る流れもあるのです。しかし、ORではなく、新しく生じたOHがプロトン化された場合はどうなるでしょうか?この場合は、水H2Oが脱離して、共鳴安定化した炭素陽イオンとなります。そして、この炭素陽イオンに第二のアルコールが求核付加して、プロトンH+ が脱離すると、アセタールが生成するのです。
酸性条件下において、アセタールの生成は、一連の平衡を含む可逆反応です。これらの反応は、どのようにして進行させられるでしょうか?過剰のアルコールを用いるのも1つの方法です。反応物のどちらか一方が過多であれば、ル・シャトリエの法則より、平衡を正反応側に移動させることができます。もう1つの方法は、正反応の生成物である水H2Oを、できるだけ除去することです。アセタール生成の逆反応(アセタールの加水分解)は、水H2Oがなければ進行できません。アセタールの合成において、アルコールが高価で大量に使うことができない場合もありえますし、特に実験室では、生成物の収率を上げるために、水H2Oを除去する操作がよく行われます。反応溶媒に水H2Oを吸着する「モレキュラーシーブス」などの乾燥剤を加えておけば、水H2Oを反応系から除去してくれます。また、反応混合物から水H2Oを蒸留するのも、1つの方法です。
(ii) 水の付加(水和反応)
水H2Oは、アルコールと同様に酸素系の求核剤であり、アルデヒドやケトンに可逆的に付加できます。例えば、ホルムアルデヒドHCHOは、水溶液中で主として、水和物で存在しています。
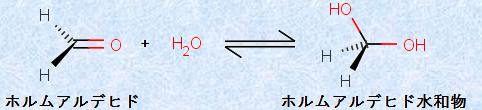
図.10 ホルムアルデヒドHCHOの水和反応(K=2.3×103)
しかし、他のアルデヒドやケトンでは、ほとんどの水和物が不安定であり、容易に水H2Oを失って、カルボニル化合物を再生します。生成物である水和物の炭素原子は、sp3混成に近い電子状態です。そのため、その構造は大変混み合っており、アルキル基の数が増すほど、立体的に不安定になるのです。
この反応は、酸性や塩基性あるいは中性のいずれの条件下でも起こります。酸性条件下では、カルボニル酸素のプロトン化により、強力なルイス酸を生成して反応が加速され、次に比較的弱い求核剤である水H2Oが付加します。塩基性条件下では、強力な求核剤である水酸化物イオンOH- が、比較的弱いルイス酸であるカルボニル基(-CO-)に付加します。
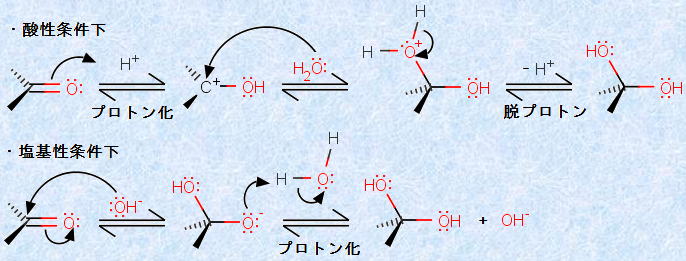
図.11 カルボニル基(-CO-)の水和反応
(iii) シアン化水素の付加
シアン化水素HCNは、カルボニル基(-CO-)に可逆的に付加して、1つの炭素上にヒドロキシ基(-OH)とシアノ基(-C≡N)が結合した構造を持つ「シアノヒドリン(cyanohydrin)」を生成します。次の図.12に、「シアノヒドリン」の生成反応を示します。この反応は、通常は塩基触媒反応です。
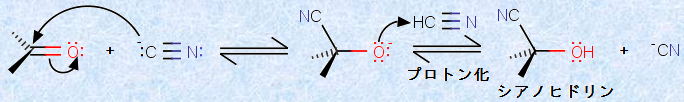
図.12 シアノヒドリンの生成反応
シアン化水素HCNは、その炭素上に非共有電子対を持たないので、そのままでは炭素系の求核剤として働くことができません。しかし、塩基を少量作用させることにより、シアン化水素HCNはある程度シアン化物イオンCN- に変換され、炭素系の求核剤として反応することになります。シアン化物イオンCN- は優れた求核剤であり、ルイス酸性のカルボニル炭素を攻撃して、アルコキシドイオンRO- を生じます。このアルコキシドイオンRO- は、シアン化水素HCNによりプロトン化され、最終生成物であるシアノヒドリンを与えます。
また、シアン化水素HCNは、揮発性の有毒ガスで扱いにくいため、一般的にはシアノヒドリンの合成で、シアン化カリウムKCNが使われることも多いです。シアン化カリウムKCNも確かに有毒ではありますが、少なくとも塩基性条件が維持されている限り揮発しないことは、皆が知っていることでしょう。
(iv) 第一級アミンの付加
第一級アミンRNH2の窒素原子は、非共有電子対を持ち、カルボニル炭素に対して、窒素系の求核剤として働きます。例えば、カルボニル化合物と第一級アミンを酸触媒下で反応させると、次の図.13のように反応します。
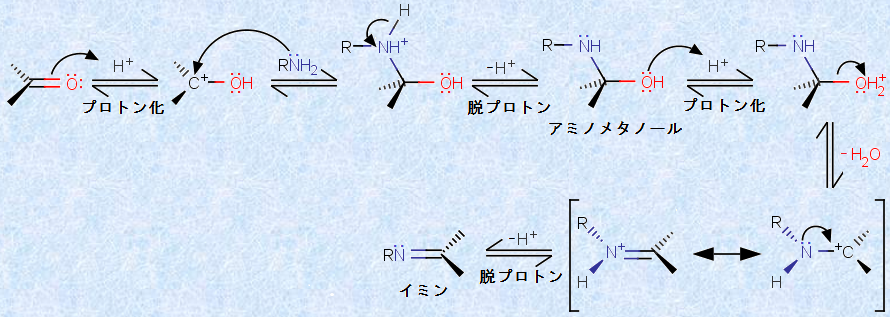
図.13 イミンの生成反応
初めに生成する「アミノメタノール(aminomethanol)」は正四面体形であり、ヘミアセタールに似ていますが、ヘミアセタールの2つの酸素のうち1つが、NH基で置き換わった構造です。通常アミノメタノールは安定ではなく、すぐに水H2Oを脱離して、C=N結合を持つ化合物を生成します。第一級アミンとの反応生成物は、「シッフ塩基(Schiff base)」あるいは「イミン(imine)」と呼ばれます。
イミンは、カルボニル化合物に似ていますが、酸素がNRで置き換わった構造をしています。イミンには、第一級アミンから誘導された様々な物質が知られており、それぞれに個別の名前が付いています。その多くは固体であり、融点測定によって簡単に同定ができるので、かつては分析化学の分野で有用な化合物でした。また、イミンはある種の生化学反応において重要な中間体であり、たいていの酵素に存在する遊離のアミノ基(-NH2)とカルボニル化合物を結合するために特に重要です。
(v) グリニャール試薬の付加
「グリニャール試薬(Grignard reagent, R-MgX)」は、カルボニル化合物に対して、炭素系の求核剤として作用する物質です。グリニャール試薬には、遊離の炭素陰イオンは存在していませんが、あたかもそれが存在しているかのように振る舞います。グリニャール反応では、グリニャール試薬のR基が、カルボニル炭素に対して非可逆的に付加し、新しいC-C結合を形成します。生成物である金属アルコキシドは、グリニャール試薬よりはるかに弱い塩基であるから、酸塩基反応の考え方では、グリニャール試薬の付加反応は有利な反応です。次の図.14に、グリニャール試薬とカルボニル化合物の反応を示します。反応全体では、生成した金属アルコキシドは、プロトン化されてアルコールになります。
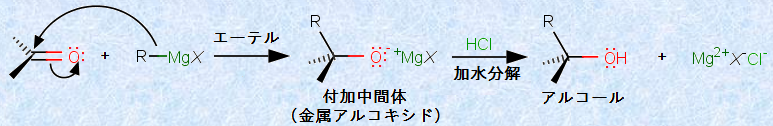
図.14 グリニャール試薬とカルボニル化合物の反応
この反応は、アルデヒドまたはケトンの無水エーテル溶液を、ゆっくりとグリニャール試薬のエーテル溶液に加える手順で行われます。無水エーテルを用いる理由は、グリニャール試薬は湿気に大変弱いためです。湿気があると、グリニャール試薬は水H2Oと直ちに反応して、炭化水素を生じさせます。
R-MgX + H-OH → R-H + HO-MgX
この反応も、炭化水素を得る方法として有用ではありますが、反応性の高いグリニャール試薬が潰れてしまうので、避けるべき反応です。そのため、溶媒で用いるエーテルは、水H2Oなどのブレンステッド酸として働く物質をできるだけ含まず、厳密に乾燥されたものでなければなりません。
また、グリニャード試薬は、マグネシウム箔をハロゲン化アルキルのエーテル溶液中で撹拌することで得られますが、そのときに溶媒のエーテルは、非常に重要な役割を果たしています。すなわち、エーテルの酸素原子上の非共有電子対が、試薬のマグネシウムMgに配位して、これを安定化しているのです。グリニャール試薬の調製には、溶媒としてジエチルエーテルの他に、テトラヒドロフラン(THF)もよく使用されます。
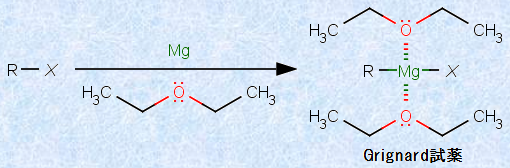
図.15 グリニャール試薬の調製
さて、図.14のグリニャール試薬とカルボニル化合物の反応では、カルボニル化合物をすべて加え終わり、グリニャール試薬の付加反応が終結してから、生成したマグネシウムアルコキシドを酸性水溶液で加水分解します。すると、アルコキシドがプロトン化され、グリニャール試薬のR基が増えたアルコールを得ることができるのです。
この反応は、アルコールの合成法として非常に有用な反応であり、カルボニル化合物の選び方次第で、生成するアルコールのタイプが決まります。例えば、ホルムアルデヒドHCHOからは、第一級アルコールが生成します。他のアルデヒドからは、第二級アルコールを生成します。アルデヒドでは、2つのR基の関係によって、2種類の合成方法が可能です。グリニャール試薬のR基は、アルデヒドのR基と同じであっても違っていても問題ありません。また、グリニャール試薬は、ケトンとも反応して、第三級アルコールを生成します。ケトンの場合も、R基が何種類あるかという違いによって、3種類の異なった合成方法が可能です。どの組み合わせが最適であるかは、原料の入手しやすさや値段で決めたり、反応物の反応性などの化学的な理由で決めたりすることもあります。
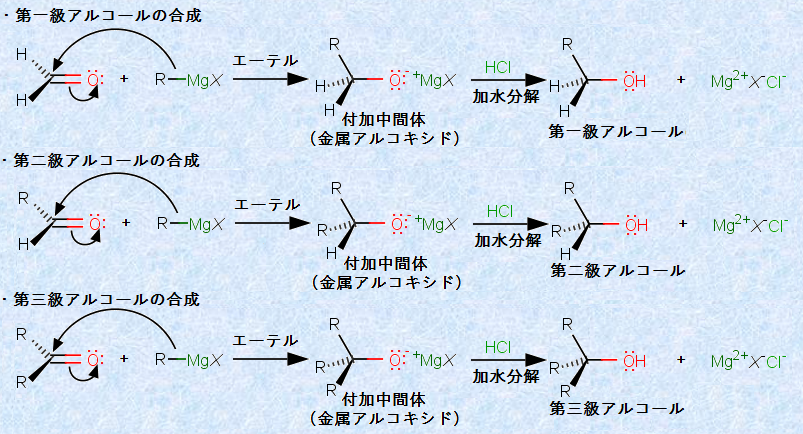
図.16 グリニャール試薬を用いたアルコールの合成
(vi) カルボニル化合物の還元反応
アルデヒドおよびケトンは容易に還元されて、それぞれ第一級および第二級アルコールになります。この還元には、いろいろな方法がありますが、金属水素化物を用いる方法が、最も一般的に知られています。金属水素化物のうちで、カルボニル化合物の還元に最もよく用いられるものは、「水素化アルミニウムリチウムLiAlH4」と「水素化ホウ素ナトリウムNaBH4」です。
特に水素化アルミニウムリチウムLiAlH4を用いた還元は、その頭文字を取って、「LAH還元(LAH reduction)」と呼ばれます。その還元力についても、水素化アルミニウムリチウムLiAlH4の方が、水素化ホウ素ナトリウムNaBH4よりもはるかに強力です。金属-水素結合は、電気陰性度の関係から、金属原子が正に、水素原子が負に分極しています。つまり、還元反応では、水素化物イオン(ヒドリドイオン)H- が、ルイス酸性のカルボニル炭素を非可逆的に求核攻撃するのです。
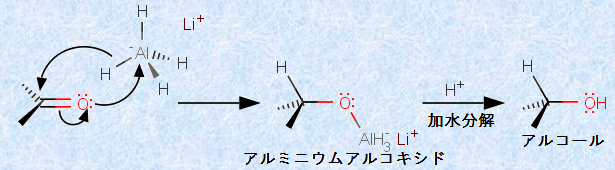
図.17 カルボニル化合物のLAH還元
この還元反応では、ヒドリドイオンH- がカルボニル炭素に求核攻撃して、まずはアルミニウムアルコキシドが生成します。そして、このアルミニウムアルコキシドが、水H2Oや酸により加水分解されて、アルコールになるのです。反応全体では、水素分子がC=O結合に付加した形になります。カルボニル化合物のLAH還元では、グリニャール反応と違って、炭素骨格が保存されているので、カルボニル化合物と同じ炭素数のアルコールを得ることができます。なお、金属水素化物も、グリニャール試薬と同じように湿気と激しく反応するので、常に湿気を遮断して、保存しなければなりません。
LiAlH4 + H2O → H2 + Li[Al(OH)H3]
(vii) カルボニル化合物の酸化反応
アルデヒドは、ケトンよりも容易に酸化されます。すなわち、アルデヒドは還元性を持つのです。アルデヒドは酸化されると、同じ炭素数のカルボン酸になります。この酸化反応は容易に起こり、過マンガン酸カリウムKMnO4や酸化クロム(VI) CrO3、酸化銀(I) Ag2O、および過酸化水素H2O2など、数多くの酸化剤がこの目的に使用できます。アルデヒドは、空気中の酸素O2によっても酸化されやすいので、保存していたアルデヒドには、対応するカルボン酸が少量含まれていることが多いです。具体的な例を、次の図.18に示します。
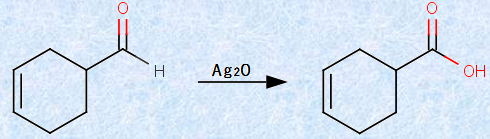
図.18 カルボニル化合物の酸化反応
酸化剤として、銀(I)イオンAg+ を使用するのはあまり経済的ではありませんが、これには二重結合を酸化せずに、アルデヒド基(-CHO)のみを選択的に酸化するという利点があります。また、アルデヒドとケトンを区別する実験室的試験法は、銀(I)イオンAg+ を用いて、両者の酸化されやすさの差を利用するというものです。アルデヒドのカルボニル基(-CO-)は酸化されやすく、ケトンのカルボニル基(-CO-)は酸化されにくいです。トレンスの「銀鏡反応(silver mirror reaction)」では、ジアンミン銀(I)イオン[Ag(NH3)2]+ がアルデヒドにより還元されて、金属銀となる反応を利用しています。この反応式は、次のように書けます。
RCHO + H2O + 2[Ag(NH3)2]+ → 2Ag + RCOO- + NH3 + 3NH4+
この試験を行うときに、清浄なガラス容器を使用すると、金属銀がガラス表面に沈着して、綺麗な鏡を作ります。この反応は、工業的にも銀メッキの手法として利用されており、アルデヒドとしては、安価なホルムアルデヒドHCHOが使用されます(カルボニル化合物(アルデヒドとケトン)を参照)。
・参考文献
1) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
2) メートランド・ジョーンズ「ジョーンズ有機化学(下)」東京化学同人(2000年発行)