・無機工業化学
【目次】
(1) アンモニアNH3の生産
19世紀後半まで、火薬や肥料などの原料として、硝酸カリウムKNO3や硝酸ナトリウムNaNO3などの硝酸塩は重要な鉱物でした。アンモニアNH3などの窒素化合物が、自然界に存在する硝化菌によって硝酸イオンNO3− に変化し、それが土中の金属イオンと結合して硝酸塩となります。しかし、一般に硝酸塩は水溶性なので、雨が降ると流れてしまったり、土中深くに潜り込んでしまったりします。また、栄養素として植物にも吸収されます。このため、雨の降る場所や植物の生えているところには、硝酸塩はごくわずかしか存在しません。コウモリの大群が棲む洞窟や海鳥の繁殖地となっている離島など、動物の糞尿が長年堆積した場所には、自然界でも豊富に硝酸塩が存在していることが知られています。

図.1 海鳥やコウモリなどの糞が長期間堆積して化石化したものを「グアノ」といい、硝酸塩が豊富に含まれる
1820年、チリの北部に位置するアタカマ砂漠で、天然の窒素を含むチリ硝石(主成分は硝酸ナトリウムNaNO3)の大鉱床が発見されます。世界で最も降水量の少ない地域として知られるアタカマ砂漠には、普通なら雨水に溶けて流れ去ってしまうような硝酸ナトリウムNaNO3が、豊富に堆積していたのです。当時、アタカマ砂漠だけで、世界中で使用される天然肥料の6割以上をまかなっていました。アタカマ砂漠のあるチリの他にも、硝酸塩の主要な産地であったチリやペルー、エクアドル、ナウルなどの国は、貿易によって莫大な富を得ました。しかし、硝石資源の枯渇も予測されるようになったことから、1898年にイギリスの化学者であるウィリアム・クルックスは、チリ硝石が枯渇する前に肥料問題を解決し、人口増加による食糧危機を乗り切る努力をすべきことを世間に訴えました。
19世紀後半になると、科学と医学の進歩により、世界の人口は、作物生産量を上回るペースで増えるようになっていました。クルックスの弁によれば、「文明国家の人々が大量餓死する時代」が間近に迫っていました。チリにおける硝石生産は1930年代をピークに衰退し、すでに斜陽を迎えていました。解決策は、人工的に合成された窒素肥料を生産することです。注目されたのは、空気中に大量に存在する窒素ガスN2です。この窒素N2を窒素化合物として固定し、土で使えるような化合物に変える方法が必要とされていました。マメ科の植物や雷による窒素固定だけでは足りません。「人類を救うのは化学者である。食糧問題は研究所で解決できる」とクルックスは言いました。空気中の窒素N2を固定するためには、アンモニアNH3の人工合成が不可欠です。クルックスの演説は「食糧問題」としてヨーロッパ各国で報道され、そこから様々なアンモニアNH3の人工合成が模索されるようになりました。

図.2 クルックスは英国科学アカデミーである王立協会の会長を務め、化学と物理学の両分野で活躍した科学者である
アンモニアNH3が、窒素Nと水素Hの化合物であることが発見されたのは、18世紀末のことです。その頃には、触媒下でのアンモニアNH3の分解と合成の実験に基づいて、アンモニアNH3の分解反応が、可逆反応であることが見出されていました。もしアンモニアNH3の分解が可逆反応であれば、窒素N2と水素H2から、原理的にはアンモニアNH3の合成ができるはずです。多くの化学者によって、アンモニアNH3の合成法が研究され、検討されるようになりました。
N2(気) + 3H2(気) ⇄ 2NH3(気) ΔH =−92 kJ
この平衡反応において、平衡状態でのアンモニアNH3の生成量を多くするには、正反応が進む右向きに平衡が移動すれば良い訳です。正反応は発熱反応(ΔH<0)なので、温度が低いほど正反応が進んで平衡が移動します。また、正反応は総物質量が減る反応なので、圧力が高いほど正反応が進んで平衡が移動します。したがって、化学平衡の面から見れば、アンモニアNH3合成は「低温高圧」の条件にすることが望ましいです。次の図.3に、窒素N2と水素H2を1:3の比率で混合して、温度と圧力を変化させて、平衡状態にしたときのアンモニアNH3の割合を示します。
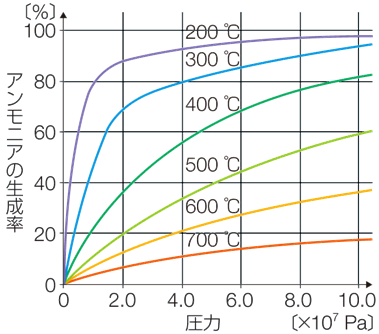
図.3 平衡状態でのアンモニアNH3の割合
ところが、工業的に反応を行う場合は、目的の物質を効率よく大量生産する必要があるため、平衡定数の他に、反応速度や反応装置の強度などが重要になってきます。平衡定数を大きくするために、あまりに低温にすると、触媒を用いたとしても反応速度が小さくなり、平衡状態に達するのに時間がかかり過ぎるので、生産効率が逆に悪くなります。そのため、アンモニアNH3の合成では、反応温度はある程度の高温にせざるをえないのです。しかしながら、反応速度を大きくするために、あまりに高温にすると、反応装置の強度や耐久性、安全性などに問題が生じてきます。一体どのような条件にすれば良いのでしょうか?
多くの化学者が、高温下においてアンモニアNH3の生成率が低いという、平衡論的立場から工業的応用を断念する中、ここで名乗りを挙げたのが、ドイツの物理化学者であるフリッツ・ハーバーでした。ハーバーは、1868年にシレジアのブレスラウ(現ポーランド領ヴロツワフ)でユダヤ人の家系に生まれ、1894年に25歳でカールスルーエ大学の助手、1906年に37歳で正教授に昇格したばかりでした。これは、当時としてはかなり遅い出世です。恐らくは、ユダヤ人に対する人種差別の影響もあったのでしょう。当時は、キリスト教徒以外が大学の研究職に就くことが許されていなかったので、ハーバーはそのために、ユダヤ教徒からキリスト教徒へと改宗していました。才気とエネルギーに溢れたハーバーは、飽くまでアンモニアNH3合成の可能性を信じて研究を進め、遂には実験的に一応の成功を収めました。

図.4 ハーバーは改宗することによって、形式的にでもドイツ人の一員になろうとしたのである
ハーバーの最初の特許(1908年)によれば、貴金属であるオスミウムOsを触媒に用いて、窒素N2と水素H2を100〜200 atm、650〜700℃で反応させて、アンモニアNH3の生成率2 vol%を得ています。この合成法は、生成したアンモニアNH3を水H2Oなどの吸収剤で除去したあと、未反応ガスに原料ガスを補給して、再循環させるというものでした。アンモニアNH3合成における「混合ガスの循環」という考え方が打ち出された、最初のものでもありました。アンモニアNH3合成の成功により、ハーバーの知名度は、著しく上昇しました。ハーバーの元には、国内外から多くの学生が集まり、ハーバーを呼び寄せようとする大学や企業からの誘いも多くありました。そして1912年には、ハーバーはベルリンに新設されるカイザー・ヴィルヘルム研究所に、初代所長として就任しました。この研究所は、政府による資金のみで運営される基礎科学研究所という、ドイツにはそれまでなかった研究所の先駆けでした。
一方で、ドイツの総合化学メーカーのBASF社の工学者であるカール・ボッシュは、この合成法の持つ工業的意義と重要性を深く認識し、1908年からハーバーと共同で研究を進めていました。しかし、ハーバーが実験的に成功させていた合成法を工業的に運用するためには、数百気圧の高圧に耐える化学装置を作る必要がありました。この時代の化学装置は、せいぜい数十気圧が限度で、数百気圧は未知の領域と考えられていました。周囲は無謀だと反対する中、ボッシュは遂に、当時技術的に困難とされていた高温高圧条件(200 atm、600℃)の化学装置を工業的に実現させました。また、触媒の研究においても、小型の反応装置を数十台並べて同時に実験することで、短期間で2,500種もの触媒を試しました。そして、ハーバーが見出した高価なオスミウムOsの触媒の代わりに、鉄Feを主体とした安価な触媒(K2O-Fe3O4/Al2O3)の開発に成功しました。

図.5 ボッシュは、反応装置の大型化や新触媒の発見に取り組み、アンモニアNH3の大量生産を実現させようとした
ボッシュが開発した触媒は、四酸化三鉄Fe3O4が活性の主成分です。酸化アルミニウムAl2O3は四酸化三鉄Fe3O4の高分散と凝集防止をするための担体、酸化カリウムK2Oは四酸化三鉄Fe3O4の活性を高める助触媒として機能します(これを二重促進鉄触媒といいます)。100年以上経った今でも、触媒の基本組成は変わっておらず、現在でもこの方法がアンモニアNH3合成の主力として、世界中で稼働している事実は驚異的です。そのため、このようなアンモニアNH3の工業的製法は、開発した2人の名を取って、「ハーバー・ボッシュ法(Haber-Bosch process)」と呼ばれています。この結果に至るまでに、彼らはなんと、2万回以上の実験を繰り返したといわれています。
N2 + 3H2 → 2NH3 ΔH =−92 kJ
1912年、BASF社でハーバー・ボッシュ法が実用化されたことにより、世界各国でアンモニアNH3合成法に関する研究が、活発に推進されました。ハーバーによる一連の実験結果は、7つの論文として、1914年から1915年にかけて専門誌に発表され、アンモニアNH3合成を行うための重要な基礎データとなりました。反応条件や触媒の検討が行われ、現在では、窒素N2と水素H2を200〜1,000 atm、400〜500℃の条件で反応させて、合成が行われています。触媒には、四酸化三鉄Fe3O4を主成分とする物質が用いられ、水素H2によって還元され生じた鉄Feが、窒素N2や水素H2を表面に吸着することで、触媒作用を示します。具体的には、窒素N2と水素H2が触媒表面上で原子状態(HadおよびNad)になり、これらが触媒表面上で順次結合し、アンモニアNH3となって触媒表面から離脱するものと考えられています。
2[Fe]Nad + 3[Fe]Had ⇄ 2[Fe]NH3
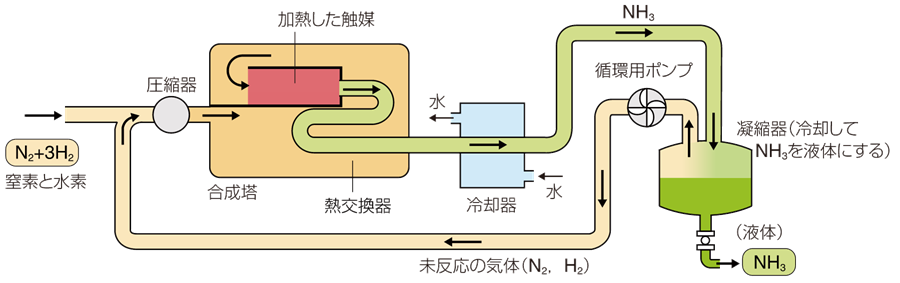
図.6 ハーバー・ボッシュ法
このハーバー・ボッシュ法は、化学工業史上最高の成功例といわれています。ハーバー・ボッシュ法は、「水と石炭と空気からパンを作る方法」ともいわれ、この方法の発見により、アンモニアNH3を原料とした窒素肥料が大量に製造され、農作物の収穫量は飛躍的に増加しました。ハーバー・ボッシュ法のおかげで、食糧不足の心配はなくなり、大勢の人々がたくさんの食物にありつける時代が到来したのです。この業績を称えられて、ハーバーは1918年にアンモニアNH3合成法の開発に関する研究で、ボッシュは1931年に高圧化学的方法に関する研究により、それぞれノーベル化学賞を受賞しました。1つの業績に2度のノーベル賞が贈られた例は、これ以外にはありません。

図.7 ハーバーは、1918年にアンモニアNH3合成法の開発に関する研究でノーベル化学賞を受賞した
パンの原料である小麦の育成には、窒素分を含む肥料の十分な供給が不可欠です。しかし、ドイツは痩せた氷河地形の上にあり、土壌が未発達である土地が多かったため、小麦の栽培は困難を極めました。主要な穀物を生産するためには、チリ硝石NaNO3などの海外の天然窒素肥料の輸入をするか、痩せた土壌に強いライ麦に頼るか、あるいは穀物の代替品として、新大陸のジャガイモに頼らざるを得なかったのです。1912年の時点では、ドイツは90万tもの硝酸塩を海外から輸入していました。もし海外の天然窒素肥料が輸入できなくなれば、国の存亡に関わります。ドイツはどこの国よりも、人工窒素肥料の重要性を理解していたのです。ハーバー・ボッシュ法によるアンモニアNH3合成法の開発以降、ドイツでは小麦の栽培が可能になりました。また、莫大な量の窒素化合物が世界中の農地に供給され、世界の人口は急速に増加しました。
空気中の窒素N2からアンモニアNH3を大量生産できるハーバー・ボッシュ法の重要性を誰よりもよく理解していたのは、「緑の革命」を指導して、1970年にノーベル平和賞を受賞したノーマン・ボーローグだったかもしれません。ボーローグは、小麦と米の新しい品種を生み出しました。しかし、本当の英雄が別にいることを、ボーローグは知っていました。彼は、受賞スピーチでこう述べています。「収量の多い矮小小麦と米の新品種が緑の革命に火をつけた触媒だとしたら、革命が突き進むためのエネルギーを供給した燃料は化学肥料だ」。誕生から100年以上が経っても、ハーバー・ボッシュ法の基本は変わらず、アンモニアNH3は地球上で最も多く人工的に合成された化学物質となりました。

図.8 ライ麦パンは、ドイツやロシアなどで多く食べられ、噛み応えや食べ応えがあって、腹持ちが良い
現在では、ハーバー・ボッシュ法は、地球の生態系において、最大の窒素固定源となっています。世界各国に存在するアンモニアNH3合成プラントは、今では、私たちの食料に含まれる窒素の1/3を供給しています。言い換えれば、ハーバー・ボッシュ法による窒素固定がなければ、世界で22億人以上が餓死するという計算になります。しかし、この方法は同時に、「平時には肥料を、戦時には火薬を空気から作る」とも形容され、爆薬の原料となる硝酸塩の大量生産を可能にしたことから、その後の戦争が長期化する要因を作りました。ドイツでは、この朗報を耳にした皇帝ウィルヘルム2世が、翌年にこれをもって第一次世界大戦(1914〜1918年)の開戦に踏み切ったとされています。1917年4月、「空爆されにくい場所」ということでロイナに建設された工場では、1年で160,000 tのアンモニアNH3が製造されました。ロイナで初日に合成されたアンモニアNH3は、「フランス人に死を!」とチョークで書かれたタンク貨車で硝酸HNO3工場に運ばれ、軍事用の火薬などに転換されました。
なお、熱烈な愛国者であったハーバーは、別な手段でも戦争に貢献しています。第一次世界大戦が勃発すると、ハーバーは軍事省化学兵器部の責任者に任命されました。銃や大砲を使わずに敵を殺すことができる毒ガスの開発に熱心に取り組み、軍もハーバーを信頼して、毒ガスに関する全権を与えました。ハーバーは、アンモニア合成などの際に獲得した企業との関係を利用し、毒ガスの原料を確保しました。さらに、カイザー・ヴィルヘルム研究所のほぼ全体を、毒ガス研究に利用しました。1,500人の作業員と150人の研究者の給料も含めた研究所の予算は、平時の50倍以上に膨れ上がっていました。ハーバーは、「戦争を毒ガス兵器によって早く終結できれば、無数の人命を救うことができる」と考え、塩素ガスやマスタードガス、ホスゲン、ツィクロンBといった毒ガスを開発し、戦場でその使用法を指揮することまでしたのです。第一次世界大戦において、各種毒ガス使用の指導的立場にあったことから、後にハーバーは「化学兵器の父」と呼ばれることになります (第17族元素(ハロゲン)を参照)。

図.9 カイザー・ヴィルヘルム研究所は、第一次世界大戦で武器の研究・実験・生産に関与した
ハーバーが指揮した毒ガス作戦は、1915年4月22日に血みどろの激しい戦闘が繰り広げられていたベルギーの第二次イープル戦線にて、遂に実行に移されました。ハーバーが選んだのは、「塩素ガス」でした。空気より重いため、塹壕に広がらせることができること、毒物を染み込ませた枕で窒息死させるかのように短時間で死に至らせられることが、選ばれた理由でした。ドイツ軍が放出した168 tの塩素ガスは、緑色の雲となって、人が走るほどの速さで、連合国軍の陣地に向かって漂って行きました。煙が塹壕の中に流れ込んだ途端、連合国軍の兵士たちの多くは視力を失い、胸をかきむしり、叫びながら倒れました。そこは、阿鼻叫喚の地獄絵図そのものに変わりました。毒ガスに対する防御策など何も持たない連合国軍は、わずか1日にして死者5,000人、重軽症者15,000人を出す大打撃を受けて、前線は大きく塗り替えられました。しかし、作戦を続けるうちに、連合国側も防毒マスクなどで対応し始め、次第に当初のような成果を挙げられなくなっていきました。また、毒ガス利用の化学戦は、「毒および毒を施した兵器の使用」を禁止したハーグ陸戦条約に抵触することから、国際的な非難を浴びました。

図.10 第一次世界大戦のイープル戦線にて、1915年4月22日にドイツ軍は塩素ガスで連合国軍を攻撃した
ハーバーの周囲でも、妻であるクララが、毒ガス兵器の開発に強く反対していました。妻のクララは、ブレスラウ大学で化学を専攻し、博士号を取る女性がまだほとんどいなかった時代に、ブレスラウ大学で女性初の博士号を取得した秀才でした。クララは、実験動物が苦しみながら死んでゆくのを見て、憐憫の情を覚えていたのです。しかし、ハーバーは頑として聞き入れません。「科学者は平和時には世界に属するが、戦争時には祖国に属する」、「毒ガスでドイツは迅速な勝利を得る」と言って、ハーバーはロシア軍への最初の毒ガス攻撃を行うため、東部戦線に出発して行きました。クララはこの非人道的な行為に抗議して、1915年5月2日の夜、軍用ピストルで自らの胸を撃ち、命を絶ちます。しかし、ハーバーはそれでも、毒ガス兵器に関する研究開発から、手を引くことはありませんでした。毒ガス利用の化学戦は、次第にエスカレートし、連合国軍も毒ガス兵器を利用するようになりました。

図.11 妻クララは、ブレスラウ大学で女性初の化学の博士号を取得した秀才である
戦争が長引くにつれ、ドイツ軍は次第に劣勢となりました。そして、1918年11月9日にドイツは降伏し、戦争は終結しました。戦争には負けたものの、ドイツ軍事大臣のハインリッヒ・ショイヒは、ハーバーの貢献に謝意を表明しました。「長きに渡る戦争の間に、貴君は広範な知識と精力を注ぎ込んで、計り知れないほど祖国のために尽くしてくれた」と彼は書いています。戦争が終結するまでに、ドイツは87,000 tの塩素ガスと24,000 tのホスゲン、7,700 tのマスタードガスを製造しました。イギリスとフランスも化学兵器を使用しましたが、最初に使い始めたのはドイツであり、目覚ましい戦果を挙げました。砲弾に毒ガスを入れて、敵に向かって打ち込む作戦を始めたのもドイツでした。第一次世界大戦では、ハーバーの化学兵器によって、100万人以上が被害に遭い、26,000人が死亡したともいわれています。
ハーバーは、化学兵器開発のかどで戦争犯罪人のリストに載れられたという噂が流れており、国際法廷において死刑の判決が下るだろうともいわれていました。そのため、ハーバーは肉体的にも精神的にも、疲れ切った状態にありました。ハーバーは偽造パスポートを作成し、スイスのサンモリッツへ逃亡しました。しかし、数か月後には、自らが逮捕される可能性がないと分かったため、ハーバーはドイツに帰国し、カイザー・ヴィルヘルム研究所の再編に取りかかりました。そのさなか、ハーバー・ボッシュ法の業績に対するノーベル化学賞受賞の知らせを聞きました。ただし、当時はドイツの科学界に対する国外からの反感は大きく、毒ガス研究をしていたハーバーの受賞に対して、各国からの批判があったといいます。ハーバーがストックホルムの授賞式に出向くと、他のノーベル賞受賞者数人が、授賞式をボイコットしました。授賞式の間も、ハーバーは何人もの科学者に握手を拒まれました。ハーバーが犯した残虐非道な行為を、彼らはどうしても受け入れることができなかったからです。かくも盲目的なまでにハーバーを突き動かしたものは、一体何だったのでしょうか?これは、ハーバーが「ユダヤ人であったこと」と関係しているのかもしれません。当時のドイツでは、ユダヤ人に対する反感が幾分かあり、ハーバーは祖国であるドイツのために尽くすことで、「ドイツ人の一員」になろうとしたのではないでしょうか。
愛国的化学者として名声の絶頂にあったハーバーですが、1933年にその生涯は暗転しました。ナチスの台頭で、アドルフ・ヒトラーがドイツを支配するようになったからです。ニュルンベルク法の施行により、ユダヤ人から公民権や生活権が奪われ、あちこちの店に「ユダヤ人お断り」の看板がかけられるようになりました。ハーバーは、自身の祖国に対する忠誠心と献身的な行動を、ドイツの最高司令部は高く評価してくれるはずだと思い込んでいましたが、現実はそれとは異なりました。ナチスにとって、ハーバーは一人のユダヤ人でしかありませんでした。ナチス政権は、知識や学問を軽く見ていました。学者や研究者は、ドイツの誇りというより、むしろ危険な存在でした。ヒトラーは、マルクス主義とはユダヤ人が世界の政治経済を支配する陰謀であると考え、「ユダヤ人は寄生動物であり、彼らを殺す以外には、その被害から逃れる方法はない」と街頭で演説するほどでした。比類ない愛国的化学者であったハーバーも、カイザー・ヴィルヘルム研究所長を辞職せざるを得ませんでした。1933年10月、ハーバーは心身の疲労のため、ドイツから出て、スイスのサナトリウムで静養します。ハーバーはその後、ケンブリッジ大学への誘いを受けて、イギリスに渡りました。

図.12 ヒトラーは反ユダヤ主義であり、ユダヤ人に対する組織的な大虐殺「ホロコースト」を主導した
しかし、イギリスでは、ハーバーの毒ガス兵器への憎しみが残っており、快適な環境ではありませんでした。例えば、「原子物理学の父」とも呼ばれるイギリスの物理学者アーネスト・ラザフォードには、この理由により会うことを拒まれました。失意の中、イギリスからスイスへの保養旅行へと出たハーバーは、遂に二度と祖国ドイツの地を踏むことなく、旅先のバーゼルで亡くなります。ヒトラーが権力を手にした日から、ほぼ1年後の1934年1月29日のことで、ハーバーは65歳でした。ユダヤ人であるハーバーの死は、ドイツの新聞などでは、ほとんど取り上げられることはありませんでした。そして、ハーバーの開発した毒ガスは、アウシュヴィッツの強制収容所で用いられ、ハーバーの親族を含む600万人のユダヤ人の命を奪うことになります。ハーバーはその遺書に、「自分の遺灰は妻クララと一緒に埋めてほしい」と記しています。1937年、長男のヘルマン・ハーバーによって、ハーバーの遺灰は妻クララと一緒に、バーゼルのヘルンリ墓地に埋葬されました。ハーバーは毒ガス兵器のことを、本当は後悔していたのかもしれません。
(2) 硝酸HNO3の生産
硝酸HNO3は、もともと硝石KNO3と硫酸塩(硫酸鉄やミョウバンなど)から作られていました。このような製造法は、ヴェネツィアを中心に15世紀には一般的になっていました。17世紀ごろには、硫酸H2SO4と直接反応させる方法も知られていました。17世紀最大の化学工業の担い手であったドイツの錬金術師ヨハン・ルドルフ・グラウバーは、1648年に硫酸H2SO4と硝石KNO3を反応させて、硝酸HNO3を合成しました。
KNO3 + H2SO4 → HNO3↑ + KHSO4
18世紀頃には、硝酸HNO3が大規模に製造されていたようです。1793年には、硫酸H2SO4の製造法として「鉛室法((3) 硫酸H2SO4の生産を参照)」が登場し、硫酸H2SO4の価格が安くなったことも後押ししました。そして19世紀には、チリのアタカマ砂漠で安価なチリ硝石NaNO3が発見されました。チリのアタカマ砂漠は、「世界で最も乾燥した土地」ともいわれ、40年間雨が一滴も降らなかった場所さえあります。このため、普通なら雨水に溶けて流れ去ってしまうような硝酸ナトリウムNaNO3が、この地には豊富に堆積していたのです。地上に存在する硝酸ナトリウムNaNO3は、ほとんどがこの地に集中しているともいわれていました。その後、安価なチリ硝石NaNO3を用いる方法は、硝酸HNO3の工業的製造法として長い間用いられてきました。しかし、チリ硝石NaNO3が枯渇した現在では、この方法はほとんど行われていません。
NaNO3 + H2SO4 → HNO3↑ + NaHSO4
後年、ドイツの物理化学者であるヴィルヘルム・オストワルドは、白金板を触媒とするアンモニアNH3酸化による硝酸HNO3生成反応を詳しく調べ、1914年には、ドイツでその工業化が成功しました。この方法は、一般的に「オストワルド法(Ostwald process)」と呼ばれます。当時、ドイツでは先述したハーバー・ボッシュ法により、アンモニアNH3は大量に供給しうる体制にあったので、硝酸HNO3の製造も急速に発展しました。これにより、肥料や爆薬の大量生産が可能になったのです。オストワルド法は、現在でも硝酸HNO3の工業的製法として重要であり、原料のアンモニアNH3を得るため、ハーバー・ボッシュ法と同時に行われることが多いです。

図.13 オストワルドは、「物理化学」という分野を確立した1人とされている
オストワルド法による硝酸HNO3の製造量は、日本だけでも年間36万tにも及びます。工業的には、まずアンモニアNH3と空気を混合し、800℃に赤熱した白金網に通じます。このとき、白金Ptは触媒として作用しますが、普通の触媒とは少し異なります。一般に触媒は、反応が平衡に達するまで接触させておきますが、この反応では短時間しか接触させません。長時間では、得られた一酸化窒素NOが白金Ptの作用で、窒素N2と酸素O2にまで分解されてしまうからです。流速を一定に保つことで、アンモニアNH3は効率良く一酸化窒素NOに酸化されます。
4NH3 + 5O2 → 4NO + 6H2O ・・・(I)
式(I)の平衡定数Kは、800℃付近ではK=36です。これは、式(I)の平衡が極端に右側にかたよっていることを示しています。式(I)の触媒としては、白金Ptがよく使われていますが、安価な他の金属でも可能です。しかし、反応効率が悪かったり、他の物質によって触媒の活性が低下したりなど、様々なデメリットがあります。白金Ptを触媒として用いる場合、ヒ素Asや硫黄Sなどの化合物は白金触媒の働きを阻害するため、アンモニアNH3の精製が重要です。かつてアンモニアNH3は、石炭ガスなどの製造で生じたものを利用していましたが、不純物である硫黄化合物などが白金Ptの触媒活性を低下させる原因となりました。一方、ハーバー・ボッシュ法で合成されるアンモニアNH3は、これらと比べると純度が高くクリーンなので、オストワルド法と大変相性が良かったようです。
次のステップは、一酸化窒素NOの酸化反応です。一酸化窒素NOは、冷却後に空気中の酸素O2と反応し、二酸化窒素NO2となります。
2NO + O2 → 2NO2 ・・・(II)
ただし、二酸化窒素NO2は、式(III)に示すように、一部が会合して四酸化二窒素N2O4となっています。両者は、与えられた温度と圧力下で一定の平衡状態にあり、高圧では平衡が右側にかたよっています。高圧ではガスの水H2Oへの吸収が促進されるので、硝酸HNO3の製造で有利です。
2NO2 ⇄ N2O4 ΔH =−53.5 kJ ・・・(III)
したがって、水H2Oへの吸収にあずかるのは四酸化二窒素N2O4であり、次のような反応によって、一酸化窒素NOを生じつつ、水H2Oに吸収されます。
3N2O4 + 2H2O → 4HNO3 + 2NO ・・・(IV)
ここで生じた一酸化窒素NOは、再び酸素O2で酸化され、二酸化窒素NO2および四酸化二窒素N2O4になります。式(IV)では、四酸化二窒素N2O4の分圧が高いほど、生成する硝酸HNO3の濃度が大きくなります。したがって、式(III)の平衡を右に移動させるために、冷却することは非常に有効です。以上より、オストワルド法における全体の反応は、式(I)〜(IV)をまとめて、次のように表されます。
NH3 + 2O2 → HNO3 + H2O
式(IV)の四酸化二窒素N2O4の吸収ステップでは水H2Oを使っていますが、生成する希硝酸HNO3は、その後に煮詰めても68.4%以上の濃度にすることは困難です。その理由は、硝酸HNO3と水H2Oが一緒に沸騰(共沸)してしまうからです。そこで、より濃い濃硝酸HNO3を製造するために、例えば接触法((3) 硫酸H2SO4の生産を参照)のように、硝酸HNO3に四酸化二窒素N2O4を吸収させる方法があります。これにより、98%以上の硝酸HNO3を作ることができます。他にも、硫酸H2SO4や硝酸マグネシウムMg(NO3)2のような脱水剤とともに蒸留して、濃縮する方法があります。
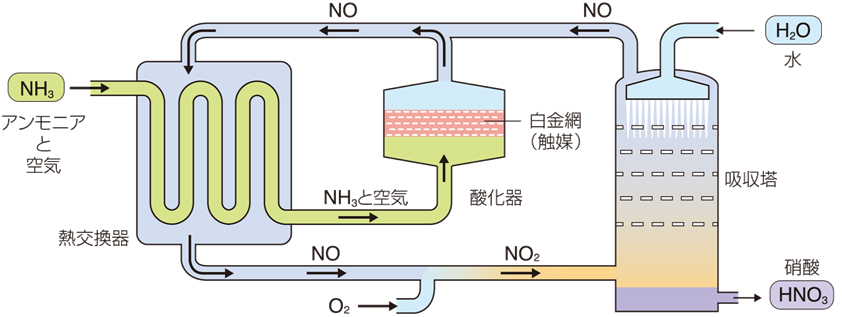
図.14 オストワルド法
なお、オストワルドは触媒を始めとした一連の研究成果により、1909年にノーベル化学賞を受賞しています。受賞当時、オストワルドはすでに化学の研究の最前線からは身を引いていました。代わりにオストワルドが力を入れ始めていたのは、研究者のため環境整備です。円滑に研究内容を伝え合うためには、基準や規格などが揃っている必要があります。基準や規格が国や研究者コミュニティによって違っていたら、お互いの研究を理解するのも一苦労です。そこでオストワルドは、原子量を定める国際原子量委員会の仕事に関わったり、産業界との連携を密にするための組織を設立したり、体系的な色分類システムである「オストワルド表色系」を考案したりと活躍していました。
また、オストワルドは、人工言語として1907年に考案された「イド語」にも注目していました。当時、化学者たちは自身の研究を英語やドイツ語、フランス語など、様々な言語で発表しており、さらに科学誌では、報告された研究を毎年ロシア語やイタリア語などに要約する必要に迫られていました。これは大変非効率なので、オストワルドは、「各国の研究者が自身の研究を世界共通語であるイド語で発表する世界」を構想しました。実際、化学論文をイド語に翻訳するのは、そこまで難しくなかったようです。オストワルドは、ノーベル化学賞の賞金の半分近くをイド語の活動に費やしたともいわれています、しかし、この夢は、第一次世界大戦の勃発により霧消してしまいました。歴史の世界にifはありませんが、もし第一次世界大戦が起こらなかったら、化学はもっと早く進歩していたかもしれません。
(3) 硫酸H2SO4の生産
硫酸H2SO4は、8世紀頃にイスラムの錬金術師が「緑礬(りょくばん)」という硫酸鉄(II)七水和物FeSO4・7H2Oが主成分の水溶性鉱物を乾留して製造したのが最初です。その後、1740年頃にイギリスでガラス容器にて、硫黄Sと硝石KNO3を燃焼して、半工業的に製造されたといわれています。日本では、江戸時代後期の蘭学者である宇田川榕菴のオランダ語訳本「舎密開宗(1837年)」にその製法の記載があり、工業的には1872年に大阪の造幣局で、貨幣の洗浄を目的に硝酸式製造法(鉛室法)で合成が始まりました。民間では、1880年の大阪の川口硫酸製造所、1890年の日本舎密工業(現日産化学小野田工場)などが生産を開始しました。
硫酸H2SO4の製造法は、「鉛室法(Lead chamber process)」と「接触法(contact process)」に大別されます。両者の違いは、二酸化硫黄SO2を三酸化硫黄SO3に酸化する際の触媒として、前者は窒素酸化物(NOやNO2など)、後者は五酸化二バナジウムV2O5を使用することです。また、製品は前者が60〜80%硫酸H2SO4なのに対し、後者は90〜100%硫酸H2SO4および「発煙硫酸(fuming sulfuric acid:H2SO4・nSO3)」を製造できるという違いもあります。後者の本格的な接触式設備は、1932年の住友肥料製造所(現住友化学)に始まり、製錬関係では1939年に日本鉱業(現JX金属)が採用して普及しました。国内の硫酸製造業者では、工業用硫酸は、次の表.1に示す硫酸協会規格を適用しています。
表.1 硫酸協会規格
|
種類 |
希硫酸 |
薄硫酸 |
濃硫酸 |
発煙硫酸 |
|
濃度 |
27〜50%H2SO4 |
60〜80%H2SO4 |
90〜100%H2SO4 |
15〜35%SO3 |
接触式による硫酸製造法では、工業的には五酸化二バナジウムV2O5を主成分とした触媒を用いて、400〜600℃で乾燥させた二酸化硫黄SO2を空気酸化し、三酸化硫黄SO3をまず作ります。そして、生じた三酸化硫黄SO3を濃硫酸H2SO4に含まれる水H2Oに吸収させることで、硫酸H2SO4が合成されます。
2SO2 + O2 → 2SO3 ・・・(V)
SO3 + H2O → H2SO4 ・・・(VI)
式(V)の反応は発熱反応ですが、活性化エネルギーがかなり大きいために、通常は起こりにくいです。火力発電所は、主として重油を燃料として運転されており、重油中には1〜2%の硫黄分が含まれているので、二酸化硫黄SO2は、重油の燃焼とともに大気中にかなり出ています。もしこの反応が簡単に起こったら、私たちは硫酸H2SO4の雨を浴びることになります。この反応を起こすために、五酸化二バナジウムV2O5を触媒として加えるのです。五酸化二バナジウムV2O5の働きについては、次のようなモデルが提唱されています。
SO2 + 2V5+ + O2- ⇄ 2V4+ + SO3
O2 + 4V4+ ⇄ 4V5+ + 2O2-
また、式(VI)の反応は、三酸化硫黄SO3を直接純水中に吸収させると、大きな水和熱と溶解熱のために水H2Oが蒸発して、吸収させにくくなります。そこで、実際には濃硫酸H2SO4に多量の三酸化硫黄SO3を吸収させて、まずは発煙硫酸H2SO4・nSO3とします。そして、これを希硫酸H2SO4と混合することで、濃硫酸H2SO4を生産しています。
H2SO4 + nSO3 ⇄ H2SO4・nSO3
接触法で必要な二酸化硫黄SO2は、黄鉄鉱FeS2を燃焼させるか、単体硫黄Sを燃焼させて製造します。黄鉄鉱FeS2を使う方は、黄鉄鉱FeS2を燃焼炉で燃焼させると、硫黄S2が遊離し、これが直ちに空気中の酸素O2と反応して、二酸化硫黄SO2に変化します。硫黄Sは非常に火の着きやすい物質であり、引火点は248〜261℃です。したがって、容易に燃焼させることができます。
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
S + O2 → SO2
黄鉄鉱FeS2の燃えかす(焼鉱)は、製鉄の原料となったり、またこれから有用金属(銅Cuや亜鉛Zn、金Au、銀Agなど)が回収されたりしています。しかし、最近では、原油からの回収硫黄の利用が急増しており、黄鉄鉱FeS2を原料として二酸化硫黄SO2を生産する方法は、現在日本国内では利用されていません。この傾向は、アメリカやヨーロッパにおいても同じであり、黄鉄鉱FeS2を用いる方法は、すでに経済的な競争力を失って、廃絶されつつあります。代わりに大気汚染防止などの環境規制から、原油の水素化脱硫装置で発生するガス中の硫化水素H2Sから硫黄Sを回収する方法が発達し、これが硫酸H2SO4の原料となっています。
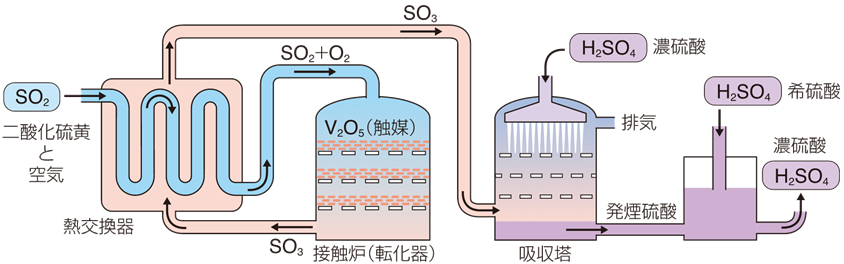
図.15 接触法
(4) 水酸化ナトリウムNaOHの生産
水酸化ナトリウムNaOHは、「苛性ソーダ」とも呼ばれ、化学工業的に非常に重要な基礎原料の1つです。イオン交換膜と電気分解を用いて、塩化ナトリウムNaCl水溶液から水酸化ナトリウムNaOH水溶液を合成する方法を、「イオン交換膜法(ion exchange membrane process)」といいます。イオン交換膜法は、電解法の1つです。電解槽の隔膜には、アルカリ耐性に優れたフッ素樹脂系の陽イオン交換膜を使用します。この膜は、陽イオンしか通過させない性質があります。
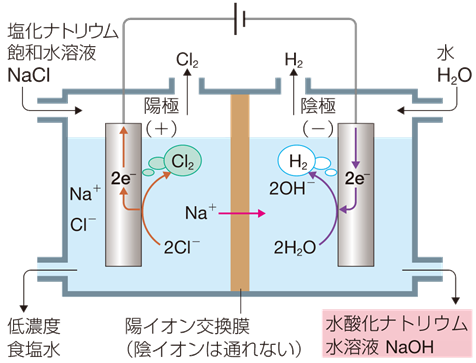
図.16 イオン交換膜法の原理
(陽極) 2Cl- → Cl2 + 2e-
(陰極) 2H2O + 2e- → H2 + 2OH-
陽極室には、精製した高濃度塩化ナトリウムNaCl水溶液が供給され、電解が進むと、陽極上で酸化反応により塩素Cl2が発生します。また、同時に陽イオン交換膜を通ったナトリウムイオンNa+ が、陽極室から陰極室へ移動します。濃度が薄くなった塩化ナトリウムNaCl水溶液は、陽極室から源塩溶解槽へ戻されます。
陰極室には、純水で希釈した約28%の低濃度水酸化ナトリウムNaOH水溶液が循環供給されます。陰極上では、水H2Oが電気分解され、水素H2が発生します。電極としては、水素H2が発生しやすいように、水素過電圧が0.3 Vと比較的小さい鉄板を使うのが一般的です。理想は水素過電圧が0.005 Vの白金Ptを使うことですが、白金Ptは高価なため、安価な鉄Feを使うようにしています。残った水酸化物イオンOH- は、陽極室から移行してきたナトリウムイオンNa+ と一緒になって、30〜35%の高濃度水酸化ナトリウムNaOH水溶液となり、陰極室から外部へ取り出されます。電解で得られる水酸化ナトリウムNaOH水溶液の濃度は30〜35%ですが、製品としては約50%まで濃縮して出荷輸送されます。
(5) 炭酸ナトリウムNa2CO3の生産
炭酸ナトリウムNa2CO3は、「炭酸ソーダ」とも呼ばれ、各種化学工業で広範囲に使用されている重要な基礎原料です。フランスの皇帝ナポレオンは、エジプト遠征のときに科学者を同行させ、ナイル川を遡らせて上流の探査を行わせました。そのとき、タンザニアで炭酸ナトリウムNa2CO3を豊富に含む「ナトロン湖」を見つけました。炭酸ナトリウムNa2CO3はソーダガラスの材料として、大量に必要ではありましたが、運搬手段がありませんでした。
そこで、その周辺を探索すると、塩化ナトリウムNaClの岩塩と、炭酸カルシウムCaCO3の石灰岩が大量に存在することに気付きました。彼らが思いついたのは、次のような化学反応です。しかし、この化学平衡は、混ぜて加熱しただけでは、決して右側には進みません。左辺の炭酸カルシウムCaCO3が沈殿するので、完全に左側に偏ってしまいます。この反応を起こすことができれば、簡単に炭酸カルシウムCaCO3が得られるのですが、当時は上手い方法がなく、この反応は諦められました。
2NaCl + CaCO3 ⇄ Na2CO3 + CaCl2
1701年から始まったスペイン継承戦争(フランス・スペインとイギリス・神聖ローマ帝国との戦争)で、イギリスが海上封鎖を行い、スペインからのバリラ(炭酸ナトリウムNa2CO3の含有量が30%もある塩性植物)の輸入が途絶えると、フランス国内ではアルカリ不足が深刻な問題になりました。この苦い経験から、フランスの王立科学アカデミーは、1775年に「塩化ナトリウムNaClから炭酸ナトリウムNa2CO3を経済的に生産する方法を発明した者には賞金2,400リーブルを与える」という懸賞で発明を募りました。この賞金は、当時としては破格の金額でした。
フランスのパリで医師をしていた二コラ・ルブランは、化学にも造詣が深く、塩化ナトリウムNaClから硫酸ナトリウムNa2SO4を作れれば、炭酸カルシウムCaCO3を組み合わせて炭酸ナトリウムNa2CO3を作れるだろうと考え、実験に没頭しました。まだ化学式や化学反応式などない時代で、地図なしでジャングルを探検するような、途方もない作業の連続でした。そして試行錯誤の末、1789年に「ルブラン法(LeBlanc method)」という製造法を考案します。これは、塩化ナトリウムNaClと硫酸H2SO4から硫酸ナトリウムNa2SO4を作り、さらに硫酸ナトリウムNa2SO4に石灰石CaCO3と木炭Cを反応させて、炭酸ナトリウムNa2CO3を工業的に生産する方法です。
2NaCl + H2SO4 → Na2SO4 + 2HCl
Na2SO4 + CaCO3 + 2C → Na2CO3 + CaS + 2CO2
上記の化学反応式から分かるように、炭酸ナトリウムNa2CO3の副生成物として、ルブラン法では塩化水素HClと硫化カルシウムCaSが大量に生成します。1800年代の初期においては、塩化水素HClは工業的に使い道がなかったことから、単純に大気中に放散されていました。塩化水素HClは雨に混じって酸性雨となり、周囲の農地や森林、建物を荒らし、家畜に被害をもたらしました。また、硫化カルシウムCaSは特に目立った用途がなく、溝を埋めるか線路を敷くときの盛り土に使うぐらいで、ソーダ工場の近辺の空き地に山積みにされました。ここに、例えば塩化水素HClが混じった雨が降ると、硫化水素H2Sを放出しながら分解し、腐った卵のような臭いを放つ元となりました。それらの有害な放出物のため、当時のソーダ工場は、訴訟と法規制の標的となりました。
CaS + 2HCl → CaCl2 + H2S
そのようなときに登場したのが、1863年にベルギーの化学者であるエルネスト・ソルベーが考案した「アンモニアソーダ法(ammonia soda process)」です。これは、塩化ナトリウムNaClと炭酸カルシウムCaCO3から、工業的に炭酸ナトリウムNa2CO3を製造する方法です。ルブラン法で問題になっていた副生成物も、アンモニアソーダ法で生じるのは塩化カルシウムCaCl2なので、公害の問題は少ないです。しかし、これら2つを混ぜ合わせただけでは、反応は起こりません。アンモニアソーダ法では、反応を5段階に分けて、炭酸ナトリウムNa2CO3を製造します。
2NaCl + CaCO3 → Na2CO3 + CaCl2

図.17 ソルベーは、アンモニアソーダ法で得た利益を慈善事業のために使い、ブリュッセル大学に様々な研究所を設立した
まず、ソルベー塔とも呼ばれる装置の中で、飽和食塩水にアンモニアNH3を十分に吸収させ、そこへ二酸化炭素CO2を吹き込みます。アンモニアNH3を先に吹き込む理由は、二酸化炭素CO2が水よりもアンモニア水に溶けやすいからです。すると、式(VII)の反応が起こり、比較的水に溶けにくい炭酸水素ナトリウムNaHCO3が沈殿します。この反応のポイントは、飽和食塩水を用いることです。塩化ナトリウムNaClが飽和していれば、炭酸水素ナトリウムNaHCO3の電離は抑えられ、かなりの量が沈殿します。得られた炭酸水素ナトリウムNaHCO3の沈殿を270℃以上で熱分解すると、式(VIII)の反応が起こり、炭酸ナトリウムNa2CO3が得られます。
NaCl + H2O + NH3 + CO2 → NaHCO3 + NH4Cl ・・・(VII)
2NaHCO3 → Na2CO3 + H2O + CO2 ・・・(VIII)
式(VIII)の反応で発生する二酸化炭素CO2を含むガスは、式(VII)の反応に使用されます。しかし、これだけでは、工程内の二酸化炭素CO2の必要量を満たせません。工業的には、炭酸カルシウムCaCO3を1,000℃で熱分解して、二酸化炭素CO2と酸化カルシウムCaOを得ています。そこで、この二酸化炭素CO2も、式(VII)の反応に使用しています。また、このとき生成する酸化カルシウムCaOは、水H2Oと反応させて、水酸化カルシウムCa(OH)2の懸濁液にします。
CaCO3 → CaO + CO2 ・・・(IX)
CaO + H2O → Ca(OH)2 ・・・(X)
一方で、式(VII)の反応で、炭酸水素ナトリウムNaHCO3が分離されたあとの母液からは、塩化アンモニウムNH4Clが回収されます。塩化アンモニウムNH4Clは酸化カルシウムCa(OH)2と反応させて、アンモニアNH3を発生させます。そして、このアンモニアNH3は、式(VII)の反応に再利用されます。そのため、理論上では、アンモニアNH3はすべて回収され、消費しません。
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O ・・・(XI)
また、式(XI)の反応を行わずに、生成した塩化アンモニウムNH4Clを、肥料としてそのまま利用することもあります(塩安ソーダ法)。この場合では、アンモニアNH3は回収されず、商品に含まれて出荷されます。第二次世界大戦後に食糧難だった日本では、副産物である塩化アンモニウムNH4Clを肥料として供給することで、食糧増産に大きく貢献することになりました。これら式(VII)〜(XI)の反応を1つにまとめると、次のようになります。
2NaCl + CaCO3 → CaCl2 + Na2CO3
このように、直接起こらない反応を5段階に分けて実現したことが、アンモニアソーダ法の最大の特徴です。この工程から発生する主な廃棄物は、塩化アンモニウムNH4ClをアンモニアNH3として回収する際に生じる塩化カルシウムCaCl2のみです。廃棄物が非常に少ない点も、アンモニアソーダ法の特徴の1つです。アンモニアソーダ法における塩化ナトリウムNaClの利用率は、理論的には約80%です。この理由は、中間生成物である炭酸水素ナトリウムNaHCO3の一部が、水に溶解してしまうからです。
ソルベーは、アンモニアソーダ法の特許をベルギーで取得し、国内に工場を建設しました。1866年には1日1 t、1867年には1.5 t、1868年には3 tと生産量が増加しました。1867年には、日本が初めて参加したことでも有名なパリ万博で披露され、世界中に普及していきました。国外の最初の工場は1872年にフランスのヴァランジュヴィルに建設され、ルブラン法が普及していたイギリスにもウィニングトンに工場が建設されました。ウィニングトンの工場は、後に世界規模の工場に成長しました。このようにして、アンモニアソーダ法は徐々に普及し、1900年代初期にはルブラン法を圧倒しました。
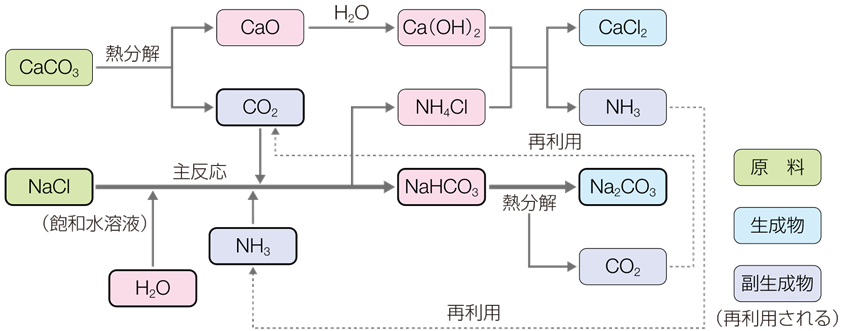
図.18 アンモニアソーダ法
ただし、1938年に炭酸ナトリウムNa2CO3の大規模な天然鉱床(トロナ鉱)が米ワイオミング州グリーンリバーで発見され、炭酸ナトリウムNa2CO3を安価に得ることができる現在では、アンモニアソーダ法はかなり衰退しました。現在では、市場の大半が安価な天然品です。100円均一ショップやホームセンターで販売されている「セスキ炭酸ソーダ」はトロナ鉱を加工したもので、その成分は炭酸ナトリウムNa2CO3と炭酸水素ナトリウムNaHCO3の複塩Na2CO3・NaHCO3・2H2Oです。セスキ炭酸ナトリウムNa2CO3・NaHCO3・2H2Oは焼成することで、炭酸ナトリウムNa2CO3に変換できます。
2(Na2CO3・NaHCO3・2H2O) → 3Na2CO3 + 5H2O + CO2
ワイオミング州の埋蔵量は1,000億tと推定され、これは人類が5万年使い続けられる量です。また、塩化ナトリウムNaCl水溶液の電気分解により生じる水酸化ナトリウムNaOHが余剰気味であるため、水酸化ナトリウムNaOHの二酸化炭素CO2による中和で製造される炭酸ナトリウムNa2CO3の量も、無視できないほど多くなっており、これもアンモニアソーダ法の衰退の一因となっています。
・参考文献
1) 石川正明「新理系の化学(下)」駿台文庫(2005年発行)
2) 遠藤瑞己「化学と歴史のネタ帳 I. 酸とアルカリ」文彩堂出版(2024年発行)
3) 栗山常吉「アンモニアの工業的製法」化学と教育66巻11号(2018年)
4) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
5) 佐藤健太郎「炭素文明論」新潮選書(2013年発行)
6) 左巻健男「面白くて眠れなくなる化学」PHP研究所(2012年発行)
7) 塩川二朗「無機工業化学」化学同人(1993年発行)
8) 長谷川一希「苛性ソーダ, 金属ナトリウム製造における電解技術」化学と教育66巻11号(2018年)
9) ポール・A・オフィット「禍いの科学 正義が愚行に変わるとき」日経ナショナルジオグラフィック社(2020年発行)
10) 森浩亮/山下弘己 共著「暮らしを支える触媒化学―目的の化学反応を促進する賢者の石―」化学と教育66巻10号(2018年)
11) 山北篤「現代知識チートマニュアル」新紀元社(2017年発行)
12) 山本安宏「硫酸工業の現状と今後」化学と教育66巻11号(2018年)