天然高分子化合物(タンパク質と核酸)
【目次】
(1) アミノ酸
「アミノ酸(amino acid)」とは、アミノ基(-NH2)とカルボキシ基(-COOH)の両方の官能基を持つ有機化合物の総称です。一方で、天然のタンパク質を希酸や酵素で加水分解すると、カルボキシ基(-COOH)に隣接するα位の炭素上に、アミノ基(-NH2)が結合した構造を持つアミノ酸が得られます。これを特に「α -アミノ酸」といいます。次の図.1に、その構造式を示します。生体のタンパク質には、Rで表記した側鎖の違いにより、約20種類のα -アミノ酸が存在します。
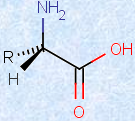
図.1 α -アミノ酸の構造式
一部の特殊なものを除き、タンパク質は、約20種類のα -アミノ酸が結合して作られています。すべてのα -アミノ酸を覚える必要はありませんが、重要なα -アミノ酸の名称と構造式は、覚えておくことが望まれます。次の表.1に、タンパク質を構成する主なα -アミノ酸を示します。アミノ酸の名称としては、一般的に慣用名が使われます。慣用名は、それらが初めて取り出された物質にちなんで命名されたものが多いです。さらに、これらのアミノ酸には、アルファベット1文字、または3文字からなる略号が付与されています。
表.1 タンパク質を構成する主なα -アミノ酸
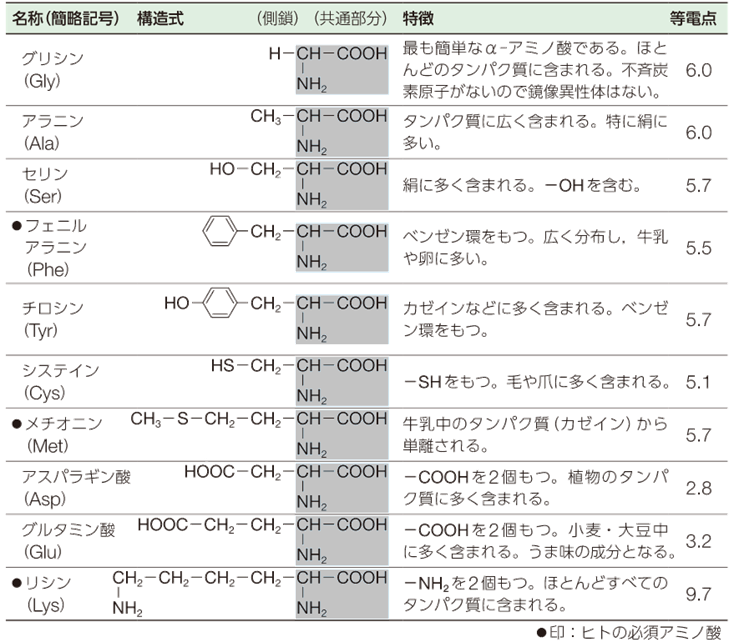
それぞれのアミノ酸は、構造によって、異なる酸塩基性を持ちます。構造内に2つのカルボキシ基(-COOH)を持つ「グルタミン酸」などのアミノ酸は酸性を示し、2つ以上のアミノ基(-NH2)を持つ「リシン」などのアミノ酸は塩基性を示し、その他のアミノ酸はほぼ中性を示します。中性アミノ酸は、カルボキシ基(-COOH)およびアミノ基(-NH2)以外に、特徴的な基によって、いくつかに分類されます。例えば、アルキル鎖(-R)を持つ「グリシン」や「アラニン」、ヒドロキシ基(-OH)を持つ「セリン」、硫黄Sを含む「システイン」や「メチオニン」、アリール鎖(-Ar)を持つ「フェニルアラニン」や「チロシン」などに分類され、タンパク質の持つ性質は、これらの分類を考慮しながら考察されます。
また、体内で全く合成できないか、もしくは必要な量を十分に合成できず、生育のために外部から摂取しなければならないアミノ酸を、「必須アミノ酸(essential amino acid)」といいます。ヒトの必須アミノ酸は、「メチオニン」・「フェニルアラニン」・「リシン」・「ヒスチジン」・「トリプトファン」・「イソロイシン」・「ロイシン」・「バリン」・「トレオニン」の9種類です。幼児では、さらに「アルギニン」も加えて10種類とします。アルギニンは体内でも合成されるので、成人では必須アミノ酸ではありませんが、成長の早い乳幼児期では、体内の合成量が十分でなく、不足しやすくなるのです。アルギニンは、免疫反応を活性化し、細胞増殖を促進する効果があります。一方で、その他のアミノ酸は、体内で合成することができるので、「可欠アミノ酸(nonessential amino acid)」と呼ばれます。なお、植物や細菌は、二酸化炭素CO2や水H2O、アンモニアNH3などの無機化合物を原料として、必要なアミノ酸やタンパク質をすべて体内で合成することができます。

図.2 アルギニンは魚介類に多く含まれ、鰹節は特に多くのアルギニンを含む
また、アミノ酸は、「うま味」や「甘味」などを持つことが多いです。例えば、「グルタミン酸」はうま味を持ち、昆布やチーズ、緑茶、魚介類などに多く含まれています。グルタミン酸のナトリウム塩である「グルタミン酸ナトリウム」は、「味の素」の主成分でもあります。また、「グリシン」はすっきりとした甘味を持ち、エビやカニの甘味の主成分になっています。グリシンには、面白いことに細菌類の芽胞の発育を阻害する作用があり、一旦滅菌された環境で細菌が増殖することを阻害します。そのため、ご飯を炊くときに1合につき1 g程度グリシンを添加すると、ご飯に自然な甘味が付加され、腐敗しにくくなります。さらに、グリシンには、末梢の血流量を増加させ、熱の放散を促して深部体温を低下させる作用があることから、就寝前に3 gを摂取すると、睡眠の質が向上するという研究があります。「アラニン」は甘味とうま味を持ち、シジミやハマグリなどの貝類に多く含まれています。しかし、中には毒のあるアミノ酸もあり、ベニテングタケに含まれる「イボテン酸」は、強いうま味を持ちますが、毒性があります(おいしさの科学を参照)。
表.2 代表的なアミノ酸の呈味
|
アミノ酸 |
閾値※ [mg/dL] |
甘味 |
苦味 |
うま味 |
酸味 |
|
グリシン(Gly) |
110 |
◎ |
− |
− |
− |
|
アラニン(Ala) |
60 |
◎ |
− |
− |
− |
|
セリン(Ser) |
150 |
◎ |
− |
− |
△ |
|
スレオニン(Thr) |
260 |
◎ |
△ |
− |
△ |
|
プロリン(Pro) |
300 |
◎ |
〇 |
− |
− |
|
オキシプロリン(Hyp) |
50 |
〇 |
△ |
− |
− |
|
リジン塩酸塩 |
50 |
〇 |
〇 |
△ |
− |
|
グルタミン(Gln) |
250 |
△ |
− |
△ |
− |
|
アスパラギン酸(Asp) |
3 |
− |
− |
△ |
◎ |
※ 閾値は味を感知できる最低濃度
また、「バリン」・「ロイシン」・「イソロイシン」のように、側鎖のRに枝分かれの構造があるアミノ酸を、「分枝鎖アミノ酸(branched−chain amino acids)」といいます。これらのアミノ酸は、その英語の頭文字を取って、「BCAA」ということもあります。BCAAは、筋繊維を構成する必須アミノ酸の30〜40%を占め、筋繊維を肥大させるためには、欠かせないアミノ酸とされています。BCAAを運動前に補給することで、筋線維の合成促進や分解抑制の他、筋肉中のグリコーゲンを節約するなどして、運動の持久力の向上にもつながるといわれています。アミノ酸飲料などに配合されることの多いBCAAですが、食品として考えた場合には、1つだけ欠点があります。それは、他のアミノ酸と比較して、とにかく苦いということです。筋力向上をうたっているアミノ酸飲料に、甘味を加えているものが多いのは、BCAAの苦味を緩和するためです。
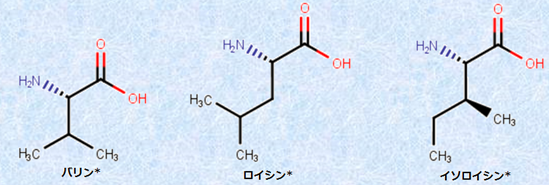
図.3 BCAAは、筋繊維を構成する主要なα -アミノ酸である
表.1のα -アミノ酸で、R=Hの「グリシン」は例外として、α -アミノ酸のα炭素は、基本的には「不斉炭素原子」です。このため、グリシン以外のタンパク質から得られるアミノ酸は、一般的に光学活性であり、さらに次の図.4に示すように、「グリセルアルデヒド」を基準とする「L-立体配置」を、ほとんどのα -アミノ酸が持っています。つまり、地球上のすべての生物は、ほとんどがL-アミノ酸だけで構成されているということになります。
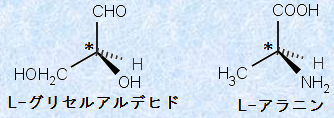
図.4 天然に存在するα -アミノ酸は、ほとんどがL-立体配置を持っている
それでは、なぜ地球上の生物は、L-アミノ酸ばかりを選ぶのでしょうか。確実に言えることは、もしL-アミノ酸の鏡像異性体である「D-アミノ酸」だけでできた生物が地球上にいたとしても、その生物は、他の生物の作った「L-アミノ酸だけでできている栄養素」を摂取することができないということです。隕石の中から、ときどきα -アミノ酸が発見されることがあります。そして、隕石中のα -アミノ酸には、L-アミノ酸とD-アミノ酸の両方が含まれています。仮説ですが、私たちの身体がL-アミノ酸だけでできているのは、初期地球で生命が誕生したときの最初の生命が、偶然にL-アミノ酸だけでできていたため、その子孫である今の生物も、そうなっているのではないかということです。つまり、私たちの身体が、L-アミノ酸ばかりでできているのは、「神様の気まぐれ」ということです。ちなみに、D-アミノ酸は、自然界に存在しないとされてきましたが、実は微生物や植物をはじめ、哺乳動物にも様々なD-アミノ酸がわずかに存在し、様々な生理機能を果たしていることが近年分かってきています。
(i) 酸塩基としての性質
アミノ酸は、分子内に酸性のカルボキシ基(-COOH)と塩基性のアミノ基(-NH2)を持ち、酸と塩基の両方の性質を示します。そのため、結晶中や水中では、分子内で酸塩基反応が起こり、アミノ基(-NH2)はプロトンH+ を受け取って第一級アンモニウムカチオン(-NH3+)に、カルボキシ基(-COOH)はプロトンH+ を失ってカルボキシイオン(-COO-)となっています。このように、分子内に正と負の両電荷を持つイオンを、「両性イオン(dipolar ion)」といいます。一般的に、アミノ酸はカルボキシ基(-COOH)とアミノ基(-NH2)とが、「本来の形のまま」で存在しているように書かれることが多いのですが、実はそれは理解しやすいように、単純化して示してあるだけなのです。
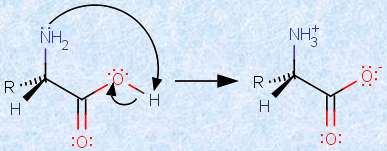
図.5 α -アミノ酸の両性イオンの構造
アミノ酸は、通常固体あるいは溶液中で、この両性イオンの構造をしています。アミノ酸の両性イオンは、互いにクーロン力で結合して、イオン結晶を形成するので、無機化合物のような性質を示します。すなわち、他の有機化合物に比べて比較的高い融点を持ち、極性の大きな水には溶けやすいですが、極性の小さなエーテルやベンゼンのような有機溶媒には溶けにくいです。また、アミノ酸は加熱していくと、両性イオン間のイオン結合が切れて融点に達する前に、分子内の共有結合の一部が切れて、分解してしまうことが多いです。
アミノ酸は、酸としても塩基としても働く両性体です。したがって、酸として働くときは、強塩基にプロトンH+ を与え、また塩基として働くときは、強酸からプロトンH+ を受け取るというように、2つの異なる挙動を示します。この挙動は、平衡式で次の図.6のように表現できます。
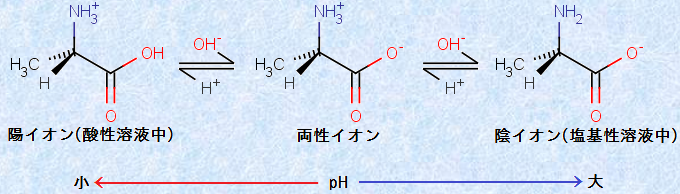
図.6 アミノ酸は、水溶液中でこのような電離平衡の状態にある
アミノ酸の水溶液では、陽イオン・両性イオン・陰イオンが平衡状態にあり、pHの変化により、その組成が変わります。特に、これらの平衡混合物の電荷が全体として0となるときのpHを、「等電点(isoelectri point)」といいます。等電点では、ほとんどのアミノ酸が、電気的に中性な両性イオンの状態になっていますが、溶液中にわずかに残っている陽イオンと陰イオンの濃度も、必ず等しくなっています。等電点の値は、だいたいpH=5〜6のものが多いですが、酸性アミノ酸のグルタミン酸はpH=3.2、塩基性アミノ酸のリシンはpH=9.7など、アミノ酸の種類によって多少異なります。
等電点では、ほとんどのアミノ酸が両性イオンになっています。そのため、等電点にあるアミノ酸の水溶液に電圧をかけても、アミノ酸分子は移動しません。しかし、等電点よりpHが小さいと、プロトンH+ を受け取って陽イオンとなり陰極側へ、等電点よりpHが大きいと、プロトンH+ を失って陰イオンとなり陽極側へ移動します。等電点の異なるアミノ酸の混合溶液に、適当なpHの下で電圧をかけると、陽極側と陰極側へそれぞれが移動するために、等電点の異なるアミノ酸を分離することができます。この手法は、「電気泳動法(electrophoresis)」と呼ばれています。
(ii) ニンヒドリン反応
「ニンヒドリン」は、アミノ酸の検出と定量を目的として用いられる試薬です。この化合物は、環状トリケトン水和物の構造を持っており、アミノ酸と反応して、「ルーへマン紫(Ruhemann's purple)」という紫色の色素を生成します。実験では、中性〜弱酸性のアミノ酸水溶液に、薄いニンヒドリン水溶液を加えて温めると、水溶液は青紫〜赤紫に呈色します。この反応を、「ニンヒドリン反応(ninhydrine reaction)」といいます。
この反応の注目すべき点は、アミノ酸の窒素原子Nだけが、この紫色色素の生成に関与しており、残りの部分は、アルデヒドRCHOや二酸化炭素CO2などに分解してしまうことです。この色素は、第一級アミノ基の-NH2を持っているアミノ酸なら、どれからでも生成します。そのため、アミノ酸だけでなく、アンモニアNH3やタンパク質中に含まれる末端のアミノ基(-NH2)とも反応します。また、アミノ酸の濃度が大きいほど、濃い紫色に発色するので、アミノ酸の定量にも利用できます。その他、ニンヒドリンは多くの捜査で、潜在指紋の検出薬としても使われています。
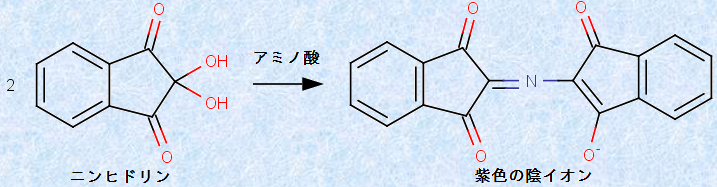
図.7 ニンヒドリン反応
(iii) ペプチド結合
アミノ酸は、カルボキシ基(-COOH)とアミノ基(-NH2)を持っているので、アミノ酸同士で縮重合することができます。この縮合で生じる「-CO-NH-結合」は、一般的に「アミド結合」と呼ばれますが、アミノ酸同士から生じるアミド結合を、特に「ペプチド結合(peptid bond)」といいます。2個のアミノ酸が縮合したものは「ジペプチド(dipeptid)」、3個のアミノ酸が縮合したものは「トリペプチド(tripeptid)」、多数のアミノ酸が縮合したものは「ポリペプチド(polypeptid)」と呼ばれます。タンパク質は、巨大なポリペプチドを主な構成単位としています。
例として、次の図.8に、アラニンとグリシンのジペプチドの構造を示します。なお、このジペプチドには、2つの可能性があります。それは、「グリシルアラニン」と「アラニルグリシン」です。グリシルアラニン構造では、グリシンがアラニンの置換基となったアミノ酸と考えることができ、アラニルグリシンでは、アラニンがグリシンの置換基となったアミノ酸と考えることができます。
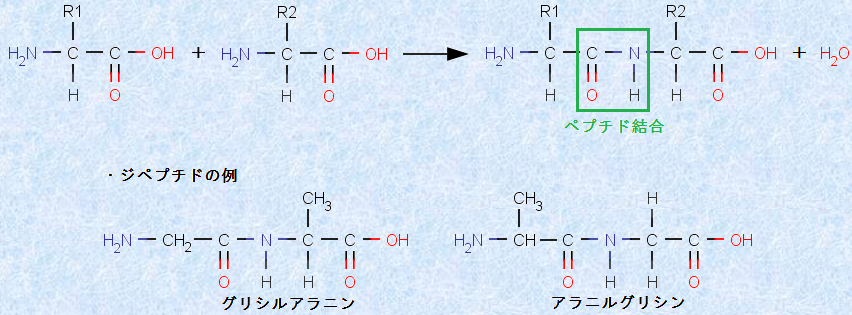
図.8 アラニンとグリシンからなる2種類のジペプチド
(2) タンパク質
「タンパク質(protein)」は、数多くのアミノ酸が、互いにペプチド結合によって繋がっている生体高分子です。分子量がおよそ1万以上のものをタンパク質と呼びますが、ポリペプチドとタンパク質の間に明確な境界はなく、例えば、分子量がおよそ6,000のインスリンも、タンパク質と呼ばれています。
タンパク質は、生命系における、無数といえるほどの生命現象の役割を果たしています。英語名の「protein」という言葉は、生命活動で最も重要な役割を果たす物質という意味から、ギリシア語の「第一人者」を意味する「proteios」から名付けられました。あるものは筋肉や皮膚、爪、毛髪などの構造組織の主成分であり、あるものは生命系の中である分子を移動させるために働いています。さらに、あるものは生命を維持するために、必要な数多くの生化学反応における触媒として働いているのです。ヒトの場合、質量で15〜18%程度がタンパク質で構築されており、これは水に次ぐ多さです。天然のタンパク質を構成するアミノ酸は約20種類ですが、アミノ酸の種類や配列順序、数の違いにより、数多くの組み合わせが可能になってきます。ヒトでは、2万種類以上のタンパク質が作られており、非常に多様なタンパク質が存在しています。
(i) タンパク質の高次構造
生物体内で起こっている反応は、「DNA」の情報をもとに合成された物質によって行われています。DNAでの情報は、たった4種類の核酸塩基「アデニン」・「グアニン」・「チミン」・「シトシン」が並んでいるに過ぎません。これらは、アミノ酸の縮合順序のみを決めているのです。このようなタンパク質を構成するアミノ酸の配列順序を、タンパク質の「一次構造(primary structure)」といいます。1955年、ウシのインスリンを構成するアミノ酸51個の配列が、初めてイギリスの生化学者であるフレデリック・サンガーによって明らかにされました。サンガーは、インスリンをいくつかのペプチドに分割し、それぞれのペプチドからアミノ酸を1個ずつ切り離して、その種類を約10年の歳月をかけて決定しました。この研究によって、タンパク質がアミノ酸の連結したものであることが、最終的に確かめられたのです。このようなタンパク質における研究が評価され、1958年にはサンガーに対して、ノーベル化学賞が贈られています。現在では、多くのタンパク質のアミノ酸配列が、多くの研究者によって明らかにされつつあります。

図.9 フレデリック・サンガーは、インスリンの一次構造の特定に初めて成功し、1958年にノーベル化学賞を受賞した
タンパク質は、アミノ酸が1列に配列した長い分子鎖からできています。そのため、一見するとその形状は、無定形で不確定なもののように想像しがちです。しかし、この予想は正しくありません。ポリペプチドは、1本の鎖状高分子であるに過ぎませんが、「水素結合」や疎水基間の「ファンデルワールス力」、「ジスルフィド結合(-S-S-)」などにより、立体的な構造に「フォールディング(folding)」されているのです。このように立体的な構造を取ることによって、タンパク質は引っ張り力や圧縮力に強くなり、外力に対する抵抗性が増します。また、外部から熱が加えられても、水素結合やファンデルワールス力の切断に熱が使われるので、熱に対する抵抗性も増します。
多くのタンパク質のポリペプチド鎖は、右巻きのらせん構造を取ることが多く、この構造を「α -ヘリックス(α -helix)」といいます。1本のポリペプチド鎖のうちで、ペプチド結合のN-H基と、別のペプチド結合のC=O基が、分子内で「水素結合」をすることにより、らせん構造は堅固に固定化されています。このらせん1巻きには、平均3.6個のアミノ酸単位が含まれており、あるアミノ酸から見て4番目のアミノ酸との間に、規則的に「水素結合」が繰り返されています。また、アミノ酸の側鎖Rはできるだけ立体障害が小さくなるようにらせんの外側に、水素原子はらせんの内側に必ず向いています。この構造は、毛髪や爪を作る「ケラチン」、筋肉を作る「ミオシン」などによく見られます。
ちなみに、日本では、戦中戦後の物資不足時代には、毛髪に含まれる「ケラチン」を塩酸HClで加水分解して、α -アミノ酸の「システイン」を得ていました。そこから得られる量は、システイン生産量全体の7割にも及び、そこから醤油に似た調味料を作っていたといいます。ただし、この調味料は揮発成分に乏しく、香りの点で本物に劣り、またコスト的にも商業レベルの実用には堪えないものであったといいます。毛髪から調味料が作られていたなんて、今からするとぞっとする話ですが、現在では、この方法は一切行われていないので安心してください。
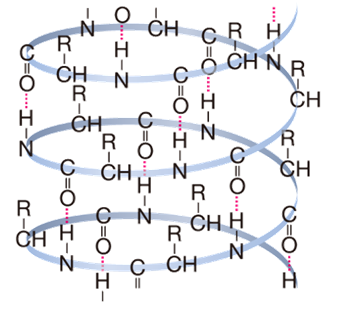
図.10 α -ヘリックスの構造
また、平行に隣り合ったポリペプチド鎖同士が、折れ曲がって並んだひだ状構造を取ることもあります。この構造を、「β -シート(β -sheet)」といいます。この構造は、ペプチド結合のN-H基とC=O基が、隣り合うポリペプチド鎖間で「水素結合」することにより、安定に保たれています。この構造は、絹糸の「フィブロイン」のような繊維状タンパク質に見られます。
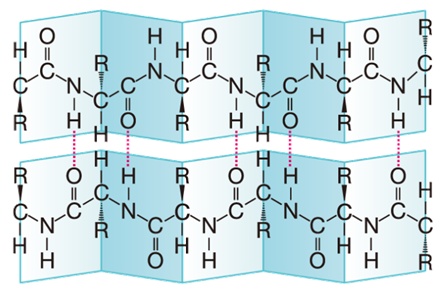
図.11 β -シートの構造
「α -ヘリックス」や「β -シート」のようなポリペプチドの立体構造を、タンパク質の「二次構造(secondary structure)」といいます。なお、この「α」と「β」は、発見された順番を表しているだけで、化学的に何らかの意味がある訳ではありません。α -ヘリックスが先に発見されたので、こちらに「α」の文字が付けられました。構成単位であるアミノ酸の側鎖Rが大きいものが多いと、β -シートよりもα -ヘリックスの方が安定となります。また、タンパク質の二次構造には、α -ヘリックスやβ -シートが不規則に連なった「ランダムコイル(random coil)」も含まれます。
さらに、多くのタンパク質は、α -ヘリックスとβ -シートの組み合わせや、構成アミノ酸の官能基間による「水素結合」や「ジスルフィド結合(-S-S-)」の形成、疎水基間の「ファンデルワールス力」などにより、分子全体が複雑な立体構造を作ります。このようなポリペプチドに、「糖」や「脂質」などの分子が結合することもあります。このような三次元的な構造を、タンパク質の「三次構造(tertiary structure)」といいます。この三次構造により、それぞれのタンパク質特有の構造が保たれており、分子の立体構造は、タンパク質の機能に重要な役割を果たしています。一般的に、体内には多量の水が存在するので、親水基を外側に向け、疎水基はできるだけ内側に向けるような三次構造を取りやすいです。
最初に三次構造が明らかになったタンパク質は、筋肉中で酸素の貯蔵と運搬を行う「ミオグロビン」です(1958年)。筋肉中にあるミオグロビンは、酸素分子を貯蔵する複合タンパク質(色素タンパク質と球状タンパク質)で、1本のポリペプチド鎖(8個のα -ヘリックスを持つ)と1分子のヘム(2価の鉄原子を中心金属とする錯体)から構成されています。次の図.12で、リボンのように見える部分は、α -ヘリックスを表しています。
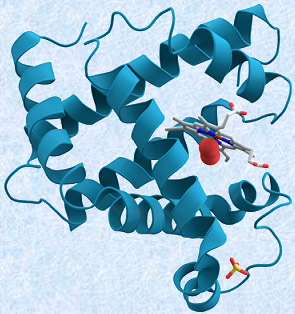
図.12 ミオグロビンは筋肉中にあって、酸素O2を代謝に必要なときまで貯蔵する色素タンパク質である
どんな生物のタンパク質も、平均数百個のアミノ酸で作られていますが、このうちの1個が異なるだけでも、生理機能が変わってしまう可能性があります。そのメカニズムを説明すると、DNAの塩基配列に突然変異が起こると、塩基配列が変わります。すると、翻訳されるアミノ酸の種類が変わり、タンパク質のアミノ酸配列も変化するのです。その結果、タンパク質の立体構造が変わり、タンパク質の生理機能が変化します。
よく知られているのは、赤血球中に含まれる「ヘモグロビン」の異常によって生じる「鎌状赤血球貧血」という病気です。この病気になると、ヘモグロビンが草刈り鎌のような尖った形(三日月形)になってしまい、酸素が運びづらくなって重度の貧血になります。通常ヘモグロビンは、「α鎖」と「β鎖」が2個ずつ集合した「四量体」と呼ばれる構造を取り、それぞれ141個、146個のアミノ酸から成り立っています。しかし、遺伝子の突然変異によって、このうちのβ鎖の6番目のアミノ酸が、「グルタミン酸」から「バリン」に変わるだけで、重篤な貧血症状を引き起こすことが分かっています。こうしたタンパク質中のアミノ酸の変異は、「ミスセンス変異(missense mutation)」と呼ばれ、多くの遺伝性疾患の原因になっています。
ところで、この鎌状赤血球貧血の遺伝子を持っていると、マラリアにかかりにくくなることが知られています。マラリアは、蚊がマラリア原虫を介して伝染させます。人を刺したときに、血液中にマラリア原虫が入り込むと、赤血球の中で増殖します。しかし、三日月形の鎌状赤血球の中では、マラリア原虫が育ちにくいのです。鎌状赤血球貧血の遺伝子は「潜性遺伝」で、父親と母親の両方から変異型の潜性遺伝子を受け継ぐ(変異型の潜性遺伝子を2つ持つ)と発症します。ただし、父親か母親のどちらか一方の遺伝子が変異しているだけの場合は、赤血球が鎌状になるものの、重度の貧血を起こさないことが分かりました。このタイプの赤血球はマラリアに感染しにくいので、一定のリスクを負ってでも、遺伝的変異が広まった方が、子供が生き延びる確率が全体として高くなるのです。このように、環境によっては病気を起こすからといって、悪い遺伝子とはいえなくなるのです。
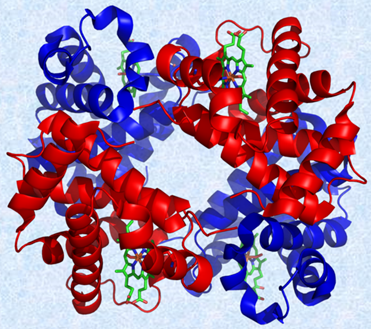
図.13 ヘモグロビンは、酸素O2と結合する性質を持ち、肺から全身へと酸素O2を運搬する役割を担っている
(ii) タンパク質の分類
タンパク質は、その形状から、「繊維状タンパク質(fibrous protein)」と「球状タンパク質(globular protein)」に大別されます。「繊維状タンパク質」は、ポリペプチド鎖が何本も束になって繊維状となった構造物質であり、その役割のために、水に不溶なものが多いです。動物の筋肉や結合組織を作っているので、物理学的にも化学的にも安定です。この種類のタンパク質は、すでにいくつか紹介していますが、「ケラチン」・「コラーゲン」・「フィブロイン」の3つに分類することができます。ケラチンは、皮膚や毛髪、羽、爪など保護を目的とする組織であり、コラーゲンは、軟骨組織や血管などの結合組織です。フィブロインは、クモの巣やカイコの繭を構成するタンパク質です。

図.14 フィブロインは、人体との親和性が高く、生体適合性に優れるので、人工皮膚などにも応用されている
それに対し、「球状タンパク質」は、疎水基を外側に向けた構造をしているので水溶性であり、名称が示すように、球形に近い形をしています。そして、球状タンパク質は、一般的に構造的物性よりも、生物学的に重要な役割を果たしているものが多いです。球状タンパク質は、「酵素」・「ホルモン」・「運搬タンパク質」・「貯蔵タンパク質」の4つに分類することができます。酵素は、生物学的触媒として働くものであり、ホルモンは、生物学的作用を調整する化学的前駆体です。運搬タンパク質は、血液中で酸素を運ぶ「ヘモグロビン」のように、体の一部から他の部分へ小さな分子を運搬するタンパク質です。貯蔵タンパク質は、卵白の「オボアルブミン」のように、食品貯蔵庫のような役割をするタンパク質です。
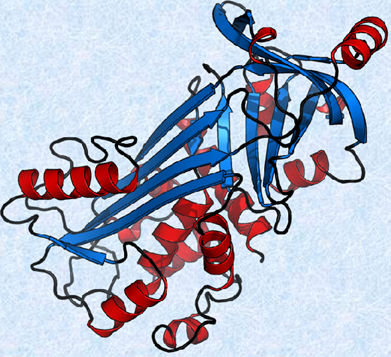
図.15 オボアルブミンは、卵白を構成する主要なタンパク質である
また、タンパク質は、その構成成分でも分類されます。タンパク質を加水分解したとき、アミノ酸のみを生じるものを「単純タンパク質(simple protein)」、アミノ酸以外に糖類や色素、核酸、脂質、リン酸などを生じるものを「複合タンパク質(conjugated protein)」といいます。複合タンパク質には、糖類を含む卵白や、色素を含むヘモグロビンやクロロフィル、リン酸を含む牛乳のカゼインなどがあります。複合タンパク質は、生体内での特殊な機能を司っているものが多いです。単純タンパク質を構成する成分元素の質量百分率は、タンパク質の種類に関係なく、ほぼ一定です。窒素Nの質量百分率が16%前後の値を取ることが多いため、窒素量の100/16=6.25倍を「粗蛋白量」と定義しています。例えば、ある食品中の窒素Nの含有量を求め、その値を6.25倍すれば、その食品に含まれるタンパク質の含有量が求められます。次の表.3に、「単純タンパク質」の元素組成を示します。
表.3 単純タンパク質の元素組成
|
成分元素 |
炭素C |
酸素O |
窒素N |
水素H |
硫黄S |
|
質量百分率 |
50〜55% |
19〜24% |
15〜19% |
7〜8% |
0〜2.5% |
(iii) タンパク質の性質
(iii-1) タンパク質の変性
タンパク質の水溶液に、硫酸ナトリウムNa2SO4や塩化マグネシウムMgCl2などの塩の水溶液を多量加えると、沈殿が生じます。これは、加えた電解質がタンパク質を取り巻いていた水分子を奪い取ったために、親水コロイドであるタンパク質の「塩析」が起こったからです(コロイド化学を参照)。また、タンパク質水溶液を加熱すると、立体構造を保っている「水素結合」や「ファンデルワールス力」などが切れ、分子の形状が変化して、性質が変わります。これを、タンパク質の「熱変性(thermal denaturation)」といいます。加熱により、タンパク質の一次構造が変化することはほとんどありません。しかし、二次以上の高次構造は、比較的崩れやすいです。例えば、卵を加熱すると、熱変性によってタンパク質の凝固が起こり、ゆで卵のようなゲル状になります。この場合は、タンパク質の立体構造に変化を生じているので、変化は不可逆的です。ちなみに、変性を起こしたタンパク質には消化酵素が働きやすくなり、栄養素として体内に吸収されやすくなります。なお、塩析の場合は、タンパク質の立体構造に変化を生じている訳ではないので、塩を取り除くなどをして、タンパク質の水和水を戻してやれば、再び元の状態に戻ります。ただし、電解質があまりに高濃度の場合や長時間放置したものは、元の状態に戻らないことが多いです。
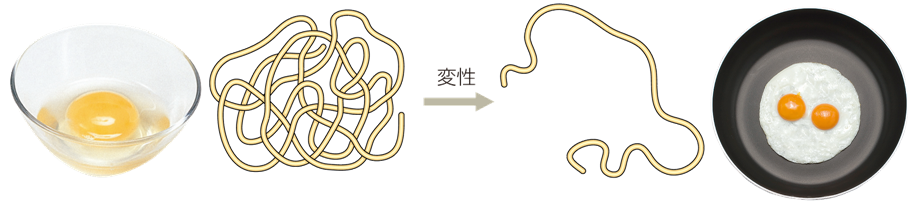
図.16 卵のタンパク質の熱変性は、不可逆的な変化である
また、タンパク質は、pHの変化によっても「変性(denaturation)」します。pHが極端に変化すると、タンパク質表面や内部の置換基の荷電状態が変化します。これにより、分子の立体構造にストレスがかかり、タンパク質の変性が起こるのです。また、タンパク質の中には、金属イオンを含んでいるものがありますが、銅(II)イオンCu2+ や鉛イオンPb2+ などの重金属イオンを加えると、重金属イオンが内部の金属イオンと置換するために、タンパク質の機能が失われます。このようなときも、変性と呼びます。タンパク質にアルコールなどの有機溶剤を加えた際にも、変性は起こります。これは、有機溶剤の影響で、内側にあった疎水基が外側に飛び出てきて、立体構造に変化が生じるためです。60〜95%エタノール水溶液を消毒薬に用いるのは、エタノールが細菌のタンパク質を変性させることを利用したものです。一般的には、複雑な構造の球状タンパク質の方が、単純な構造の繊維状タンパク質よりも変性を受けやすいです。
ところで、かつてはタンパク質の熱変性は、不可逆的な変化であると考えられていました。例えば、調理した卵の白身は、冷めても硬くて白いままで、ねばねばした透明な状態には戻りません。しかし、最近になって、比較的弱い損傷なら、多くのタンパク質は修復して、正しい構造を再生することが可能であることが分かってきました。例えば、生体内には、「シャペロン(chaperone)」というタンパク質の変性を抑制するタンパク質があります。シャペロンには、いくつかの種類があり、その多くは、「ヒートショックプロテイン(Heat Shock Protein:HSP)」です。ヒートショックプロテインは、細胞が熱などのストレス条件下にさらされた際に、発現が上昇することが知られています。ある研究によれば、40〜42℃の温度で入浴することで、ヒートショックプロテインが活性化し、健康な身体になるといいます。シャペロンの多くは、まだまだ研究段階ですが、最近では、タンパク質の立体構造そのものを修理するシャペロンが発見されました。このシャペロンを加えた卵白は、加熱しても変性しません。シャペロンの研究が進めば、いずれ「ゆで卵を生卵に戻すこと」も可能になるかもしれません。
図.17 ヒートショックプロテインは、細菌感染や炎症、活性酸素、紫外線、飢餓などの様々なストレスにより、誘導されることが知られている
(iii-2) ビウレット反応
タンパク質水溶液に、水酸化ナトリウムNaOH水溶液を加えて塩基性にしたあと、薄い硫酸銅(II)CuSO4水溶液を少量加えると、ペプチド結合部位で銅(II)イオンCu2+ と配位結合を形成して、赤紫色に呈色します。この反応を、「ビウレット反応(biuret reaction)」といいます。ビウレット反応は、次の図.18に示すように、2つ以上のペプチド結合を持つペプチド、すなわちトリペプチド以上のペプチドで見られます。これは、図.18のような五員環構造の錯体を形成するときに、2つ以上のペプチド結合で挟み込むようにして配位結合する必要があるからです。このような錯体を、「カニのハサミ」を意味するラテン語「chela」にちなんで、「キレート錯体(chelate complexes)」といいます。アミド基(-NHCO-)の窒素原子に結合している水素原子Hは、隣接する位置にカルボニル基(-CO-)が存在するために、わずかに酸性度が高くなっています。そこで、水溶液を塩基性にすると、プロトンH+ の電離がかなり起こるのです。そうすると、アミド基(-NHCO-)の窒素原子Nは電子豊富になり、銅(II)イオンCu2+ と錯体を作りやすくなります。
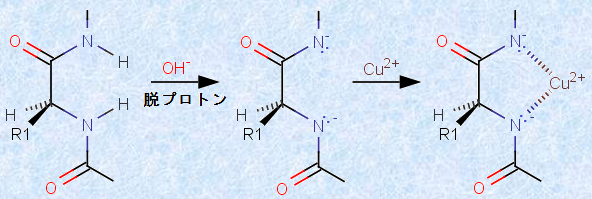
図.18 ビウレット反応の原理
(iii-3) キサントプロテイン反応
タンパク質水溶液に、濃硝酸HNO3を加えて加熱すると黄色沈殿を生じ、冷却後に、アンモニア水などを加えて塩基性にすると橙色になります。これを、「キサントプロテイン反応(xanthoprotein reaction)」といいます。「キサント(xantho)」は、ギリシア語で「黄色の」という意味です。ほとんどのタンパク質は、「チロシン」や「フェニルアラニン」のような側鎖にベンゼン環を有するアミノ酸を、構成単位の1つとして持っています。この呈色は、そのベンゼン環が「ニトロ化」されて、黄色になったことによると考えられています。
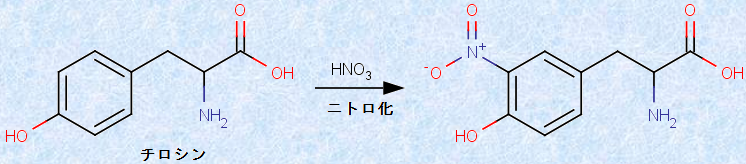
図.19 チロシンのニトロ化反応
濃硝酸HNO3を加えた直後は、タンパク質の変性により白色沈殿を生じますが、加熱をするとベンゼン環のニトロ化が起こって、沈殿は次第に黄色へ変化していきます。なお、アンモニアNH3を加えたときに、さらに橙色に変化するのは、チロシンのフェノール性ヒドロキシ基のプロトンH+ が電離するためです。フェニルアラニンの場合は、電離できるプロトンH+ がないので、アンモニアNH3を加えても色は変化しません。また、最近の報告によると、フェニルアラニンはベンゼン環の活性が弱いので、キサントプロテイン反応がそもそも起こりにくいといいます。しかしながら、チロシンを含まないタンパク質はまれなので、事実上、すべてのタンパク質はキサントプロテイン反応を示すことになります。

図.20 卵白のキサントプロテイン反応
(iii-4) 硫黄Sの検出反応
タンパク質水溶液に、水酸化ナトリウムNaOH水溶液を加えて加熱すると、ジスルフィド結合(-S-S-)が切れてチオール基(-SH)に戻り、さらに水酸化物イオンOH- による求核置換反応が起こって、硫化水素イオンHS- が遊離します。そして、硫化水素イオンHS- は、すぐに中和されて硫化物イオンS2- になります。この液に、鉛(II)イオンPb2+ を加えておくと、硫化鉛(II) PbSの黒色沈殿が生じます。この反応は、「システイン」のような硫黄Sを含むアミノ酸を構成単位とするタンパク質で起こります。なお、「メチオニン」のCH3S-は、「システイン」のHS-に比べて、硫化物イオンS2- がかなり電離しにくいため、水酸化ナトリウムNaOH水溶液を用いた方法では、完全に検出することはできません。また、鉛(II)イオンPb2+ は両性イオンなので、アルカリ性溶液中で、水酸化鉛(II) Pb(OH)2として沈殿することはありません。
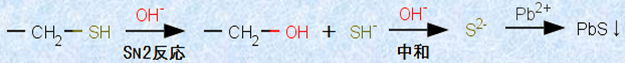
図.21 硫黄Sの検出反応
(3) 酵素
(i) 酵素の性質
「酵素(enzyme)」は、100〜1,000個程度のアミノ酸でできた、タンパク質を主体とした高分子化合物です。タンパク質の種類で見たときに最も多いのが酵素であり、タンパク質の約半数が酵素だともいわれています。現在、ヒトの体内だけでも約4,000種の酵素が発見されています。酵素は、生体内の化学反応に対して、「触媒」として働きます。酵素は、無機触媒に比べて、はるかに強い触媒作用を示します。例えば、デンプン水溶液に酵素「アミラーゼ」を加えて約40℃に保つと、デンプンは加水分解されて、マルトースやグルコースなどに変化します。また、食事で摂取したタンパク質は、タンパク質分解酵素である「プロテアーゼ」の働きで、生体内でアミノ酸にまで加水分解されます。「カタラーゼ」という酵素は、活性酸素の一種である過酸化水素H2O2を、無害な水H2Oと酸素O2に分解しています。1分子のカタラーゼは、毎秒20万個もの過酸化水素H2O2を分解しています。私たちの体内で起こっている化学反応を、フラスコ内で起こそうとすると、通常かなりの高温を必要とします。しかし、生体内の種々の反応は、約40℃という穏やかな条件でも速やかに進みます。これは、触媒として働く様々な酵素が存在するからに他ありません。
酵素の中には、食品に含まれるものもあります。例えば、パパイヤやキウイ、パイナップルなどにはタンパク質分解酵素の「プロテアーゼ」が含まれており、食肉を軟らかくする効果があるため、食肉の軟化剤としての利用がされています。プロテアーゼは洗剤にも配合されており、タンパク質による汚れの分解を促進します。プロテアーゼはウグイスの糞にも含まれており、平安時代から、和服のシミ抜きに応用されてきました。また、プロテアーゼは、顔のシミや肌のタンパク質を分解することにより、肌を白くするとされています。そのため、ウグイスの糞は、女性によって、昔から美肌を作るためにも使われ続けました。次の表.4に、主な酵素とその働きを示します。酵素名には、「ペプシン」や「トリプシン」のような慣用名が使われることもありますが、通常は反応の種類や基質の名称に、語尾「アーゼ(ase)」を付けて命名されます。
表.3 主な酵素とその働き
|
名称 |
基質 |
生成物 |
所在 |
||
|
アミラーゼ |
糖 類 |
デンプン |
マルトース |
唾液、膵液、麦芽 |
|
|
マルターゼ |
マルトース |
グルコース |
小腸壁、唾液、膵液 |
||
|
インベルターゼ (またはスクラーゼ) |
スクロース |
転化糖 (グルコースとフルクトース) |
植物、酵母菌、カビ、小腸壁 |
||
|
ラクターゼ |
ラクトース |
グルコースとガラクトース |
植物、細菌類、小腸壁 |
||
|
チマーゼ |
グルコース |
エタノールと二酸化炭素 |
酵母菌 |
||
|
セルラーゼ |
セルロース |
セロビオース |
植物、菌類、細菌類 |
||
|
プロテ アーゼ |
ペプシン |
タンパク質 |
ペプチドやアミノ酸 |
胃液 |
|
|
トリプシン |
タンパク質 |
ペプチドやアミノ酸 |
膵液 |
||
|
ペプチダーゼ |
ペプチド |
アミノ酸 |
膵液、小腸壁 |
||
|
リパーゼ |
油脂 |
高級脂肪酸とモノグリセリド |
膵液、胃液、植物 |
||
|
カタラーゼ |
過酸化水素 |
酸素と水 |
血液、肝臓、植物 |
||
さて、酵素や反応物は、体内の各細胞や血液中などに混在しています。それにもかかわらず、酵素は、自分が触媒すべき反応物(基質)をしっかりと識別して、誤りなく反応を進めることができます。これは、酵素は立体的に複雑な構造を形成していて、触媒作用を行う活性点付近に、特定の基質のみが上手くはまり込む「穴」を有しているからです。これは、よく「カギ」と「カギ穴」の関係に例えられます(1894年のフィッシャーによる「カギとカギ穴説」)。基質が「カギ」で、酵素に開いている穴が「カギ穴」です。この穴の表面には、種々の官能基があり、基質の官能基とイオン結合などの相互作用をすることで、基質を固定します。この穴に捉えられた基質は、分子鎖の運動ができない上に、効率よく反応を受ける環境に置かれるため、素早く構造変化を受けて生成物になり、その穴に適合できなくなってから、酵素から離れます。その結果、酵素は特定の基質だけを捉え、効率的に反応を進めることができるのです。このような性質を「基質特異性(substrate specificity)」といい、無機物質の触媒には見られない性質です。
例えば、膵臓から分泌されるタンパク質分解酵素の「トリプシン」は、塩基性アミノ酸の「リシン」のカルボキシ基(-COOH) 側のペプチド結合を選択的に加水分解します。これは、トリプシンの表面にリシンがすっぽりと入り込むような穴が開いていて、その穴の底にはアスパラギン酸の-COO− があり、リシンの-NH3+ とイオン結合することで、基質のリシンを固定するからです。そのため、この穴には、リシンのような塩基性アミノ酸だけが入ることになります。この他の酵素も、基本的には同じような原理で、穴の大きさが変わったり、穴の底のアミノ酸の種類が変わったりすることで、基質を選択的に固定しています。
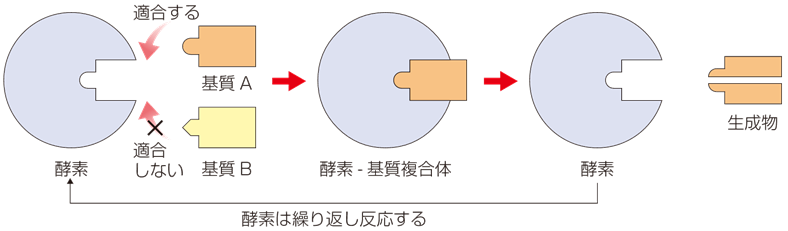
図.22 酵素の「カギとカギ穴説」
酵素が基質に作用するには、酵素が基質と結びつく必要があります。しかし、pHの変化や加熱により、酵素タンパク質が変性し、酵素の活性部位の立体構造が大きく変化すると、酵素は基質を受け入れることができなくなり、酵素の働きが失われます。このことを、酵素の「失活(deactivation)」といいます。酵素が失活してしまうと、再び元の状態に戻しても、その働きは回復しません。
酵素や基質の立体構造や電離基の電子状態は、pHにより変化するので、酵素ごとに最もよく働くpHがあります。このpHを、「最適pH(optimum pH)」といいます。例えば、唾液に含まれるアミラーゼの最適pHは約7で、弱塩基性の膵液に含まれるトリプシンの最適pHは約8など、多くの酵素では、最適pHは6〜8の中性付近です。しかし、強酸性の胃液に含まれるペプシンの最適pHは約2であり、pHが7以上では全く働きません。このように最適pHは、酵素の種類によって異なっています。
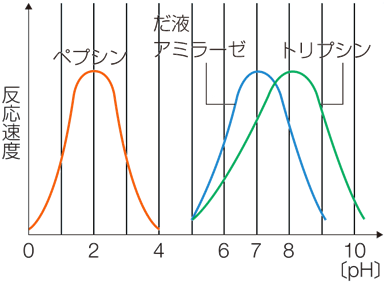
図.23 酵素の最適pH
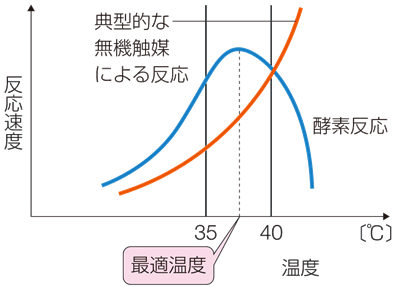
また、一般的な化学反応では、温度を上げると、活性化エネルギーを超す分子数が増加するので、反応速度は大きくなります。無機触媒でも、温度が高くなるほど、反応速度は大きくなります。しかし、酵素が作用する反応では、ある温度までは反応速度は大きくなりますが、それ以上の温度になると、急激に反応速度が小さくなります。これは、酵素がタンパク質であるために、ある温度以上では、高温になるほど熱変性が進み、触媒としての機能を失うからです。多くの酵素は、60℃以上で活性部位の立体構造が変化して、失活してしまいます。反応速度が最大となる温度を、「最適温度(optimum temperature)」といい、恒温動物では、体温付近の35〜40℃にあるものが多いです。60℃以上の高温では、タンパク質の熱変性が起こるため、酵素反応のグラフは左右非対称となります。
(ii) ミカエリス・メンテンの式
酵素Eと基質Sが結合して、酵素-基質複合体ESを形成する反応は、可逆反応です(E+S ⇄ ES)。さらに、酵素-基質複合体ESから生成物Pが生じ、酵素Eが再生される反応は、ゆっくりと進む不可逆反応です(ES→E+P)。このような一連の変化を踏まえ、ドイツの生化学者レオノール・ミカエリスとカナダの生化学者モード・メンテンは、酵素Eの濃度が一定であるときの、基本的な酵素反応の反応速度を表す式を示しました。この式を「ミカエリス・メンテンの式(Michaelis-Menten equation)」といいます。
E + S ⇄ ES → E + P
![]()
ここで、vは反応速度、[S]は基質濃度、Kmはミカエリス定数、Vmaxは最大反応速度を示します。酵素の量を一定にしていたとき、酵素反応の速度vは、基質濃度[S]が小さいときは[S]に比例し、基質濃度[S]がある程度大きいときは一定(v=Vmax)になります。この式をグラフにすると、次の図.23のようになります。
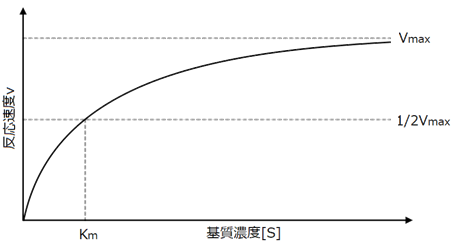
図.25 基質濃度と反応速度の関係
基質濃度[S]が低いときは、相対的に酵素が余剰にある状態なので、反応速度vは基質濃度[S]に従って上昇します。しかし、基質濃度[S]が高いときには、すべての酵素が基質と結合してしまっており、基質濃度[S]が増えても反応速度vは変化しません(v=Vmaxで一定となる)。このことから、酵素の働きには、限界があることが分かります。ミカエリス定数Kmは、基質と酵素の親和性を表す重要な値で、ミカエリス定数Kmが小さいと基質との親和性が高く、ミカエリス定数Kmが大きいと基質との親和性が低いということになります。つまり、ミカエリス定数Kmが小さい基質ほど、その酵素にとって働きやすい基質ということになります。
(4) 核酸
(i) 核酸
生物の細胞には、「核酸(nucleic acid)」という高分子化合物が存在しており、遺伝情報の伝達の中心的な役割を果たしています。スイスの生理学者であるフリードリッヒ・ミーシェルは、白血球の研究のために、包帯についた膿を大量に病院から集めていました。1869年、ミーシェルは膨大な量の膿(白血球の死骸)を分析して、白血球の細胞の核から謎の酸性物質を発見し、未知の有機化合物と大量のリン酸を含んだこの物質を、「細胞の核から得られた酸性物質」という意味で、「核酸」と名付けました。当時、この未知の物質が、遺伝を司る遺伝子の本体であることに気付く人はいませんでした。
この発見の4年前、チェコの修道士グレゴール・ヨハン・メンデルが、エンドウ豆の交配から遺伝には法則性があり、「遺伝子」というものが情報を運んでいるという画期的な論文を発表していました。しかし、研究者ではなく、単なる修道士が書いた論文だとして、誰からも注目されずに埋もれたままになっていました。そして、ミーシェルが発見した核酸こそが、実はその遺伝子の実体であると分かるまで、さらに80年もの歳月がかかったのです。
核酸の単量体を「ヌクレオチド(nucleotide)」といい、その中の五炭糖に窒素Nを含む有機塩基が共有結合した部分を「ヌクレオシド(nucleoside)」といいます。このヌクレオシドのヒドロキシ基(-OH)とリン酸(H3PO4)がエステル結合すると、ヌクレオチドの構造が形成されます。核酸は、ヌクレオチド同士がC-3位のヒドロキシ基(-OH)ともう一方のヌクレオチドのリン酸部分のヒドロキシ基(-OH)で縮合重合した、ポリヌクレオチドです。
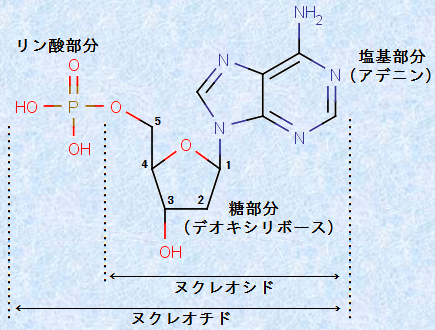
図.26 DNAのヌクレオチドの構造式
核酸には、「デオキシリボ核酸(deoxyribonucleic acid:DNA)」と「リボ核酸(ribonucleic acid:RNA)」があります。DNAの接頭語の「デオキシ」というのは、「de(脱)」と「oxygen(酸素)」を繋げたもので、DNAは「酸素を失ったRNA」という意味になります。RNAでは糖部分が「リボースC5H10O5」になっているのに対し、DNAでは糖部分が「デオキシリボースC5H10O4」になっているのです。デオキシリボースのC-2位の水素原子(-H)が、ヒドロキシ基(-OH)に置換されるとリボースになります。リボースでは、C-2位のヒドロキシ基(-OH)が隣接するリン酸基と反応しやすいため、RNAはDNAよりも加水分解されやすく不安定になります。
両者は酸素原子一つの違いでありながら、その性質も働きも大きく異なります。DNAは「二重らせん構造」を取るので安定で、常温付近の温度で中性付近の液性のもとでは加水分解されず、数百万年に渡ってその構造を保ちます。しかし、RNAは「一本鎖構造」を取り加水分解されやすいため、相当気を付けて実験しないと、すぐに分解してしまうほど不安定な物質なのです。という訳で、DNAは遺伝情報を長期保存する「ROM(Read Only Memory)」の役割となり、RNAはそこからコピーした情報を編集・伝達する「RAM(Random Access Memory)」の役割を担うことになりました。RNAの不安定さは、裏を返せば「分解処理しやすい」ということであり、一時的な働きはピッタリなのです。核酸における酸素原子一つの差は、かなり大きな意味を持っているといえます。
表.4 デオキシリボ核酸(DNA)とリボ核酸(RNA)
|
|
デオキシリボ核酸(DNA) |
リボ核酸(RNA) |
|
所在 |
細胞の核内に局在する |
細胞全体に分布する |
|
役割 |
遺伝情報を伝達する |
遺伝情報を転写し、タンパク質を合成する |
|
分子量 |
106〜109程度 |
104〜106程度 |
|
糖部分 |
デオキシリボースC5H10O4 |
リボースC5H10O5 |
|
塩基 |
アデニン(A), グアニン(G), シトシン(C), チミン(T) |
アデニン(A), グアニン(G), シトシン(C), ウラシル(U) |
|
構成鎖数 |
二本鎖(二重らせん) |
一本鎖 |
(ii) デオキシリボ核酸(DNA)
DNAを構成する塩基には、ピリミジン骨格を持つ「ピリミジン塩基(pyrimidine base)」とプリン骨格を持つ「プリン塩基(purine base)」の2種類があります。ピリミジン塩基には「シトシン(cytosine, 記号C)」と「チミン(thymine, 記号T)」が、プリン塩基には「アデニン(adenine, 記号A)」と「グアニン(guanine, 記号G)」があり、それらの塩基配列は生物の種類によって様々です。生物の「遺伝情報」は、細胞核の中の染色体に存在している「DNAの塩基配列」として受け継がれているのです。生物のDNAには、タンパク質のアミノ酸配列順序が記録されており、遺伝情報に従って、特定のタンパク質が合成されます。
ヒトのゲノムの全配列が解読されたのは、2003年4月のことです。ヒトの遺伝子は、約20,500個だと分かりました。遺伝子1個の塩基数は平均で3,000個ですが、そのサイズは幅広いです。最大級のタンパク質である「ジストロフィン」は、220万個の塩基が設計図になります(体内でジストロフィンを上手く合成できなければ、筋ジストロフィー症となる)。ヒトゲノム計画の結果を見ると、ヒト同士では、30億の塩基配列のうち99.9%が同じであり、たった0.1%(300万ヶ所)の違いが、容姿や性格などの個体差をもたらしています。その他、ヒトとネコでは10%、ヒトとウシでは20%、ヒトとネズミでは25%、ヒトとハエでは40%、ヒトとバナナでは50%の違いが、塩基配列にあるといわれています。
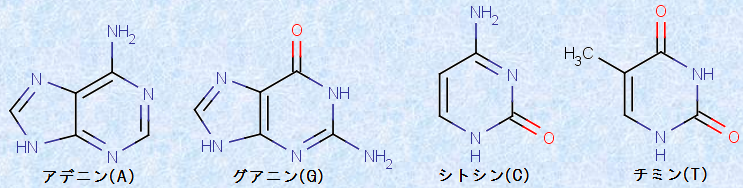
図.27 DNAの塩基は、アデニン(A)・グアニン(G)・シトシン(C)・チミン(T)の4種類しかない
種々の生物のDNAの塩基組成を調べた結果、アデニン(A)とチミン(T)およびグアニン(G)とシトシン(C)は、常に等物質量ずつ存在することが分かっています。これを1950年に初めて発見したのは、オーストリアの生化学者であるエルヴィン・シャルガフです。これを「シャルガフの法則(Chargaff’s rule)」といいます。等物質量の組を作っている理由は、アデニン(A)とチミン(T)は2本の水素結合、グアニン(G)とシトシン(C)は3本の水素結合で、互いに「塩基対(base pair)」を作っているからです。シャルガフの研究結果は、DNAの分子構造の発見に繋がる重要な業績となりました。
|
アデニン(A)・・・2本の水素結合を介してチミン(T)と結合 シトシン(C)・・・3本の水素結合を介してグアニン(G)と結合 グアニン(G)・・・3本の水素結合を介してシトシン(C)と結合 チミン(T)・・・2本の水素結合を介してアデニン(A)と結合 |
なお、ヒトに近い動物として知られるチンパンジーとヒトでは、塩基配列に1.5%の違いがあります。1931年にアメリカの心理学者であるウィンスロップ・ケロッグが行った実験は、「チンパンジーとヒトとの違いを示した実験」として有名です。ケロッグは、環境要因と遺伝要因のどちらが子供の発育・発達に大きく影響するのかを調べるため、生後10カ月の自分の息子ドナルドを生後7カ月半のチンパンジーのグアと一緒に育てることにしました。もちろん、ケロッグの妻は猛反対しましたが、長い説得の末、ついに実現することとなったのです。
チンパンジーのグアは、人間として扱われる状況に驚くほどの適応能力を示し、人間のドナルドより優れている点が多かったのですが、1つだけ重要な例外がありました。ドナルドの方が、物事を真似る能力が高かったのです。ドナルドは、グアの鳴き声をそっくり真似してコミュニケーションを取り、19カ月のときに話せた単語はわずか3つでした。平均的なアメリカ人の子供であれば、19カ月ともなると50以上の単語を発し、2語文を使い始める時期です。要するに、ケロッグは「チンパンジーを人間のように育てよう」と計画したのですが、結局は「人間がチンパンジーのようになってしまった」のです。実験は9カ月で打ち切られ、グアは類人猿センターへと戻されましたが、本当の母親と馴染めずに翌年に死にました。
一方のドナルドは、後にハーバード大学の医学部を卒業して精神科医になりましたが、鬱病になって42歳のときに自殺しています。ドナルドの息子ジェフは、父であるドナルドの死を「45年に渡った殺人」と呼びました。ドナルドは42歳で自殺したのにも関わらず、なぜ45年としたのでしょうか?それは、ケロッグがドナルドの生まれる前の1927年から、この実験を計画していたからです。

図.28 実験の対象になったドナルドとグア
第二次世界大戦が終わって、物理学と化学の知識、方法論、研究手段が生物学に応用されるようになると、「分子生物学」という分野が生まれました。イギリスやフランス、アメリカなどで隆盛を極め、核酸やタンパク質の構造、働きについて、分子レベルの研究が大いに進みました。電子顕微鏡やX線回折法などが、大幅に取り入れられたことも大きいでしょう。「遺伝情報」を解明するには、どうしたらいいのでしょうか?それは、「DNAの分子構造」を明らかにすることです。こういう考えによって、1940年代から1950年代にかけて、生物学者や生化学者、さらには物理学者まで加わって、研究が進められました。
並みいる一流の研究者を尻目にかけて、この難問を解いたのは、無名の若い2人の科学者でした。アメリカの遺伝学者であるジェームズ・ワトソンと、イギリスの物理学者であるフランシス・クリックです。ワトソンは、アメリカから修行にやって来た25歳。クリックは、大戦中はレーダーの研究をしていた37歳でした。場所は、イギリスのケンブリッジ大学のキャベンディッシュ研究所です。彼らは、DNA結晶のX線の回折像を決め手に、DNAが「二重らせん構造」を取っていることを、1953年に突き止めたのです。そして、1953年4月25日号のネイチャー紙に、彼らはたった2ページの論文を発表し、DNAの二重らせん構造を世に示しました。この功績により、ワトソンとクリックは、1962年にノーベル生理学・医学賞を受賞しました。
DNAが二重らせん構造なのは、2本のヌクレオチド鎖が、アデニン(A)とチミン(T)、およびグアニン(G)とシトシン(C)で、塩基対を作っているからです。ヒトのDNAでは、約30億対(約60億個)の塩基が並んでいます。DNAの連続した3個ずつの塩基配列の組が、それぞれタンパク質を構成するアミノ酸1つに対応しています。例えば、「GGC」はグリシンで、「CGA」はアラニン、「AAA」はリシンという具合です。らせん構造の一巻き中には、約10組の塩基対があります。らせんの一巻きの長さは約3.4 nmなので、塩基対間の距離は0.34 nmであることになります。
ちなみに、ヒトの生命の設計図であるゲノムの全配列が解読されたのは、ワトソンとクリックがDNAの二重らせん構造を発見してから、ちょうど50年後の2003年4月のことです。「20世紀最大の発見」といわれた二重らせん構造の発見から、たった半世紀の時間で、生命の設計図であるヒトゲノムDNAの解読という偉業が成し遂げられたのです。ダーウィンの「種の起源」の出版が1859年、メンデルの「遺伝の法則」の再発見が1900年の出来事ですから、生命科学はおよそ50年刻みで大きな発展期を迎えてきたことになります。
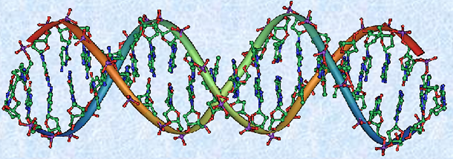
図.29 ワトソンとクリックは、DNAの二重らせん構造を発表し、この功績からノーベル生理学・医学賞を受賞した
遺伝情報をコピーするのにも、DNAの二重らせん構造が重要な役割を果たしています。DNAの二重らせん構造は、塩基間の水素結合により保たれています。しかし、DNAを水溶液中などで穏やかに加熱すると、らせん構造がほどけて1本鎖になり、それをゆっくり冷ますと、元の2本鎖に戻ります。細胞が分裂するときも、まずDNAの2本鎖がほどけて、それぞれの1本鎖に対応する新たなヌクレオチドを形成し、二重らせん構造がそっくり「複製(replication)」されます。このとき、塩基対の水素結合の組み合わせ(A-T対またはG-C対)は決まっているので、同じ塩基配列を持つDNAの二重らせん構造2組を複製することができるのです。DNAにおけるこのような性質を「相補性(complementation)」といいます。
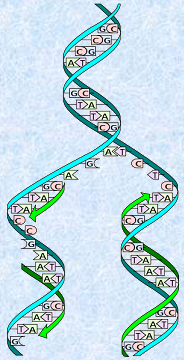
図.30 複製をしているDNA
DNAは常温付近の温度、中性付近の液性のもとでは安定ですが、波長260 nm付近の紫外線を吸収しやすい性質を持ち、強い紫外線の照射を受けると、二重らせん構造が壊れてしまうことがあります。しかし、DNAに相補性があるおかげで、二重らせん構造の1本が切れてしまっても、DNAはほとんど元通りに修復されます。しかし、まれに鎖が2本とも切れてしまうことがあり、こうなると切れた隙間に他のDNAが紛れ込んだり、間違ったところが繋がったりして、DNAの修復が上手くいかないことがあります。これをそのまま放置しておくと、DNAは正しい遺伝情報を伝えられなくなって、正常な細胞分裂ができなくなり、ガン細胞に変化してしまう恐れがあります。
しかし、人体には損傷した細胞が次の細胞分裂を起こす前に、その細胞を排除する仕組みが備わっています。これは「アポトーシス(apoptosis)」といわれる現象で、日本語では「プログラムされた細胞死」と訳されます。細胞は、自らに何らかの異常が発生したことを察知すると、「p53遺伝子」という遺伝子が働いて、自爆して果てるのです(毒の科学を参照)。これによって、ほとんどの異常な細胞は取り除かれ、本格的なガンに変化する前に芽を摘まれてしまいます。ちなみに、アポトーシスは細胞に異常が発生したときだけでなく、正常な成長過程でも起きています。例えば、ヒトの手は、胎児のときには「水かき」がある状態で形成されますが、後にアポトーシスによって、指の間の細胞が死滅することで5本の指になります。オタマジャクシがカエルに成長する際、尻尾が消えるのもアポトーシスです。

図.31 アポトーシスによってオタマジャクシの尻尾が消え、カエルになる
このアポトーシスの詳しいメカニズムは、「C・エレガンス(Caenorhabditis elegans)」という線虫の研究を通して解明されました。受精卵が分裂して1,090個の細胞ができ、うち131個がアポトーシスするといった、細かい器官発生の過程がすべて解明されています。この研究に取り組んだイギリスの生物学者シドニー・ブレナー、アメリカの生物学者ロバート・ホロヴィッツ、イギリスの生物学者ジョン・サルストンは、2002年のノーベル生理学・医学賞を受賞しています。このC・エレガンスという線虫は、体調1 mmほどの小さな土壌動物ですが、体が透明で観察しやすく、飼育もしやすいことなどから、生物学者にモデル動物として、広く愛用されています。多細胞生物として、初めて全ゲノム配列が解読された生物でもあります。
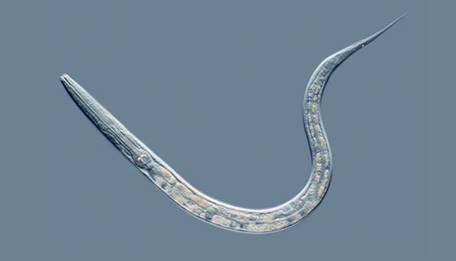
図.32 C・エレガンスは、実験材料として非常に優れた性質を持つことから、モデル生物として広く利用されている
ところで、DNAの複製は完全無欠ではないので、人体の細胞では1遺伝子当たりで100万回に1回の割合でコピーミスが起こり、毎日5,000個ものガン細胞ができているともいわれています。これらの細胞は、アポトーシスや免疫系の働きによって排除されているため、通常はガンを発症することはありません。この攻防の中で、取り逃がしたたった1個の細胞が、ガンへと成長していくということになります。
そして、このコピーミスが生殖細胞を作る減数分裂で起こると、子に親とは違った形質が現れることになり、生物に進化が起こります。生物が誕生した初期には、激しく変化する環境に対応するため、コピーミスが多く起こった方がむしろ有利だったと思われます。DNA研究の世界的権威であるアイスランドのカーリ・ステファンソンらが行った大規模な研究結果によると、人は誰もが平均70個の新たな突然変異を持って生まれ、父親にも母親にもない新たな塩基配列が生じることが判明しています。このような突然変異が原動力となり、DNAを遺伝物質とする生物は、常にどんどん環境に適したものに進化していきます。もしDNAのコピーミスが起こらない、もしくは繁殖をせずに不死であるといった生物が存在した場合、その生物は変化する環境に適応できず、絶滅することになるでしょう。生物はあえてミスを犯すシステムを採用することで、自らの存続性を確保する道を選んだのです(ガンの科学を参照)。
(iii) リボ核酸(RNA)
RNAも、ヌクレオチド鎖からなる高分子化合物です。RNAの塩基は、「アデニン(A)」・「ウラシル(U)」・「グアニン(G)」・「シトシン(C)」の4種類です。DNAの塩基の種類と1つだけ違い、「チミン(T)」ではなく「ウラシル(uracil, 記号U)」が使われています。ちなみに、チミン(T)は、ウラシル(U)の水素原子の1つがメチル基(-CH3)に置換した構造を持っています。言い換えれば、チミン(T)は「メチルウラシル」です。塩基対は、アデニン(A)とウラシル(U)、グアニン(G)とシトシン(C)で形成されます。また、DNAが「二重らせん構造」を取っているのに対し、RNAは通常「一本鎖構造」として存在します。
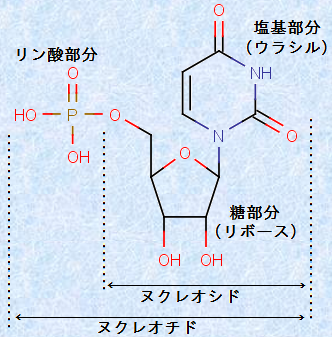
図.33 RNAのヌクレオチドの構造式
ところで、DNAとRNAで異なる塩基が使われる理由は何でしょうか?なぜRNAでは、チミン(T)ではなくウラシル(U)を用いるのでしょうか?DNAは遺伝情報を確実に保存する必要がありますが、DNAの塩基は確率的に他の塩基に変化してしまうことがあります。4つの塩基のうち、「シトシン(C)」が脱アミノ化されて「ウラシル(U)」に置き換わる現象は、比較的高頻度に起こります。そのような場合、変化した塩基を修復する働きを持つ酵素が、これを直していきます。もしDNAの塩基に「ウラシル(U)」が用いられていた場合、もともと「ウラシル(U)」なのか、「シトシン(C)」が変化した「ウラシル(U)」なのか、酵素は見分けることができません。DNAでは、「ウラシル(U)」ではなく「チミン(T)」を用いることにより、仮に「ウラシル(U)」があれば「シトシン(C)」が変化したものであると見分けることができるので、修復する酵素が正しく「シトシン(C)」に戻すことができます。DNAでは、置き換わった塩基を見分けやすくするために、「シトシン(C)」からの変化が起きやすい「ウラシル(U)」ではなく、「チミン(T)」を使っていると考えられています。こう考えると、RNAが「ウラシル(U)」を用いる利点はほとんどないようですが、「チミン(T)」は「ウラシル(U)」をもとに作られるので、合成と分解が頻繁なRNAでは、「ウラシル(U)」を用いる方がエネルギー的に有利となります。
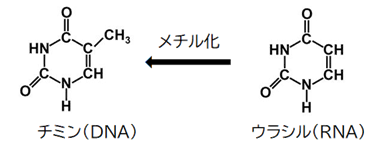
図.34 「チミン(T)」は「ウラシル(U)」をメチル化して合成される
タンパク質を合成するときは、まず細胞の核に含まれる長いDNAの二重らせんのうち、必要な部分の2本鎖だけをほどきます。そして、そのうちの1本を鋳型鎖(アンチセンス鎖)として、これと相補的な塩基配列を持つRNAを核の中で合成します。すると、遺伝情報を塩基配列として持つ非鋳型鎖(センス鎖)と、同じ塩基配列を持つRNAができあがります。この過程を遺伝情報の「転写(transcription)」といい、この過程は「RNAポリメラーゼ(RNA合成酵素)」によって営まれています。また、転写されるDNAの領域を「遺伝子(gene)」といい、専門的には「コード領域(coding region)」とも呼ばれます。遺伝子は、全DNAの中で、体の中で必要な様々なタンパク質に変換される部分のことです。遺伝情報を受け継いだRNAは、「メッセンジャーRNA(mRNA)」と呼ばれ、分子量は約100万です。
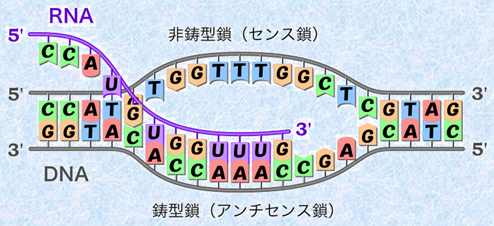
図.35 DNAの遺伝情報は、mRNAとして転写される
mRNAの連続した3つの塩基配列一組(トリプレット)が示す遺伝暗号を「コドン(codon)」といい、その塩基の配列が1つのアミノ酸に対応しています。RNAの塩基は4種類あるので、コドンには43=64通りの組み合わせがあります。現在では、各コドンが20種類のアミノ酸・翻訳開始・翻訳停止の計22種類を指定していることが分かっています。64通りで22種類を指定しているので、同じアミノ酸を指定するコドンが重複している訳です。例えば、グリシンを指定するコドンは、「GGU」・「GGC」・「GGA」・「GGG」の4種類があります。コドンが重複する理由は、DNAが放射線などの影響で突然変異しても、アミノ酸の並びとしての情報をなるべく変えないようにするためです。
生物の種類が異なると、コドンの意味も変わってくるのでしょうか?ヒトのコドンの意味が解明されたあと、様々な生物でコドンの解読が行われましたが、地球上のほとんどすべての生物で、コドンの意味は同じだったのです。どの生物のタンパク質も20種類のアミノ酸からできていることから、これは「生命が一回起源で、そこから分化して現在の姿になった」と考えられる根拠だとされました。他にも、細胞膜の構造などもすべての生物で共通しており、「生命の一回起源」を示す証拠とされています。もちろん、「生命が二回以上の起源を持っていて、何らかの理由により、現在見られる共通性を獲得した」という仮説を否定することはできません。しかし、「二回以上の起源があった」という証拠は見つかっていないので、現在では「生命の一回起源」が有力な仮説となっています。
表.5 コドンとそれに対応するアミノ酸
|
アミノ酸 |
コドン |
|
アラニンAla |
GCU、CCC、GCA、GCG |
|
アルギニンArg |
CGU、CGC、CGA、CGG、AGA、AGG |
|
アスパラギンAsn |
AAU、AAC |
|
アスパラギン酸Asp |
GAU、GAC |
|
システインCys |
UGU、UGC |
|
グルタミンGln |
CAA、CAG |
|
グルタミン酸Glu |
GAA、GAG |
|
グリシンGly |
GGU、GGC、GGA、GGG |
|
ヒスチジンHis |
CAU、CAC |
|
イソロイシンIIe |
AUU、AUC、AUA |
|
ロイシンLeu |
UUA、UUG、CUU、CUC、CUA、CUG |
|
リシンLys |
AAA、AAG |
|
メチオニンMet |
AUG |
|
フェニルアラニンPhe |
UUU、UUC |
|
プロリンPro |
CCU、CCC、CCA、CCG |
|
セリンSer |
UCU、CUU、CUA、UCG、AGU、AGC |
|
トレオニンThr |
ACU、ACC、ACA、ACG |
|
トリプトファンTrp |
UGG |
|
チロシンTyr |
UAU、UAC |
|
バリンVal |
GUU、GUC、GUA、GUG |
|
開始コドン |
AUG、(AUA)、(GUG) |
|
終止コドン |
UAG、UGA、UAA |
DNAの遺伝情報を転写したmRNAは、細胞の核の外に出て細胞質に移動し、タンパク質の合成の場である「リボソーム」と結合します。リボソームは、小サブユニットと大サブユニットに分かれていて、この間にmRNAを挟み込むように結合して、タンパク質の合成を行います。塩基配列に対応したアミノ酸を、リボソームに挟まれているmRNAのコドンまで運ぶRNAは、分子量が2〜3万の「トランスファーRNA(tRNA)」です。tRNAは、細胞内に散らばっている個々のアミノ酸を拾い集めて、リボソーム上のmRNAのコドンに基づいて、次々と特定のアミノ酸を結合させます(毎秒で10個ほどのアミノ酸が結合する)。この過程を遺伝情報の「翻訳(translation)」といいます。これによって、特定のアミノ酸配列のポリペプチドやタンパク質が合成されるのです。tRNAに付いているアミノ酸を連結させるRNAは、「リボソームRNA(rRNA)」と呼ばれます。
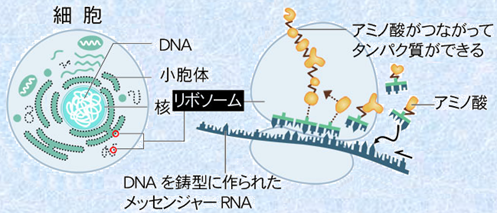
図.36 リボソームでタンパク質の合成が行われる
細菌などの単細胞生物では、DNAのほとんどの部分が、何らかのタンパク質の設計情報を担っています。しかし、ヒトのDNAの中で、mRNAとして転写されて、タンパク質として翻訳される遺伝子の部分は、DNA全体のうちの1.4%に過ぎないことが分かっています。ヒトのDNAを伸ばして繋ぐと1.5 mほどになりますが、ヒトの精子や卵が持ち寄る1.5 mのDNAのうち、タンパク質の設計情報が書き込まれている遺伝子の部分は、たったの2.1 cmしかないことになります。DNAの残りの部分は、設計図の働きがなく、どういう役割があるのかよく分かっていなかったため、「何の働きもないゴミだ」とさえいわれていました。研究者たちの間でも、「ゴミくずのようなもの」という意味で、しばしば「ジャンクDNA」と呼ばれていました。タンパク質に変換されない領域という意味で、専門的には「非コード領域(non-codingregion)」といわれます。
DNAの98.6%もの領域を「ゴミ」だとするのは、いささか乱暴にも聞こえます。しかし、全DNAを解読するには非常にコストがかかる(2000年代初頭で、1人分を全部読み込むのに10年以上、数千億円)ため、多くの研究は、働きのよく分からない98.6%の部分ではなく、より重要な発見が見込めそうな1.4%の遺伝子の部分のみを対象に行われていました。しかし、近年のDNA解析技術の飛躍的な進歩により、解析スピードが一気に加速したことで、世界中の研究者たちは、我先にとDNAの残りの98.6%の研究に乗り出しました。その結果、「ゴミ」と呼ばれてきた遺伝子以外の領域にも、私たちの姿形、性格、才能など、様々な個性を決める重要な情報が潜んでいることが、次々と明らかになってきたのです。
例えば、DNAの残り98.6%の部分で、mRNAにコピーされ、20〜25塩基程度まで小さくなったものを、「マイクロRNA(miRNA)」といいます。1993年、アメリカの生物学者であるヴィクター・アンブロスらは、C・エレガンスの研究をしているときに、そのDNAからmiRNAを発見しました。miRNAは、mRNAと結合して翻訳反応を阻害し、タンパク質の合成を抑制します。このようにして、miRNAは様々な細胞機能の発現に関わっていると考えられています。miRNAが発見されるまで、そのような小さなRNAは、タンパク質の設計図にはなり得ない「ゴミ」のようなものだと思われていました。しかし、実は遺伝子発現に際して、miRNAは絶妙なブレーキ役であることが分かったのです。miRNAの発見と遺伝子制御に関する研究成果が評価され、2024年のノーベル生理学・医学賞は、ヴィクター・アンブロスらに贈られています。
また、miRNAの中には、細胞のガン化に深く関与している「ガン促進型」と「ガン抑制型」があることが、最近の研究で分かってきました。2010年にアメリカの研究グループが行った動物実験では、リンパ腫を人為的に発症させたマウスを使って、ガン促進型のmiRNAの発現量を抑制したところ、マウスのリンパ腫が消滅したということです。そのため、ガン促進型のmiRNAの発現量を低下させ、ガン細胞を消滅させるという方法は、ガンの新たな治療薬の開発手法の1つになるのではないかと注目されています。

図.37 ヴィクター・アンブロスは、1993年にC・エレガンスのDNAからmiRNAを発見した
(iv) 生命の起源
「生命がいかにして誕生したのか」ということは、生物学の重要なテーマですが、生命の誕生に有力な説があります。それは、単純な化合物である「ホルムアルデヒド」などから、RNAを構成する「リボース」のような複雑な糖を作る反応です。これは、「ホルモース反応(formose reaction)」といわれる反応で、1861年にロシアの有機化学者であるアレクサンドル・ブトレーロフが発見しました。初期の地球を模した実験では、リボースは、ホルムアルデヒドとグリセルアルデヒド、コールマナイトまたはケルナイトのようなホウ素化合物の混合物から生成したといいます。興味深いことに、宇宙空間において、ホルムアルデヒドとグリセルアルデヒドが分光学的に観測されており、現在においても、ホルモース反応は、「自然発生説」の有力な説となっています。
1977年、アメリカの微生物学者であるカール・ウーズは、生命の起源に関して、「まずRNAが存在し、それが現生生物へと進化した」という「RNAワールド仮説(RNA world hypothesis)」を提唱しました。このホルモース反応は、RNAワールド仮説を裏付けする重要な反応であると考えられています。原始地球条件下では、DNAよりもRNAの方が比較的合成されやすいので、生命の起源に関しては、「DNAよりもRNAが先であった」というRNAワールド仮説が支持されています。

図.38 カール・ウーズは、rRNAによる生物分類学の先駆者であり、1977年にRNAワールド仮説を提唱した
しかし、RNAワールド仮説にも、疑問は残っています。実際にRNAの材料であるリボースが偶然に合成され、そこからRNAが作られたとしても、生命誕生時のタンパク質の酵素が存在しない状況では、そのRNAは期待されるものと異なり、遺伝情報を作ることはできないことが実験で分かっています。こうした点から、RNAワールド仮説とは、別の視点で考えられた説もあります。それは、1986年にアメリカの生化学者であるウォルター・ギルバードが提唱した、「まずアミノ酸ができ、重合してポリペプチド、さらにタンパク質が作り出され、これが触媒として働いて生命を作り出した」という「プロテインワールド仮説(protein world hypothesis)」です。この説では、DNAやRNAよりも先に、タンパク質が誕生していたとしています。タンパク質は、DNAがなくても単純な構造のものであれば作ることができ、生命の誕生には、この単純なタンパク質で十分だったのではないかというのです。

図.39 ギルバートは、分子生物学の草分けの一人であり、1980年には「核酸の塩基配列の決定」の業績から、ノーベル化学賞を受賞している
生命の起源については、その他にも、地球外で誕生した生命が、何らかの手段で地球にもたらされたという「パンスペルミア仮説(panspermia hypothesis)」が唱えられています。この説は、酸と塩基の定義をしたことでも知られるスウェーデンの化学者スヴァンテ・アレニウスが、1903年に提唱したものです。実際、隕石などからは、細胞を作るタンパク質の材料となるアミノ酸が検出されているので、その可能性は否定できません。ただし、この説の場合、「その地球外の生物は、どのようにして誕生したのか」という謎が残ります。結局、どの説も疑問が残り、定説には至っていません。生命のルーツの謎が解き明かされる日は来るのでしょうか。
・参考文献
1) 石浦章一「タンパク質はすごい!」技術評論社(2014年発行)
2) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
3) 卜部吉庸「化学の新研究」三省堂(2013年発行)
4) 齊藤烈/藤嶋昭/山本隆一/他19名「化学基礎」啓林館(2012年発行)
5) 佐藤健太郎「医薬品とノーベル賞 がん治療薬は受賞できるのか」角川新書(2016年発行)
6) 谷川実『酵素反応の基礎―名前はよく聞くが, よくわからない「酵素」を知るために』―化学と教育66巻12号(2018年)
7) 日本博学倶楽部『[決定版]「科学の謎」未解決ファイル』PHP研究所(2013年発行)
8) 長谷川英祐「面白くて眠れなくなる生物学」PHP研究所(2014年発行)
9) 萩原清文「好きになる分子生物学」講談社(2002年発行)
10) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
11) 船山信次「こわくない有機化合物超入門」技術評論社(2014年発行)
12) 山口幸夫「理科がおもしろくなる12話」岩波書店(2001年発行)