・窒素を含む芳香族化合物
【目次】
(1) 芳香族アミン
「アミン(amine)」は、アンモニアNH3の有機化合物誘導体であり、アンモニアNH3の水素原子Hを、1つから3つの炭化水素基で置き換えたものです。アミンにも、アンモニアNH3のような悪臭がありますが、少し違った「もっと嫌な臭い」である場合が多いです。例えば、トリメチルアミン(CH3)3Nという物質は、「くさや」が放つ悪臭の主成分です。これは、魚が腐ったときに発する悪臭の主成分の1つでもあります。また、カダベリンH2N(CH2)5NH2という物質は、動物の体組織が腐敗する際に生成し、腐敗臭の原因となる物質です。生体内でも少量作り出されており、「精液」の特有の臭いの主成分の1つでもあります。

図.1 くさやは、新鮮な魚をくさや液と呼ばれる発酵液に浸潤させたあと、これを天日干しにした食品である
置換基がフェニル基のような芳香族の基である場合を「芳香族アミン(aromatic amine)」といい、置換基が鎖式炭化水素の基である場合を「脂肪族アミン(aliphatic amine)」といいます。アンモニアNH3と同様にアミンは塩基であり、天然物の中で、アミンは最も一般的な有機塩基です。次の図.2に、様々な「芳香族アミン」を示します。
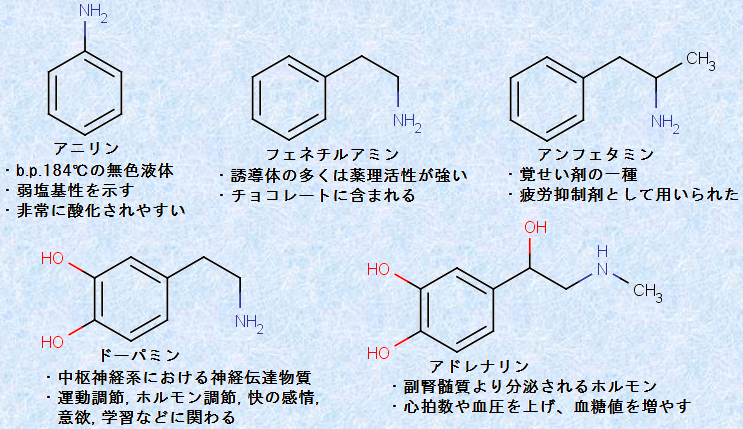
図.2 様々な芳香族アミン
上の図.2で示したアンフェタミンやドーパミン、アドレナリンなどの「フェネチルアミン骨格」を有するアミンは、すべて「アルカロイド(alkaloid)」と呼ばれる化合物群です。1819年、ドイツの薬剤師であるカール・マイスナーは、植物に含まれる塩基性の有機化合物をひっくるめて、「アルカロイド」と呼びました。「アルカロイド」は、ラテン語で「塩基性の」という意味を持つ「alkali」と、「〜のような」という意味を持つ「oides」を組み合わせて作った言葉です。これを「植物塩基」と日本語に訳したのは、明治時代の薬学者で、日本最初の薬学博士である田原良純です。
現在では、窒素原子Nを含み、塩基性を示す天然由来の有機化合物を、一般的にアルカロイドと呼んでいます。アルカロイドは、微生物や真菌、植物、動物を含む非常に様々な生物によって生産され、天然物の中の一群をなしています。多くのアルカロイドは、一般的に塩基性を示すので、酸と反応させることで水に溶けやすくなり、容易に抽出することができます。多くのアルカロイドは、他の生物に対して有毒です。しかし、アルカロイドはしばしば顕著な薬理活性を示し、医療における「医薬品」になったり、娯楽のための「麻薬」になったりします (毒の科学を参照)。
(2) アニリンの反応
(i) 酸塩基反応
窒素原子上に存在する「非共有電子対」が、アミンの化学的性質を支配しています。この電子対が存在するため、アミンは水素イオンH+ を引き寄せる性質を持ち、水に少し溶けて弱塩基性を示します。ただし、脂肪族アミンの塩基性は、アンモニアNH3よりも強いですが、芳香族アミンの塩基性は、アンモニアNH3よりも弱いです。これは、アルキル基が電子供与性の置換基であるのに対して、フェニル基は電子求引性の置換基だからです(酸と塩基(酸と塩基の強さ)を参照)。
最も単純な芳香族アミンは「アニリン」です。1834年、ドイツの化学者であるフリードリッヒ・ルンゲは、天然染料の藍(スペイン語で「Anil」という)を分解・蒸留後、強塩基を加えて遊離した成分を「アニリン」と命名しました。しかし、アニリンの塩基性はアンモニアNH3よりも弱く、赤色リトマス紙を青変させるほどの力もありません。次の図.3に、アニリンが弱塩基性であるために起こるいくつかの反応を示します。アニリンは塩酸HClと反応して、水溶性のアニリン塩酸塩を作ります。また、アニリン塩酸塩の水溶液に水酸化ナトリウムNaOHを加えると、油状のアニリンが遊離します。
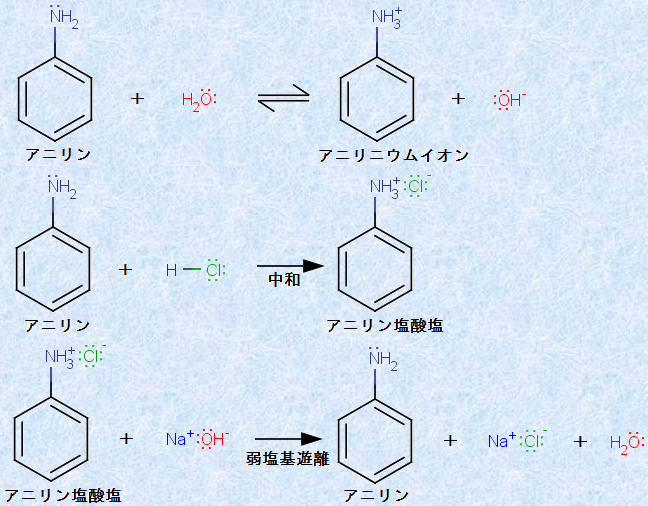
図.3 アニリンに起こる化学反応
(ii) 酸化反応
アニリンは、非常に酸化されやすい物質です。これは、電子供与性のアミノ基(-NH2)により、ベンゼン環の電子密度が大きくなって、酸化剤の攻撃を受けやすくなっているからです。そのため、アニリンを空気中に放置しておくと、酸化されたアニリン同士が重合を繰り返して、複雑な組成を持つ着色化合物を生成し、無色から褐色に変わります(ただし、純粋なアニリンは無色の液体ですが、淡黄色に着色していることが多いです)。また、さらし粉CaCl(ClO)・H2Oを加えると赤紫色を呈し、硫酸酸性二クロム酸カリウムK2Cr2O7水溶液を加えると「アニリンブラック(aniline black)」と呼ばれる水に溶けにくい染料に変化します。アニリンブラックは、日光や洗濯、漂白剤などに強く、安価で実用価値の高い黒色染料であり、顔料や塗料にも使われます。黒い油性フェルトペンの独特の臭いは、アニリンブラックの臭いです。
表.1 アニリンの酸化反応
|
アニリンに対して |
変化 |
|
空気中に長時間放置する |
徐々に褐色に変化する |
|
さらし粉を加える |
赤紫色に変化する |
|
硫酸酸性二クロム酸カリウムを加える |
黒く濁る(アニリンブラック) |
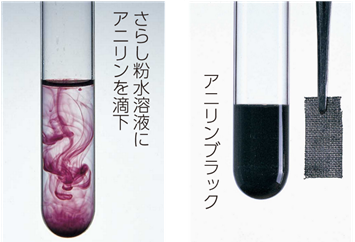
図.4 アニリンの呈色反応と染料
(iii) アシル化合物との反応
アニリンに酢酸CH3COOHと濃硫酸H2SO4を加えて加熱するか、または無水酢酸(CH3CO)2Oを作用させてアセチル化すると、アミドの一種である「アセトアニリド」が生成します。アセトアニリドは、無色無臭の板状結晶(m.p.115℃)で、かつては「解熱鎮痛剤」として用いられていました。
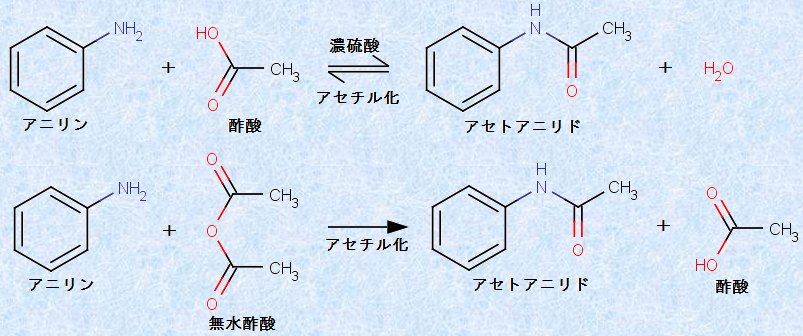
図.5 アセトアニリドの合成
アセトアニリドの解熱鎮痛作用は、偶然に発見されました。1880年代のドイツで、腸内寄生虫による疾病に苦しむ患者にナフタレンを投与すべきところ、誤ってアセトアニリドを投与するケースが発生しました。このとき、寄生虫の駆除はできなかったものの、患者の熱が下がるという偶然の発見があり、1886年に解熱鎮痛薬「アンチフェブリン」として処方されるようになりました。しかし、1948年、アメリカの生化学者であるジュリアス・アクセルロッドらは、アセトアニリドを服用すると血球が破壊され、肝臓や腎臓に障害をもたらすことを明らかにしました。
アセトアニリドが、他の同用途の医薬品に比べて高い毒性を持つことが判明してからは、「アセトアミノフェン」などの毒性のより低い医薬品にその地位を譲ることになりました。アセトアミノフェンは、アセトアニリドの誘導体ですが、驚いたことに、人間の尿の中から見つかりました。鎮静剤としてアセトアニリドを服用した人の小便を濃縮したところ、苦い味のする白色の結晶が残りました。何を思ったのか、興味を持った研究者は、この結晶を舐めてみることにしました。信じられないことをする研究者がいたものだと思いますが、それが後に、優れた鎮痛効果を持つ物質として報告されたのです。
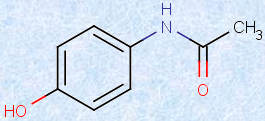
図.6 アセトアミノフェンの構造式
アセトアミノフェンは、アセトアミノ基(-NHCOCH3)のp位にフェノール性ヒドロキシ基(-OH)を置換した有機化合物です。人間の体内に入った化合物は、代謝を受けて、水溶性の高い構造に変換され、尿や便から排出されます。ヒドロキシ基(-OH)を化合物に置換することは、主な代謝方法の1つです。
アセトアミンフェンは、「アスピリン」と同じように鎮痛作用を持ちながら、胃腸への厄介な障害を起こしません。アスピリンと同様に、細胞内の「シクロオキシゲナーゼ」を阻害して、プロスタグランジンの合成を抑制することによって、鎮痛作用を示すと考えられています。しかし、炎症に関係した免疫細胞では働かず、脳内をターゲットとして作用するのが特徴です。このことから、胃の粘膜を弱くする作用がなく、空腹時に飲んでも胃腸障害が生じないという、アスピリンにはない利点を持っています。また、眠気や興奮などの副作用もないことから、「モルヒネ」のような鎮痛薬とも異なる性質を持っているといえます(アスピリンの科学を参照)。
現在、アセトアミノフェンは、発熱や頭痛など、風邪の諸症状を抑える解熱鎮痛剤として広く使用されています。アセトアミノフェンは、標準的な服用法では非常に安全な薬物ですが、アルコールと一緒に服用すると、強い肝臓障害が現れることが知られています。アセトアミノフェンとアルコールとを同時に大量摂取させることによる、「保険金殺人事件」が発生したこともあります(毒の科学を参照)。医薬品の服用法には、十分に注意したいものです。
(3) アニリンの合成
アニリンの窒素原子上の結合は、N-H結合かN-C結合のいずれかです。したがって、アニリンの窒素原子Nの酸化数は-IIIであり、極めて酸化されやすい、「還元型」の性質を持っているといえます。そこで、逆に「酸化型」の窒素原子を持つ有機化合物を、適切な還元剤を用いて還元することで、容易にアニリンを得ることができるのです。アニリンを合成する最良の方法は、対応する酸化型の窒素原子を持つ「ニトロベンゼン」を還元することです。原料のニトロベンゼンは、求電子的な芳香族ニトロ化反応で容易に合成することができ、このニトロ基(-NO2)は、還元剤を用いた化学量論的な反応、または水素を用いた触媒反応で、極めて容易に還元できます。
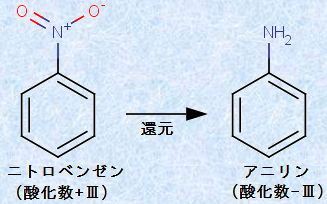
図.7 ニトロベンゼンを還元することで、アニリンが得られる
(i) ニトロベンゼンのベシャン還元
スズSnまたは鉄Feのような金属を還元剤として、ニトロベンゼンに濃塩酸HClを加えて、酸性条件下でニトロ基(-NO2)を還元すると、アニリン塩酸塩が生成します。続いて、アニリン塩酸塩に水酸化ナトリウムNaOH水溶液を作用させれば、酸塩基反応によって、弱塩基のアニリンが遊離します。通常、アニリンは酸化されやすいので、塩酸HClのように酸化力の弱い酸を使います。なお、使用する還元剤については、スズSnは高価なので、工業的には安価な鉄Feを使用することが多いです。このように、金属を還元剤とした化学量論的な還元反応を、「ベシャン還元(Bechamp reduction)」といいます。
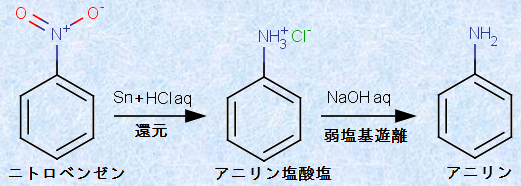
図.8 ニトロベンゼンのベシャン還元
ベシャン還元は、操作が簡単で、スズSnと塩酸HClを加えて、反応液を撹拌するだけ良いという利点があります。しかし、廃棄物が多い上に、還元剤が高価なので、現在は実験室でしか行われていません。ニトロベンゼンをSn+HClで還元したときの反応式は、次のようになります。
2C6H5NO2 + 3Sn + 4HCl → 2C6H5NH3Cl + 3SnCl4 + 4H2O

図.9 アニリンの実験室的合成法
(ii) ニトロベンゼンの接触還元
ニッケルNiやパラジウムPdといった水素化触媒を用いて、水素ガスH2をニトロベンゼンに作用させると、ニトロ基(-NO2)がアミノ基(-NH2)へと還元されたアニリンが生成します。このように水素ガスH2を還元剤とした触媒反応を、「接触還元(catalytic reduction)」といいます。
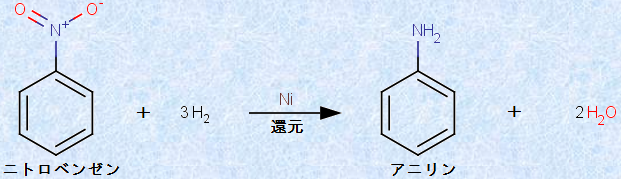
図.10 ニトロベンゼンの接触還元
接触還元は、還元剤が水素H2なので、触媒は再利用が可能で、理論的には廃棄物が一切出ないという利点があります。しかし、水素ガス素H2を使うので、大がかりな実験装置が必要となり、実験室で行われることはほとんどありません。接触還元は、工業的な還元方法です。
(4) アゾ化合物
(i) ジアゾ化反応
アニリンの希塩酸溶液を5℃以下に冷却しながら、亜硝酸ナトリウムNaNO2水溶液を加えると、塩化ベンゼンジアゾニウムの水溶液が得られます。このようなジアゾニオ基(-N+≡N)の構造を持つジアゾニウム塩を作る反応を、「ジアゾ化反応(diazotization)」といいます。

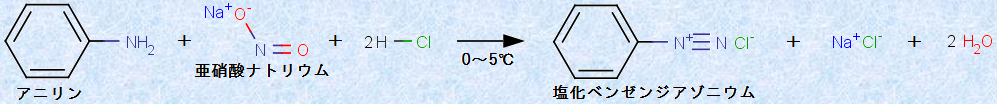
図.11 アニリンのジアゾ化
ちなみに、「亜硝酸ナトリウムNaNO2」というあまり聞き慣れない化合物は、食肉の「発色剤」として使用されます。その分解の過程で生じた一酸化窒素NOが、食肉中の「ミオグロビン」というタンパク質の鉄(II)イオンFe2+ に配位結合して、鉄(II)イオンFe2+ が鉄(III)イオンFe3+ に酸化されて、色が黒くなるのを防止するのです。亜硝酸ナトリウムNaNO2は、天然の岩塩にも多く含まれており、岩塩でソーセージを作ると、発色が良くなるということは、昔から経験的に知られていたようです。
なお、アニリンのジアゾ化では、反応温度が極めて重要です。ベンゼンジアゾニウムイオンは、5℃以上では不安定であり、反応温度を5℃以下に保たないと、窒素N2を脱離して、すぐに分解してしまうのです。例えば、次の図.12に示すように、塩化ベンゼンジアゾニウムは、加熱すると加水分解して、フェノールになります。この反応も、フェノールを得ることができるので、重要な反応ではあります。しかし、アニリンの価格はフェノールよりもはるかに高いので、この反応を利用してフェノールを工業的に作ることはありません。一般にフェノールは、ベンゼンスルホン酸ナトリウムなどを用いた「芳香族置換反応」で合成する場合がほとんどです(酸素を含む芳香族化合物を参照)。
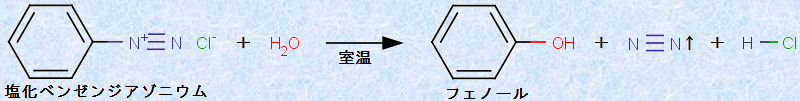
図.12 塩化ベンゼンジアゾニウムの加水分解により、フェノールが生成する
(ii) ジアゾカップリング
ベンゼンジアゾニウムイオンは、正電荷を帯びているので、「求電子剤」の一種になります。しかしながら、その正電荷は、共鳴により安定化しているので、求電子剤としては弱い部類です。次の図.13にベンゼンジアゾニウムイオンの共鳴構造式を示します。
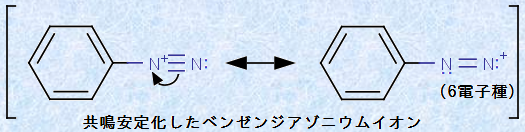
図.13 ベンゼンジアゾニウムイオンの共鳴構造式
図.13の右側の共鳴構造式では、右端の窒素原子は6電子しか持たないので、ここが「求核剤」との反応点になります。ベンゼンジアゾニウムイオンは、強く活性化されたベンゼン環のp位に求電子的な攻撃を行い、「芳香族求電子置換反応」により、「アゾ化合物(azo compound)」を生成します。ここで、強く活性化されたベンゼン環とは、フェノールやアニリンのベンゼン環のことです。フェノールやアニリンなどでは、ヒドロキシ基(-OH)やアミノ基(-NH2)がベンゼン環に対して電子供与的に働くので、ベンゼン環のo位とp位が電子豊富になるのです。また、o位とp位では、立体障害の少ないp位の方が反応しやすくなるので、p位に対して求電子攻撃をすることになります。例えば、塩化ベンゼンジアゾニウムの水溶液にナトリウムフェノキシドの水溶液を加えると、橙赤色の「p -ヒドロキシアゾベンゼン(p -フェニルアゾフェノール)」が生成します。


図.14 カップリングによるp -ヒドロキシアゾベンゼンの合成
ベンゼンジアゾニウムイオンが持っていた2つの窒素原子が、生成物中に持ち込まれていることに注目して欲しいです。このタイプの芳香族求電子置換反応は、生成物の構造を見ると、2つのベンゼン環がアゾ基(-N=N-)で結ばれているので、「ジアゾカップリング(diazo coupling)」とも呼ばれます。このとき、ジアゾ化に用いた芳香族アミンを「ジアゾ成分(diazo component)」、カップリングされる芳香族化合物を「カップリング成分(coupling component)」といいます。p -ヒドロキシアゾベンゼンの場合では、アニリンがジアゾ成分、フェノールがカップリング成分になります。
なお、ジアゾカップリングの際にフェノールではなくナトリウムフェノキシドの形で反応させているのは、ベンゼン環内の電子密度をより高めるためです。事実、酸性条件下では、大部分が相対的に活性の低いフェノールの状態にあり、カップリング反応はあまり起こりません。また、通常は立体障害のためにp位でのカップリングが優先しますが、p位に置換基がある場合は、o位でのカップリングが起こります。アゾ化合物は、すべてが着色しています。その中には、繊維用染料やカラー写真用色素として製造され、使用されているものが数多くあります。
表.2 様々なアゾ化合物
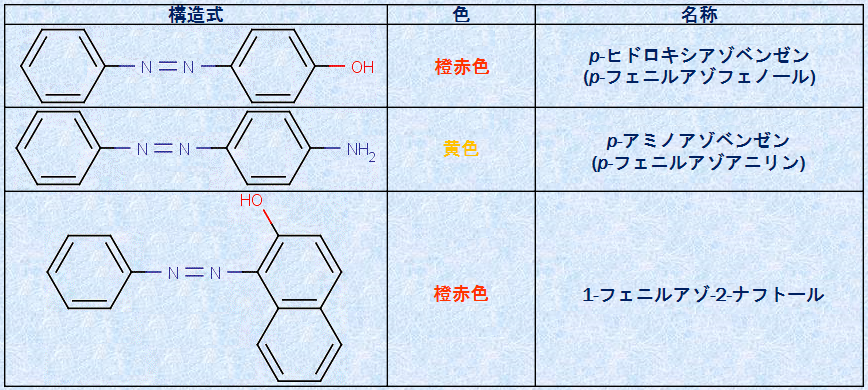
また、中和滴定の指示薬として有名な「メチルオレンジ」も、実はアゾ染料の一種です。メチルオレンジは、酸性溶液中(pH 3.1以下)では、水素イオンH+ がアゾ基(-N=N-)に付加して、ベンゼン環の構造がキノン環構造になり、可視光の吸収域が変わって、黄色から赤色に変色します。
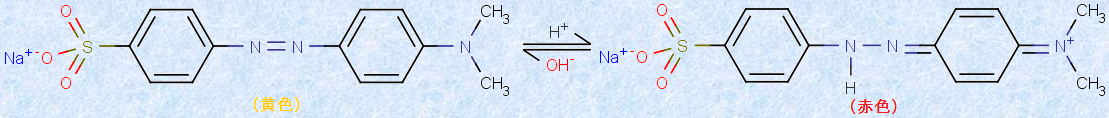
図.15 メチルオレンジの構造式
ただし、指示薬の代名詞ともいえる「フェノールフタレイン」は、アゾ染料ではありません。次の図.16に、フェノールフタレインの構造式を示します。フェノールフタレインは、酸性側(pH 8.2以下)では紫外線しか吸収しないので無色ですが、塩基性側(pH 8.2〜12.0)では黄緑色の光を吸収するので赤色に見えます。
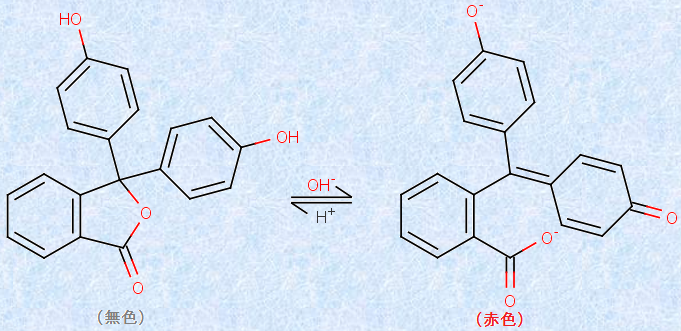
図.16 フェノールフタレインの構造式
これら指示薬の多くは、ベンゼン環を含む長い「共役系(conjugated system)」を持つ有機化合物です。特定のpHで分子構造が変化し、共役系の長さが変わることで、可視光(380〜780 nm)の吸収域が変わって、色が変化します。ベンゼン環自体は、単独では共役系が短いので、紫外線領域(225 nm)しか吸収しません。しかし、共役系が長くなると、電子の共鳴周波数が下がって、ベンゼン環を含む共役系は、より長波長の可視光領域を吸収するようになります。すると、化合物は紫色から青色の可視光を吸収して、黄色から赤色を呈するのです。大まかに言えば、共役二重結合が8個以上になると、吸収極大波長が可視光領域に入るので、色を持つようになります。ただし、青色や緑色の化合物は、通常、共役二重結合のみには頼っていません。
表.3 エチレンが連結した分子群H−(CH=CH)n−Hの吸収極大波長
|
n |
最大吸収波長 |
|
1 |
162 nm |
|
2 |
217 nm |
|
3 |
268 nm |
|
4 |
304 nm |
|
5 |
334 nm |
|
6 |
364 nm |
|
7 |
390 nm |
|
8 |
410 nm |
|
10 |
422 nm |
・参考文献
1) 枝川義邦「身近なクスリの効くしくみ」技術評論社(2010年発行)
2) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
3) 花岡健二郎「生体内pH測定のための蛍光指示薬―蛍光プローグの開発によるpHのバイオイメージング―」化学と教育68巻7号(2020年)
4) 船山信次「こわくない有機化合物超入門」技術評論社(2014年発行)
5) Peter W. Atkins著/千原秀昭・稲葉章訳「分子と人間」東京化学同人(1993年発行)
6) 松岡雅忠「高校化学におけるアニリン系解熱鎮痛薬の話題―アセトアニリドの実験室的合成―」化学と教育73巻8号(2025年)