・酸素を含む芳香族化合物
【目次】
(1) フェノール類
ベンゼン環の水素原子Hをヒドロキシ基(-OH)で置換した形の化合物を、「フェノール類(phenols)」といいます。フェノール類のうち、最も単純な化合物は、「フェノール」です。例として、次の図.1に様々な「フェノール類」を示します。
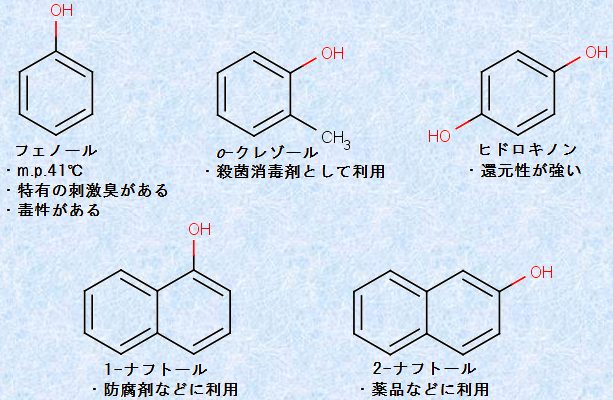
図.1 様々なフェノール類
また、複数のヒドロキシ基(-OH)を有するものは、「ポリフェノール」と呼ばれます。ポリフェノールは、天然では茶や香辛料、ハーブ、植物性の和漢薬などに多く含まれ、生体内や食品中で生じる活性酸素を還元して、安定な非ラジカル性生成物に変える性質があります。お茶の渋味成分である「カテキン」は、代表的なポリフェノールです。カテキンには抗酸化作用や抗菌作用があり、お茶を頻繁に飲む人は虫歯になりにくく、ガンにもなりにくいといわれ、また出がらしの緑茶は水虫に効果があることが分かっています。
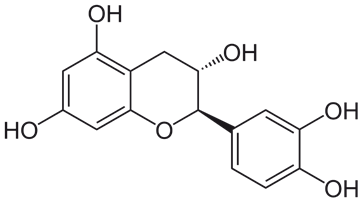
図.2 カテキンには、抗酸化作用や抗菌作用などの様々な生理活性作用がある
赤ワインに含まれる「レスベラトロール」にも、優れた生理活性作用があることが知られています。1992年、フランスのボルドー大学の研究グループが、赤ワインと動脈硬化の関係を明らかにしました。動脈硬化は、血中の悪玉コレステロール(LDLコレステロール)が増えたり、酸化したりすると起こりやすいことが分かっています。ところが、フランス人は、他の欧米諸国よりも相対的に喫煙率が高く、チーズや肉類などの飽和脂肪酸が豊富に含まれる食事を摂取しているのにも関わらず、動脈硬化になる人が他国に比べて少ないのです。この「フレンチパラドックス」を解く鍵として、フランス人が愛飲する赤ワインに白羽の矢が立ちました。赤ワインに含まれるレスベラトロールに、悪玉コレステロールの酸化を防ぐ抗酸化作用があることが、各種の動物実験によって確かめられたのです。

図.3 赤ワインにフレンチパラドックスを解く鍵があった
さらに、レスベラトロールには、「寿命延長作用」があるとの研究が、酵母・線虫・ハエ・魚類で報告されています。2006年には、科学雑誌「Nature」で、マウスの寿命を延長させるとの効果が発表され、種を超えた寿命延長作用として、大きな注目を集めました。動物実験によると、1日に赤ワイン300杯分のレスベラトロールの投与で、マウスの寿命が30%前後延長されたそうです。高カロリー食を与えられたマウスは、一般に糖尿病や脂肪肝になりやすいのですが、レスベラトロールを投与されたマウスは、これらの症状が抑えられ、太ったままに長生きしたといいます。
レスベラトロールは、「長生き遺伝子」または「抗老化遺伝子」ともいわれる「サーチュイン遺伝子(Sir2遺伝子)」を活性化すると考えられています。摂取カロリーを通常の7割程度に抑えると、サーチュイン遺伝子が活性化し、「サーチュインタンパク質」が合成され、長生きになることが分かっています。酵母のような微生物からサルなどの高等生物に至るまでの生物が、この方法によって生存期間が延長することが、様々な実験によって確認されているのです。これは、低カロリー状態に置かれると、サーチュイン遺伝子が活性化して、様々な遺伝的な調整を行い、DNAの活動を抑制するためだと考えられています。これが、結果的にDNAの損傷防止につながり、DNAの損傷防止は、直接的に長寿につながるという訳です。
図.4 サーチュインタンパク質は、DNAに作用して遺伝的な調整を行うことで、寿命を延ばすと考えられる
ちなみに、熟したアボカドやリンゴの断面が褐色に変化するのは、ポリフェノールが原因です。果肉に含まれる「カテコール」のようなフェノール系化合物が、空気中の酸素O2に触れると、果肉中のポリフェノール酸化酵素によって「キノン化合物」に変化します。キノン化合物は抗菌作用を持つため、酸素O2に触れてから腐り始めるまでの時間が長くなります。生成したキノン化合物は、重合反応を起こしてポリフェノールとなります。果肉を褐色にさせるのは、この重合反応で生成した「メラニン」のようなポリフェノールが原因です。果肉を切る前は、果肉が酸素O2に触れていないだけでなく、フェノール系化合物は細胞中の小胞に蓄えられており、細胞質中の酵素はフェノール系化合物と直接は接していません。しかし、果肉を切ることで細胞を傷付けると、酵素とフェノール系化合物が接触し、酸素O2にさらされるようになり、果肉は褐色になるのです。
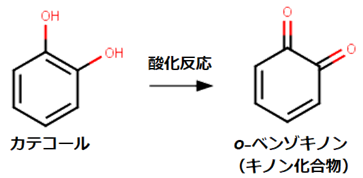
図.5 アボカドの果肉がすぐに褐色に変化するのは、含まれているフェノール系化合物が原因である
フェノール類は、構造上ヒドロキシ基(-OH)を有するという点で、アルコールと類似しています。しかし、置換している基が、脂肪族炭化水素ではなく芳香族炭化水素であるため、フェノール類は、アルコールとは異なる性質を示します。したがって、フェノール類は、通常アルコールには分類されません。
例えば、フェノール類のヒドロキシ基(-OH)は、アルコールとは異なり、水溶液中でわずかに電離して、弱酸性を示します。なお、フェノール(pKa=10)の酸性度は、アルコール(pKa=15〜17)より強いですが、炭酸(pKa=6.4)やカルボン酸(pKa=3〜5)より弱く、青色リトマス紙を赤変させるほどの力もありません。
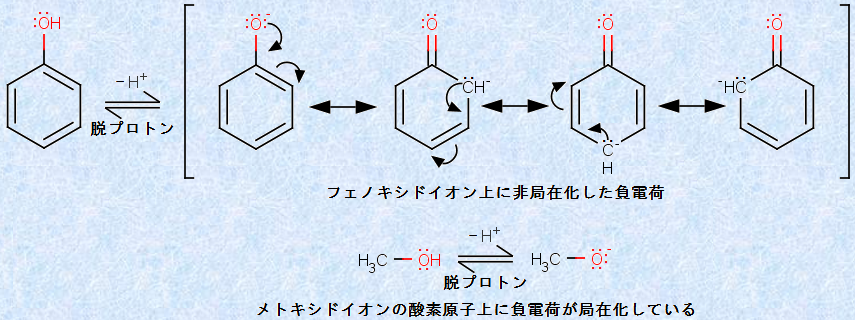
図.6 フェノールは、共鳴安定化したフェノキシドイオンを生じるために弱酸性を示す
フェノールが、アルコールよりも強い酸である主な理由は、共役塩基である「フェノキシドイオン」が、共鳴によって安定化できるからです。すなわち、アルコールでは、負電荷が酸素原子上に局在化するのに対して、フェノールでは、フェノキシドイオンの負電荷は、共鳴によってo位とp位に非局在化できるのです。それ故に、その生成は、アルコキシドイオンの生成に比べて、はるかに有利となります。その結果として、フェノールはアルコールより、105倍以上も強い酸になるのです。
そのため、一般的にアルコールを水酸化ナトリウムNaOHで処理しても反応しませんが、フェノールは水酸化ナトリウムNaOHと中和反応をして、フェノキシドイオンを生成します。
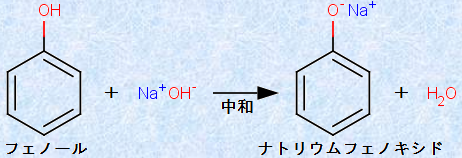
図.7 フェノールと水酸化ナトリウムNaOHの反応
また、フェノールは、ナトリウムNaなどイオン化傾向の大きい金属の単体とも反応して、フェノキシドイオンを生成し、同時に水素H2を発生させます。この反応は、水素H2が抜けることで不可逆的に進行するため、アルコールでも起こります(アルコールを参照)。ただし、アルコールに比べてフェノールの方が、ヒドロキシ基(-OH)の極性が大きくなっているので、ナトリウムNaとの反応はかなり激しく起こります。
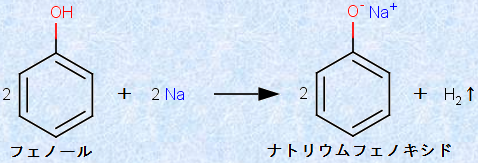
図.8 フェノールとナトリウムNaの反応
フェノール(pKa=10)は、炭酸(pKa=6.4)よりも弱い酸なので、ナトリウムフェノキシドの水溶液に二酸化炭素CO2を通じると、フェノールが遊離して白濁します。この反応は、分析化学において非常に重要であり、これを逆に言うと、フェノールは炭酸水素ナトリウムNaHCO3と反応しないということです。
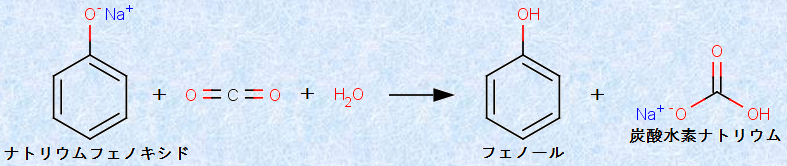
図.9 弱酸であるフェノールの遊離
(2) フェノール類の反応
(i) 塩化鉄(III)との反応
フェノール類に塩化鉄(III) FeCl3水溶液を加えて反応させると、鉄(III)イオンFe3+ にフェノール性ヒドロキシ基(-OH)が配位して、フェノールの酸素原子Oから鉄(III)イオンFe3+ へ電荷の移動が起こり、「電荷移動錯体(charge-transfer complex)」を形成して紫系に呈色します。クレゾールのようにベンゼン環に電子供与性の基が付くと、可視光の吸収は長波長側に移り、呈色は青色になります。一方で、サリチル酸のようにベンゼン環に電子求引性の基が付くと、可視光の吸収は短波長側に移り、呈色は赤紫色を帯びるようになります。このように、フェノール類の構造の違いで、呈色は青色や青紫色、紫色、赤紫色など様々ですが、フェノール類でなければ呈色しません。この反応は、フェノール性ヒドロキシ基(-OH)を持つ化合物の、簡易的な検出法として広く知られています。
6C6H5OH + FeCl3 → 3H+ + [Fe(OC6H5)6]3− + 3HCl
表.1 フェノール類と塩化鉄(III)水溶液の反応
|
名称 |
融点〔℃〕 |
沸点〔℃〕 |
FeCl3aqとの呈色 |
|
フェノール |
41 |
182 |
紫 |
|
o -クレゾール |
31 |
191 |
青 |
|
m -クレゾール |
12 |
203 |
青 |
|
p -クレゾール |
35 |
202 |
青 |
|
1-ナフトール |
96 |
288 |
紫 |
|
2-ナフトール |
122 |
296 |
緑 |
|
サリチル酸 |
159 |
昇華 |
赤紫 |
(ii) 臭素との反応
フェノール性ヒドロキシ基(-OH)は、オルト-パラ配向性であり、ベンゼン環の反応を活性化させる置換基です。したがって、フェノールの溶液に臭素Br2水を加えると、室温で速やかに反応して、「2,4,6-トリブロモフェノール」の白色沈殿が生じます。この反応に、触媒は全く必要としません。2,4,6-トリブロモフェノールは、日本では年間で2,500 tほど合成されており、殺菌剤や難燃剤の中間体として利用されています。
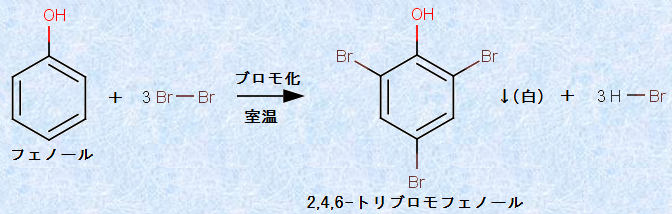

図.10 フェノールのブロモ化
(iii) 酸無水物との反応
フェノール類は、アルコールと同じように酸無水物と反応し、カルボン酸エステルを生じます。例えば、次の図.11のように、フェノールは無水酢酸(CH3CO)2Oと反応して、「酢酸フェニル」を生じます。フェノール類のエステル化は、アルコールに比べるとかなり起こりにくく、氷酢酸CH3COOHではなかなか反応しないので、反応性の大きい無水酢酸(CH3CO)2Oを使用しなければなりません。これは、フェノール類の求核性がアルコールに比べて低く、カルボニル基(-CO-)に付加する力が低下しているからです。
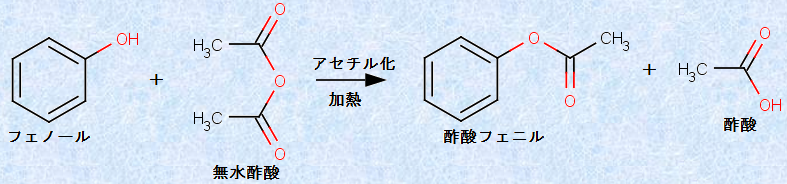
図.11 フェノールのアセチル化
(3) フェノールの合成
フェノールは、1834年にドイツの化学者であるフリードリッヒ・ルンゲによって、石炭を乾留して得られるコールタールの中より発見されました。しかし、純粋に取り出されたのは、それから7年もあとのことです。別名であるドイツ語の「カルボル・ゾイレ」や日本語の「石炭酸」は、石炭に由来して付けられた名前であり、初めはカルボン酸と同じような酸であると考えられていました。これを「フェノール」と命名し直したのは、後にアセチルサリチル酸を合成するフランスの化学者シャルル・フレデリック・ジェラールでした。

図.12 コールタールは芳香族化合物を多量に含み、独特の臭気を持つ
フェノールは、室温では白色結晶であり、融解すると無色になります(m.p.41℃, b.p.182℃)。水とは互いにほとんど溶け合わずに2層に分かれ、65℃以上では、任意の割合で混合するようになります。タンパク質を凝固・変性させる力が非常に強く、細菌にもよく浸透して、強い殺菌・消毒作用を示します。一方で、皮膚や粘膜を強く侵す腐食性があり、手に付着すると、突き刺すような激しい痛みを感じます。
筆者は、実験でフェノールを使っていたときに手の皮膚を化学損傷したことがありますが、最初は皮膚が真っ白になり、数時間後には真っ黒に変色しました。皮膚科に行くと、フェノールの化学損傷が物珍しいのか、何人かの先生が集まって、治療よりも先に写真を撮り始めてしまいました。記念撮影でしょうか。そして、いざ治療が始まると、治療は自然治癒以外にないようで、1週間ほどで痛みも消え、1年も経つと傷跡も消えました。フェノールの取り扱いには、十分に注意してください。

図.13 フェノールは、水彩絵具のような薬品臭を持ち、皮膚に触れると薬傷を引き起こす
(i) フェノールを消毒剤に使った男
フェノールは、有機合成化学工業において重要な原料であり、フェノールの2008年度の日本国内生産量は、約70万tにもなります。「フェノール樹脂」に代表されるプラスチックの他、医薬品や染料など、各種化学製品の原料として広く用いられています。フェノールそのものも、希釈して「消毒剤」などに利用されます。消毒のために手術室にフェノールを噴霧し、傷口を薄めたフェノール液で洗浄する方法を考案したのは、イギリスのグラスゴー大学医学部の外科教授であるジョゼフ・リスターでした。細菌が発見されたのは1676年のことですが、当時はとても小さな生物がいることが確認されただけでした。細菌によって病気が発生することは、1859年のフランスの細菌学者であるルイ・パスツールの研究によります。このため、19世紀半ばまで、衛生や消毒という概念は存在しませんでした。
これは医療においても同じで、汚れたままの器具で手術を行ったり、汚い手で傷を手当したり、そもそも傷口を洗浄するという考えすらありませんでした。そのため、外科手術の際に傷口が化膿して発熱することが多く、これは「手術熱」といわれて、19世紀の外科医たちを悩ませました。四肢を切断した患者の死亡率が80%に達した病院さえ存在したし、ちょっとした虫唾炎の手術でさえ、命取りになることは少なくありませんでした。外科医であるリスターは、数多くの骨折患者を診てきましたが、単純な骨折なら、固定さえしておけば自然に治癒するのに対し、骨が皮膚を突き破った「開放骨折」では、患者が感染症にかかるケースが多いことを知っていました。当時は、むき出しになった組織が、空気中の酸素O2により害を受けるのではないかと考えられていました。つまり、酸素O2が傷口の有機物を分解し、膿ができると考えられていたのです。そのため、リスターの時代には、酸素O2を遮断するため、傷口に包帯をきつく巻き付けるのが一般的な処置でした。ところが、実際には包帯を巻くと細菌の増殖が助長され、耐えがたい悪臭が病棟に広がりました。多くの医師が、この「悪臭」こそが感染症の原因であり、外科手術後の患者の死亡率が高いのも、そのせいだと信じ込んでいました。ところが、辻褄の合わない話ですが、その「悪臭」を消して、問題を解決しようとした医師は、ほとんどいませんでした。

図.14 リスターは、「術後の創傷の化膿は細菌による感染である」と考え、術野や用具をフェノールで消毒することを考案した
やがて、進展が訪れました。イギリスの化学者であるトマス・アンダーソンが、フランスの細菌学者であるルイ・パスツールの新しい学説(1859年)を、リスターに伝えたのです。パスツールは、空気中に放置した肉汁がすぐに腐ってしまうのに対し、加熱したあとに微生物が入らないように保てば、肉汁は腐敗しないことを見出したのでした。そもそも、「酸素犯人説」を信用していなかったリスターにとって、パスツールの学説は斬新でした。リスターは、「何か目に見えない埃」が傷口に居座っているのではないかと想像していたからです。早速、リスターは実験に取りかかりました。採取したての尿を加熱し、その半分をガラス管に入れて密封し、あとの半分は空気にさらしておきました。翌朝、臭いをかいでみると、空気にさらしておいた方の尿は、激しい悪臭を放っていましたが、ガラス管に密封した方の尿には、悪臭がありませんでした。明らかに、空気中の微生物が、封をしなかった方の尿に侵入したのです。

図.15 パスツールは、ドイツの細菌学者ロベルト・コッホとともに、「近代細菌学の開祖」とされる
しかし、患者を加熱するのは、実行可能な研究方法ではありません。そこで、リスターは化学物質を利用して、細菌を殺せないものかと考えました。ある日、リスターは、石炭産業の副産物であるフェノールを下水溝に流すと、酷い悪臭が消えるという新聞記事を発見しました。そして、フェノールで処理された下水が肥料として使われ、その肥料をまいた牧草地の草を食んだウシは、寄生虫などに感染しないことも知られていました。「これだ!」と直感したリスターは、早速アンダーソンから分けてもらったフェノールを、馬車にひかれて骨折し、脛骨がむき出しになった11歳の少年の傷口に塗布してみました。すると、少年は合併症を併発することなく、無事に回復しました。そこで、リスターは、傷口を包む包帯や医療器具をフェノールで洗浄し、手術室全体をフェノールで消毒する霧吹きを開発しました。結果は、すぐに表れました。外科で切断手術を受けた患者の死亡率が、50%から15%に激減したのです。
けれども、この新しい方法は、初めはなかなか一般に認められませんでした。なぜなら、細菌――当時「小さな獣」と呼ばれた微生物――などという目に見えないものは、決して信じないという医師が多かったからです。リスターが当時無名の外科医であり、フェノールの正しい使用法が、まだ確立していなかったことも影響しました。しかし、リスターの方法が実際に効果を挙げるにつれて、次第に各国の医師たちの注目を集めるようになりました。細菌学の進展も、これを後押ししました。やがて、リスターはヴィクトリア女王の膿瘍手術に立ち会い、時のイギリス国王であるエドワード7世の盲腸手術の執刀医に指名されるまでになります。王立協会の会長にも選出され、医師としては初めて、男爵位の称号を受けることにもなりました。
フェノールやクレゾールは、手術時の消毒に欠かせぬ重要な役割を果たすようになりました。ぷんと鼻に付くあの独特な昔の病院の臭いは、消毒液として使われたフェノールやクレゾールの臭いだったのです。特にクレゾールは、フェノールよりも腐食性が少なく、約2.5倍の殺菌力を持っていたので、薄めた水溶液(クレゾール石鹸液)が、医療機関などで消毒液として汎用されました。しかし、特有の強い臭いと取り扱いの困難さから、医療機関での使用は減少しています。現在では、刺激が少なく、殺菌効果がより優れた消毒液が色々使われるようになって、あのお馴染みの病院の臭いも消えてしまいました。

図.16 クレゾールは、かつて医療機関などで消毒液として用いられていたが、現在ではその使用は減少している
ちなみに、クレゾール中毒になると、尿が黒くなることが知られています。2013年にオープンジャーナルに投稿された症例報告によると、自宅で50%のクレゾール石鹸液に足を浸していた男性が失神したため、救急部に搬送されたそうです。男性は無気力状態にあり、全体から強い薬品臭が漂っていました。足は茶色く変色し、嚢胞を形成していました。しかし、その割にバイタルサインは正常だったそうです。家族によれば、男性はクレゾールに足を付ける習慣があり、これで水虫が治るものだと信じていたようです。このクレゾールの足湯の習慣は、半年以上もの期間、週3回続けられました。今回は、足にクレゾールを浸していた時間が、5〜6時間と非常に長かったようです。尿検査をしたところ、黒い尿が出てきたそうですが、これも8時間のうちに元通りの色に戻ったそうです。
(ii) 芳香族求核置換反応
芳香族化合物の最も一般的な反応は、求電子剤とベンゼン環の水素原子が置き換わる「求電子置換反応」でした(芳香族炭化水素を参照)。しかし、置換ベンゼンにおいては、置換基が脱離しやすい基である場合に限り、置換基と求核剤が置き換わる「求核置換反応(nucleophilic substitution reaction)」が起こる場合があります。ここで、脱離基の脱離能は「塩基性」によって決まり、その物質が弱い塩基であるほど、優れた脱離基になります。また、求核剤はその物質の「塩基性」が強くなるほど、優れた求核剤になります。
したがって、芳香族求核置換反応でフェノールを合成するためには、優れた脱離基を持つ置換ベンゼンに、優れた求核剤である水酸化物イオンOH- を作用させれば良いということになります。ただし、この反応は簡単には起こらないので、一般的に高温・高濃度の条件で、激しく反応させる必要があります。次の図.17に、置換ベンゼンと水酸化ナトリウムの「芳香族求核置換反応」を示します。
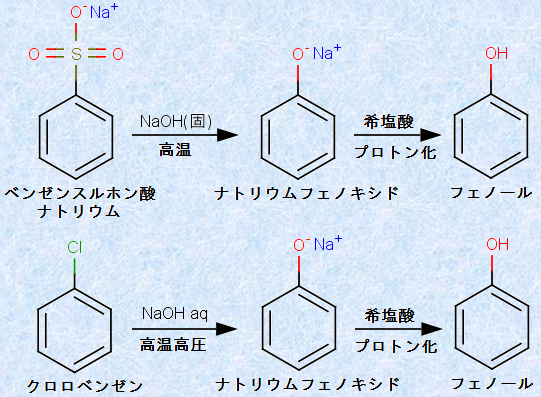
図.17 置換ベンゼンと水酸化ナトリウムNaOHの芳香族求核置換反応
スルホ基(-SO3H)やクロロ基(-Cl)は、電子求引性が高い置換基であり、これらは優れた脱離基になります。そこで、これに優れた求核剤である水酸化物イオンOH- を作用させることで、脱離基と求核剤の置換反応が起こり、フェノールが生成するのです。ただし、反応条件は強塩基性なので、フェノールはこの条件では、直ちに中和されてナトリウムフェノキシドになります。そこで、最後に希塩酸HClなどの強酸を作用させてプロトン化すると、弱酸のフェノールが得られます。
ベンゼンスルホン酸ナトリウムの場合は、固体の水酸化ナトリウムNaOHを約290〜340℃に加熱して、融解状態の水酸化ナトリウムNaOHにベンゼンスルホン酸ナトリウムを少しずつ加えながら反応させます。この操作を「アルカリ融解(alkaline resolution)」といいます。また、クロロベンゼンの場合は、分子性物質なので揮発性(b.p.131℃)があり、高温にするとすぐに蒸発してしまうので、アルカリ融解で反応させることができません。そこで、耐圧容器にクロロベンゼンと水酸化ナトリウムNaOH水溶液を入れて、約200気圧程度まで圧力をかけながら360℃程度に加熱して反応させる必要があります。この操作を「クロロベンゼン法(chlorbenzene method)」といいます。
さらに、ジアゾニウム化合物のように、強力な求核剤を必要としない反応もあります。例えば、次の図.18に示すように、塩化ベンゼンジアゾニウムは室温で水H2Oと反応して、フェノールになります。このとき、水分子は求核剤として作用しています。ジアゾニウムイオンは非常に不安定な化合物であり、ジアゾニオ基(-N+≡N)は優れた脱離基となります。したがって、水H2Oのような弱い求核剤でも、反応することができるのです。塩化ベンゼンジアゾニウムは、温度が5℃以上になると、窒素N2を切り離して分解します。この反応では、求核剤は必ずしも水H2Oである必要はなく、種々の求核剤を用いることで、ジアゾニウムイオンを様々な置換ベンゼンに変換することができます。
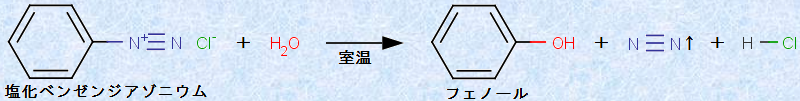
図.18 塩化ベンゼンジアゾニウムの加水分解
(iii) クメン法
「クメン法(cumene process)」とは、クメンを空気酸化して得られるクメンヒドロペルオキシドを希硫酸H2SO4で分解して、アセトンとフェノールに転位させる化学合成法のことです。現在、工業的に生産されるフェノールのほとんどが、このクメン法によります。クメン法は、副産物の後処理に困るアルカリ融解法や、高圧容器を必要とするクロロベンゼン法よりも、工業的に優れた方法です。
まず、ベンゼンとプロペンを「フリーデル・クラフツアルキル化反応」で置換反応させて、クメンを製造します。そして、これを空気中に含まれる酸素O2で酸化すると、過酸化物であるクメンヒドロペルオキシドが生成します。「ペルオキシド」というのは「過酸化物」という意味で、-O-O-結合を持つ化合物のことを指します。特にR-O-O-Hの構造を持つ化合物を「ヒドロペルオキシド」といいます。続いて、クメンヒドロペルオキシドを希硫酸H2SO4中で50〜60℃に加熱すると、フェニル基の転移による複雑な反応が起こって、アセトンとフェノールに分解します。アセトンは、フェノールと等物質量が生じるので、生産過剰気味です。
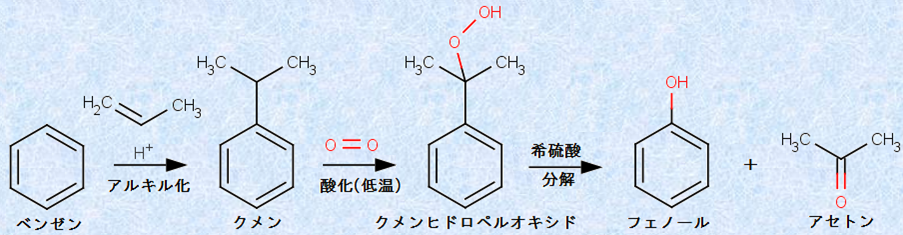
図.19 クメン法は、工業的に広く利用されているフェノールの合成法である
(4) フェノール類の合成
(i) ピクリン酸の合成
フェノール性ヒドロキシ基(-OH)は、オルト-パラ配向性です。したがって、フェノールの溶液に希硝酸HNO3を低温で反応させると、o位やp位の水素原子がニトロ基(-NO2)で置換された「ニトロフェノール」が生成します。フェノールのo位とp位の水素原子をニトロ基(-NO2)で置換した「2,4-ジニトロフェノール」は、代謝を促進する作用があるため、かつては「やせ薬」として使われていました。しかし、副作用として発疹、味覚障害、失明などの症状が現れ、急激に体温が上昇して熱中症で死亡するケースが相次ぎ、現在は完全に市場から消えています。
また、フェノールの溶液に濃硝酸HNO3と濃硫酸H2SO4の混酸を高温で反応させると、「2,4,6-トリニトロフェノール(ピクリン酸)」が生成します。ピクリン酸は鮮やかな黄色結晶で、皮膚に付着すると黄色に変色することから、実験動物の耳などにピクリン酸を付けて、各個体を識別するためのマーカーとして使われています。安価な黄色の染料がなかった時代には、絹や羊毛の合成染料にも使われました。
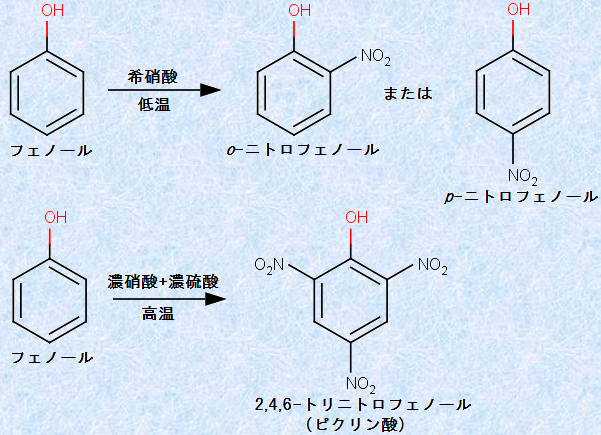
図.20 フェノールのニトロ化
ピクリン酸は、弱酸性(pKa=10)のフェノールとは異なり、強酸性(pKa=0.29)を示します。この理由は、ニトロ基(-NO2)の誘起効果によって、水素イオンH+ を電離したあとの共役塩基が安定化されるためです。ちなみに「ピクリン酸」という名称は、この化合物が、強い酸性と苦味(picro=苦味)を持つことに因ります。梅干しにも微量含まれ、肝臓の機能を活性化するといわれています。
ニトロ基(-NO2)を3つ持つピクリン酸には強い爆発性があり、かつて日露戦争において、日本海軍の主力爆薬として用いられていました。当時は「下瀬火薬」と呼ばれており、1905年5月27日の日本海海戦でロシアのバルチック艦隊を粉砕した爆薬は、ピクリン酸でした。しかし、酸性が強く金属と反応しやすいこと、湿気に弱く雨天の日には不発弾が多いこと、非常に不安定で取り扱いに注意が必要であることなどから、後により安定な「2,4,6-トリニトロトルエン(TNT)」などに取って代わられました。TNTは中性であり、湿気にも影響されなかったので、軍事的にはピクリン酸よりも扱いやすかったのです。ただし、ピクリン酸の爆速は7,800 m/sで、爆発の威力ではTNTの7,000 m/sを上回っていたといいます。

図.21 ピクリン酸の黄色結晶
フェノール類の検出方法の1つとして、塩化鉄(III) FeCl3による呈色反応が知られています。しかし、ピクリン酸はフェノール性ヒドロキシ基(-OH)があるにもかかわらず、この反応に対して陰性です。この理由として、ピクリン酸には電子求引性の置換基であるニトロ基(-NO2)がベンゼン環上に3つ存在しており、これらニトロ基(-NO2)が、フェノール性ヒドロキシ基(-OH)の酸素原子上の非共有電子を求引して、電子密度を減少させることが原因と考えられます。それ故に、ピクリン酸の鉄(III)イオンFe3+ に対する配位力が非常に弱くなり、呈色を示さなくなるのです。
(ii) サリチル酸の合成
ナトリウムフェノキシドの水溶液に二酸化炭素CO2を通じると、弱酸のフェノールが遊離します。しかし、高温に加熱したナトリウムフェノキシドの融解液に対して、高圧の二酸化炭素CO2を反応させると、o位にカルボキシ基が置換した「サリチル酸ナトリウム」が生成します。o位に置換が起こるのは、フェノキシドイオンの近くに位置しているナトリウムイオンNa+ に引き寄せられるように、二酸化炭素CO2が近付いて反応するからです。その後、生成物を水に溶かし、強酸を加えると、弱酸のサリチル酸が得られます。この反応は、発見者のヘルマン・コルベと、反応条件を見出したルドルフ・シュミットの両名にちなんで、「コルベ・シュミット反応(Kolbe-Schmitt reaction)」と呼ばれます。
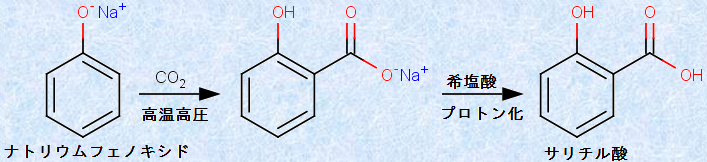
図.22 コルベ・シュミット反応を用いたサリチル酸の合成
サリチル酸は、無色針状の結晶です。強い殺菌力を持つので、ひと頃は日本酒の防腐剤にも一役買った立役者であったのですが、今は使われていません。サリチル酸の有害作用が問題視されて、1975年7月に使用が禁止されました。それ以降、開封した日本酒は腐りやすくなりました。分子中にヒドロキシ基(-OH)とカルボキシ基(-COOH)の2つの官能基を持っているので、サリチル酸はフェノール類とカルボン酸の両方の性質を示します。例えば、サリチル酸はフェノール性ヒドロキシ基(-OH)を持っているので、塩化鉄(III) FeCl3水溶液により赤紫色を呈します。その昔、防腐剤としてのサリチル酸がたくさん入った安酒の盃に、塩化鉄(III) FeCl3水溶液を落として、日本酒を赤紫色に呈色させ、赤提灯の女将さんに叱られた化学者の卵がいたものです。
また、サリチル酸に無水酢酸(CH3CO)2Oを作用させると、サリチル酸のヒドロキシ基(-OH)がアセチル化された「アセチルサリチル酸」が生成します。アセチルサリチル酸は「アスピリン」とも呼ばれ、代表的な「解熱鎮痛剤」の1つです。アスピリンは、1899年の発売開始以来、長きに渡ってベストセラーの座を守り続けている「医薬の王様」です。その消費量は、500 mg錠剤換算で年間1,000億錠(年間5万t)、一列に並べると月まで1往復半近くになるといいますから、その売れ行きの凄まじさが分かります。特にアメリカでは、何かあればすぐアスピリンを飲むというくらいの愛されぶりで、映画「ダイ・ハード」のブルース・ウィリス演じるマクレーン刑事も、片頭痛持ちで頻繁にアスピリンを飲んでいるという設定でした。19世紀から基本的に姿を変えることなく、今もなお売れ続けている製品など、医薬に限らずあらゆる工業製品の中でも極めてまれでしょう。
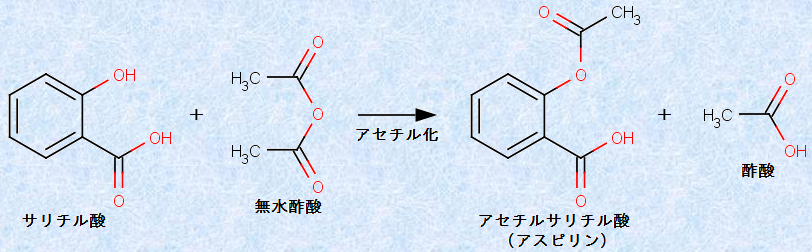
図.23 アセチルサリチル酸の合成
アスピリンが1899年にバイエル社によって発売されるまでは、ヤナギ科の「セイヨウシロヤナギ(Salix alaba)」の樹皮から得られたサリチル酸が、解熱鎮痛剤として用いられていました。この樹皮は、古くから解熱の目的で使用されており、その使用の記録は、紀元前400年まで遡るといいます。古代ギリシアの代表的な医師であるヒポクラテスは、ヤナギの樹皮を熱や痛みを和らげる目的で使用していました。日本でも、虫歯のときにヤナギの樹皮を噛む習慣があったといいます。江戸時代の川柳に「歯痛には柳楊枝」という表現があり、爪楊枝はヤナギの木で作られ、それで歯を掃除していました。しかし、サリチル酸は比較的強い酸(pKa=2.97)であり、pHは1.7と胃酸程度の強さです。サリチル酸をそのまま服用すると、強い胃腸障害が出るという副作用の問題がありました。
そこで、サリチル酸の酸性を弱めて、副作用を弱くしたものが、アセチルサリチル酸(pKa=3.49)です。アセチルサリチル酸は、サリチル酸と同等の鎮痛効果を示し、そして何よりも安全な薬であったことから、「世紀の薬」として、瞬く間に世界中で使われるようになりました。当時、鎮痛薬としては依存性や耽溺性の問題がある「モルヒネ」が第一の選択肢、というより唯一の選択肢であった時代ですから、その衝撃の大きさが伺えます。分子の構造を意図的に変えながら、理想的な構造へ向けて最適化することで、新しい医薬を生み出せるということが明らかになった点において、アセチルサリチル酸が後世に与えた影響は、計り知れないものがあります(アスピリンの科学を参照)。

図.24 バイエルのアスピリンは、瞬く間に人気商品となった
ところで、アセチルサリチル酸がどのような仕組みで鎮痛作用を示すのかは、1971年まで不明でした。アセチルサリチル酸の鎮痛作用を解明したのは、イギリスの薬理学者であるジョン・ベーンです。アセチルサリチル酸が鎮痛作用を示す理由は、体内で「シクロオキシゲナーゼ(COX)」という酵素の作用を阻害することによって、「プロスタグランジン(PG)」の合成を抑制するためです。プロスタグランジンは、発熱や痛覚の情報を伝達する「オータコイド(ホルモンおよび神経伝達物質以外の生理活性物質)」であり、プロスタグランジン自体には発痛作用はありませんが、「ヒスタミン」や「ブラジキニン」などの発痛物質による発痛を増強させる作用があるといわれています。このプロスタグランジンの研究の功績により、ジョン・ベーンは、1982年にノーベル生理学・医学賞を受賞しました(アスピリンの科学を参照)。

図.25 ベーンは、プロスタグランジンの研究により、ノーベル生理学・医学賞を受賞した
発痛補助物質であるプロスタグランジンは、細胞膜のグリセロリン脂質からアラキドン酸を経て合成されます。アセチルサリチル酸は、アラキドン酸からプロスタグランジンへの経路をブロックすることにより、人が感じる痛みを和らげているのです。ちなみに、「傷口は見ない方がいい。見ると痛くなる」という話がありますが、プロスタグランジンはある程度精神力でコントロールできる物質なので、あながち間違っている話ではありません。プロスタグランジンは、「痛い」と思えば思うほど大量に分泌され、発痛を増強してしまうのです。プロレスラーなどの格闘家は、痛みに対する精神力が非常に強いため、プロスタグランジンの分泌が抑えられ、痛みを感じにくい身体になっていると考えられます。

図.26 発痛のしくみ
一方で、サリチル酸にメタノールCH3OHと濃硫酸H2SO4を作用させると、カルボキシ基(-COOH)がエステル化され、「サリチル酸メチル」が生成します。サリチル酸メチルは、北米産のシャクナゲ科の植物ガウテリア・プロクムベス(オオウメガソウ)から取れる油に多く含まれ、「冬緑油」として、古くから盛んに抽出されていました。冬緑油は、強い刺激性がありますが、皮膚に擦り込むと、炎症を抑える働きを示しました。そこで、冬緑油は、打ち身や疲れの回復の盛んに使われました。現在でも、サリチル酸メチルは、高濃度では「湿布薬」として、関節痛・筋肉痛などの鎮痛剤として用いられます。サロンパスの颯爽たる香りは、このサリチル酸メチルの香りです。また、低濃度では、食品添加物としてチューインガムや練り歯磨き粉などの香料として用いられます。
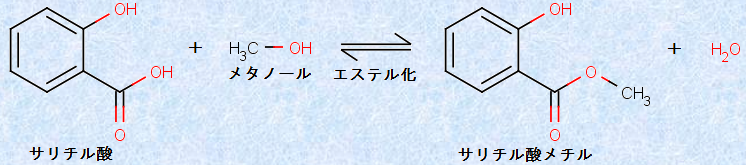
図.27 サリチル酸メチルの合成
(5) 芳香族カルボン酸
ベンゼン環の水素原子をカルボキシ基(-COOH)で置換した化合物を、「芳香族カルボン酸(benzoic acid)」といいます。芳香族カルボン酸は、一般的には無色の固体で、冷水には溶けにくいです。しかし、温水には少し溶けて、弱酸性を示します。芳香族カルボン酸は、塩基と中和して塩を作り、水によく溶けるようになります。最も単純な芳香族カルボン酸は、「安息香酸」です。例として、次の図.28に、「安息香酸」と水酸化ナトリウムNaOHの中和反応を示します。
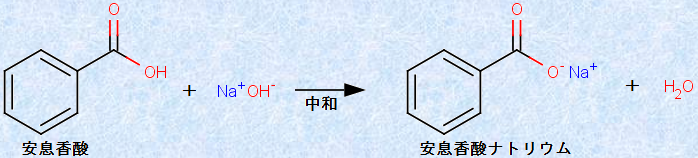
図.28 安息香酸と水酸化ナトリウムNaOHの中和反応
芳香族カルボン酸は、染料や医薬品などの原料に用いられます。また、「テレフタル酸」のように、合成樹脂や合成繊維の原料に用いられるものもあります。例として、次の図.29に、様々な「芳香族カルボン酸」を示します。
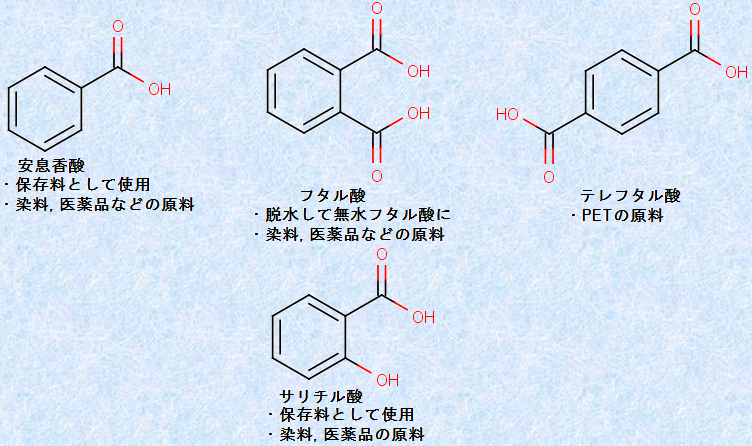
図.29 様々な芳香族カルボン酸
安息香酸は、代表的な芳香族カルボン酸です。「安息香酸(benzoic acid)」とは、いかにも変な名前ですが、これには由来があります。中世にアラビア人が香料として用いたエゴノキ科のアンソクコウノキから取れる「安息香(benzoin)」という樹脂を乾留し昇華して、初めて安息香酸が得られたのです。安息香には、黄白色の「シャム安息香」と赤褐色の「スマトラ安息香」とがあって、ともにほのかな良い香りがします。産出量はスマトラ安息香の方がずっと多いですが、香料としての品質は、シャム安息香の方が優れています。強く加熱していくと、シャム安息香からは、安息香酸とそのエステルだけが昇華してきます。しかし、スマトラ安息香からは、主として「桂皮酸」とそのエステルが昇華してきます。桂皮酸エステルには、芳香を持つものが何種類かあり、桂皮酸メチルは「マツタケ臭」、桂皮酸エチルは「シナモン臭」がします。

図.30 安息香は、アンソクコウノキに傷を付けて、そこからにじみ出て固化した樹脂を収集することで得られる
この安息香は、昔は香料として使われた他に、去痰薬として内服されたり、殺菌性を利用して、洗浄やうがいに使われたりしました。現在では、もうこの用途ではほとんど使われていません。現在では、安息香酸の抗菌・静菌作用を利用して、水溶性のナトリウム塩の形にして、安息香酸ナトリウムが清涼飲料水などの保存料として添加されています。
(6) 芳香族カルボン酸の合成
芳香族カルボン酸は、ベンゼン環に結合したアルキル基を酸化することによって合成できます。この反応は、ベンゼン環が極めて高い安定性を持つことを、改めて立証しています。すなわち、酸化を受けるのは、アルカンに似たアルキル基であり、ベンゼン環ではないからです。この反応では、酸化剤がベンゼン環に隣接するベンジル位のC-H結合を攻撃します。次の図.31に示すように、ベンゼン環に結合したアルキル基は、どんな長さのものでも、最終的に安息香酸になります。なお、酸化剤として中性条件の過マンガン酸カリウムKMnO4を作用させるのは、酸性条件の過マンガン酸カリウムKMnO4では爆発する恐れがあるからです。
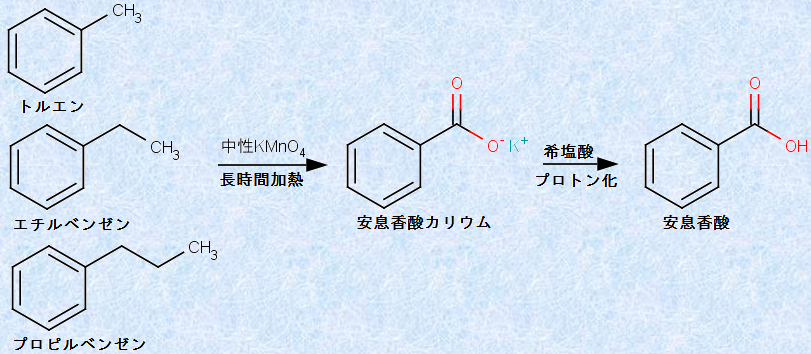
図.31 安息香酸の合成
「トルエン」は、シンナーの成分であり、かつてシンナーを吸引する若者が多数出現して、大きな社会問題となりました。トルエンは、血液脳関門を通過しやすく、脳内に侵入して、中枢神経を麻痺させる作用があることから、大変に危険な物質です。それでは、トルエンとベンゼンでは、どちらの方の毒性がより強いでしょうか。これを聞くと、「ベンゼンよりもトルエンの方が危険性が高い」と答える人が多いです。しかし、実はベンゼンの方が、トルエンよりも毒性が強いのです。
体内に炭化水素が侵入したとき、人体はそれを除くために、肝臓で酸化して水溶性物質に変換し、尿や便などから排出しやすくなるように化学反応を起こします。しかし、ベンゼンの場合は、ベンゼン環が極めて安定なので、酸化されにくく、長時間体内に残存して、重い肝臓障害を引き起こします。ベンゼンを排出するためには、ベンゼン環を酸化する必要がありますが、このとき生成する酸化反応中間体が、有害であると考えられています。一方でトルエンの方は、側鎖のメチル基(-CH3)が酸化されやすく、安息香酸となって容易に体外へ排出されるため、このときの中間酸化生成物は、ほとんど無害なのです
多環式芳香族炭化水素の中には、極めて強い毒性を持つ物質があります。例えば、化石燃料の燃焼過程で生成する「ベンゾ[a]ピレン」という物質は、強い発ガン性を持ち、ハツカネズミの皮膚にごくわずかの量を塗布するだけで、皮膚腫瘍を引き起こします。このような発ガン性炭化水素は、コールタールだけでなく、油煙(すす)やタバコの煙の中、またバーベキューの焼肉の中にも存在するといわれています。これらの悪性の生理的効果が初めて注目されたのは、煙突掃除夫の陰嚢ガン発生の主原因が、煤煙であると指摘された1775年に遡ります。それと同時に、肺ガンや口唇ガンも、ベンゾ[a]ピレンによって引き起こされやすくなることが分かってきました。ベンゾ[a]ピレンは、酵素酸化によりジオールエポキシドに変換されますが、この生成物が細胞のDNAと反応して、変異を引き起こすと考えられています。
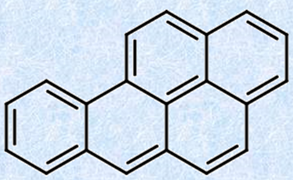
図.32 ベンゾ[a]ピレンは、発ガン性や催奇形性などが報告されている
なお、ベンゼン環の側鎖のベンジル位にC-H結合が存在しないと、代わりにベンゼン環が酸化されることになります。例えば、次の図.33のように、tert -ブチルベンゼンを中性過マンガン酸カリウムKMnO4で長時間加熱すると、2,2-ジメチルプロパン酸が生成します。
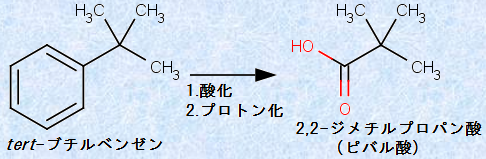
図.33 ベンジル位にC-H結合が存在しないアルキルベンゼンの酸化反応
中性過マンガン酸カリウムKMnO4以外の酸化剤を使用するこのタイプの酸化反応には、工業的に重要なものがあります。例えば、ポリエチレンテレフタレート(PET)の製造に必要な原料物質である「テレフタル酸」は、次の図.34に示すように、コバルトCoを酸化触媒としたp -キシレンの空気酸化法で合成されています。また、染料や医薬品の合成に有用な「フタル酸」も、o -キシレンの酸化によって、同様の方法で工業的に製造されています。
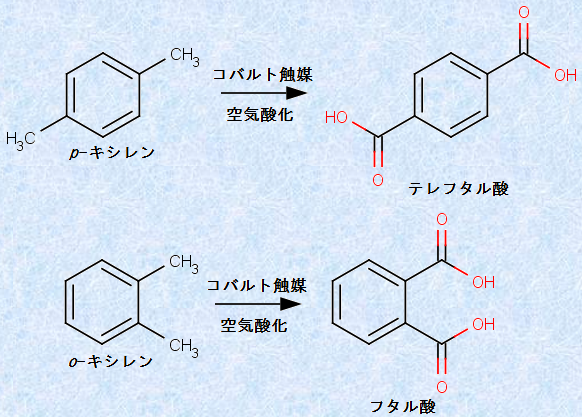
図.34 テレフタル酸とフタル酸の合成
・参考文献
1) 朝日新聞科学グループ編「今さら聞けない科学の常識」講談社(2008年発行)
2) Andy Brunning著/高橋秀依・夏苅英昭訳「カリカリベーコンはどうして美味しいにおいなの?」化学同人(2016年発行)
3) 枝川義邦「身近なクスリの効くしくみ-薬理学はじめの一歩-」技術評論社(2010年発行)
4) 倉原優「本当にあった医学論文」中外医学社(2014年発行)
5) 佐藤健太郎「医薬品とノーベル賞 がん治療薬は受賞できるのか」角川新書(2016年発行)
6) 佐藤健太郎「化学で「透明人間」になれますか?」光文社新書(2014年発行)
7) 佐藤健太郎「世界史を変えた薬」講談社(2015年発行)
8) ジョー・シュワルツ「シュワルツ博士の化学はこんなに面白い」主婦の友社(2002年発行)
9) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
10) 船山信次「こわくない有機化合物超入門」技術評論社(2014年発行)
11) 山崎幹夫「新化学読本-化ける、変わるを学ぶ」白日社(2005年発行)
12) 矢沢サイエンスオフィス編「薬は体に何をするか-「あの薬」が効くしくみ-」技術評論社(2006年発行)