・酸と塩基(酸と塩基の強さ)
【目次】
(1) 酸と塩基の定義
私たちが化学物質を同定し、区別するとき、その手掛かりとなるのは、物質の何らかの性質です。また、いくつかの物質を分類するときも、共通の性質を持つ一群のものをひとまとめにします。こうして、金属・土・水・油・空気などが、それぞれの共通の性質によって分類され、それらの中でも最も基本的と考えられるものが、古代以来「元素(element)」と呼ばれてきました。「酸性(acidity)」は、物質のこのような顕著な性質の1つであり、そういう性質を持ついくつかの物質が、「酸(acid)」としてまとめられました。酸の英語「acid」は文字通り、ラテン語の「acidus(酸っぱい,舌を刺す)」に由来しています。
身近な酸の代表例は、レモンに含まれるクエン酸や、お酢に含まれる酢酸、ヨーグルトに含まれる乳酸などです。教科書に出てくる塩酸や硫酸、硝酸といった無機化合物の酸、いわゆる「鉱酸(mineral acid)」が登場するのは、蒸留技術が向上した中世以降の時代です。13世紀のヨーロッパでは、硫酸鉄(II) FeSO4の乾留によって硫酸H2SO4が、硫酸鉄(II) FeSO4と硝酸カリウムKNO3の混合物の乾留によって硝酸HNO3が得られていました。
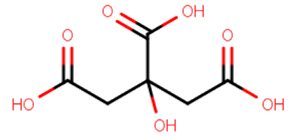
図.1 クエン酸の構造式
一方で、酸と反応して、その働きを弱める物質もまた、昔から分かっていました。それは、陸の植物や海藻を焼いた灰の中にありました。再結晶によって、陸の植物からは主に炭酸カリウムK2CO3が、海藻からは主に炭酸ナトリウムNa2CO3が得られました(両者は長い間区別はされていませんでした)。これらの物質は、舌を刺激する特有の辛味があり、中世の錬金術師ゲーベルは、これらを「アルカリ(alkali)」と呼びました。「アルカリ」の語源は、アラビア語の冠詞「al」と「qily(植物を焼いた灰)」に由来します。アルカリをさらに強熱すると、一部は二酸化炭素CO2などの気体となって消え、さらに強いアルカリ性の物質が残りました。当時の人たちは、加熱したあとに残る部分は、もとの灰よりも堅固な物質だと考え、ギリシア語の「basis(基礎)」にちなんで、「塩基(base)」と名付けました。今日では、酸の対概念には基本的に「塩基」を用いますが、水に溶けやすい無機塩は、特に「アルカリ」とも呼んでいます。

図.2 ゲーベルの著作は400を超えるともいわれ、中世ヨーロッパの錬金術に大きな影響を与えた
酸と塩基の定義は、時代によって変遷していきました。化学の黎明期に当たる17世紀に入ると、実用的色彩の強かった化学も、自然科学の一分野として、しかるべき地位が与えられるようになり、なぜそうした性質を示すのかという点にまで、目が向けられるようになりました。例えば、イギリスの物理学者であったロバート・ボイルは、植物色素を使用して、酸と塩基の定義をしました。酸とは水溶液中でスミレ花汁やリトマスなどの植物色素を赤色に変えるもの、塩基とはスミレ花汁やリトマスなどの植物色素を青色に変えるというものです。ボイルの定義により、酸と塩基は、多くの物質を判定する客観的な基準となりました。しかし、化学の進歩とともに、このような単純な定義で酸と塩基を議論するということが困難になり、より広義な酸と塩基の定義に拡張されていきました。

図.3 地中海沿岸の岩石上に生えるリトマスゴケから、リトマス色素が得られる
酸をどう定義すべきか――これは、過去の化学者も悩んだ問いでした。実は、酸性のもとになる「酸っぱさ」が、何か特定の物質によるものだという考え方は、古代ギリシアの時代からありました。例えば、古代ギリシアの哲学者であるプラトンは、酸味のもとである酸は、「発酵(fermentation)」によって生成された物質だと考えていました。古代ギリシアでは、柑橘類はメジャーではなかったようで、酸といえば発酵によって得られた酢でした。そのため、「酸は発酵によって生成された」と考えたようです。プラトンはまた、酸の特徴として、「発泡を引き起こす」ことを挙げています。恐らく、酢酸CH3COOHを含む酢を石灰石CaCO3などの欠片にかけると、発泡することを発見したのでしょう。
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
18世紀後半になると、フランスの化学者であるアントワーヌ・ラボアジエが、新たな酸の定義を提唱しました。ラボアジエは、酸っぱい物質はどれも「発見されたばかりの元素」を含むように思えたため、この元素をギリシア語の「oxy(酸っぱい)」と「gen(〜のもと)」から「oxygen(酸素)」と命名し、「酸の性質を持つためには酸素Oが必要だ」と考えました(酸の酸素説)。確かに、硫酸H2SO4や硝酸HNO3、酢酸CH3COOHなどの多くの酸には、酸素原子Oが含まれていたので、ラボアジエの考えは正しそうでした。
しかし、1800年代の初めに発見された塩酸HClには、酸素原子Oは含まれていません。塩酸HClは、二酸化マンガンMnO2と反応させると塩素Cl2が発生します。当時は、「塩酸は未知の元素の酸化物」であり、塩酸HClには酸素原子Oが含まれていると考えられていました。そのため、塩酸HClがさらに酸化されて生成する塩素Cl2にも、当然酸素原子Oが含まれると考えられていました。多くの化学者が塩素Cl2から酸素元素Oを検出しようとしましたが、その試みはことごとく失敗しました。
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O

図.4 塩素Cl2の製法
そこで、1810年にイギリスの化学者ハンフリー・デービーは、「塩素Cl2は酸素Oを含まない単体である」と考えて、気体が黄緑色(ギリシア語でchloros)であったことから、その元素を「塩素(chlorine)」と命名しました。塩素Cl2と水素H2を混合して火花を飛ばすと塩酸HClが合成できることから、「塩酸HClには酸素Oは含まれない」と考えられるようになりました。こうして、酸素原子Oを含まない酸もあることが分かったのです。
H2 + Cl2 → 2HCl
そして、1811年にフランスの化学者であるベルナール・クールトアによってヨウ素Iが発見され、ヨウ化水素HIにも酸素原子Oが含まれていなそうだと分かってからは、「酸の性質は酸素Oではなく水素Hによるもの」だと考える説(酸の水素説)が登場しました。1838年には、ドイツの化学者であるユストゥス・リービッヒが、「酸とは水素Hを含む化合物で、水素Hが金属と置換されうるもの」と定義しました。「酸は水素Hを含む」というアイディアを大胆に表現したのは、フランスの化学者であるオーギュスト・ローランです。ローランは、酸を「水素塩」と表現しました。こうして、酸は水素原子Hと密接に結び付けられて考えられるようになりました。
(ii) アレニウスの定義
19世紀後半になると、物理学の発展とともに、「物理化学」が生まれてきました。スウェーデンの化学者であるスヴァンテ・アレニウスは、1887年に水溶液の浸透圧や電気伝導性などの諸性質が、塩類の水溶液においては異常な値を取ることを、「イオンの電離説」によって明らかにしました。アレニウスは、このような電解質の電離の理論に関する業績により、1903年にノーベル化学賞を受賞しています。アレニウスの電解質水溶液の理論を参考に酸塩基が議論された結果、ドイツの化学者であるヴァルター・ネルンストが、「アレニウスの見方によれば、溶液中の酸に特徴的な反応は、正電荷を帯びた水素イオンH+ を生成するという事実に基づいている」という文章を発表し、これにより次のような「アレニウスによる酸塩基の定義」が定着したと考えられています。
「酸とは水溶液中で水素イオンH+ を生じる物質であり、塩基とは水溶液中で水酸化物イオンOH− を生じる物質である」
今日では、酸性は水溶液中に存在する水素イオンH+ (正確にはオキソニウムイオンH3O+)の性質であり、また塩基性は水溶液中に存在する水酸化物イオンOH− の性質であることが知られています。ここで、アレニウス酸をHAとし、アレニウス塩基をROHとします。アレニウス酸HAは、水溶液中で水素イオンH+ とA− に電離し、アレニウス塩基ROHは、水溶液中でR+ と水酸化物イオンOH− に電離します。つまり、アレニウスの定義によると、酸と塩基は電離により、水素イオンH+ あるいは水酸化物イオンOH− を生じる物質だということが言えます。
アレニウス酸:HA → H+ + A−
アレニウス塩基:ROH → R+ + OH−
この定義に従うと、例えば、塩酸HClは水溶液中で水素イオンH+ と塩化物イオンCl− に電離するので、塩酸HClはアレニウス酸となります。また、水酸化ナトリウムNaOHは水溶液中でナトリウムイオンNa+ と水酸化物イオンOH− に電離するので、水酸化ナトリウムNaOHはアレニウス塩基となります。
HCl → H+ + Cl−
NaOH → Na+ + OH−
なお、この定義によると、アンモニアNH3はその溶液がアルカリ性を示すのに、水酸化物イオンOH− を持たないので、塩基ではないということになります。同様に、二酸化炭素CO2はその溶液が酸性を示すのに、水素イオンH+ を持たないので、酸ではないということになります。そこで、アレニウスの定義は拡張され、アンモニアNH3や二酸化炭素CO2は次のように水H2Oと反応し、それぞれが水酸化物イオンOH− や水素イオンH+ を生じるので、塩基および酸であると定義できるようになりました。
NH3 + H2O ⇄ NH4+ + OH−
CO2 + H2O ⇄ H+ + HCO3−
つまり、アレニウスの定義は、もともと水溶液中で定義される酸と塩基を分類したものなのです。したがって、アレニウスの定義における酸とは、水H2Oよりも強い酸のことであり、アレニウスの定義における塩基とは、水H2Oよりも強い塩基のことです。なお、塩基とアルカリの違いについては、高校の化学ではあまり取り上げて学習しませんが、アルカリ性は水に溶けて塩基性を示す物質の性質のことなので、アレニウスの定義における塩基性とは、一般的にアルカリ性と同じ意味で使われます。
アレニウスの定義における酸:HA + H2O → A− + H3O+
アレニウスの定義における塩基:B + H2O → HB+ + OH−
また、このアレニウスの定義に基づくと、酸や塩基は、化学式の示す1粒子当たりに何個の水素イオンH+ または水酸化物イオンOH− が出せるかという点から、1価、2価、3価・・・と「価数(valence)」を決めることができます。また、水素イオンH+ や水酸化物イオンOH− を出す強さの違いから、大雑把に様々な物質を強酸や弱酸、強塩基、弱塩基に分類することができます。
表.1 主な酸と塩基の分類
|
|
1価 |
2価 |
3価 |
|
強酸 |
HCl、HNO3、C6H5SO3H |
H2SO4 |
|
|
弱酸 |
CH3COOH、C6H5OH |
H2C2O4、H2CO3、H2S |
H3PO4 |
|
強塩基 |
NaOH、KOH |
Ca(OH)2、Ba(OH)2 |
|
|
弱塩基 |
NH3、C6H5NH2 |
Fe(OH)2、Cu(OH)2 |
|
酸と塩基の強さについては、溶かした電解質の量に対する電離した電解質の割合から決めることができ、これを「電離度(degree of ionization)」といいます。電離度は、記号「α」を用いて表すことが多いです。
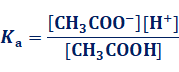
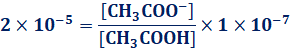
図.5 弱酸と強酸の電離度
電離度がα ≒1で、水溶液中でほぼ100%電離する酸塩基を、それぞれ強酸や強塩基といいます。それに対して、電離度がα << 1で、水溶液中ではあまり電離しない酸塩基を、それぞれ弱酸や弱塩基といいます。なお、電離度αは、物質によって固有の値という訳ではなく、物質の濃度や温度によって、電離度αは大きく変化します。一般的に物質の濃度が小さいほど電離度αは大きくなり、無限に希釈した希薄溶液では、弱酸や弱塩基でもα=1になります。例として、酢酸CH3COOHを無限に希釈した希薄溶液の電離度αを考えてみます。酢酸CH3COOHの酸解離定数をKaとすると、次のように表せます。
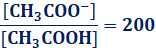
ここで、酸解離定数Kaは2×10−5 mol/L、[H+]は純水に近付くので1×10−7 mol/Lと見なせます。すると、[CH3COO−]/[CH3COOH]=200という値が出てきます。これは、最初に酢酸CH3COOHが201個あったら、200個が電離して酢酸イオンCH3COO− となり、1個が電離せずに酢酸CH3COOHのままで残ったという意味です。つまり、酢酸CH3COOHを無限に希釈した希薄溶液の電離度αは、200/201≒1と計算できるという訳です。
![]()
![]()
![]()
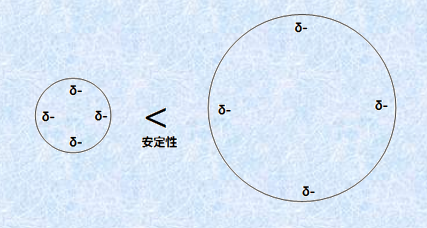
図.6 酢酸CH3COOHの濃度と電離度の関係(25℃)
アレニウスの定義は実に有効であり、日常的には、この定義に対して不満を持つことはまずありません。しかし、アレニウスの定義は、溶媒の関与を考慮していませんでした。20世紀に入る頃から、有機溶媒や液体アンモニアNH3などの水H2O以外の溶液へと、化学の研究対象は広まりました。それに伴い、非水溶媒における酸塩基に拡張し得る定義が必要になりました。そこで1923年、デンマークの化学者であるヨハンス・ブレンステッドは、酸と塩基の定義を次のように提唱しました。なお、イギリスの化学者であるマーチン・ローリーも、たまたま同時期に同じような説を提唱していたため、この定義を「ブレンステッド・ローリーの定義」と呼ぶこともあります。
「酸とは水素イオンH+ を他に与える物質であり、塩基とは水素イオンH+ を他から受け取る物質である」
この定義に当てはまる酸を「ブレンステッド酸」といい、塩基を「ブレンステッド塩基」といいます。ブレンステッドの定義では、酸は水素イオン供与体として、塩基は水素イオン受容体として働きます。水素イオンH+ は陽子(proton)のことなので、酸塩基反応とは、「大きさほぼゼロの正電荷(proton)が物質から物質へと飛び移る現象」に他なりません。この定義は、水溶液中以外でも適用することができるので、水素Hを持つあらゆる物質に適用できるという点で、アレニウスの定義よりもかなり広義な定義になります。ブレンステッド酸をHAとし、ブレンステッド塩基をBとすると、一般的にブレンステッドの酸塩基反応は、次のように表すことができます。
HA(酸) + B(塩基) ⇄ A− (共役塩基) + HB+ (共役酸)
この平衡において、A− を酸HAの「共役塩基(conjugate base)」といい、HB+ を塩基Bの「共役酸(conjugate acid)」といいます。このような名称になる理由は、もし逆反応が進行すれば、共役塩基と共役酸のそれぞれが、塩基や酸として働くからです。
ブレンステッドの定義とアレニウスの定義の大きな違いは、アレニウスの定義は、酸と塩基を別々に分類して扱うのに対し、ブレンステッドの定義は、酸と塩基を反応の中で同時に扱うことです。ブレンステッドの定義では、反応によって同じ物質が酸として働いたり、塩基として働いたりすることがあります。例えば、ブレンステッドの定義では、水H2Oは次のように酸としても塩基としても働きます。
CH3COOH(酸) + H2O(塩基) ⇄ CH3COO− (共役塩基) + H3O+ (共役酸)
H2O(酸) + NH3(塩基) ⇄ OH− (共役塩基) + NH4+ (共役酸)
アレニウスの定義では、水H2Oは酸でも塩基でもない中性物質でした。しかし、ブレンステッドの定義では、水H2Oは酢酸CH3COOHに対しては水素イオン受容体の塩基として、アンモニアNH3に対しては水素イオン供与体の酸として働くのです。つまり、ブレンステッドの定義では、水素イオンH+ を他に与える能力が強い物質をその反応における酸と定義するものであり、どちらが水素イオンH+ を与える力が相対的に強いのかを問題にするだけで、強酸や弱酸というような絶対的な酸の強さを表す用語は、もはや意味をなさなくなるのです。例えば、強酸として知られる硝酸HNO3も、硫酸H2SO4との反応では、次のように塩基として振る舞います。
H2SO4(酸) + HNO3(塩基) ⇄ HSO4− (共役塩基) + H2NO3+ (共役酸)
したがって、ブレンステッドの定義は、水素イオンH+ の関与する反応を正確に理解できるだけでなく、この定義を使うと、酸塩基の強弱表さえあれば、有機反応も含めすべての水素イオンH+ 移動反応が、どちらへ進むかなどの判断がたちどころにできるのです。この点で、この定義は非常に有効であるものの、反応によって物質が酸になったり塩基になったりするので、物質を酸や塩基に分類して、そこから物質の関係を理解していこうとするときにはむしろ不便になり、初学者にとっては混乱を起こしやすいという欠点もあります。したがって、酸と塩基を分類しようというときには、アレニウスの定義なのかブレンステッドの定義なのかを、はっきりさせた上で分類しなければなりません。一般的に反応が進行するかどうかなどの反応論を扱うときには、ブレンステッドの定義を使うと便利です。しかし、明らかに酸と塩基が区別されている中和反応などを扱うときは、アレニウスの定義の方が分かりやすく便利になります。なお、一般的に酸や塩基というときは、水H2Oを中性物質とした、アレニウスの定義における分類を用いることが多いです。
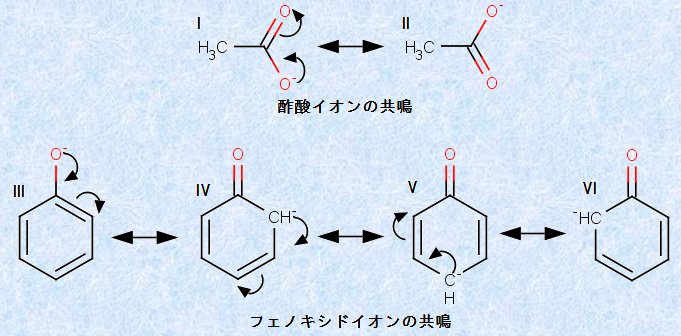
図.7 酸の相対的な強さ
ルイスの定義における酸と塩基は、ブレンステッドの定義をさらに拡張して、電子対の供与と享受で定義しました。ルイスの定義では、およそ酸や塩基とは思えないような物質が酸塩基反応を起こします。
「酸とは電子対を受け取る物質であり、塩基とは電子対を与える物質である」
例えば、アンモニアNH3と三フッ化ホウ素BF3の反応では、電子供与体であるアンモニアNH3がホウ素Bのp軌道に価電子を与えて、窒素Nとホウ素Bの間に共有結合が形成されます。
BF3(酸) + :NH3(塩基) → F3B-NH3
この反応では、三フッ化ホウ素BF3はルイス酸、アンモニアNH3はルイス塩基として働いています。このように電子供与体から与えられた電子対により形成された新たな共有結合は、「配位結合(coordinate bond)」と呼ばれます。そして、この配位結合により生じた新たな分子は「錯体(complex)」と呼ばれ、電子供与体は「配位子(ligand)」と呼ばれます。
また、水分子H2Oにおいて、水素原子Hは酸素原子Oの高い電気陰性度のために、部分正電荷δ+を帯びています。そのため、非共有電子対を持つ窒素Nのような原子と配位結合を形成し、水素原子Hは電子対を受け取るルイス酸として作用します。一方で、水分子中の酸素原子Oは非共有電子対を持ち、水素イオンH+ のような電子欠乏種と配位結合を形成し、電子対を与えるルイス塩基として作用します。
H-OH(酸) + :NH3(塩基) → H-NH3+ + OH−
HCl(酸) + :OH2(塩基) → H-OH2+ + Cl−
つまり、非共有電子対を持つ原子は、すべてルイス塩基として作用する可能性を持ち、原子価軌道が電子で満たされていない原子は、ルイス酸として作用する可能性を持つのです。ルイスの定義はこのように明瞭であり、無機化学だけでなく有機化学の反応など、応用範囲は広いです。ルイスの定義は、アレニウスの定義やブレンステッドの定義の範疇である水素イオンH+ が関与する反応ばかりではなく、水素イオンH+ を生成しないような反応にも適用できます。
強酸として知られる塩酸HClは、水中で以下のように水H2Oと酸塩基反応をします。この反応は平衡反応ですが、その平衡は著しく右に偏っています。つまり、塩化水素HClのほとんどが、水中では塩化物イオンCl− になっているということです。水H2Oと反応するとき、平衡定数が著しく大きくなるような酸を、一般的に強酸といいます。次の反応の平衡定数は、推定で5.0×103以上の値と見積もられています。
HCl(酸) + H2O(塩基) ⇄ Cl− (共役塩基) + H3O+ (共役酸)
この平衡が右に偏っているのは、酸性度がHCl>H3O+ であることが理由です。つまり、この平衡反応で、酸として働く可能性のある物質が、塩化水素HClとオキソニウムイオンH3O+ なのですが、塩化水素HClの方が水素イオンH+ を放出する能力が強いため、この平衡は右に偏っているのです。この判断をするためには、酸塩基の強弱表をすべて暗記していなければならないのでしょうか?しかし、酸として働く物質は無数にあるため、暗記に頼っても限度があります。そこで、酸の強さを調べようとするとき、共役塩基の弱さ、すなわち共役塩基の安定性を考えることにします。
この平衡において、塩化水素HClの共役塩基は、塩化物イオンCl− です。塩化物イオンCl− の安定性については、塩素の電子親和力が大きいことからも分かるように、塩化物イオンCl− は比較的安定な物質です。つまり、塩酸HClが強酸である理由は、共役塩基である塩化物イオンCl− が安定だからです。すなわち、酸HAの強さは共役塩基A− の安定性に左右され、共役塩基A− が安定なほど、酸HAの酸性度は強くなるということができます。酸HAの共役塩基A− の安定性を判断する要因として、一般的に次のようなことがあります。
(i-1) A原子の電気陰性度が大きい
例えば、メタンCH4とアンモニアNH3、水H2O、フッ化水素HFの酸の強さの関係は、HF>H2O>NH3>CH4 のようになります。このような順になる理由は、原子の電気陰性度がF>O>N>Cの関係になるからです。一般的に原子Aの電気陰性度が大きいほど、共有電子対を自身に引き付ける強さが大きいということになるので、結果として、水素イオンH+ を放出しやすいということになります。また、電気陰性度が大きいほど、一般的に電子親和力も大きくなる傾向があるので、酸HAの共役塩基A− が安定化します。つまり、原子Aの電気陰性度が大きいほど、酸HAの酸性度は強くなります。
(i-2) A原子が大きい
例えば、フッ化水素HFと塩化水素HCl、臭化水素HBr、ヨウ化水素HIの酸の強さの関係は、HI>HBr>HCl>HFのようになります。これは、電気陰性度がF>Cl>Br>Iの関係になるので、一見すると先の考察と矛盾しているようにも思えます。しかし、原子Aの大きさは、I>Br>Cl>Fの関係になっているので、この影響が電気陰性度の寄与を上回ります。酸HAが水素イオンH+ を電離して共役塩基A− になると、その負電荷は原子全体に分散されます。このときに原子Aの大きさが大きいほど、負電荷が共役塩基中で広く分散されることになるので、より陰イオンA− が安定化するのです。つまり、原子Aの大きさが大きいほど、共役塩基A− が安定化して、酸HAの酸性度は強くなります。
図.8 共役塩基A− が大きいほど負電荷が分散して安定になる
(i-3) A−の共鳴安定化
例えば、酢酸CH3COOHとフェノールC6H5OH、エタノールC2H5OHの酸の強さの関係は、CH3COOH>C6H5OH>C2H5OHのようになります。このようになる理由は、酸HAが共役塩基A− になったとき、共役塩基A− が「共鳴(resonance)」して負電荷が分散されることによって、共役塩基A− が安定化するからです。酢酸CH3COOHとフェノールC6H5OHの共役塩基である酢酸イオンCH3COO− やフェノキシドイオンC6H5O− は、実際には次のような構造になっています。
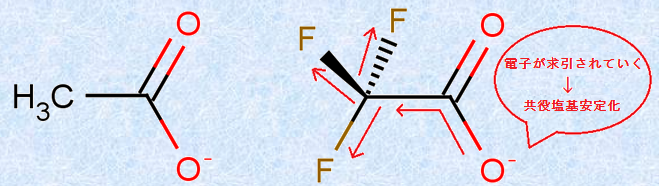
図.9 酢酸イオンCH3COO− とフェノキシドイオンC6H5O− の共鳴構造式
上の図.9において、p軌道の価電子対が、別の原子のp軌道に移動することによってできる1つ1つの構造式を、「共鳴構造式(resonance structure)」といいます。これらの共鳴構造式は、共役塩基A− の化学変化によって生じるものではありません。共役塩基A− の真の構造は、これらすべてを掛け合わせた「共鳴混成体(resonance hybrid)」なのです。つまり、共鳴においては、負電荷は1つの原子に局在化してはおらず、すべての共鳴構造式の間に分散して存在しているのです。よって、共鳴構造式が多く書ければ書けるほど、負電荷がより分散されるということになるので、共役塩基A− はより安定化します。しかしながら、ただ共鳴構造式が多く書ければ良いという訳でもありません。共鳴混成体におけるそれぞれの共鳴構造式の寄与は、その構造よって異なるので注意が必要です。
例えば、酢酸イオンCH3COO− の共鳴構造式は、図.9のIとIIの2つで考えることができます。それぞれの共鳴構造式は等価なので、酢酸イオンCH3COO− の負電荷は、2個の酸素原子Oに均等に分散されることになります。しかし、フェノキシドイオンC6H5O− においては、共鳴構造式のすべてが等価ではないので、共鳴混成体における寄与が異なってくるのです。フェノキシドイオンC6H5O− の共鳴では、酸素原子Oのp軌道の非共有電子対が、ベンゼン環に移動することによって、炭素原子Cが負電荷を帯びる構造をいくつか考えることができます。しかし、炭素原子Cは電気陰性度があまり大きくはないので、負電荷を帯びることはあまり有利に働かないのです。また、酸素原子Oの電子対がベンゼン環に移動してしまうと、ベンゼン環の芳香族性は破壊されてしまいます。したがって、フェノキシドイオンC6H5O− の真の構造は、現実ではIIIの構造に偏ることになります。つまり、酢酸イオンCH3COO− とフェノキシドイオンC6H5O− の共鳴構造式を考えたとき、共役塩基の安定性は、総合的に見てCH3COO−>C6H5O− なのです。よって、酸性度もCH3COOH>C6H5OHになります。エタノールC2H5OHについては、共役塩基であるエトキシドイオンC2H5O− の構造を取ったとき、安定な共鳴構造式を全く書くことができないので、酸性度はこの中では最小となります。
ブレンステッドの定義における塩基とは、水素イオンH+ を他から受け取る物質でした。次の化学反応で、アンモニアNH3は塩基として働きます。
H2O(酸) + NH3(塩基) ⇄ OH− (共役塩基) + NH4+ (共役酸)
この反応で、アンモニアNH3は水素イオンH+ に非共有電子対を提供することにより、配位結合を形成しています。つまり、塩基の強さとは、水素イオンH+ に非共有電子対を与える強さともいうことができます。すなわち、塩基の強さは非共有電子対の電子密度に左右され、電子密度が大きく非共有電子対が不安定なほど、塩基の反応性は高くなって、塩基性度は強くなるということができます。
強塩基としては、一般的にアルカリ金属やアルカリ土類金属の水酸化物が知られています。水酸化リチウムLiOHと水酸化ナトリウムNaOH、水酸化カリウムKOHの塩基性の強さの関係は、KOH>NaOH>LiOHのようになります。この理由は、イオン半径の大きさの関係がK>Na>Liだからです。一般的にイオン半径が大きければ大きいほど、陽電荷は分散されて、単位面積あたりの陽電荷は小さくなります。したがって、イオン半径の大きさが大きいほど、水酸化物イオンOH− とのクーロン力が弱くなり、水酸化物イオンOH− に負電荷が局在化することになるのです。つまり、イオン半径の大きさが大きいほど、水酸化物イオンOH− の電子密度は大きくなって、非共有電子対は不安定になるので、塩基の塩基性度は強くなります。
また、同周期の塩基において、水酸化カリウムKOHと水酸化カルシウムCa(OH)2の塩基性の強さの関係は、KOH>Ca(OH)2のようになります。この理由は、金属イオンの電荷が、カリウムKでは1価なのに対して、カルシウムCaでは2価だからです。2価のイオンであるカルシウムイオンCa2+ の場合、水酸化物イオンOH− との間により強いクーロン力が働くため、水酸化物イオンOH− の電子密度が小さくなって、水酸化物イオンOH− が安定化します。つまり、金属イオンの価数が小さいほど、クーロン力が弱くなり、水酸化物イオンOH− の電子密度が大きくなって、非共有電子対が不安定になるので、塩基の塩基性度は強くなります。
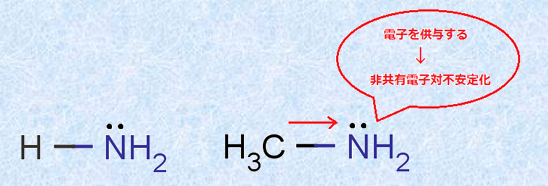
図.10 周期表の左下の金属水酸化物ほど塩基性が強い
酸や塩基の強さは、隣接する置換基の効果も受けて、もとの酸や塩基の強さが変化します。例えば、酢酸CH3COOHとフルオロ酢酸FCH2COOH、ジフルオロ酢酸F2CHCOOH、トリフルオロ酢酸F3CCOOHの酸の強さの関係は、F3CCOOH>F2CHCOOH>FCH2COOH>CH3COOHのようになります。これは言い換えれば、共役塩基の安定性がF3CCOO− >F2CHCOO− >FCH2COO− >CH3COO− であるということにもなります。このように、炭素原子Cに結合するフッ素原子Fの数が多くなるほど共役塩基A− が安定化する理由は、電気陰性度の大きいフッ素Fが、共役塩基A− の負電荷を求引して、負電荷を広く分散させ、電荷を非局在化させるからです。
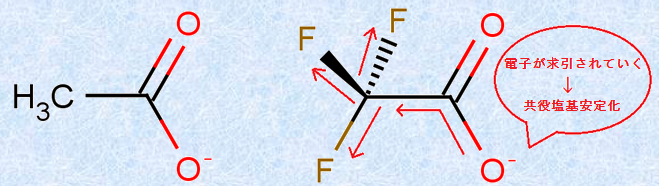
図.11 誘起効果(-I効果)により共役塩基A− が安定化する
フッ素Fのような「電子求引性(electron-withdrawing)」の置換基が隣接すると、共役塩基A− は大きく安定化します。この現象を「誘起効果(Inductive effect)」といいます。また、誘起効果は、フッ素Fのような電子求引性の置換基だけではなく、「電子供与性(electron-releasing)」の置換基でも起こる現象です。例えば、メチル基(-CH3)は電子供与性の置換基であり、アンモニアNH3とメチルアミンCH3NH2の塩基性の強さの関係は、CH3NH2>NH3のようになります。電子供与性の置換基は、非共有電子対の電子密度を増大させるので、塩基性を強くする効果があるのです。
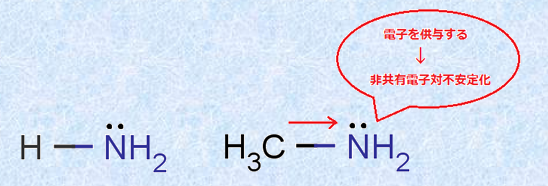
図.12 誘起効果(+I効果)により非共有電子対が不安定化する
このように誘起効果には、電子求引性の置換基と電子供与性の置換基の2種類があり、前者の誘起効果を特に-I効果、後者の誘起効果を+I効果といいます。誘起効果を現す置換基は、原子の電子密度を変えるので、酸や塩基の強さを判断する手段になるだけではなく、有機化学の反応機構にも大きく関与してくることになります。次の表.2に主な誘起効果を現す置換基を示します。ただし、ヒドロキシキ基(-OH)やアルコキシキ基(-OR)などのように、非共有電子対が基質に隣接する位置に存在する電子求引基が、カルボニル基(-CO-)やフェニル基(-C6H5)などの電子求引性の置換基に隣接した際には、共鳴によって非共有電子対が移動して、電子供与的に働く場合があるので注意が必要です。
表.2 主な誘起効果を現す置換基
|
−I効果(電子を求引する) |
+I効果(電子を供与する) |
|
-F、-Cl、-Br、-I、-OH、-OCH3、-NO2、 -CN、-CHO、-CO-、-COOH、-C≡CH、-C6H5 |
-O−、-COO−、-Li、-MgX、-C(CH3)3、 -CH(CH3)2、-CH2CH3、-CH3 |
・参考文献
1) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
2) 内田正夫「酸・塩基・塩の歴史」化学と教育55巻6号(2007年)
3) 遠藤瑞己「化学と歴史のネタ帳 I. 酸とアルカリ」文彩堂出版(2024年発行)
4) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
5) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)