・化学結合
【目次】
(i-2) 枝分かれの少ない直線分子はファンデルワールス力が大きい
(i-3) 極性分子は無極性分子よりもファンデルワールス力が大きい
(1) 化学結合とは何か?
原子と原子がどのように結びついているのかは、様々に議論がされてきましたが、19世紀末まで全く分かっていませんでした。こうした中、1897年にイギリスの物理学者であるジョゼフ・ジョン・トムソンによって、電子が初めて発見されます。トムソンは、陰極線に電圧を加えると、陰極線が+極の方向に曲げられること、また陰極の金属の種類を変えても曲げられる度合いが一定であることなどから、陰極線は「負の電荷を持つ粒子(電子)の流れ」で、電子はすべての原子に含まれる基本的な粒子であることを明らかにしました。やがて、原子と原子を結び付けているのは電子であることが分かり、電子の振る舞いを解き明かすことの重要性が判明してきました。

図.1 陰極線の実験
そして、1916年にアメリカの物理化学者であるギルバート・ルイスは、現在でも使われている「化学結合(chemical bond)」の理論を提案しました。ルイスは、貴ガスであるヘリウムHeが原子核の周囲に2個の電子だけを持ち、それに次ぐ貴ガスのネオンNeが10個の電子を持つことに、何か特別な意味があるのではないかと推測しました。そして、これらの貴ガスの原子は、他の原子と結合しないので、非常に安定な電子構造を持つに違いないと考えました。さらに、ルイスは「貴ガス以外の原子はこのような安定な電子配置を獲得するように反応する」ということを示唆しました。この理論は、後の化学結合の研究の基礎となり、また着想を与えることになったのです。

図.2 ルイスは、共有結合の発見・酸塩基の定義・光化学実験などの業績で知られている
貴ガスの電子配置は「閉殻構造(closed shell structure)」と呼ばれ、ヘリウムHeの場合は最外殻に電子が2個、その他の貴ガスは最外殻に電子が8個収容された電子配置になっています。次の表.1で示すように、貴ガスの原子は、最外殻のs軌道とp軌道が完全に電子で満たされているので、エネルギー的に安定になっています。なぜ閉殻構造が安定なのかというと、閉殻構造は電子間の反発が最も上手く避けられた、バランスのいい電子配置だからです。
表.1 貴ガス元素の電子配置
|
原子 番号 |
元素 記号 |
K殻 |
L殻 |
M殻 |
N殻 |
O殻 |
P殻 |
|||||||||
|
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
5s |
5p |
5d |
6s |
6p |
||
|
2 |
He |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
Ne |
2 |
2 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
18 |
Ar |
2 |
2 |
6 |
2 |
6 |
|
|
|
|
|
|
|
|
|
|
|
36 |
Kr |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
|
|
|
|
|
|
|
|
54 |
Xe |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
|
2 |
6 |
|
|
|
|
86 |
Rn |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
10 |
2 |
6 |
17族元素の電子親和力が大きいのは、電子を受け取ることで閉殻構造を獲得できるからであり、また1族元素のイオン化エネルギーが小さいのも、電子を放出することで閉殻構造を獲得できるからです。つまり、化学結合とは、原子が安定性を求めて閉殻構造を獲得するような反応であり、このような理由から、原子は分子や結晶などを作って存在しているのです。
(i) 化学結合の力
しかしながら、化学結合とは「どのような力」で形成されているのでしょうか?原子は温度に比例する運動エネルギーを持っているので、絶対零度でない限り、原子は無差別に拡散していきます。原子と原子が化学結合をするためには、何らかの引力が作用していなければなりません。現在、自然界で存在している力は4種類あって、それは「万有引力(universal gravitation)」・「クーロン力(coulomb force)」・「強い核力(strong interaction)」・「弱い核力(weak interaction)」です。この中で、強い核力と弱い核力は、極めて距離が近い物体同士に作用する力で、原子核内部で素粒子が相互作用するときなどに働く力です。したがって、原子と原子の間のように比較的遠い距離で働く力としては、万有引力かクーロン力のどちらかが考えられます。どちらの寄与が化学結合に効いているのか、次の図.3の簡単な水素分子モデルを使って計算してみましょう。
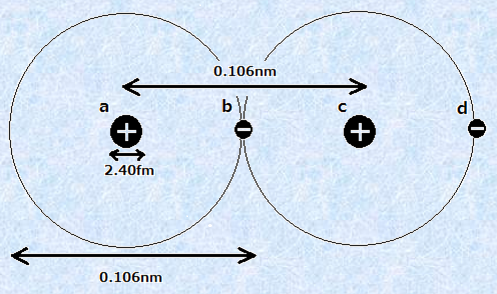
図.3 水素分子モデル
※ 水素原子の直径は0.106 nm(1.06×10−10 m)、水素原子核の直径は2.40 fm(2.4×10−15 m)とする
(i-1) 化学結合における万有引力の寄与
万有引力は、質量のある物体に働く普遍的な力なので、水素分子を作るときに働く力として、「原子核と原子核に働く力」・「原子核と電子に働く力」・「電子と電子に働く力」の3種類が考えられます。しかし、電子の質量は陽子や中性子の質量の約1/1840であり、原子核の質量に比べて極めて小さいので、電子に関わる万有引力はほとんど無視することができます。つまり、化学結合を作る万有引力は、実質「原子核と原子核に働く力」でほとんど決まってしまいます。万有引力定数をG=6.67×10−11 N・m2/kg2、原子核の質量をMa=mc=1.67×10−24 kg、原子核間の距離をr=1.06×10−10 mとすると、万有引力は次のようになります。
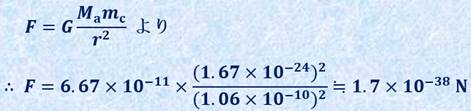
(i-2) 化学結合におけるクーロン力の寄与
クーロン力は、荷電粒子間に働く力のことで、粒子の電荷が同符号なら斥力になり、異符号なら引力になります。つまり、「原子核と原子核に働く力」および「電子と電子に働く力」は斥力で、「原子核と電子に働く力」が引力になります。クーロン定数をk=9.0×109 N・m2/C2、電気量をq=1.6×10−19 C、粒子間の距離をrとすると、クーロン力は次のようになります。
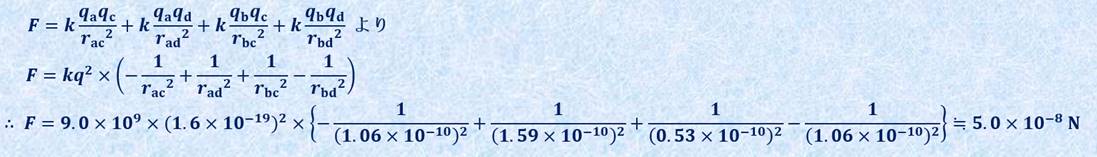
以上の(i-1)および(i-2)の計算から、クーロン力>>万有引力という結果になりました。原子間に働く万有引力は、クーロン力による相互作用に比べて、桁外れに小さいのです。これらの結果から、化学結合における主な寄与は、陽子や電子などの荷電粒子によるクーロン力であるという結論を導き出すことができます。
(2) 共有結合と配位結合
貴ガス以外の原子は、単一の存在では不安定なので、化学結合によって他の原子と相互作用して、エネルギー的に安定化しようとします。「共有結合(covalent bond)」とは、原子同士が1対、またはそれ以上の数の電子対を互いに共有することで形成される化学結合です。原子同士が「不対電子(unpaired electron)」を互いに出し合って、「共有電子対(shared electron pair)」を作るのです。このような化学結合をすることで、原子は貴ガスの電子配置を獲得して、安定した存在になることができます。
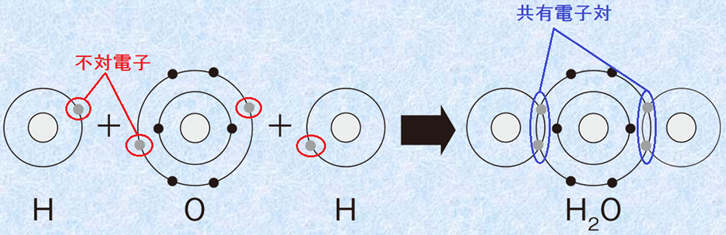
図.4 共有結合の形成
多くの原子は、貴ガスの電子配置を獲得するときに最外殻電子を8個にすることが多いので、これを「オクテット則(octet rule)」と呼ぶことがあります。ただし、このオクテット則は第2周期までの元素にしか適用することができず、第3周期からはリンPや硫黄Sのように最外殻に8個以上の電子を配置する元素もあうので、化学における普遍的な法則であるという訳ではありません。このようなオクテット則を満たさない原子を有する化合物は、「超原子価化合物(hypervalent molecule)」と呼ばれています。しかしながら、オクテット則は多くの有機化合物に適用できるという点で、便利な法則ではあります。
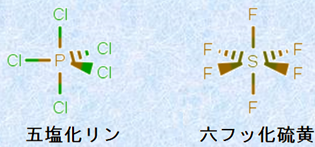
図.5 超原子価化合物の例
共有結合は、化学結合の中で最も強固な結合であり、原子は共有結合を形成して安定化するときに、外部に大きなエネルギーを放出します。しかし、逆に言えば、これは共有結合を開裂するときに、それと同量の大きなエネルギーが必要だということです。例えば、1 molの水素分子H-Hを開裂するためには435 kJのエネルギーが必要であり、これは1 Lの水を0℃から100℃まで上昇させるのに必要なエネルギーとほぼ等しいです。たった2 gの水素分子H-Hを開裂するだけで、これだけのエネルギーが必要になるのです。特に気体状分子内の二原子間の共有結合1 mol分を開裂して、バラバラの原子にするのに必要なエネルギーを「結合エネルギー(bond energy)」といい、共有結合ごとに異なる値があります。
表.2 主な共有結合の結合エネルギー(データは-273.15℃のときの値)
|
共有結合 |
分子 |
結合エネルギー |
|
C-C |
ダイヤモンド |
354 kJ/mol |
|
C-C |
C2H6 |
366 kJ/mol |
|
C=C |
C2H4 |
719 kJ/mol |
|
C≡C |
C2H2 |
957 kJ/mol |
|
H-H |
H2 |
432 kJ/mol |
|
H-Cl |
HCl |
428 kJ/mol |
|
H-O |
H2O |
459 kJ/mol |
|
H-N |
NH3 |
386 kJ/mol |
|
H-C |
CH4 |
411 kJ/mol |
|
O=O |
O2 |
494 kJ/mol |
|
O=C |
CO2 |
799 kJ/mol |
|
Cl-Cl |
Cl2 |
239 kJ/mol |
|
N≡N |
N2 |
942 kJ/mol |
なぜ共有結合は、このように極めて大きい結合エネルギーを持つのでしょうか?単一原子では、価電子が1個の原子核だけに引き付けられているのに対し、共有結合を形成している場合では、共有電子対が両方の原子核によって引き付けられています。共有電子対は両方の原子核の間に入って、原子核を自分の方へ引き付けようとするから、あるいは、この共有電子対を両方の原子核が引き付けようとするから、原子間に全体として引力が生じるのです。
しかし、分子内には、他にこの共有電子対と原子核間に働く引力を相殺する力も働いています。そのような力には、同種の電荷を持った原子核間の斥力があり、また同種の電荷を持った電子間の斥力もあります。これらの引力と斥力との間には、平衡が保たれているので、原子は互いに離れ去ることも、融合してしまうこともないのです。したがって、共有結合をする二原子は、結合したまま「結合距離(bond distance)」と呼ばれる一定範囲の平衡距離の中で振動しています。結合距離は共有結合ごとに異なる値をとり、結合エネルギーと逆相関の関係があります。つまり、一般的に結合が強くなるほど、結合距離は小さくなります。
表.3 有機化合物の結合距離
|
共有結合 |
分子 |
結合距離 |
|
C-H |
CH4 |
1.10×10−10 m |
|
C-C |
C2H6 |
1.54×10−10 m |
|
C=C |
C2H4 |
1.47×10−10 m |
|
C≡C |
C2H2 |
1.37×10−10 m |
共有結合は、価電子が両方の原子核に均等に相互作用することで引力を働かせるので、電気陰性度の差が小さい原子間でしか形成されません。具体的には、電気陰性度の差が1.7より小さい原子間の結合では、共有結合性が高くなります。また、共有結合と同類の結合として、「配位結合(coordinate bond)」があります。これは、一方の原子が非共有電子対を他方の空軌道に提供して、それを互いに共有することで生じる結合のことです。配位結合は、結合の形成方法が違うだけで、結合の性質としては、共有結合と全く同じ化学結合です。
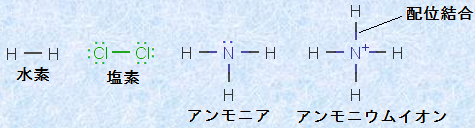
図.6 共有結合と配位結合は同種の結合である
(3) イオン結合
共有結合は、電気陰性度の差が小さい原子間で形成される化学結合です。しかし、塩化ナトリウムNaClのように電気陰性度の差が大きい原子間の化学結合は、原子によって共有電子対を引き付ける強さが違うことから、共有結合とは性質の異なる化学結合になることが予想されます。電気陰性度の差が大きい原子間で化学結合を形成する場合、その共有電子対は電気陰性度の大きい原子に強く引き付けられることになり、極端な場合では、原子がイオン化した状態で化学結合を作ることになります。このように、電気陰性度の差が大きい原子間の結合を「イオン結合(ionic bond)」といいます。
化学結合には、共有結合とイオン結合の中間的な性質を持つ結合も存在するといったのは、アメリカの化学者であるライナス・ポーリングです。ポーリングは、量子力学を化学に応用した先駆者であり、「原子と原子はなぜ結合するのか」という化学結合の本性を記述した功績により、1954年に「ノーベル化学賞」を受賞しています。イオン結合と共有結合の違いは、原子間の電気陰性度の差であり、具体的には、電気陰性度の差が1.7より大きくなると、イオン結合性が強くなります。
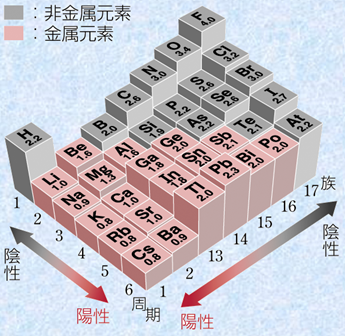
図.7 ポーリングの電気陰性度
イオン結合の経験則として、金属元素は電気陰性度が小さく陽性で、非金属元素は電気陰性度が大きく陰性なので、「イオン結合は金属元素と非金属元素間の結合である」と言われることがあります。ただし、これには例外も多くあり、塩化アンモニウムNH4Clは非金属元素だけからできていますが、アンモニウムイオンNH4+と塩化物イオンCl− がイオン結合した物質です。また、ヨウ化銀AgIは金属元素と非金属元素の組み合わせですが、その結合は共有結合性がかなり強いイオン結合になります。イオン結合性の物質は、水に溶解させると陽イオンと陰イオンに電離しますが、ヨウ化銀AgIのように共有結合性が強い物質の場合では、電離に必要なエネルギーが大きくなるので、水に溶けずに沈殿となることがあります(無機化学(錯イオン生成反応)を参照)。
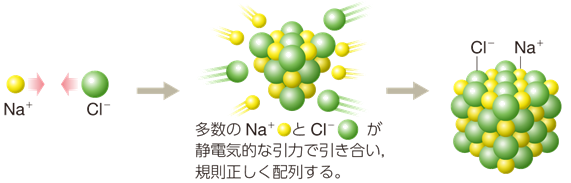
図.8 塩化ナトリウムNaClはナトリウムイオンNa+と塩化物イオンCl− がイオン結合した物質である
イオン結合においては、原子間の共有電子対は電気陰性度の大きい原子にほぼ完全に奪われ、その結合は陽イオンと陰イオンのクーロン力により形成されることになります。このため、イオン結合は陽イオンと陰イオンが交互に並んだ結晶を作ることになり、共有結合のように分子を作ることはありません(結晶化学を参照)。
(4) 金属結合
化学結合の中でも、空軌道を多く持ち、イオン化エネルギーの小さい原子同士が共有結合すると、若干特殊な結合になります。イオン化エネルギーとは、電子を1個取り去って、1価の陽イオンにするのに必要な最小のエネルギーのことです(イオン化エネルギーと電子親和力を参照)。つまり、イオン化エネルギーが小さいということは、容易に電子を放出できるということなので、共有電子対は容易に放出され、共有電子対が隣接する原子の空軌道を使って、自由に多原子間を動き回るようになります。

図.9 ナトリウムNaの金属結合
例えば、ナトリウムNaはイオン化エネルギーが小さいので、二原子間で共有結合を形成すると、その共有電子対は容易に放出されます。さらに、ナトリウムNaの価電子は1個なので、結合に利用できる空軌道が多く存在しています。したがって、ナトリウムNa同士が共有結合すると、原子間の共有電子対は原子間に束縛されることはなく、共有電子対は多原子間を自由に動き回るようになります。このような結合を「金属結合(metallic bond)」といい、金属結合に見られるような多原子間を自由に動き回る電子を「自由電子(free electron)」といいます。

図.10 自由電子の存在により、金属結合を形成する物質は電気伝導性を示す
ところで、空軌道を多く持ち、イオン化エネルギーの小さい原子は、そのほとんどが金属元素です。したがって、金属結合は主に金属元素間で見られる化学結合ということができます。一方で、逆に空軌道を持たず、イオン化エネルギーの大きい原子同士が共有結合した場合では、このような自由電子は現れません。例えば、塩素Clのように空軌道を持たず、イオン化エネルギーの大きい原子同士が共有結合した場合、共有電子対は自由電子のように振る舞うことはできず、その共有電子対は二原子間に固定されます。このように二原子間に共有電子対が固定される結合を共有結合と呼ぶのであって、誤解を恐れずに言うなら、金属結合は共有結合における特殊な場合の化学結合と考えられます。
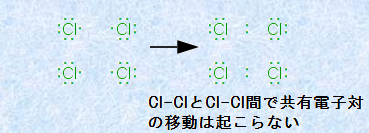
図.11 塩素Cl2の共有結合
(5) 化学結合のまとめ
化学結合には、共有結合・イオン結合・金属結合があり、その本質は、化学結合をすることによって貴ガスの電子配置を獲得し、エネルギー的に安定化することです。また、化学結合の分類は、電気陰性度の値やその差によって大まかに分類することができ、これらをまとめると、次の表.4のようになります。
表.4 化学結合のまとめ
|
|
共有結合 |
イオン結合 |
金属結合 |
|
構成粒子 |
原子 |
陽イオンと陰イオン |
陽イオンと自由電子 |
|
主な元素 |
非金属元素 |
金属元素と非金属元素 |
金属元素 |
|
共有電子対の存在様式 |
二原子間に局在 |
陰イオンに局在 |
多原子間を自由に運動 |
|
電気陰性度の平均値 |
大きい |
中程度 |
小さい |
|
電気陰性度の差 |
小さい(1.7未満) |
大きい(1.7以上) |
小さい |
|
物質例 |
H2、H2O、CH4、CO2 |
NaCl、KOH、CuSO4、NH4Cl |
Na、Fe、Cu、Ag |
非金属原子間の結合は共有結合、金属原子と非金属原子間の結合はイオン結合、金属原子間の結合は金属結合と呼ばれますが、これは一般論であり、例外もあります。この3種類の結合様式には、明確な境界がある訳ではありません。ほぼ純粋な結合様式と見なせる場合もありますが、多くの場合は、この3種類の結合様式が混ざったものになります。したがって、物質の化学結合を論ずる場合は、「共有結合性70%、イオン結合性20%、金属結合性10%」などのように表記した方がより正確になります。また、これらの化学結合は、すべてクーロン力に依存したものです。一般的にその粒子間の結合の強度は、次のようになります。
共有結合 > イオン結合・金属結合 >> 水素結合 > ファンデルワールス力 >> 万有引力
天体などの極めて質量の大きい物体を扱う物理学では、万有引力が重要になってきます。しかし、化学の世界で、万有引力が粒子間の結合に大きな影響を持つことはありません。化学の対象となる「粒子」は、それだけ質量が小さいのです。また、粒子間の結合では、共有結合が最も強固な結合で、融点も共有結合結晶であるダイヤモンドが、3,550℃と全元素の中で最も高い融点になります。ただし、イオン結合と金属結合も強固な結合なので、その結晶の融点は、一般的に高い値になります。金属元素の中で最も融点が高いタングステンWは、3,410℃とダイヤモンドに匹敵する融点です。また、共有結合をしていても、ファンデルワールス力により結晶を作る物質や、分子となって結晶を作らない物質は、一般的に融点が小さくなる傾向にあります。

図.12 様々な結晶の融点の比較
(i) ケテラーの三角形
次の図.13は、第2周期元素の単体および2種類の元素が作る化合物についての化学結合性を整理したものです。この図を「ケテラーの三角形(triangle of Ketelaar)」といいます。横軸方向に二原子間の電気陰性度の平均値を、縦軸方向に二原子間の電気陰性度の差を取って、各物質をプロットします。すると、リチウムLi、フッ素F、フッ化リチウムLiFを頂点とする三角形を描くことができます。フッ化リチウムLiFのように二原子間の電気陰性度の差が大きい場合では、イオン結合性が高くなります。その一方で、単体では電気陰性度の差がゼロとなるため、イオン結合性は低くなり、三角形の底辺に当たる部分に並ぶことになります。また、リチウムLiのように電気陰性度が低い元素は、一般的にイオン化エネルギーも小さくて電子を放出しやすいため、その単体は金属結合性が高くなります。
リチウムLi、フッ素F、フッ化リチウムLiFで作られる三角形の頂点は、それぞれ金属結合性、共有結合性、イオン結合性の極めて高い物質が位置することになり、その間では、それらの性質が混ざった状態と考えることができます。そして、底辺に位置する各元素の単体から両辺に平行な線を引いたとき、各線の交点には、それぞれの線の元にある2種類の元素からなる化合物がほぼ位置します。この三角形を用いることで、その物質を形成する化学結合に3種類の結合様式が、どの程度寄与しているかを考えることができるのです。
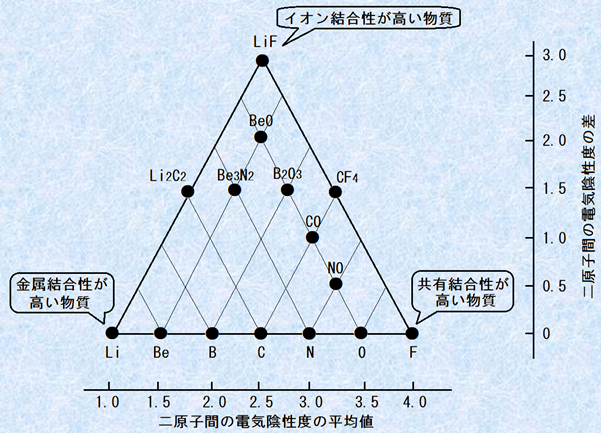
図.13 第2周期元素の単体および2種類の原子からなる化合物の化学結合性
(6) 分極した共有結合
共有結合は、電気陰性度の差が小さい原子間に形成される化学結合です。しかし、原子間の電気陰性度の差がある程度大きい共有結合は、その結合にいくらかのイオン結合性を持つことになります。このような共有結合の場合には、共有電子対は二原子間に均等に共有されることはありません。このような共有結合は、「分極(polarization)した共有結合」または「極性(polarity)がある共有結合」などと呼ばれ、結合している原子は、部分的に正または負の電荷を帯びることになります。
次の図.14で示す塩化水素HClは、分極した共有結合を持つ分子の一例です。塩素原子Clは、水素原子Hよりも電気陰性度が大きく、その差は1.0あります。つまり、水素原子Hと塩素原子Clの結合は、イオン結合性を持った共有結合ということができます。塩化水素HClの持つイオン結合性とは、共有電子対が塩素原子Clの方へ引き付けられ、塩素原子Clが水素原子Hに比べて多少の負電荷を帯びることによります。このような部分電荷は、一般的に「δ (delta)」というギリシア文字を用いて、「δ+」あるいは「δ-」などと表現します(δは英語differenceのdに対応)。

図.14 塩化水素HClの分極
原子間の電気陰性度の差が大きいほど、共有電子対が一方の原子に偏ることになるので、その部分電荷は大きくなります。すなわち、電気陰性度の差が大きいほど、共有結合性が小さく、イオン結合性が大きくなるのです。このような分子の極性を考えると、溶媒との親和性を予測することができるようになります。溶媒には、水H2Oのような「極性溶媒(polar solvent)」とベンゼンC6H6のような「無極性溶媒(nonpolar solvent)」があります。極性溶媒には極性の大きい溶質が、無極性溶媒には極性の小さい溶質がよく親和します。つまり、分子内の共有結合の極性が大きい物質は、水H2Oなどの極性溶媒に溶解しやすくなるのです。これは、水H2O自身が分子内の共有結合に極性を持ち、極性のある物質同士で相互作用して、エネルギー的に安定化するからです。例えば、塩化水素HClは、水中では次の図.15のように水H2Oと相互作用して、部分電荷を互いに中和することで安定化します。
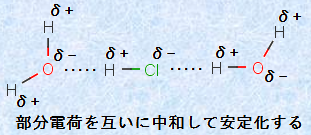
図.15 塩化水素HClと水H2O分子の相互作用
(i) 双極子モーメント
分子や原子間の結合の極性の大きさを示す尺度として、「双極子モーメント(dipole moment)」というものがあります。双極子モーメントを用いると、分子構造や結合のイオン結合性を調べるのに役立ちます。正電荷+q〔C〕と負電荷−q〔C〕が距離r〔m〕だけ離れているときに、双極子モーメントμは、μ=qr(単位はC・m)で表されます。双極子モーメントが大きいものほど、極性が大きいことになります。
表.5 双極子モーメントの例
|
物質 |
双極子モーメントμ |
|
フッ化水素HF |
6.09×10−30 C・m |
|
塩化水素HCl |
3.70×10−30 C・m |
|
臭化水素HBr |
2.8×10−30 C・m |
|
ヨウ化水素HI |
1.5×10−30 C・m |
双極子モーメントを測定することにより、「共有結合にイオン結合性がどの程度混ざっているか」を調べることができます。例えば、塩化水素HCl分子の双極子モーメントμは3.70×10−30 C・mで、結合距離は1.27×10−10 mです。仮に塩化水素HClが「純粋なイオン結合」で結び付いているとすると、H+とCl−(電子の電荷の大きさは1.60×10−19 C)が1.27×10−10 mの距離にあることになり、双極子モーメントμ0は次のように求められます。
![]()
塩化水素HClの双極子モーメントの測定値μと、「塩化水素HClがイオン結合で結び付いている」と仮定して求めた双極子モーメントμ0の比から、結合にどの程度イオン結合性があるかが分かります。塩化水素HClの結合の場合では、次のように18%程度のイオン結合性があると考えられます。
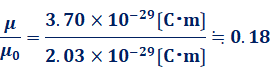
(7) 分子とは何か?
いくつかの原子が、共有結合によって結合した粒子のことを「分子(molecule)」といいます。ほとんどの原子は、現実には原子単体で存在していることはなく、同種あるいは異なる原子と共有結合を形成して、分子として存在しています。このように原子が集まって分子を形成する理由は、共有結合をすることによって、エネルギー的に安定な閉殻構造を獲得できるからです。
分子は構成原子の数によって、「単原子分子(monoatomic molecule)」・「二原子分子(diatomic molecule)」・「三原子分子(triatomic molecule)」などと呼ばれます。貴ガスは、化学結合をしなくても閉殻構造をすでに持っているため、全元素中で唯一単原子分子として存在しています。水素H2は二原子分子であり、二酸化炭素CO2は三原子分子です。水素分子H-Hは、原子間が1組の共有電子対で結ばれており、このような結合を「単結合(single bond)」といいます。これに対して、酸素分子O=Oのように、原子間が2組の共有電子対で結ばれている結合は、「二重結合(double bond)」と呼ばれます。窒素分子N≡Nでは、原子間が3組の共有電子対で結ばれているので、このような結合は「三重結合(triple bond)」と呼ばれます。
表.6 代表的な分子の電子式と構造式
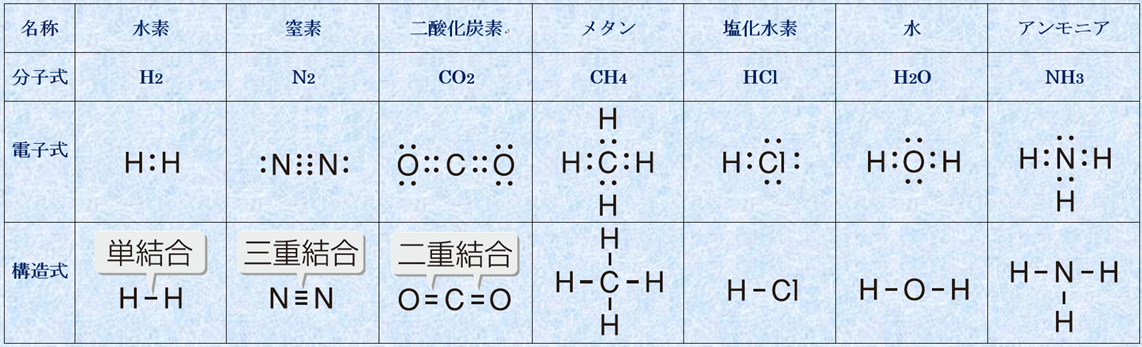
表.6に、代表的な分子の電子式と構造式を示しました。酸素O2や窒素N2、二酸化炭素CO2は、その分子内に多重結合を含みます。なぜこれらの分子は、多重結合を形成するのでしょうか?この理由は、それらの分子の電子式を見れば理解できます。どの電子式を見ても、1つの原子の周りには電子が8個存在していることが分かります。これは、偶然電子が8個になったのではなく、原子が自身の周囲の電子を8個にするように化学結合した結果なのです。これは、原子が最外殻電子を8個にすると、貴ガスの閉殻構造を獲得して安定化するためです。
また、分子の形は、中心原子の周りの共有電子対、あるいは非共有電子対の反発をもとにして推測することができます。電子対同士は、互いにクーロン力により反発するため、分子は各電子対が最も離れた立体構造を取るようになります。電子対は、その種類によって反発力が異なり、その関係は次のようになります。
非共有電子対間の反発 > 非共有電子対と共有電子対間の反発 > 共有電子対間の反発
このような関係になるのは、非共有電子対間には、クーロン力による強い反発力が働くからです。共有結合を作る結合電子対は、結合原子間に束縛されるため、共有電子対は原子核から離れた位置に存在することになります。しかし、非共有電子対の場合、その電子対は強く原子核に束縛されることになり、距離の2乗に反比例するクーロン力により、強い反発力が働くことになるのです。よって、結合間の角度も次のようになります。
非共有電子対間の角度 > 非共有電子対と共有電子対間の角度 > 共有電子対間の角度
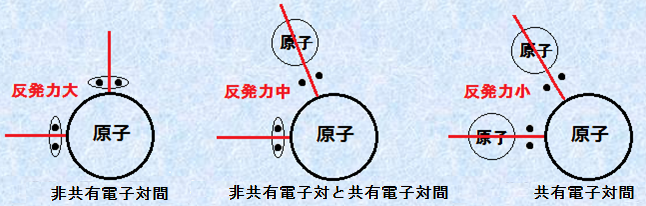
図.16 電子対の反発力の違い
これにより、メタンCH4とアンモニアNH3、水H2O分子の形は、次の図.17のように説明することができます。アンモニアNH3と水H2Oは、それぞれ窒素原子Nと酸素原子Oに非共有電子対を持っており、非共有電子対のクーロン力による強い反発の結果、共有電子対の作る共有結合の結合角が小さくなるのです。
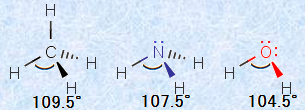
図.17 左からメタンCH4、アンモニアNH3、水H2O分子の形
また、分子全体としての電荷のかたよりを「分子の極性(the polarity of the molecule)」といい、極性のある分子を「極性分子(polar molecule)」、極性のない分子を「無極性分子(nonpolar molecule)」といいます。分子の極性は、結合の「分極(polarization)」によって生じますが、分子の形によっては、結合の極性が打ち消し合うことで正電荷と負電荷の重心が一致し、分子全体としては極性を持たない場合もあります。次の図.18に、主な分子の形と極性を示します。
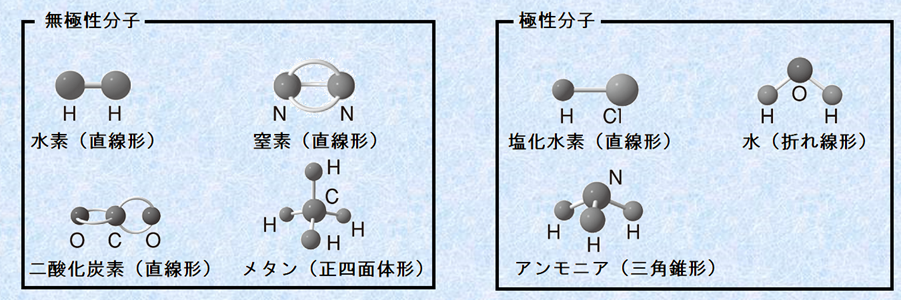
図.18 主な分子の形と極性
(8) 分子間力
電気的には中性な分子でも、分子間にはクーロン力に起因する引力が作用しており、互いに引き合っています。このような力を「分子間力(intermolecular force)」といいます。分子間力が強く働く分子は、分子間を引き離すのに大きなエネルギーが必要となるため、一般的に蒸発しにくく、沸点が高くなります。このような分子間力にはいくらか種類があり、代表的なものが「ファンデルワールス力(van der Waals force)」と「水素結合(hydrogen bond)」です。
(i) ファンデルワールス力
分子は電気的には中性なので、全体としては電荷を持っていません。そのため、陽イオンと陰イオン間で働くような、強いクーロン力が分子間に働くことはありません。しかし、分子は原子核とその周囲を動き回る電子の集合体であるから、ミクロに見れば、分子内で瞬間的に電子が不均等に分布することがあります。このとき、分子内にはδ+とδ-の部分電荷が生じます。このように分極した分子同士は、互いに反発し合うより、互いに引き合う方がエネルギー的には安定になります。そのため、長時間で見れば、分子同士は互いに弱く引き合うことになります。このような瞬間的に生じる部分電荷による分子間の相互作用を、「ファンデルワールス力(van der Waals force)」といいます。
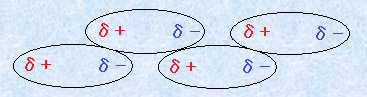
図.19 瞬間的に生じる部分電荷により、分子同士は弱く引き合う
ファンデルワールス力を応用している生物としては、爬虫類のヤモリがあげられます。ヤモリは、民家やその周辺に生息するトカゲで、垂直な壁を上ったり、天井に張り付いたりすることができます。ヤモリの足からは粘着性の物質が分泌されていないことから、かつてはヤモリの特殊能力と考えられていました。しかし、電子顕微鏡による観察によって、その秘密が指の構造にあることが分かってきました。ヤモリの足指の裏には、長さ約0.05 mmの非常に多くの微小な繊毛が生えており、さらにその繊毛の先端も、何百本ものヘラ状構造の毛に枝分かれしています。ヤモリはヘラ状構造の毛によって接着面積を最大化し、自身と接着面との間に働くファンデルワールス力を指数関数的に増大させることができるのです。ヤモリは繊毛の角度を変化させることで、吸着力の強さを簡単に調節することができるようです。現在では、これを応用して、繰り返し使用可能な接着剤の研究がなされています。
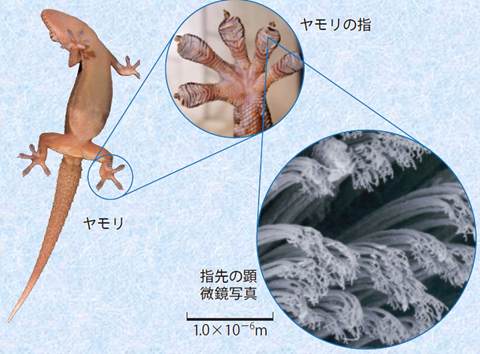
図.20 ヤモリは足指の毛の角度を変えることで、吸着力を強めたり弱めたりすることができる
ファンデルワールス力には3つの規則があり、これによりファンデルワールス力の大小、すなわち分子の沸点の高さを予想することができます。
(i-1) 分子量が大きいほどファンデルワールス力が大きい
ファンデルワールス力は、部分電荷によって生じるクーロン力が原因であるから、部分電荷を生じさせる電子数が多ければ多いほど、その力は大きくなるはずです。中性原子では、電子数は陽子数と等しく、陽子数が多いほど一般的に分子量も大きくなります。したがって、ファンデルワールス力は、分子量とともに大きくなると言うことができそうです。
一般的に分子量というと、質量との関係性が強いので、ファンデルワールス力には万有引力が関係しているのではないかという誤解がよくされます。しかし、化学結合における寄与は、飽くまでクーロン力が主役であることに注意してください。つまり、分子量が大きいほど、電子数が多くなるので、ファンデルワールス力は大きくなります。また、ファンデルワールス力が大きいほど、分子間を引き離すのに必要なエネルギーが大きくなるため、沸点は高くなります。
表.7 分子量による沸点の違い
|
化学式 |
F2 |
Cl2 |
Br2 |
I2 |
|
分子量 |
38 |
71 |
160 |
254 |
|
沸点 |
-188℃ |
-34℃ |
59℃ |
184℃ |
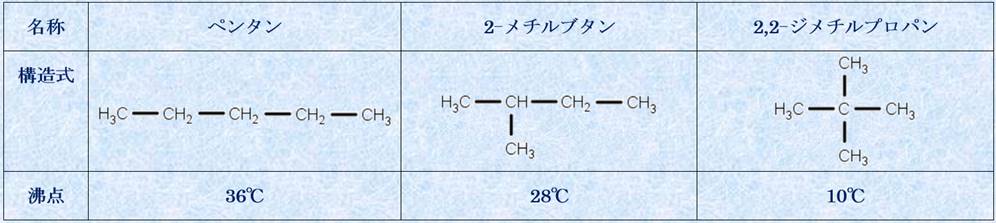
(i-2) 枝分かれの少ない直線分子はファンデルワールス力が大きい
分子量が等しい分子同士でも、構造の違いによって、ファンデルワールス力の大きさが異なることがあります。一般的には、枝分かれが少なくて分子間の接近が立体的に起こりやすい分子の方が、枝分かれが多くて分子間の接近が困難な分子よりも、ファンデルワールス力が大きくなります。つまり、分子の枝分かれが少ないほど、分子間の接近が起こりやすくなるので、ファンデルワールス力は大きくなります。また、ファンデルワールス力が大きいほど、分子間を引き離すのに必要なエネルギーが大きくなるため、沸点は高くなります。
表.8 分子の形による沸点の違い
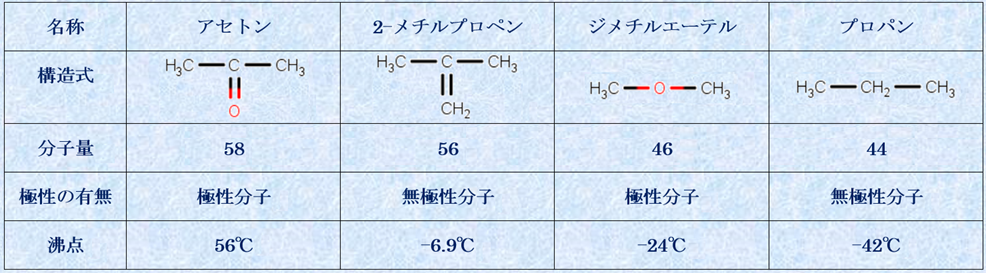
(i-3) 極性分子は無極性分子よりもファンデルワールス力が大きい
ファンデルワールス力は、分子内の瞬間的な部分電荷によって生じるクーロン力が原因でした。実は、極性分子と無極性分子とでは、ファンデルワールス力の大きさが変わってきます。極性分子同士が近付いた場合、δ+とδ-の部分電荷が互いに向かい合うように配向する機会が多くなり、無極性分子同士に働くファンデルワールス力よりも強い引力が生じます。このようなファンデルワールス力を、特に「双極子-双極子相互作用(dipole-dipole interaction)」といいます。
なぜ極性分子では、δ+とδ-の部分電荷が互いに向き合うように配向する機会が多くなるのでしょうか?極性分子は無極性分子とは異なり、瞬間的に部分電荷が生じているのではなく、永久的に部分電荷が生じているという違いがあります。すなわち、極性分子では、無極性分子よりもファンデルワールス力が働きやすい状況になっているといえます。そこで、極性分子同士に働く引力を双極子-双極子相互作用というのに対して、無極性分子同士に働く引力を「ロンドン分散力(London dispersion force)」といったりします。ロンドン分散力は、ドイツの物理学者であるフリッツ・ロンドンによって示されました。極性分子にあっては双極子-双極子相互作用が、無極性分子にあってはロンドン分散力が、ファンデルワールス力の大部分を占めています。つまり、極性分子では、ファンデルワールス力の双極子-双極子相互作用が働くことにより、分子間を引き離すのに必要なエネルギーが大きくなるため、沸点は高くなります。
表.9 極性分子と無極性分子のファンデルワールス力による沸点の違い
(ii) 水素結合
フッ素F・酸素O・窒素Nなどの電気陰性度の大きな原子が水素原子Hと共有結合している場合、特別な分子間力が働きます。これらの電気陰性度の大きい原子と水素原子Hとの結合間には強い極性が生じるので、水素原子Hは正電荷を帯び、水素原子Hは付近の別の分子に含まれる負に帯電した原子と相互作用することになります。そこで、フッ素F・酸素O・窒素Nのような電気陰性度の大きい原子をXまたはYとすると、次の図.21のような相互作用が起こることになります。
![]()
図.21 水素結合の様子
図.21の「・・・」で示されるような結合を、特に「水素結合(hydrogen bond)」といいます。水素結合は特殊な結合であり、H・・・Yの水素結合が形成されるとすぐにX−Hの共有結合が切れ、新たにX・・・Hの水素結合とH−Yの共有結合が形成されます。このように、2つの陰性原子XとYは、その間に挟まれた水素原子Hを絶えず受け渡し合いながら、互いに引き合うことになります。
ところで、電気陰性度の大きな原子が水素原子Hと共有結合すると、なぜこのような現象が起こるのでしょうか?これは、水素原子Hは電子を放出すると水素イオンH+ になりますが、その構造は、陽子1個だけで構成される特別な物質だからです。陽子のことを英語で「proton」といいますが、化学で「プロトン」というと、それは一般的に水素イオンH+ のことを意味します。クーロン力は距離の2乗に反比例するため、陽子がむき出しの構造になっている水素イオンH+ には、非常に強いクーロン力が生じるのです。
フッ素F・酸素O・窒素Nなどの電気陰性度の大きな原子と共有結合した水素原子Hは、部分的には裸の水素イオンH+ に近い状態になっています。そのため、水素結合は分子間力の中では特異的な強さを持つことになり、普通のファンデルワールス力とは区別して考えることにしているのです。水素結合は、共有結合やイオン結合に比べると弱い結合ですが、ファンデルワールス力よりもずっと強い結合です。そのため、水H2O・フッ化水素HF・アンモニアNH3のように分子間で水素結合を形成しうる物質は、分子量から期待される沸点よりも高い沸点を持ちます。次の図.22を見ると、水H2O・フッ化水素HF・アンモニアNH3の沸点が、他の同族の水素化物の沸点よりも高くなっていることが分かります。
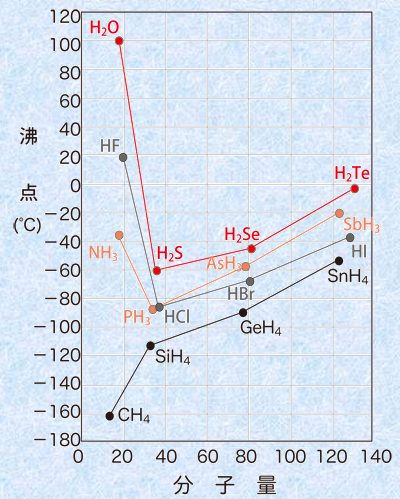
図.22 水素化物の沸点
ところで、水素結合は、塩化水素HClの塩素原子Clのように、電気陰性度は大きくても原子半径が大きな原子では形成されません。この理由は、原子半径が大きいと電子密度が小さくなり、水素結合におけるほとんど陽子1個のような状態の水素原子Hと相互作用をするのには、不十分となるからです。水素結合において、強いクーロン力を持つ水素原子Hを満足させるためには、相互作用する原子の電気陰性度が大きく、かつ電子密度も大きくなくてはならないのです。次の表.10には、ロンドン分散力の強さを1としたときの他の分子間力の相対的な強度を示してあります。
表.10 分子間力の相対的な強度
|
相互作用 |
引力が働く粒子 |
相対強度 |
|
イオン結合 |
陽イオンと陰イオン |
103 |
|
水素結合 |
水素原子とフッ素原子or酸素原子or窒素原子 |
102 |
|
双極子-双極子相互作用(ファンデルワールス力) |
極性分子と極性分子 |
10 |
|
ロンドン分散力(ファンデルワールス力) |
無極性分子と無極性分子 |
1 |
|
万有引力 |
原子核と原子核 |
10−35 |
(iii) 水素結合を利用する接着剤
アロンアルファなどのシアノアクリレート系の瞬間接着剤は、水H2Oの水素結合を利用して、物体同士を接着させています。シアノアクリレート系の瞬間接着剤は、使用前はモノマーの状態であり、粘性の低い状態です。しかし、使用時には空気中などに存在するわずかな水分子によって、瞬間的に重合を開始し、ポリマーとなって硬化します。この瞬間接着剤は、分子内にシアノ基(-CN)を多数持っており、被着材との間に入り込み、被着材と水素結合をすることで、物体同士を接着させているのです。アノアクリレート系の瞬間接着剤は、金属の接着に用いられることが多いですが、これは水H2Oの水素結合を利用しているからです。一般的に金属の表面は、空気中の酸素O2により酸化されていて、酸化物の状態になっています。表面に存在している酸素原子Oは、負の電荷を帯びているため、これが空気中の水H2Oと水素結合する結果、瞬間接着剤による強力な接着が可能になるのです。

図.23 アロンアルフアは1963年に誕生し、日本では瞬間接着剤の代名詞となっている
また、このときに瞬間接着剤が被着材の表面にある空隙に侵入硬化し、楔のような役割をする「アンカー効果」の寄与も考えられます。一見滑らかに見える面にも、実は小さな凸凹がたくさんあって、この凸凹に潜り込んだ接着剤が固まることによって、アンカー効果が働きます。木工用ボンドに用いられるポリ酢酸ビニルは、主にアンカー効果によって接着作用を示すと考えられています。その他、デンプン糊の接着機構にも、水素結合が関与しています。紙はセルロースでできており、多数のヒドロキシ基(-OH)を持っています。一方のデンプンにも、多数のヒドロキシ基(-OH)があるため、両者のヒドロキシ基(-OH)の間に水素結合が起きて、接着される訳です。ポリエチレンがデンプン糊で接着できないのは、ポリエチレンには、表面にこのようなヒドロキシ基(-OH)がないからです。

図.24 木工用ボンドは、紙接着や繊維・木工・合板用などに使われる
・参考文献
1) 卜部吉庸「化学の新研究」三省堂(2013年発行)
2) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
3) 佐藤健太郎「すごい分子 世界は六角形でできている」講談社(2019年発行)
4) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
5) 船山信次「こわくない有機化合物超入門」技術評論社(2014年発行)