・第17族元素(ハロゲン)
【目次】
(1) 第17族元素
周期表において、第17族に属するフッ素F・塩素Cl・臭素Br・ヨウ素Iなどの元素を、総称して「ハロゲン(halogen)」といいます。「ハロゲン」の語源は、ギリシア語の「halos(塩)」と「gen(生むもの)」によります。ハロゲンは、化学式中で「X」と表記されることが多く、任意のハロゲン単体は、「X2」のように表されます。ハロゲンの原子は、最外殻電子配置がns2np5である元素(n=2,3,4・・・)です。外部から電子を1個受け取って、貴ガスと同じ電子配置を作って安定化するため、-1のイオン価を持つ陰イオンが広く知られています。
ハロゲン単体は、一般的に有色で毒性が強いです。ハロゲンを含む化合物でも、「ダイオキシン類」や「サリン」などのように、強い毒性を持つものが数多くあります。ハロゲン単体の酸化力の強さは、電気陰性度の関係から、F2>Cl2>Br2>I2のようになります。単体の毒性もこの順に強くなり、フッ素F2は淡黄色の猛毒の気体です。室温では、塩素Cl2は黄緑色で空気より重く、刺激臭のある気体です。臭素Br2は赤褐色の液体、ヨウ素I2は昇華性のある固体です。ハロゲンはその高い反応性のために、天然で単体X2のまま存在することはなく、すべてが安定な化合物として存在しています。
表.1 ハロゲンの性質のまとめ
|
元素 |
F |
Cl |
Br |
I |
|
|
単 体 |
沸点 |
−188℃ |
−34℃ |
59℃ |
185℃ |
|
融点 |
−220℃ |
−101℃ |
−7℃ |
114℃ |
|
|
常温の状態 |
気体 |
気体 |
液体 |
固体 |
|
|
色 |
淡黄色 |
黄緑色 |
赤褐色 |
黒紫色 |
|
|
H2との反応 |
H2+F2→2HF 常温暗所で爆発的 |
H2+Cl2→2HCl 常温光で爆発的 |
H2+Br2→2HBr 高温・触媒下で進行 |
H2+I2⇄2HI 高温・触媒下で平衡状態 |
|
|
H2Oとの反応 |
2F2+2H2O→4HF+O2 |
Cl2+H2O⇄HCl+HClO |
Br2+H2O⇄HBr+HBrO |
水に溶けにくい |
|
|
その他 |
― |
水道水の殺菌剤 |
C=CとC≡Cの検出 |
ヨウ素デンプン反応 |
|
|
化 合 物 |
HX |
弱酸 |
強酸 |
強酸 |
強酸 |
|
AgX |
水に溶ける |
白色沈殿 |
淡黄色沈殿 |
黄色沈殿 |
|
|
CaX2 |
白色沈殿 |
水に溶ける |
水に溶ける |
水に溶ける |
|
表.2 ハロゲン化水素の製法
|
化学式 |
作り方 |
|
HF |
蛍石に濃硫酸を加えて加熱する CaF2 + H2SO4 → CaSO4 + 2HF |
|
HCl・HBr・HI |
ハロゲン化ナトリウムに濃硫酸を加えて加熱する NaX + H2SO4 → NaHSO4 + HX |
(2) フッ素
(i) フッ素F2
「フッ素(fluorine)」は、天然では蛍石CaF2や氷晶石Na3AlF6などのフッ化物の鉱物として存在します。その語源は、英語の「fluorite(蛍石)」に由来します。「fluor」はラテン語で「流れる」という意味で、蛍石は火中に入れた金属素材の流動性を高める性質があります。このような性質を持つことから、蛍石は古くから冶金の融剤として使われていました。その他には、幅広い波長の光を透過するなどの特徴を持ち、レンズなどにも多用されます。純粋な結晶は無色透明ですが、不純物が含まれると有色となり、不純物の種類によって、実に多様な色を帯びます。また、加熱によって青白い蛍光を発し、加熱を止めてもしばらくは暗闇の中で蛍光が続きます。

図.1 蛍石は、フッ化カルシウムCaF2を主成分とするハロゲン化鉱物である
フッ素Fは、全元素中で最大の電気陰性度を持つ元素です。このため、多くのフッ化物は、イオン結合性を示します。フッ素Fの単体は、二原子分子のF2として存在します。常温常圧では、フッ素F2は淡黄色で特有の臭いを持つ気体です。すべての元素の単体の中で最も酸化力が強く、窒素N2を除くすべての元素と直接反応します。フッ素F2を吹き付ければ、ほとんどすべての単体や化合物が、たちまちに炎上するのです。例えば、フッ素F2は、化学的に不活性であるはずの水H2Oやガラスの主成分である二酸化ケイ素SiO2を酸化することができます。山盛りの鉄粉にフッ素F2を吹き付ければ、次の図.2のようにその反応熱によってたちまちに燃え上がります。
2H2O + 2F2 → O2 + 4HF
SiO2 + 2F2 → O2 + SiF4
2Fe + 3F2 → 2FeF3

図.2 フッ素F2を鉄粉Feに吹き付けるだけで、鉄粉Feが燃え上がる
ガラスや白金Ptでさえも侵すその性質上、フッ素F2を単体で保存することは極めて困難です。今までに、多くの化学者たちがフッ素F2の単離に挑戦してきましたが、その酸化力および毒性の強さのために、ことごとくが失敗してきました。電気分解で有名な、イギリスの化学者であるハンフリー・デービーもその一人です。デービーは、強力なボルタ電池を使った電気分解により、1806年からカリウムK、ナトリウムNa、カルシウムCa、ストロンチウムSr、マグネシウムMg、バリウムBa、ホウ素Bを次々と単離していました。そして1813年、デービーは満を持して、フッ素F2の単離に挑戦します。フッ素F2は、白金電極でフッ化水素HFを電気分解することで得られます。電気分解を続けていくと、陽極から目的のガスが発生したように見えました。しかし、実際には分解されていないフッ化水素酸HFが揮発しただけでした。デービーはこのガスに接触してしまったために、フッ素中毒になってしまいました。デービーの能力を持ってしても、フッ素F2は単離できなかったのです。
(陽極) 2F− → F2 + 2e−
(陰極) 2H+ + 2e− → H2
さらに、アイルランドのクノックス兄弟は、フッ素F2の単離実験中にフッ素中毒になり、一人は3年間寝たきりになってしまいます。ベルギーのポ−リン・ロイエットとフランスのジェローム・ニクレも、フッ素中毒で相次いで死亡しています。そして1886年6月26日、遂にフランスの化学者であるアンリ・モアッサンが、フッ化水素HFの電気分解により、フッ素F2の単離に成功します。蛍石CaF2の捕集容器を使って、得られたフッ素F2の反応を抑えるために、電気分解を−50℃という低温下で進めたことが成功の鍵でした。モアッサンはその後、20世紀の初頭にかけて数多くのフッ素化合物を合成し、これらの研究の功績により、1906年のノーベル化学賞はモアッサンに贈られています。現在でも、基本的にはモアッサンの方法で、フッ素F2は単離されています。
ちなみに、このときにモアッサンと1906年のノーベル化学賞を争っていたのが、周期表を発表したことで知られるロシアの化学者ドミトリ・メンデレーエフです。メンデレーエフは、このときわずか一票差でモアッサンに敗れています(メンデレーエフは翌年の1907年に亡くなっているので、ノーベル賞は受賞できませんでした)。ただし、モアッサンもこの実験で無傷という訳にはいかず、実験の過程で、片目の視力を失っています。ノーベル化学賞を受賞した翌年の1907年、モアッサンは54歳の若さで急死していますが、フッ素F2の研究との因果関係は不明です。

図.3 モアッサンは、フッ素F2を単離したあと、六フッ化硫黄SF6などのような様々なフッ素化合物を発見している
多くの化学者を苦しめたように、フッ素F2の単体は極めて反応性が高いため、これまで自然界には単体のフッ素F2は存在しないと考えられていました。しかし、興味深いことに蛍石の一種である「アントゾナイト」の中に、自然界には存在しないと考えられていた単体のフッ素F2が含まれていることが、2012年にミュンヘン工科大学の研究チームによって報告されました。アントゾナイトは、ドイツのウェルセンドルフに産出する黒い鉱石で、それを割ったり砕いたりすると、独特な奇妙な臭いがすることは知られていました。これは、結晶が破壊されるとフッ素F2が放出され、空気中の酸素O2や水蒸気H2O反応して、オゾンO3が生じるからです。このときに生じたオゾンO3の特徴的な臭いが、「アントゾン(antozone)」と呼ばれる仮説上の化合物と誤認されたことから、「アントゾナイト(antozonite)」と命名されました。
F2 + O2 + H2O → O3 + 2HF

図.4 アントゾナイトは、結晶が破壊されたときにフッ素F2を放出する特徴がある
(ii) フッ化水素HF
フッ化水素HFは、蛍石CaF2と濃硫酸H2SO4を混合して加熱するか、水H2Oとフッ素F2を反応させることで発生します。単体のフッ素F2は扱いが難しいので、蛍石CaF2から得るのが一般的です。フッ化水素HFは、ガラスに含まれる二酸化ケイ素SiO2を溶かす性質があるので、ガラス製の容器中で行うことはできません。これらの反応は、白金製または鉛製の容器中で行われます。
CaF2 + H2SO4 → CaSO4 + 2HF
2H2O + 2F2 → O2 + 4HF
蛍石から得られるフッ化水素HFが、ガラスを溶かすことは17世紀には知られていたようです。フッ化水素HFの水溶液である「フッ化水素酸(フッ酸)」をガラスに垂らすと、ヘキサフルオロケイ酸H2SIF6を生じて、ガラスを腐食させます。1670年、ドイツのハインリヒ・シュヴァンハルトが蛍石から得たフッ化水素酸HFで、ガラス上に図柄を書く「エッチング」と呼ばれる技法を完成させました。例えば、理科実験に使うガラス器具には、目盛りの付いたものがありますが、その目盛りを刻むのにフッ化水素酸HFを使っています。なお、気体のフッ化水素HFをガラスに反応させた場合は、四フッ化ケイ素SiF4が生じて、ガラスを腐食させます。フッ化水素酸HFはガラス製の容器に保存できないので、ポリエチレン製の容器に保存します。
SiO2 + 6HF(水溶液) → H2SiF6 + 2H2O
SiO2 + 4HF(気体) → SiF4 + 2H2O
ちなみに、北アメリカの水道局では、ヘキサフルオロケイ酸ナトリウムNa2SIF6などのフッ化物を、水道水に0.7〜1.2ppmの濃度で添加しています。この理由は、フッ化物イオンF− には、歯のエナメル質の主成分であるヒドロキシアパタイトCa5(PO4)3(OH)の耐酸性を高める効果があるからです。歯に吸収されたフッ化物イオンF− は、Ca5(PO4)3(OH)中のOHと入れ替わります。そうすると、エナメル質が酸によって溶け出しづらくなり、結果として歯が強くなります。他にも、フッ化物イオンF− は歯の再石灰化を促すようです。歯磨き粉などにフッ化ナトリウムNaFが配合されているのは、この効果を狙ったものです。2007年時点で、アメリカ合衆国住民の66%にフッ化物を添加した上水道が供されていました。水道水フッ化物添加(フロリデーション)には、賛否両論の議論があります。しかし、米国疾病予防センターは、「飲料水をフッ素化することは、20世紀における公衆衛生上の10の偉大な業績のうちの1つである。地域の飲料水をフッ素化することは、過去60年以上に渡って、虫歯の発生率を下げる主要な要因であり続けている」と述べているなど、高い評価をしています。
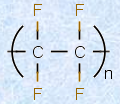
図.5 フッ化物イオンF− には、歯の耐酸性を高める効果がある
また、フッ化水素HFには、塩化水素HClなどの他のハロゲン化水素と比較して、性質の異なる点がいくつかあります。まず、希薄水溶液においては、フッ化水素HFだけが、弱酸として振る舞います(塩化水素HClと比べると、1011倍も弱い酸です)。これは、共役塩基であるフッ化物イオンF− のイオン半径が小さいため、負電荷が狭い領域に局在化して、水素イオンH+ を電離することが不安定になるからです。原子番号の大きいハロゲンほど、陰イオンになったときのイオン半径が大きくなり、共役塩基が安定になるので、酸性度は強くなります。また、フッ化水素HFは分子間で水素結合をするため、他のハロゲン化水素よりも沸点が高くなります(90℃以上では1分子ですが、常温常圧では水素結合で2〜6分子が会合しています)。さらに、ハロゲン化銀では、フッ化銀AgFだけが水溶性であり、ハロゲン化カルシウムでは、フッ化カルシウムCaF2だけが沈殿を作ります。これらはすべて、フッ素Fの特異的な性質です。
表.3 ハロゲン化水素の性質
|
化学式 |
主な分子間力 |
沸点(℃) |
状態 |
希薄水溶液の液性 |
|
HF |
水素結合 |
19.5 |
気体 |
弱酸性(pKa=3.2) |
|
HCl |
ファンデルワールス力 |
-85 |
気体 |
強酸性(pKa=-8) |
|
HBr |
ファンデルワールス力 |
-66.4 |
気体 |
強酸性(pKa=-9) |
|
HI |
ファンデルワールス力 |
-36 |
気体 |
強酸性(pKa=-10) |
フッ化水素HFには強い毒性があり、過去に事故が起こったことがあります。1982年には、歯科治療用のフッ化ナトリウムNaFと間違えて、フッ化水素HFを3歳の女児の歯に塗布してしまい、女児が急性薬物中毒のために死亡する事故が東京都八王子市で起こりました。フッ化水素HFを塗布された女児は、激痛による筋肉の痙攣で診察台から跳ね上がって転がり落ち、口からは白煙が上がっていたといいます。フッ化ナトリウムNaFは、歯のエナメル質成分と反応して、歯の耐酸性を強化するので、虫歯予防の目的で歯に塗布することがあります。実際に虫歯予防で、水道水にフッ化ナトリウムNaFを0.6〜0.8ppm添加すると、虫歯が50〜60%減少するというデータもあります。しかし、フッ化水素HFの方は、皮膚に少し触れただけでも壊疽を起こすほどの猛毒であり、一般的に歯科治療に用いられることはありません。さらに2013年には、ストーカー被害に遭っていた女性が、靴にフッ化水素HFを塗られ、壊疽により足の指5本を切断する事態になったというニュースが話題になりました。
(iii) テフロン(C2F2)n
最も有名なフッ素化物は、「テフロン(teflon)」でしょう。テフロンの発見は、偶然の産物でした。1938年、デュポン社の研究員であるロイ・プランケットが、クロロフルオロカーボン(フロン)冷媒を開発しようとしていたときに、テトラフルオロエチレンのボンベ内に、意図せぬ産物としてそれを発見しました。当初の研究目的からは大外れでしたが、テフロンは耐熱性や耐薬品性に優れ、強い腐食性を持つフッ化水素酸にも溶けないことから、結果的には画期的な大発見となりました。「テフロン」という名称は、実はデュポン社の商品名であり、IUPAC系統名では「ポリテトラフルオロエチレン」といいます。テフロンは、現在までに発見されている物質の中で、最も摩擦係数の小さい物質です。その耐熱性や耐薬品性から、フライパンやレインコートなどの表面加工から、軍用品や実験器具まで、様々な分野で利用されています。

図.6 ポリテトラフルオロエチレン(テフロン)の構造式
(3) 塩素
(i) 塩素Cl2
「塩素(chlorine)」は、アルカリ金属またはアルカリ土類金属の塩化物として地殻中に存在する他、塩化物イオンCl− として海水中にも含まれます。電気陰性度が大きいので、天然には単体Cl2は存在しません。体重70 kgの成人の体には、約100 gの塩素Clが含まれています。塩化ナトリウムNaClは、血液中に0.9%の濃度で含まれ、体液の浸透圧維持に役立っています。
塩素Clを元素として正しく認識したのは、フッ素Fのときにも紹介した、イギリスの化学者ハンフリー・デービーでした。当時、フランスの化学者アントワーヌ・ラボアジエが、「すべての酸には酸素が含まれている」と主張していたことから、塩酸は未知の元素の酸化物だと考えられており、塩酸がさらに酸化されて生じる気体は、「酸化塩素」と名付けられていました。1810年にデービーは、塩酸から酸素を取り出そうと様々な実験をしましたが、どうしても酸素は得られません。そこで、デービーは「酸化塩素」は単体だと考えて、「塩素」という名前に変えました。また、塩素と水素を混合して火花を飛ばすと塩酸が合成できることから、「塩酸は酸素ではなく水素を含む」と考えるようになりました。こうして、酸素を含まない酸もあることが分かり、塩素が発見されたのでした。

図.7 デービーは、アルカリ金属やアルカリ土類金属をいくつか発見し、塩素やヨウ素の性質を研究したことでも知られている
単体の塩素Cl2は、常温常圧では、特有の刺激臭を有する黄緑色の気体です。塩素Clの語源も、ラテン語の「黄緑(chloros)」によります。重い気体で、密度は空気の2.5倍弱もあります。酸化力が非常に強く、多くの金属や有機化合物と反応して、塩化物を形成します。例えば、熱したナトリウムNaに塩素Cl2を作用させると、両者は激しく反応して、塩化ナトリウムNaClが生成します。
2Na + Cl2 → 2NaCl
塩素Cl2は水に少し溶けて、その一部が自己酸化還元反応し、塩化水素HClと次亜塩素酸HClOを生じます。次亜塩素酸HClOは、化学的に不安定な物質であり、水溶液としてのみ存在し、強い酸化作用があります。その強力な酸化力によって、細菌やウイルスの組織を破壊したり、色素の構造を変えたりするので、塩素水はパルプや衣類の漂白剤、水道水やプールの殺菌剤として用いられます。次亜塩素酸イオンClO− も同様に殺菌力がありますが、殺菌力は次亜塩素酸HClOの方が次亜塩素酸イオンClO− よりも80倍も強いです。水溶液が中性から弱酸性の場合は次亜塩素酸HClOが多くなり殺菌力が強くなりますが、塩基性では次亜塩素酸イオンClO− が多くなり殺菌力が弱くなります。水圧を利用して勢いよく水を噴出されるシャワーからは、塩素Cl2が発生するようで、シャワーを15分浴びることは、水道水を飲むより7〜100倍も有害とする結果が、アメリカで研究報告されています。

図.8 塩素の漂白作用
Cl2 + H2O ⇄ HCl + HClO
ClO− + 2H+ + 2e− → H2O + Cl−
実験室で塩素Cl2を発生させるときは、二酸化マンガンMnO2に濃塩酸HClを加えて加熱し、次の図.9のように下方置換で捕集します。このとき、二酸化マンガンMnO2は触媒ではないので、化学量論量加える必要があります。発生した塩素Cl2には、不純物として塩化水素HClや水蒸気H2Oが混じっているので、最初に水H2Oに通して不純物である塩化水素HClを水H2Oに溶かします。しかし、得られた塩素Cl2には、まだ水蒸気H2Oが含まれているので、さらに濃硫酸H2SO4に通して乾燥させます。なお、工業的に塩素Cl2を合成するには、塩化ナトリウムNaCl水溶液の電気分解をします(無機工業化学を参照)。
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O

図.9 塩素Cl2の製法
塩素Cl2には漂白作用がありますが、そのまま漂白剤として使うには、毒性が強すぎて扱いが難しいです。そこで、18世紀に塩素Cl2を塩基性の水溶液に溶かして、安全性を高める方法が発案されました。例えば、塩素Cl2は、水酸化ナトリウムNaOHや水酸化カルシウムCa(OH)2と自己酸化還元反応し、次亜塩素酸ナトリウムNaClOやさらし粉CaCl(ClO)・H2Oを生成します。これらは、いずれも次亜塩素酸イオンClO− を含むために酸化作用があり、漂白・殺菌作用を示します。特にさらし粉CaCl(ClO)・H2Oは、安価に生産可能な物質であり、大量に輸送できるのが利点でした。
こうした塩素漂白技術の登場は、大きな転換点でした。それまで漂白は、日光に長時間さらして行われており、漂白の程度や漂白にかかる時間は、天候や季節によって大きく左右され、人為的に制御することは不可能でした。ところが塩素漂白技術が登場したことで、漂白は年中安定して実施できるようになりました。このように、塩素漂白は「化学の発展により自然現象を制御できるようになった例」といえます。
2NaOH + Cl2 → NaCl + NaClO + H2O
Ca(OH)2 + Cl2 → CaCl(ClO)・H2O
しかしながら、これらの次亜塩素酸化物(亜塩素酸イオンClO− を含む)は、塩酸HClなどの強酸性物質と反応すると、有毒な塩素Cl2を発生させます。家庭用の塩素系漂白剤にある「混ぜるな危険」の注意書きは、この反応が起こることを示唆するものです。1987年12月、徳島県の主婦がトイレ内で塩酸HClを含むトイレ用の酸性洗剤を使っていました。そこへ、汚れをさらに綺麗にするために次亜塩素酸ナトリウムNaClO入りの塩素系漂白剤を使用したところ、塩素Cl2が発生。狭いトイレ内のため、急激に塩素濃度が上昇し、急性中毒により死亡してしまったのです。その事故が起こってから、家庭用品品質表示法が改正され、1988年から「混ぜるな危険」のラベル添付が義務付けられました。しかし、その後も同様の事故の報告が続いています。
NaClO + 2HCl → NaCl + H2O + Cl2
CaCl(ClO)・H2O + 2HCl → CaCl2 + 2H2O + Cl2

図.10 家庭用の塩素系漂白剤と酸性洗剤を混ぜると、塩素Cl2が発生して危険である
このように、塩素Cl2は簡単に発生させることができるのにも関わらず、強い毒性を持つため、人類初の本格的な化学兵器として使用された歴史があります。舞台となったのは、1915年に第一次世界大戦中のドイツ軍と連合国軍が戦った、ベルギーの第二次イープル戦線です。ドイツが塩素Cl2を選んだのには、理由がありました。ドイツでは、1890年に食塩水を電気分解する工業的な方法で、極めて良質な水酸化ナトリウムNaOHを製造する方法を確立していました。そのとき、副生成物として大量の塩素Cl2ができていました。水酸化ナトリウムNaOHは、石鹸やガラスの原料となる重要な物質です。石鹸やガラスの需要が高まるとともに、塩素Cl2の生産量も増加しましたが、当時はさらし粉CaCl(ClO)・H2Oにするぐらいしか活用法がなかったために、生産過剰になっていました。そこで、ドイツは生産過剰な塩素Cl2に目を付けて、第一次世界大戦に利用することにしたのです。
ちなみに、このときに毒ガスを使用したドイツ軍の化学兵器部隊の司令官を務めたのが、ドイツの物理化学者であるフリッツ・ハーバーです。ハーバーは、1918年にノーベル化学賞を受賞し、高校化学でもアンモニアNH3を合成する「ハーバー・ボッシュ法」でその名を残しています(無機工業化学を参照)。ハーバーは、盲目的とも言えるほどの愛国心の持ち主であり、ドイツへの愛国心から自ら従軍し、毒ガス開発に携わりました。「戦争を毒ガス兵器によって早く終結できれば、無数の人命を救うことができる」と、ハーバーは考えていたのです。第一次世界大戦において、各種毒ガス使用の指導的立場にあったことから、「化学兵器の父」と呼ばれることもあります。

図.11 ハーバーは、毒ガスの開発に熱心に取り組み、軍もハーバーを信頼して、毒ガスに関する全権を与えた
1915年4月22日、血みどろの激しい戦闘が繰り広げられていたイープル戦線にて、ドイツ軍が最初の毒ガス攻撃を開始しました。ドイツ軍は、前線に5,700本もの塩素ボンベを並べ、風向きが敵陣方向変わったとき、すぐにボンベのバルブを開けて、一目散に退避しました。ドイツ軍が放出した168 tの塩素Cl2は、緑色の雲となって、人が走るほどの速さで、連合国軍の陣地に向かって漂って行きました。煙が塹壕の中に流れ込んだ途端、連合国軍の兵士たちの多くは視力を失い、胸をかきむしり、叫びながら倒れ、阿鼻叫喚の地獄絵図そのものに変わりました。彼らの口からは、「にかわ」のような粘液が溢れ出しました。塩素Cl2を吸入すると、肺内部の粘膜が剥がれ、それが粘液となって気管を詰まらせ、肺に溜まってしまいます。当時、毒ガスに対する防護策など何も持たない連合国軍は、わずか1日にして死者5,000人、重軽症者15,000人を出す大打撃を受けて、前線は大きく塗り替えられました。
塩素Cl2を吸引すると、まずは呼吸器に損傷を与えます。また、空気中である程度以上の濃度では、皮膚や粘膜を強く刺激します。高濃度での被曝の場合は、外科的な処置をしなくてはまず助かることはなく、不可逆的な損傷を呼吸器に与えます。高濃度の塩素Cl2を吸引した場合は、人工呼吸器などの処置を行っても、数時間から1日程度で死に至ります。低濃度の被曝の場合でも、長時間では呼吸器に損傷を与えるので、基本的には吸引しない方が良いでしょう。

図.12 第一次世界大戦のイープル戦線にて、ドイツ軍は塩素Cl2で連合国軍を攻撃した
(ii) 塩化水素HCl
塩化水素HClは、常温常圧下では、無色の刺激臭を持つ気体です。塩化水素HClの水溶液を「塩酸」といいます。塩酸HClはかつて海水(ラテン語でmuria)から得られる塩化ナトリウムNaClから作られていたので、「海酸(muriatic acid)」とも呼ばれていました。工業的には、塩化水素HClは塩化ナトリウムNaCl水溶液の電気分解によって生じる塩素Cl2と水素H2を直接反応させて作ります。実験室では、塩化ナトリウムNaClに濃硫酸H2SO4を加えて穏やかに加熱し、発生した塩化水素HClを下方置換で捕集します。なお、このとき発生する塩化水素HClには、加熱により発生する水蒸気H2Oが混入しています。塩化水素HClは酸性の気体なので、その乾燥には濃硫酸H2SO4など酸性乾燥剤が適当です。
H2 + Cl2 → 2HCl
NaCl + H2SO4 → NaHSO4 + HCl

図.13 実験室での塩化水素HClの発生と捕集
乾いた試験管に塩化水素HClを取り、これを倒立させて水に入れると、試験管内に水が入ってきます。これは、塩化水素HClが水に溶けやすい性質を持っているためです(溶解度は30℃で670 g/L)。そして、この試験管内の液をリトマス紙で調べると、強い酸性であることが分かります。これは、塩化水素HClの水溶液である塩酸が、強酸性を示す物質だからです。市販の濃塩酸HClの濃度は約37%(12 mol/L)で、試薬瓶の栓を開けると白煙を生じます。これは、気体となった塩化水素HClが、空気中の水蒸気を集めて細かい塩酸HClの霧となるためです。このような性質を「発煙性(fuming)」といいます。

図.14 塩酸HClの瓶を開けると、白い煙のようなものが生じる
塩酸HClにマグネシウム片を入れると、水素H2を発生して溶けます。これは、マグネシウムMgのイオン化傾向が、水素H2よりも大きいからです。水素H2よりイオン化傾向が大きい金属は、塩酸HClの水素イオンH+ で酸化されて陽イオンとなるので、塩酸HClに溶けます。
Mg + 2HCl → MgCl2 + H2

図.15 塩酸HClは、イオン化傾向が水素H2より大きい金属を溶かすことができる
(iii) ピロリ菌発見のドラマ
胃酸には、塩酸HClが含まれており、胃粘膜の胃腺にある壁細胞から、毎日1〜3 Lが分泌されています。胃粘膜からは「ムチン」という粘液が分泌されており、胃酸から保護しています。胃の内部は、pH=1〜2の強い酸性で保たれているため、従来は、胃の内部は細菌が生息できない環境だと考えられていました。しかし、現在では「ピロリ菌」と呼ばれる細菌が、胃の中に寄生していることが分かっています。強酸性の胃の中で、ピロリ菌が身を守る手段は興味深いです。自身が生産する「ウレアーゼ」という酵素で、胃粘液中の尿素(NH2)2COをアンモニアNH3と二酸化炭素CO2に分解し、生じたアンモニアNH3で局所的に胃酸を中和することによって、胃へ感染しているのです。
(NH2)2CO + H2O → CO2 + 2NH3
ピロリ菌の正式な学名は、「ヘリコバクター・ピロリ(Helicobacter pylori)」といいます。この名は、「ヘリコプター」の翼に似た鞭毛を持っていることに由来します。「ピロリ」の方は、胃の出口(幽門)を指す「ピロルス(pylorus)」に由来します。この菌は、胃の幽門部から初めて見つかりました。ピロリ菌は、胃の粘膜の中で、活性酸素を発生させます。すると、胃の粘膜の保護作用が弱くなってしまい、十二指腸潰瘍や胃潰瘍の原因になると考えられています。ピロリ菌は、胃ガンの発生にも深く関連していると考えられており、実に胃ガン患者の80%以上が、ピロリ菌の感染者であるとの報告もされています。

図.16 ピロリ菌の発見により、動物の胃に適応して生息する細菌が存在することが明らかにされた
消化性潰瘍の三大原因としては、「アスピリン」・「精神的なストレス」・「ピロリ菌」がよくあげられます。一般的には、精神的なストレスが一番の原因だと思われがちですが、それだけで胃潰瘍ができるのは、ごく稀なケースです。1980年代前半までは、胃潰瘍の原因は、「精神的なストレス」が原因とされていました。重度のストレスを抱えていた胃潰瘍の患者が多かったので、ほとんどの医師は、精神的なストレスによって胃潰瘍が引き起こされると思い込んでいました。しかし、ある事象Aが別の事象Bの前に起こったからといって、「前の事象Aが原因となってあとの事象Bが起きた」と判断するのは早計です。これだけでは、AとBに「相関関係」はあっても、「因果関係」があるとは判断できないからです。とにもかくにも、ピロリ菌が存在して初めて、胃潰瘍ができるとする学説が、現在の主流です。つまり、「どんなにストレスがあっても、胃にピロリ菌がいなければ、胃潰瘍にはならない」――このような「ピロリ菌説」が、現在では主流となっています。現在では、胃潰瘍の70〜80%、十二指腸潰瘍の実に90%以上が、ピロリ菌の感染を原因とすることが分かっています。
「ピロリ菌は、ヒトが生まれたときから胃の中にいるのか」というと、そんなことはありません。人の排泄物に紛れて出たものが、不潔な環境で、別の人の口から胃に感染していると考えられています。それには疫学的な証拠があり、アフリカや南米では、ピロリ菌の保持者は80%を超えますが、欧米では約20%、日本では約50%なのです。日本人の50歳以上では、保有率は70%を超えますが、日本人の若年層は、欧米並みの約20%だといわれています。日本人の50歳以上で保有率が高い理由は、戦時中や戦後の衛生状態の悪かった時代に、汚染された水や食事を介して、保菌されるようになったからです。
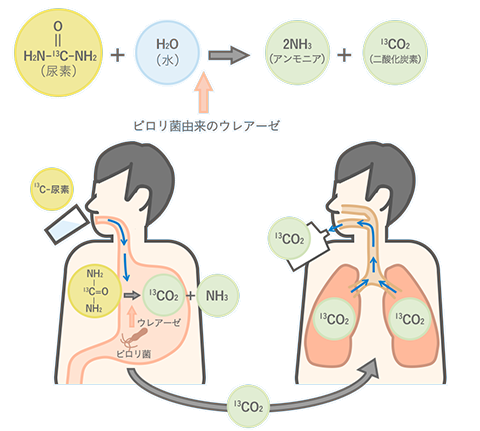
図.17 先進国と発展途上国の年代別ピロリ菌感染率
ピロリ菌に感染しているかどうかを調べる方法は、いくつかあります。最近は、炭素の安定同位体13Cを用いた方法が迅速にして簡便なので、よく用いられています。人体の中には、ピロリ菌由来以外の酵素ウレアーゼは存在しません。したがって、ピロリ菌に感染している人が尿素(NH2)2CO水溶液を飲むと、ピロリ菌のウレアーゼによって尿素(NH2)2COは分解されて、アンモニアNH3と二酸化炭素CO2になります。二酸化炭素CO2は速やかに血液中に吸収され、肺から呼気として排出されます。このとき、尿素(NH2)2COの炭素原子を13Cで標識しておけば、呼気中の二酸化炭素CO2の13Cの割合が増えていれば陽性、増えていなければ陰性というように判断できる訳です。

図.18 尿素呼気試験法の原理
ところで、このピロリ菌の発見には、ドラマがあったことはご存知でしょうか?ピロリ菌を発見したのは、オーストラリアの微生物学者であるバリー・マーシャルと、病理学者であるロビン・ウォレンでした。1980年代前半、彼らは共同で、人間の胃の中に生息している細菌を研究しており、「ピロリ菌」という細菌が、十二指腸潰瘍患者からは100%、胃潰瘍の患者からも75%の割合で見つかることを発見しました。マーシャルが胃炎の患者に抗生物質を投与すると、ピロリ菌が除去でき、同時に胃炎も消失しました。このテスト結果から、ピロリ菌は胃炎だけでなく、十二指腸潰瘍や胃潰瘍の発症にも関与しているのではないかと、彼らは考えたのでした。
この仮説を検証するため、マーシャルはチューブを自分の喉から胃に差し込み、胃壁の組織を採取しました。これを検査し、マーシャルは自分の胃には、胃潰瘍もピロリ菌も存在しないことを確認しました。胃壁が回復するのを待って、マーシャルは、66歳の慢性胃潰瘍の男性の胃袋から採取した「ピロリ菌の培養液」を飲み込みました。このときの体験を「生肉に似た少し嫌な臭いがした」と、マーシャルは後に語ります。マーシャルが期待したことは、このピロリ菌のせいで、実際に体の具合が悪くなることでした。人類史上、自分から積極的に胃潰瘍になろうとしたのは、マーシャルただ1人でしょう。もちろん、事前に予防策は取ってありました。つまり、実験許可が下りないとまずいので、病院の倫理委員会には伝えなかったし、自分の妻にも事後報告しかしなかったのです。

図.19 マーシャルは、仮説を立証するために、慢性胃潰瘍の患者から取り出したピロリ菌の培養液を飲み込んだ
「ピロリ菌の培養液」を飲んでから最初の数時間、マーシャルは腹部の蠕動が増えたのに気付きました。その後1週間は、何事もなく過ぎました。8日目の朝、マーシャルは少量の粘液を吐きました。2週間目には、妻がマーシャルの口臭に気付きました。また、マーシャルは頭痛がして、イライラするようになりました。10日目に、同僚がマーシャルの食道から胃へと胃カメラを入れると、胃潰瘍の前段階である重度の胃炎が見つかりました。マーシャルは大喜びで、「この胃炎から胃潰瘍が生じてくれれば、これから何年も論文の材料には事欠かないだろう」と思いました。
しかし、この実験について妻に話したところ、「抗生物質を飲むか、それとも家を出て1人で暮らすか」の厳しい選択を迫られてしまいました。ピロリ菌はアンモニアNH3を発生させるため、口臭がトイレのような臭いになるのです。妻は、マーシャルの口臭を酷く嫌がっていました。マーシャルは抗生物質を選びましたが、実際には、これは不必要でした。感染は、2週間後には自然に消失したからです。明らかに、マーシャルの免疫系が、ピロリ菌に打ち勝ったのです。このことは、ピロリ菌の蔓延の仕方とも矛盾がありません。現在では、世界の人口の約半数がピロリ菌に感染していると考えられていますが、その中で実際に潰瘍と診断されるのは、ピロリ菌感染者の2〜3%程度といわれています。
しかし、胃潰瘍が感染症だという説が、一般の医師たちにまで浸透するのには、さらに13年の年月が必要でした。何百万人もの患者が、胃腸の専門医や外科医の処置を定期的に必要としていたし、製薬業界も儲かっていたからです。特に製薬業界は、「胃炎が抗生物質によって数週間で回復する」という説を広めることには、ほとんど関心を示しませんでした。製薬業界は、場合によっては何年間も飲まなくてはならない「ザンタック」や「タガメット」などの胃酸分泌抑制薬で、非常に大きな利益を上げていたからです。当時、胃酸分泌抑制薬は、年間売り上げが10億ドルにも上り、世界の潰瘍治療薬市場は、1994年には80億ドルを超えていました。その間、何百万人もの患者が、間違った薬を処方されたり、不必要な手術を受けさせられたりしました。

図.20 ザンタックは、ヒスタミンのアンタゴニストとして作用し、胃酸分泌を抑制する
当初、批判者たちは、胃潰瘍が細菌による感染症だとする説を、全く信じていませんでした。胃潰瘍の原因は、心理的問題やストレスのせいだと、誰もが信じていたからです。胃の中に細菌がいるという説については、強酸性の中で細菌が生きられるはずがないとされました。恐らく決定的だったのは、当時マーシャルが研修医で、マーシャルもウォレンも胃腸科専門医ではなかったことでした。胃の専門家でもないのに、何が分かるのかという訳です。
専門家が一笑に付したその発見に対して、2005年にノーベル生理学・医学賞が授与されました。マーシャルの実験を契機に、他の病気についても、感染症ではないか見直そうという動きが起こりました。現在では、統合失調症や心臓発作、リウマチ、糖尿病についても、細菌やウィルスが影響している可能性を疑って、盛んに研究が行われています。しかし、これまでのところ、残念ながらこのような疑いで正しいと証明されたものは、ほとんどありません。
(4) 臭素
(i) 臭素Br2
「臭素(bromine)」は、ギリシア語の「悪臭(bromos)」を語源に持つ元素です。天然には単体のBr2として存在せず、地殻中に臭化物として存在します。臭化物イオンBr− は、海水の成分でもあります。一般的に「室温」とされる温度領域で、液体状態の安定元素は、水銀Hg(m.p.-38.8℃)と臭素Br2(m.p.-7.2℃)だけです。ちなみに、ガリウムGa(m.p.30℃)やセシウムCs(m.p.28℃)も、夏場の室温では、融解して液体になる元素です。
常温常圧では、臭素Br2は赤褐色の刺激臭のある液体です。臭素Br2の沸点は59℃なので、非常に蒸発しやすい性質を持ちます。臭素Br2を室温で放置すると、たちまち蒸発して、赤褐色の気体となります。

図.21 臭素Br2の単体は、赤褐色の刺激臭のある液体である
臭素Br2は、フッ素F2や塩素Cl2ほどではないものの、酸化力が強いので、人体に対しては猛毒です。皮膚に触れると腐食を引き起こすため、取り扱いには注意が必要です。また、臭素Br2は水に少し溶け、その一部が自己酸化還元反応して、臭化水素HBrと次亜臭素酸HBrOを生じます。
Br2 + H2O ⇄ HBr + HBrO
実験室で臭素Br2を発生させる場合は、臭化ナトリウムNaBr水溶液に塩素Cl2を吹き込みます。これは、酸化力の強さがCl2>Br2であり、次の化学反応式の逆反応より正反応の方が有利になるからです。工業的にも、臭化物イオンBr- を含む水溶液に酸性条件下で塩素Cl2を吹き込み、酸化された臭素Br2を蒸留精製することで製造しています。イスラエルの死海周辺の井戸水やアメリカ合衆国アーカンソー州の地下水には、臭化物イオンBr- が豊富に含まれることが知られ、この2カ国で世界の生産量の8割を占めます。
2NaBr + Cl2 → 2NaCl + Br2
また、有機化学の分野でも、臭素Br2は活躍しています。触媒なしで臭素Br2はアルケンに付加し、「ビシナル二ハロゲン化物」を与えます。この反応では、臭素Br2の赤褐色の脱色を伴うので、臭素Br2は有機化合物中の不飽和結合(C=C, C≡C)を検出するための、化学的試験としてよく用いられます。20世紀初頭、臭素Br2は有機化学の試薬として重要であり、相当量の需要がありました。しかし、当時は効率的な生産法が確立されていなかったので、この時代の臭素Br2の価格は、同質量の金Auよりも高価であったといいます。ちなみに、塩素Cl2でも同様の反応が起こりますが、塩素Cl2は気体でコントロールが難しいので、臭素Br2が好んで使われます(脂肪族炭化水素(アルケン)を参照)。

図.22 臭素Br2とアルケンの付加反応
臭素Br2は、一部の色素の中にも含まれています。地中海で取れるアッキガイ科の「シリアツブリガイ」という貝は、薄い黄緑色の液体を分泌します。この分泌液は臭素Brを含み、空気中で酸化されると「6,6’-ジブロモインジゴ」という紫色の色素となります。この色は、クレオパトラやローマ皇帝が愛したことから「皇帝紫(royal purple)」と呼ばれ、ローマ時代から貴重な紫色の色素でした。1万2,000個のシリアツブリガイから紫色の染料が1.5 gしかとれないほど貴重で、鮮やかな紫色の染料は人々を虜にしました。19世紀に「モーヴ」というアニリン系の色素が合成されるまでは、ほとんど唯一の紫色染料でした。西洋において、長らく紫色が高貴な色とされてきたのは、紫色染料が大変貴重であったためです。ちなみに、小中学校の理科で使うBTB(ブロモチモールブルー)も、臭素Brを含む色素です。

図.23 シリアツブリガイから得られる「皇帝紫」は、世界で最も高貴で美しい色といわれる
(ii) 臭化水素HBr
臭化水素HBrは、常温常圧下では、無色の刺激臭を持つ気体です。その水溶液は、強酸性の「臭化水素酸」です。臭化水素HBrは、臭化ナトリウムNaBrに濃硫酸H2SO4を加えて、加熱することで発生します。
NaBr + H2SO4 → NaHSO4 + HBr
(iii) 臭化カリウムKBr
臭化カリウムKBrは、臭化水素HBrと水酸化カリウムKOHの中和反応によって生成します。精神的な興奮状態や性欲を鎮める作用があるため、19世紀には興奮性の精神病の治療薬、鎮静剤、性欲抑制剤として用いられました。しかし、連用により体内に臭素Brが蓄積し、臭素中毒を引き起こすなど毒性があるため、現在ではこの用途でほとんど用いられません。今日では、抗てんかん薬として、イヌの治療薬として用いられるぐらいです。
HBr + KOH → KBr + H2O
(5) ヨウ素
(i) ヨウ素I2
「ヨウ素(iodine)」は、1811年にフランスの化学者であるベルナール・クールトアによって発見され、1813年にフランスの化学者であるジョセフ・ゲーリュサックによって新元素であることが確認されました。甲状腺ホルモンを合成するのに必要なため、ヒトにとっては必須の元素です。海水中に含まれるヨウ化物イオンI− を、海藻は濃縮して蓄積します。そこで、日本のように海藻を手軽に摂取できる国は問題ありませんが、海から遠く離れた国では、ヨウ素欠乏症が起こります。ヨウ素欠乏症は、直ちに甲状腺肥大につながります。大陸の中央部では、地理的にヨウ素Iが不足しやすいです。そこで、アメリカ合衆国では国の規定で、食塩には微量のヨウ化ナトリウムNaIが含ませてあります。これによって、甲状腺肥大を防いでいるのです。
表.4 食品100 g当たりのヨウ素含有量
|
食品 |
含有量〔µg/100 g〕 |
|
マコンブ(素干し) |
240,000 |
|
干しヒジキ |
47,000 |
|
昆布の佃煮 |
11,000 |
|
青海苔 |
2,800 |
|
焼き海苔 |
2,100 |
|
生ワカメ |
1,600 |
|
干し海苔 |
1,400 |
ヨウ素I2の単体は、常温常圧では、黒紫色の固体です。結晶は分子結晶ですが、金属のような光沢を持ちます。ヨウ素I2は室温で固体ですが、同族の臭素Br2と同じく、かろうじて固体でいるだけです。ヨウ素I2の固体をゆっくりと加熱すると、114℃で融解してすぐに蒸発し、紫色の濃密の蒸気になります。これは、ヨウ素I2が昇華性を持つためで、元素名もギリシア語の「紫(iode)」に由来します。日本語の「沃素」は、明治期にドイツ語の「ヨウ素(jod)」を「沃度(ようど)」と音訳したところからきており、漢字としての意味はありません。

図.24 ヨウ素I2は昇華性があり、紫色の濃密の蒸気になる
ヨウ素I2の反応性は、他のハロゲンの単体より穏やかで、酸化力を有するものの、それほど強くはありません。ヨウ素I2は、水にはあまり溶けませんが、ヨウ化カリウムKI水溶液にはよく溶けます。これは、次にようにヨウ素I2がヨウ化物イオンI− と錯体を形成するためです。
I2 + I− ⇄ I3−
一般的に「ヨウ素液」とは、ヨウ素ヨウ化カリウム水溶液のことを指し、ヨウ素I2の固体は黒紫色ですが、ヨウ素液は三ヨウ化物イオンI3− のために褐色です。ヨウ素液は、デンプンの指示薬として用いられ、ヨウ素デンプン反応が起こるために、青紫色を呈します。
この反応は、ヨウ素滴定にも利用されています。ヨウ素滴定では、ヨウ素I2の入ったコニカルビーカーに、チオ硫酸ナトリウムNa2S2O3などの還元剤をビュレットから滴下し、ヨウ素I2の物質量を定量的に求めます(酸化還元を参照)。この滴定の終点直前に、指示薬としてデンプンを加えると、ヨウ素デンプン反応によって、青紫色に呈色します。そして、ヨウ素I2がすべて消費されると、溶液の青紫色が無色になり、そこが終点となるのです。
I2 + 2S2O32− → S4O62− + 2I−

図.25 ヨウ素滴定では、ヨウ素I2によるヨウ素デンプン反応の青紫色の呈色が消えたときが終点となる
ちなみに、ヨウ素デンプン反応が起こる理由は、ヨウ素I2がデンプンのらせん構造の中に入り込んで、「電荷移動錯体(charge-transfer complex)」を作るためです。すると、デンプンからヨウ素I2へ電荷の移動が起こり、可視光領域に黄緑色付近の新しい吸収帯を生じます。ヨウ素デンプン錯体は、青紫色の補色である黄緑色の光をよく吸収するため、ヨウ素デンプン反応で青紫色を呈するのです。また、呈色しているヨウ素デンプン錯体を加熱すると、ヨウ素I2がデンプンのらせん構造から抜けるので、元の褐色に戻ります。

図.26 ヨウ素デンプン反応の原理
実験室的には、ヨウ素I2は、ヨウ化カリウムKI水溶液に塩素Cl2を吹き込むことで生成します。このとき、生成物のヨウ素I2は、反応物のヨウ化物イオンI− と錯体(三ヨウ化物イオンI3− )を作るので、反応液は褐色になります。この反応液にヘキサンなどの有機溶媒を加えて水層を抽出すると、水に溶けにくいヨウ素I2がヘキサンに溶けるので、ヘキサンは黒紫色になります。そして、ヨウ素I2を溶かしたヘキサンを留去すれば、ヨウ素I2を単離することができます。
2KI + Cl2 → 2KCl + I2

図.27 ヨウ素I2は無極性分子なので、水H2Oよりもヘキサンなどの有機溶媒に溶けやすい
「日本は資源のない国だ」とよくいわれますが、実はヨウ素I2だけは豊富です。世界第1位のチリ(66%)に続いて、世界第2位(31%)の輸出量を誇っています。その約8割は、千葉県で生産されており、千葉県単独で見ても、世界の生産量の1/4になります。千葉県の九十九里浜海岸一帯の地下には、海水の約2,000倍ものヨウ化物イオンI− が溶解している地下かん水が存在しており、それを汲み上げて、ヨウ素I2が生産されています。その製造方法は、実験室的な方法と同じで、ヨウ化物イオンI− に塩素Cl2などの酸化剤を反応させ、それを昇華させることで製造しています。千葉県のかん水に多量のヨウ化物イオンI− が含まれるのは、陸地がかつて海底にあったとき、海藻などの有機物が堆積し、これらに含まれるヨウ素Iが濃縮されて残ったためと考えられています。
表.5 ヨウ素の生産量と埋蔵量(2017年推定値)
|
国名 |
生産量 |
埋蔵量 |
|
チリ |
21,200 t |
700,000 t |
|
日本 |
10,600 t |
5,000,000 t |
|
トルクメニスタン |
500 t |
70,000 t |
|
アゼルバイジャン |
210 t |
170,000 t |
|
インドネシア |
15 t |
100,000 t |
|
アメリカ |
― |
250,000 t |
|
ロシア |
― |
120,000 t |
(ii) ヨウ化水素HI
ヨウ化水素HIは、常温常圧下では無色の刺激臭を持つ気体です。その水溶液は、強酸性の「ヨウ化水素酸」です。ヨウ化水素HIは、ヨウ化カリウムKIに濃硫酸H2SO4を加えて加熱するか、ヨウ素I2と水H2Oの混合物を冷却しながら、赤リンPを加えると生成します。
KI + H2SO4 → KHSO4 + HI
2P + 5I2 + 8H2O → 2H3PO4 + 10HI
・参考文献
1) 石川正明「新理系の化学(下)」駿台文庫(2005年発行)
2) 枝川義邦「身近なクスリの効くしくみ-薬理学はじめの一歩-」技術評論社(2010年発行)
3) 遠藤瑞己「化学と歴史のネタ帳 I. 酸とアルカリ」文彩堂出版(2024年発行)
4) 大東孝司「プラグマティック化学」河合出版(2017年発行)
5) 大宮信光「面白いほどよくわかる 化学」日本文芸社(2003年発行)
6) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
7) 桜井弘「元素118の新知識 引いて重宝、読んでおもしろい」講談社(2017年発行)
8) 左巻健男「面白くて眠れなくなる化学」PHP研究所(2012年発行)
9) 左巻健男「面白くて眠れなくなる元素」PHP研究所(2016年発行)
10) セオドア・グレイ「世界で一番美しい元素図巻」創元社(2011年発行)
11) トレヴァー・ノートン「世にも奇妙な人体実験の歴史」文藝春秋(2012年発行)
12) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)
13) レト.U.シュナイダー「狂気の科学-真面目な科学者たちの奇態な実験-」東京化学同人(2015年発行)