�E�_���Ҍ�
�y�ڎ��z
(i) �߃}���K���_�J���E��KMnO4���n�t�ɂ��H��
(1)�@�_���ƊҌ��Ƃ͉����H
�u�_������(oxidation)�v�́A�ł��g�߂ȉ��w������1�ł��B�Ⴆ�A������R����̂́A�L�@���������_�fO2�Ɣ������āA��_���Y�fCO2�␅H2O�Ȃǂɕω�����_�������ł��B���̂Ƃ��ɔ�������G�l���M�[�́A�M����̃G�l���M�[�ƂȂ��āA�O���ɕ��o����܂��B�܂��A�������i���K�т錻�ۂ��A�_��������1�ł��B�Ⴆ�A�SFe�͋�C���Ŏ_�fO2�␅H2O�Ɣ������āA�I�L�V���_���S(III)FeO(OH)�Ȃǂ̕��G�ȍ\���̉����������܂��B
4Fe�@�{�@2H2O�@�{�@3O2�@���@4FeO(OH)
�܂��A�u�Ҍ�����(reduction)�v�́A�g�߂ł́A�SFe�⓺Cu�Ȃǂ̂悭�ėp���������B����ꍇ�ɍs���鉻�w�����ł��B�n����ɑ��݂���SFe�⓺Cu�Ȃǂ̋����́A�ʏ�͍z�Β��Ŏ_�������邢�͗������ȂǂƂ��đ��݂��Ă���A���̂܂܂ł͗��p���邱�Ƃ��ł��܂���B�����ŁA�������܂ލz��n�z�F���ŊҌ����A�P�̋����ɂ���̂ł��B
Fe2O3�@�{�@3CO�@���@2Fe�@�{�@3CO2
Cu2S�@�{�@O2�@���@2Cu�@�{�@SO2
�@���̂悤�ɁA�_���ƊҌ��͐̂���g�߂ŋN�����Ă��������ł���A�l�ނ����߂Ď_���ƊҌ����`�����̂́A18���I�̂��Ƃł����B18���I�̌㔼�ɂ́A�ΊD��CaCO3���ǂɊ܂܂���_���Y�fCO2��A��C���ɑ��ʂɊ܂܂�钂�fN2�A��H2O�̑f�ƂȂ鐅�fH2�Ȃǂ̋C�̂����X�ƕ�������A��������Ă��܂����B�����������ŁA�t�����X�̉��w�҂ł���A���g���[�k�E���{�A�W�G�́A�ڂɌ����Ȃ��C�̂��܂߂āA���w�������l���Ȃ��Ă͂Ȃ�Ȃ��ƍl���܂����B�����ŁA���{�A�W�G�͔��������ׂĖ��e��̒��ōs���A�����O��ł̎��ʕω��𐳊m�ɑ��肵�܂����B����Ɖ��Ƃ������Ƃ��A�n�̎��ʂ������̑O��ŕω����邱�Ƃ��Ȃ������̂ł��B�u���ʕۑ��̖@��(law of conservation of mass)�v�̔����̏u�Ԃł����B���{�A�W�G�́A���̎������ʂ����ƂɁA�u�R�ĂƂ͋�C���Ɋ܂܂��_�f���R���������Ɖ������邱�Ƃł���v�ƒ����̂ł��B�����ă��{�A�W�G�́A���̂Ƃ��Ɏ_���ƊҌ������̂悤�ɒ�`���܂����B
�u�_���Ƃ͕������_�f�Ɖ������锽���ł���A�Ҍ��Ƃ͎_��������_�f�������锽���ł���v
(2) �_���ƊҌ��̒�`
�_���ƊҌ��̒�`�ɂ��ẮA���{�A�W�G�̒�`����n�܂�A���j�I�ɐF�X�ƕω������Ă��܂����B���݂ł́A���̂悤�ɓd�qe- �̋���ɂ���Ē�`����Ă��܂��B
�\.1 �_���ƊҌ��̒�`
|
�_��(�_�������)���� |
�Ҍ�(�Ҍ������)���� |
|
�d�q���������� ��) A�@���@A+�@�{�@e- |
�d�q�锽�� ��) A�@�{�@e-�@���@A- |
�܂�A�u�_���Ҍ�����(oxidation-reduction reaction)�v�ɂ����āA�d�qe- ����������(�d�qe- ���E�ӂɗ��锽��)���_�������ŁA�d�qe- �锽��(�d�qe- �����ӂɗ��锽��)���Ҍ������ɂȂ�̂ł��B�悭�_���Ҍ������ɂ����āA�u�_�f���qO�Ɖ������锽�����_�������ŁA�_�f���qO�������������Ҍ������ł���v�ȂǂƂ����A18���I���̌Â���`�������ɐ�������邱�Ƃ�����܂��B�������A����ł͔����̐����ɕs�\���ł��B�����A�_�fO2���ŒY�fC���R�Ă��锽���́A�Y�fC���_�f���qO������Ă���̂ŁA18���I������`�ɂ��Ǝ_�������ł��B
C�@�{�@O2�@���@CO2
�������A�Y�fC���_�fO2���ł��Ȃ��A���f�K�XCl2���ŔR�Ă�������ǂ��Ȃ�ł��傤���B�������́A���̂悤�ɕ\���܂��B
C�@�{�@2Cl2�@���@CCl4
���Ƃ��Ɓu�_���v�Ƃ́A�u�R�Ă��锽���v�ƒ�`����Ă����̂ł�����A���̔R�Ĕ������A�ԈႢ�Ȃ��_�������ł���͂��ł��B�܂�A�_�������Ƃ́A�_�f���qO���������锽�������Ƃ͌���Ȃ��̂ł��B����́A�Ҍ��������R��ł���A�_�f���qO�����������������A�Ҍ������Ƃ͌���܂���B�_���Ҍ����_�f���qO�̋����ōl���Ă��܂��ƁA�_�f���qO���ւ���Ă��Ȃ������̎_���Ҍ����`�ł��Ȃ��Ȃ��Ă��܂��̂ł��B�����œo�ꂵ���̂��A�d�qe- �̋���ɂ���āA�_���Ҍ����`����Ƃ������̂ł��B�_���Ҍ�������d�qe- �̋���ɂ���čl����ƁA�S�̂̔����ł́A�_�������ɂ���Ď���ꂽ�d�q���A�Ҍ������̓d�q�ɒ��ڎg���邱�ƂɂȂ�܂��B
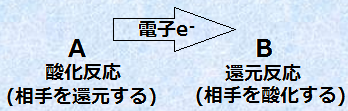
�}.1 �_���ƊҌ��̓d�qe- �̈ړ�
�܂�A�_���Ҍ������ɂ����āA�d�qe- �̈ړ��̗��ꂩ�炷��A�_���ƊҌ��͓����ɋN���锽���Ȃ̂ł��B����āA��̉��f�K�XCl2���ŒY�fC���R�Ă��锽���ł́A�Y�fC���猩��A���̔����́u�Y�fC�̎_�������v�ł����A���fCl2�̗��ꂩ�猩��A���̔����́u���fCl2�̊Ҍ������v�ɂȂ�̂ł��B���̂悤�ɍl���邱�ƂŁA�l�X�Ȕ������_���Ҍ������Ƃ��āA�L��������悤�ɂȂ�܂����B�悭�_���Ҍ��������A�_�f���qO�␅�f���qH�̈ړ��ɂ���Đ�������l�����܂��B�������A���̍l�������ł́A����̉��w�ɒʗp���܂���B�_���Ҍ������Ƃ́A�d�qe- �̋���ɂ��u�d�q�ړ�����(electron transfer reaction)�v�Ȃ̂ł��B
(3) �_����
�@�_���Ҍ������Ƃ́A�d�q�ړ������̂��Ƃł��B�������A�����ɂ́A����e- �̈ړ��̐��ۂ̔���́A�����P���ł͂���܂���B�Ⴆ�A���Ɏ�����H2O�̐��������́A���fH2�̎_�������ɂȂ�܂��B
2H2�@�{�@O2�@���@2H2O
�������A���̔����́A�d�q�ړ������̊ϓ_���猩��ƁA�d�q���ړ����Ă���̂��ǂ������A�肩�ł͂Ȃ��̂ł��B�������fH2���_�����ꂽ�Ƃ����̂Ȃ�A���fH2�͐��f�C�I��H+ �ƂȂ��āA�d�qe- ���_�fO2�Ɏn���A�_�fO2�͐��fH2����d�qe- ������āA�_�����C�I��O2- �ɂȂ�͂��ł��B����ǂ������ɂ́A��H2O�͂��̂悤�Ȑ��f�C�I��H+ �Ǝ_�����C�I��O2� �ɂ��C�I�����̉������ɂȂ��đ��݂��Ă͂��炸�A��H2O�͋��L�������̉������Ƃ��đ��݂��Ă��܂��B
�����ŁA1938�N�ɃA�����J�̉��w�҂ł���E�F���f������e�B�}�[�́A�_���Ҍ������ɂ����āA�e�������q�̊ԂŋN����d�qe- �̋���̗l�q����₷���������闝�_�Ƃ��āA�u�_����(oxidation number)�v�Ƃ����T�O����܂����B�_�����́A�Ώی��q�̓d�q���x���A�P�̂ł���Ƃ��Ɣ�r���āA�ǂ̒��x�ł��邩��m��ڈ��̒l�̂��Ƃł��B�Ⴆ�A�_���Ƃ́A���q���d�q���������Ƃł��邩��A�P�̂ł������Ƃ����d�q���x�͒Ⴍ�Ȃ��ėz���������Ȃ�܂��B����ɑ��āA�Ҍ��Ƃ́A���q���d�q�邱�Ƃł��邩��A�P�̂ł������Ƃ����d�q���x�͍����Ȃ��ĉA���������Ȃ�܂��B
�܂�A���錴�q���_����Ԃɂ���ꍇ�A�d�q���x�͒Ⴍ�Ȃ��Ă���̂ŁA���̌��q�͕����I�ɐ��d�ׂ�тт邱�ƂɂȂ�A���錴�q���Ҍ���Ԃɂ���ꍇ�A�d�q���x�������Ȃ��Ă���̂ŁA���̌��q�͕����I�ɕ��d�ׂ�тт邱�ƂɂȂ�̂ł��B���̉ߏ�d�ׂ̂��Ƃ��A�_�����ƌĂ�ł���̂ł��B���錴�q���_����Ԃɂ���Ƃ��́A�_�����͐��̒l�����A�t�ɊҌ���Ԃɂ���Ƃ��́A�_�����͕��̒l�����܂��B�_�����́A��ʓI�Ɉȉ��̂悤�ɂ��ċ��߂܂��B
|
�@ �P���q�C�I���̏ꍇ�ɂ����ẮA���̃C�I���������̂܂_�����ƂȂ� �A �P�̂̌��q�̎_������0�Ƃ��� �B �d�C�I�ɒ����̉������ɂ����ẮA�\�������̎_�����̑��a��0�ł��� �C ���L�����łł��������ł́A���L�d�q��d�C�A���x�̑傫�����̌��q�ւ��ׂĊ��蓖�Ă��Ƃ��Ɏc��d�ׂ��_�����Ƃ��� |
�_�����@���@�������q�ɂ����鉿�d�q�̐��@�|�@���L���Ă���d�q�̐�
�����ŗ��Ƃ��āA���^��CH4�̒Y�f���qC�̎_�������l���Ă݂܂��B���^��CH4�́A�Y�f���qC���܂������̒��ŁA�Y�f���qC���ł��Ҍ����ꂽ�\�������Ă��܂��B�Y�f���qC�ߖT�̓d�q���x�͍ő�ƂȂ��Ă���A���̎_������-IV�ł��B���^��CH4�͎_������Ă����ɏ]���āA���̂悤�ɕω����Ă����܂��B
���^��CH4�@���@���^�m�[��CH3OH�@���@�z�����A���f�q�hHCHO�@���@�M�_HCOOH�@���@��_���Y�fCO2
���^��CH4�̎_�������ɔ����A�Y�f���qC�ߖT�̓d�q���x�͌������Ă����܂��B�����āA�Y�f���qC���ł��_�����ꂽ�\���ł����_���Y�fCO2�ł́A���̎_�����́{IV�ƂȂ�܂��B�܂�A�_���������N����Ǝ_�����͑������A�Ҍ��������N����Ǝ_�����͌�������̂ł��B
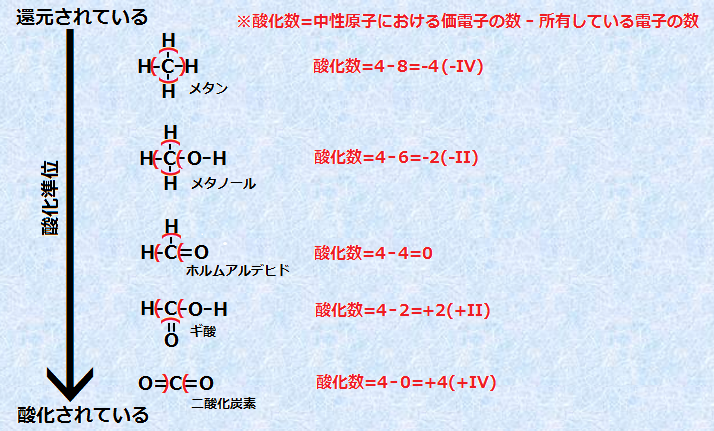
�}.2 �Y�f�������̎_����
�_�����́A�}.2�̂悤�ɍ\�����������A�u(�v�Ő����������A�u�_�������������q�ɂ����鉿�d�q�̐��|���L���Ă���d�q�̐��v���A�ߏ�d�ׂ����߂�Ƃ����̂���{�I�ȕ��@�ł��B�������A�\�������������������Ƃ����͖̂ʓ|�ł��邵�A�\���̕�����Ȃ��������ł́A��������o�Ȃ��Ȃ��Ă��܂��܂��B���̂��߁A���������ȕւȕ��@���l����K�v������܂��B�����ŁA�_�����̋��ߕ��ɂ����ẮA�ȉ��̋K�����߁A�㐔�v�Z�ɂ���Ď_���������߂邱�Ƃ������ł��B
|
�K�� |
�� |
|
�@ �����������̎_�����̑��a��0�Ƃ��� |
H2O��NH3�ł́A�e���q�̎_�����̑��a��0�Ƃ��� |
|
�A �����q�C�I�����\�����錴�q�̎_�����̑��a�́A���̃C�I���̉����ɓ����� |
MnO4 - �ł́A�e���q�̎_�����̑��a�́|1�Ƃ��� |
|
�B ���������̐��f���q�̎_�����́{I�A�_�f���q�̎_�����́|II�Ƃ��� |
�_������H=�{I�AO=�|II�Ƃ���(�������A��O����) |
|
�C 1�����f�̎_�����́{I�A2�����f�̎_�����́{II�Ƃ��� |
Na���{I�AK=�{I�AMg=�{II�ACa���{II�ABa=�{II�Ƃ��� |
���̂悤�ȋK���ɏ]���đ㐔�v�Z������ƁA���������\�����������Ȃ��Ă��A�e�ՂɎ_���������߂邱�Ƃ��ł��܂��B���̂悤�Ɏ_���������߂邱�Ƃ��ł���̂́A�قƂ�ǂ̉������ɂ����āA�\�����f�̒��Ŏ_�f���qO�͍ł������d�C�A���x�������A���f���qH���܂�1����2���̌��f(Na�AK�AMg�ACa�ABa)�͍ł��Ⴂ�d�C�A���x��������ł��B�܂�A�_�f���qO�͍ł��Ҍ����ꂽ�\�������A���f���qH�͍ł��_�����ꂽ�\�������ƁA���炩���ߌ��߂Ă��܂��̂ł��B
�������A���ׂĂ̌��f�̒��Ŏ_�f���qO�͍ő�̓d�C�A���x������ł͂Ȃ����A���ׂĂ̌��f�̒��Ő��f���qH�͍ŏ��̓d�C�A���x������ł��Ȃ��̂ŁA���Ȃ��炸��O�����݂��܂��B�Ⴆ�A�ߎ_�����fH2O2�␅�f���i�g���E��NaH�Ȃǂ̉������ɂ����ẮA���̋K�������Ă͂܂�܂���B

�}.3 �ߎ_�����fH2O2�Ɛ��f���i�g���E��NaH�̎_����
�ߎ_�����fH2O2�̏ꍇ�́A�_�f���q���m��-O-O-�̌���������A�����ŋ��L�d�q�̓d�q��2�������邽�߁A�_�fO�̎_�������|I�ƂȂ�܂��B�܂��A���f���i�g���E��NaH�̏ꍇ�́A�i�g���E��Na�̕������fH������d�C�A���x�����������߁A�i�g���E��Na�̎_�������{I�ƂȂ�A���fH�̎_�������|I�ƂȂ�̂ł��B
����ɁA�t�b�fF�̂悤���_�fO�����d�C�A���x�̑傫�����q���A�_�f���qO�Ɍ������Ă���ꍇ�����ӂ��K�v�ł��B�Ⴆ���A��t�b���_�fOF2�́A��H2O�̐��f���qH���t�b�f���qF�ɒu�������\�������Ă��܂��B���̉������ɂ����ẮA�ő�̓d�C�A���x�����t�b�fF�ɋ��L�d�q����̂���邱�ƂɂȂ�̂ŁA�t�b�fF�̎_�������|I�A�_�fO�̎_�������{II�ƂȂ�܂��B
(4) �_���܂ƊҌ���
�_���ƊҌ��͓����ɋN���锽���ł����A�����ɂ���ẮA�F�X�ȑ�����������܂��B�Ⴆ�A���Ɏ��������ŁAA�ł͎_���������AB�ł͊Ҍ����������ꂼ��N�����Ă��܂��B
A�@�{�@B�@���@A+�@�{�@B-
(�_������) A�@���@A+�@�{�@e-
(�Ҍ�����) B�@�{�@e-�@���@B-
�܂�A�S�̂̔����ł́AA���d�qe- ��B�ɒ��ڎn���Ƃ����A�d�q�ړ�����(�_���Ҍ�����)���N�����Ă���̂ł��B�����ŁA���ʁu�_�������v���Ƃ��u�Ҍ������v���Ƃ������Ƃ��A����́u�_������锽���v�Ɓu�Ҍ�����锽���v�ł����āA����̌��q�܂��͕��q�Ɏ��_��u�������̂ł��B�������A���̂悤�ɑS�̂̔����߂Ă��ƁA���邱�ƂɋC���t���܂��B����́A���炪�_�������Ƃ��͑�����Ҍ����A���炪�Ҍ������Ƃ��͑�����_������Ƃ������Ƃł��B���̂悤�ɁA���_��̕����ɒ�߂��Ƃ��A���肩��d�q��D��������_�����镨�����u�_����(oxidant)�v�Ƃ����A����ɓd�q��^��������Ҍ����镨�����u�Ҍ���(reductant)�v�Ƃ����܂��B�_�����g�͊Ҍ��������N����̂ŁA�_�����͌����������ŁA�Ҍ����g�͎_���������N����̂ŁA�_�����͑������܂��B
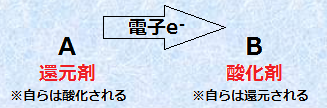
�}.4 �Ҍ��܂Ǝ_����
�����ŁA��\�I�ȊҌ��܂Ǝ_���܂��A���̕\.2�Ɏ����܂��B���̕\�Ɏ����������炢�́A�Œ���o���Ă����܂��傤�B
�\.2 ��\�I�ȊҌ��܂Ǝ_����
|
|
�Ҍ���(reductant) |
�Ҍ���(oxidant) |
|
�P �� |
����(K�ACa�ANa���) ���fH2 �Y�fC |
�n���Q��(F2�ACl2�ABr2�AI2) �_�fO2 �I�]��O3 |
|
�� �� �� |
��_���Y�fCO �O���R�[�XC6H12O6 �V���E�_H2C2O4 �������fH2S ��_������SO2 �V���E�_�C�I��C2O42- ���E����I- �S(II)�C�I��Fe2+ �`�I���_�C�I��S2O32- |
�_���}���K��(IV) MnO2 �Ɏ_HNO3 �M�Z���_H2SO4 �ߎ_�����fH2O2 �߃}���K���_�C�I��MnO4- ��N�����_�C�I��Cr2O72- |
�܂��A�\.2�Ɏ����Ҍ��܂���ю_���܂ŁA���ӂ��ׂ�����������������܂��B����(i)�`(iv)���Q�Ƃ��Ă��������B
(i) �}���K��Mn�̉������ɂ���
�߃}���K���_�C�I��MnO4- �́A�t���ɂ���Ď_���͂̋������ς���Ă��܂��B�t�����_���̏����ł́A�߃}���K���_�C�I��MnO4- �͋��͂Ȏ_���܂Ƃ��č�p���āA������̓}���K��(II)�C�I��Mn2+ �ƂȂ�܂��B�������A�t���������`����̏����ł́A�߃}���K���_�C�I��MnO4- �͏\���Ȏ_���͂��ł����ɁA�����͓�_���}���K��MnO2�Ŏ~�܂��Ă��܂��܂��B
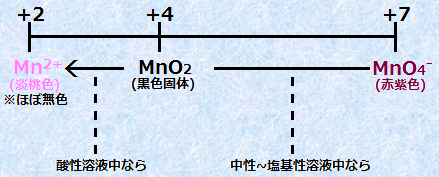
�}.5 �t���ɂ��}���K��Mn�̉������̎_���͂̕ω�
(�_���n�t���ł�)MnO4-�@�{�@8H+�@�{�@5e-�@���@Mn2+�@�{�@4H2O
(�����`����n�t���ł�)MnO4-�@�{�@2H2O�@�{�@3e-�@���@MnO2�@�{�@4OH-
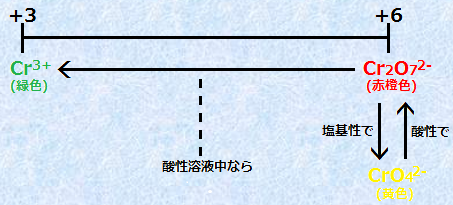
(ii) �N����Cr�̉������ɂ���
��N�����_�C�I��Cr2O72- �́A�t�����_�������ł́A���͂Ȏ_���܂Ƃ��ē����܂��B�������A�t������������ɂȂ�ƁA�N�����_�C�I��CrO42- �ɂȂ�A�����_����p�������Ȃ��Ȃ�܂��B
�}.6 �t���ɂ��N����Cr�̉������̎_���͂̕ω�
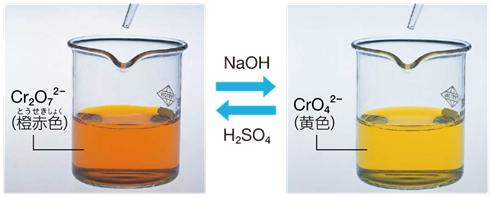
�Ȃ��A���n�t�ł́A��N�����_�C�I��Cr2O72- �ƃN�����_�C�I��CrO42- �͉��w���t�̊W�ɂ���A�t���̎_���x�������Ƃ��́A�Ԟ�F�̓�N�����_�C�I��Cr2O72- ���D���ɂȂ�A�t���̎_���x���Ⴍ�Ȃ�ƁA���F�̃N�����_�C�I��CrO42- ���D���ɂȂ�܂��B�܂��A��N�����_�C�I��Cr2O72- �ƃN�����_�C�I��CrO42- �́A����Cr�̎_�������{VI�Ȃ̂ŁA���̉��w���t�͎_���Ҍ������ł͂���܂���B
2CrO42-�@�{�@2H3O+�@⇄�@Cr2O72-�@�{�@3H2O
(�_���n�t���ł�) 2CrO42-�@�{�@2H+�@���@Cr2O72-�@�{�@H2O
(����n�t���ł�) Cr2O72-�@�{�@2OH-�@���@2CrO42-�@�{�@H2O
�}.7 ��N�����_�C�I��Cr2O72- �ƃN�����_�C�I��CrO42- �̉��w���t
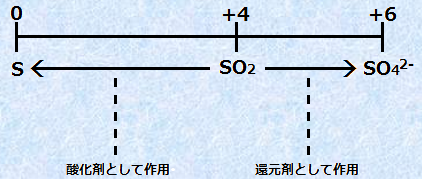
(iii) ��_������SO2�ɂ���
�@��_������SO2�́A�ʏ�͊Ҍ��܂Ƃ��ē����܂��B�������A�������fH2S�Ȃǂ̓�_������SO2���������Ҍ��͂��������Ɣ�������Ƃ��́A�_���܂Ƃ��ē����܂��B
�}.8 �_���܂Ƃ��Ă�������_������SO2
��) SO2�@�{�@2H2S�@���@3S�@�{�@2H2O
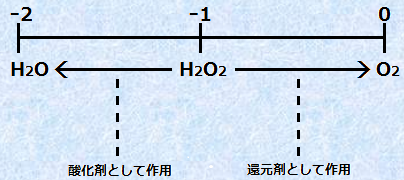
(iv) �ߎ_�����fH2O2�ɂ���
�@�ߎ_�����fH2O2�́AO-O�����������Ă��邽�߁A�_�fO�̎_�����́|I�ł��B�_�fO�̎�蓾��_�����̒��ł́A�ߎ_�����fH2O2�̎_�fO�͒��Ԃ̏�Ԃɂ���A����ȁ|II�̎_�����ɂȂ낤�Ƃ���X���������̂ŁA�ʏ�͎_���܂Ƃ��ē����܂��B�������A�߃}���K���_�C�I��MnO4- ���N�����_�C�I��Cr2O72- �Ȃǂ̋����_���͂��������Ɣ�������Ƃ��́A�Ҍ��܂Ƃ��ē����܂��B
�}.9 �Ҍ��܂Ƃ��Ă������ߎ_�����fH2O2
��) 5H2O2�@�{�@2MnO4-�@�{�@6H+�@���@5O2�@�{�@2Mn2+�@�{�@8H2O
�@���̂悤�ɁA�ߎ_�����fH2O2���߃}���K���_�C�I��MnO4- �ɑ��Ă͊Ҍ��܂Ƃ��ē����̂ŁA�_���͂̋�����H2O2��MnO4- �ł���Ɛ������Ă��镶���������܂��B�܂�A�u�ߎ_�����fH2O2���߃}���K���_�C�I��MnO4- ���ア�_���܂Ȃ̂ŁA�߃}���K���_�C�I��MnO4- �ɑ��Ă͊Ҍ��܂Ƃ��ē����v�Ƃ��������ł��B���̐������A����2�̓_�Ō�肪����܂��B
�@�܂�1�ڂ́A�_���Ҍ��������N���邩�ǂ������A�_���͂������͊Ҍ��͂̋����Ŕ�r���Ĕ��f����Ƃ��́A���ӂƉE�ӂ̕����Ŕ�ׂȂ���Ȃ�Ȃ��Ƃ������Ƃł��B�Ⴆ�A���̎_���Ҍ��������N���闝�R�́A�_���͂̋�����Cl2��Br2������ł��B���̔������N���闝�R���A�u���fCl2�͏L�����C�I��Br- ��苭���_���܂�����v�Əq�ׂ�͕̂s�K�ł��B�܂�A�ߎ_�����fH2O2���߃}���K���_�C�I��MnO4- �ɑ����Ҍ��܂Ƃ��ē����̂́A�u�߃}���K���_�C�I��MnO4- �͎_�fO2��苭���_���܂������v�Ƃ������Ƃł��B
Cl2�@�{�@2Br-�@���@2Cl-�@�{�@Br2
�@������2�ڂ́A���ۂ̎_���͂�H2O2��MnO4- �ŁA�ߎ_�����fH2O2�͉߃}���K���_�C�I��MnO4- ���������_���܂ł���Ƃ������Ƃł��B�ߎ_�����fH2O2�̎_���͂����܂苭���Ȃ����̂ƍl���Ă���l�����ɑ����̂ł����A�W���d�ɓd��(�C�I�����X�����Q��)�̒l������ƁA�_���܂Ƃ��Ẳߎ_�����fH2O2�̕W���d�ɓd�ʂ�1.763 V�ŁA���}���K���_�C�I��MnO4- ��1.51 V�����傫���A�_���͂�H2O2��MnO4- �ƂȂ�܂��B
�\.3 ��ȕ����̕W���d�ɓd�ʁi�\�̏㑤�̕����قǎ_���͂������j
|
���� |
�_���� ⇄ �Ҍ��� |
�W���d�ɓd�� |
|
�t�b�f |
F2�@�{�@2e-�@⇄�@2F- |
�{2.87 V |
|
�I�]�� |
O3�@�{�@2H+�@�{�@2e-�@⇄�@O2�@�{�@H2O |
�{2.075 V |
|
�ߎ_�����f |
H2O2�@�{�@2H+�@�{�@2e-�@⇄�@2H2O |
�{1.763 V |
|
�_����(IV) |
PbO2�@�{�@4H+�@�{�@SO42-�@�{�@2e-�@⇄�@PbSO4�@�{�@2H2O |
�{1.698 V |
|
��(III)�C�I�� |
Au3+�@�{�@3e-�@⇄�@Au |
�{1.52 V |
|
�߃}���K���_�C�I���i�_���j |
MnO4-�@�{�@8H+�@�{�@5e-�@⇄�@Mn2+�@�{�@4H2O |
�{1.51 V |
|
���f |
Cl2�@�{�@2e-�@⇄�@2Cl- |
�{1.396 V |
|
�j�N�����_�C�I�� |
Cr2O72-�@�{�@14H+�@�{�@6e-�@⇄�@2Cr3+�@�{�@7H2O |
�{1.36 V |
|
�_���}���K��(IV) |
MnO2�@�{�@4H+�@�{�@2e-�@⇄�@Mn2+�@�{�@2H2O |
�{1.23 V |
|
�L�f |
Br2�@�{�@2e-�@⇄�@2Br- |
�{1.0874 V |
|
�Ɏ_�C�I�� |
NO3-�@�{�@4H+�@�{�@3e-�@⇄�@NO�@�{�@2H2O |
�{0.957 V |
|
��(I)�C�I�� |
Ag+�@�{�@e-�@⇄�@Ag |
�{0.7991 V |
|
�_�f |
O2�@�{�@2H+�@�{�@2e-�@⇄�@H2O2 |
�{0.685 V |
|
�߃}���K���_�C�I���i�����j |
MnO4-�@�{�@2H2O�@�{�@3e-�@⇄�@MnO2�@�{�@4OH- |
�{0.60 V |
|
���E�f |
I2�@�{�@2e-�@⇄�@2I - |
�{0.5355 V |
|
��(II)�C�I�� |
Cu2+�@�{�@2e-�@⇄�@Cu |
�{0.340 V |
|
���f�C�I�� |
2H+�@�{�@2e-�@⇄�@H2 |
�{0.0000 V |
|
��(II)�C�I�� |
Pb2+�@�{�@2e-�@⇄�@Pb |
�|0.1263 V |
|
�S(II)�C�I�� |
Fe2+�@�{�@2e-�@⇄�@Fe |
�|0.44 V |
|
�A���~�j�E���C�I�� |
Al3+�@�{�@3e-�@⇄�@Al |
�|1.676 V |
|
�i�g���E���C�I�� |
Na+�@�{�@e-�@⇄�@Na |
�|2.714 V |
|
���`�E���C�I�� |
Li+�@�{�@e-�@⇄�@Li |
�|3.045 V |
�@����ł́A�ǂ����ĉߎ_�����fH2O2���߃}���K���_�C�I��MnO4- �ɑ��Ă͊Ҍ��܂Ƃ��ē����̂��Ƃ����ƁA��ɂ��������܂������A�_���͂�MnO4- ��O2������ł��B�����̐l�́A�ߎ_�����fH2O2���Ҍ��܂Ƃ��ē����ꍇ�́A�_���܂��߃}���K���_�C�I��MnO4- ���N�����_�C�I��Cr2O72- �̂Ƃ��������ƈËL���Ă��܂����A���ۂ��͎_����(IV) PbO2�≖�fCl2�ȂǁA�������̕������ߎ_�����fH2O2�ɑ��Ď_���܂Ƃ��ē����܂��B
(5) �_���Ҍ������̔������̍���
�_���Ҍ������́A�d�q�ړ������ł��B�������AA�{B��A+ �{B- �̂悤�ȉ��w�������ł́A�ꌩ����Ɠd�qe- �̈ړ��̗l�q���悭������܂���B�����ŁA�_���܂ƊҌ��܂̓d�qe- �̋���̗l�q���AB�{e- ��B- ��A��A+�{e- �̂悤�ɕʁX�ɕ\���������A�u��������(half reaction formula)�v�Ƃ����܂��B���̎�������A1 mol�̎_���܂܂��͊Ҍ��܂�����d�qe- �̕����ʂ��A�����ɕ�����̂ł��B��ʓI�ɔ��������́A�ȉ��̂悤�ɂ��č쐬���܂��B
|
�@ �_���܁E�Ҍ��܂��A������ɉ��ɕω����邩�����o�� �A ���ӂ̎_�f���qO�̐���H2O�ō��킹�� �B ���ӂ̐��f���qH�̐���H+ �ō��킹�� �C ���ӂ̓d�ׂ̃o�����X���l����e- �������� |
�Ⴆ�A�߃}���K���_�C�I��MnO4- �̎_�����n�t���ɂ����锼�������́A���̂悤�ɂ��č쐬�ł��܂��B
�@ MnO4-�@���@Mn2+
�A MnO4-�@���@Mn2+�@�{�@4H2O
�B MnO4-�@�{�@8H+�@���@Mn2+�@�{�@4H2O
�C MnO4-�@�{�@8H+�@�{�@5e-�@���@Mn2+�@�{�@4H2O
�������������ɂ������āA�C�̒i�K�ł́A���ӂ̓d�ׂ̃o�����X���l���āA�d�qe- ��������̂��ԈႢ���Ȃ����m�ł��B�������A���̍쐬�Ɋ���Ă����Ȃ�A�_�����̕ω��Ƌ���d�q���Ƃ��Ή����Ă��邱�Ƃ����܂��Ĕ������������ƁA���_���Ҍ������̗������[�܂�ł��傤�B�Ⴆ�A�߃}���K���_�C�I��MnO4- ���_���܂Ƃ��ē����Ƃ��A�}���K��Mn�̎_�������{VII�����{II�ɕω����܂����A���̕ω��ɍ��킹�āA1 mol�̉߃}���K���_�C�I��MnO4- ��5 mol�̓d�qe- �����܂��B�_���Ҍ������ł́A�d�qe- �̈ړ����K�������̂ŁA���̂悤�Ɏ_�����̕ω��Ƌ���d�q���͓������Ȃ�܂��B
�Ȃ��A���������́A�_���܂ƊҌ��܂�������ɂǂ̂悤�ȕ����ɂȂ�̂����������Ă��Ȃ��ƁA�ꂩ���邱�Ƃ��ł��܂���B�����ŁA���̕\.4�Ɏ�ȊҌ��܂Ǝ_���܂̔����O�Ɣ�����̕ω��������܂��B������o���Ă����A���������͊ȒP�ɍ�邱�Ƃ��ł��܂��B
�\.4 ��ȊҌ��܂Ǝ_���܂̔����O�Ɣ�����̕ω�
|
��ȊҌ��܂̔����O�Ɣ�����̕ω� |
��Ȏ_���܂̔����O�Ɣ�����̕ω� |
||
|
�����P�� �V���E�_ �������f ��_������ ���E�����C�I�� �S(II)�C�I�� �`�I���_�C�I�� |
�@M�@���@Mn+ H2C2O4�@���@2CO2 H2S�@���@S SO2�@���@SO42- 2I-�@���@I2 Fe2+�@���@Fe3+ 2S2O32-�@���@S4O62- |
�_�f �n���Q�� �I�]�� �_���}���K��(IV) �Z�Ɏ_ ��Ɏ_ �M�Z���_ �ߎ_�����f �߃}���K���_�C�I�� �߃}���K���_�C�I�� ��N�����_�C�I�� |
O2�@���@2H2O X2�@���@2X- O3�@���@O2�@�{�@H2O(�_�����n�t��) MnO2�@���@Mn2+(�_�����n�t��) HNO3�@���@NO2 HNO3�@���@NO H2SO4�@���@SO2 H2O2�@���@H2O(�_�����n�t��) MnO4-�@���@Mn2+(�_�����n�t��) MnO4-�@���@MnO2(�����`������n�t��) Cr2O72-�@���@2Cr3+(�_�����n�t��) |
�������A���������������珑���Ă��A���w�������������Ȃ���A�_���Ҍ������������Ɋw���Ƃɂ͂Ȃ�܂���B�����ŁA�_���Ҍ������̉��w�������́A�_���܂ƊҌ��܂̔������������Ƃɂ��āA���̂悤�ɍ쐬���܂��B
|
�@ �_���܂�e- ����锼�������ƊҌ��܂�e- ��^���锼�����������ꂼ�ꏑ�� �A�u�Ҍ��܂̗^����e- ��mol���_���܂̎��e- ��mol�v���Ae- �̌W���𗼕ӂœ��������āA2�̔��������𑫂���e- ����������(�C�I���������̊���) �B �������̊e�C�I���̑C�I���𗼕ӂɉ����Ď�������(���w�������̊���) |
��Ƃ��āA���_H2SO4�������Ď_���ɂ����߃}���K���_�J���E��KMnO4���n�t�ɁA�ߎ_�����fH2O2���������Ƃ��ɋN���锽���̉��w�����������܂��B���̔����ł́A�߃}���K���_�C�I��MnO4- ���_���܁A�ߎ_�����fH2O2���Ҍ��܂Ƃ��Ĕ������܂��B���������́A���̒ʂ�ł��B
MnO4-�@�{�@8H+�@�{�@5e-�@���@Mn2+�@�{�@4H2O ���(i)
H2O2�@���@O2�@�{�@2H+�@�{�@2e- ���(ii)
�d�qe- �̌W���𑵂��ď������邽���A(i)�~2�{(ii)�~5�̂悤�Ɍv�Z������������ƁA�_���Ҍ������̃C�I���������������܂��B
2MnO4-�@�{�@16H+�@�{�@5H2O2�@���@2Mn2+�@�{�@8H2O�@�{�@5O2�@�{�@10H+
�� 2MnO4-�@�{�@6H+�@�{�@5H2O2�@���@2Mn2+�@�{�@5O2�@�{�@8H2O ����C�I���������̊���
���n�t�ɃC�I�������݂��Ă��Ă��A���n�t�S�̂Ƃ��Ă͒������ۂ���Ă���̂ŁA�e�C�I���Ƀy�A�ƂȂ�C�I���𑫂��āA���w���������쐬���܂��B���ڂ���̂́A�C�I���������̍��ӂɂ��锽�����̃C�I���ł��B���̎_���Ҍ������̍��ӂ�2MnO4- ��6H+ �̑C�I���́A���ꂼ��2K+ ��3SO42- �ł��B���f�C�I��H+ �̑C�I������������ł����A���_H2SO4�������Ď_�������ɂ��Ă��邱�Ƃ��v���o���Ă��������B�����āA���ӂ�2K+ ��3SO42- ��������ƁA���ӂ̃C�I���������āA�_���Ҍ������̉��w�������������܂��B
2KMnO4�@�{�@5H2O2�@�{�@3H2SO4�@���@K2SO4�@�{�@2MnSO4�@�{�@5O2�@�{�@8H2O ������w�������̊���
(6) �_���Ҍ��H��
�_���Ҍ��������N�����₷�������̔Z�x�́A�_���Ҍ������𗘗p���āA���߂邱�Ƃ��ł��܂��B���Ȃ킿�A�_���Ҍ������ł́A�Ҍ��܂��^����d�qe- �̕����ʂƎ_���܂����d�qe- �̕����ʂ����������Ƃ��A�u�_���Ҍ��H��(oxidation-reduction titration)�v�ɂ���āA�Z�x�����肷�邱�Ƃ��ł���̂ł��B
�Ҍ��܂��^����e- ��mol = �_���܂����e- ��mol
�����ł́A���a�H��ȂǑ��̓H��Ɠ��l�ɁA�z�[���s�y�b�g��r�����b�g�Ȃǂ̃K���X�����g���Ď������܂��B�������A���a�H��Ƃ͈قȂ�A�����̊����_��m�邽�߂̎w�����܂�Ȃ��̂ŁA��������͌����Ă��܂��B
(i) �߃}���K���_�J���E��KMnO4���n�t�ɂ��H��
�@�Z�x���m�̊Ҍ��܂��z�[���s�y�b�g�Ő��m�Ɏ��A�\���ʂ̊_H2SO4����ꂽ�R�j�J���r�[�J�[�ֈڂ��܂��B�����ցA�Z�x���m�̉߃}���K���_�J���E��KMnO4���n�t���r�����b�g�œH�肷��ƁA�_���Ҍ��������N����A�_���܂̉߃}���K���_�J���E��KMnO4�́A���̂悤�ɕω����܂��B
MnO4-(�Ԏ��F)�@�{�@8H+�@�{�@5e-�@���@Mn2+(�قږ��F)�@�{�@4H2O
�������N�����Ă���Ԃ́A�Ԏ��F�̉߃}���K���_�C�I��MnO4- �͂����ɊҌ�����āA�W���F�̃}���K��(II)�C�I��Mn2+ �ɂȂ�܂��B�������A�}���K��(II)�C�I��Mn2+ �͊ȗn�t�ł͂قƂ�ǖ��F�Ȃ̂ŁA���̂悤�Ɏ������s�����ꍇ�ɂ́A�}���K��(II)�C�I��Mn2+ �̒W���F�͊ώ@�ł��܂���B���̂��߁A�r�����b�g����߃}���K���_�J���E��KMnO4���n�t��H������ƁA��u�����R�j�J���r�[�J�[���̗n�t�͐Ԏ��F�ɂȂ�܂����A�Ҍ��܂Ɣ�������Ƃ����ɐF���������܂��B�������A���ׂĂ̊Ҍ��܂��߃}���K���_�C�I��MnO4- �ɂ���Ď_������Ă��܂��ƁA�߃}���K���_�C�I��MnO4- �͊Ҍ�����Ȃ��Ȃ�A�Ԏ��F�������Ȃ��Ȃ�܂��B�܂�A�߃}���K���_�J���E��KMnO4���n�t�ɂ��H��́A�H�������߃}���K���_�C�I��MnO4- �̐Ԏ��F�������Ȃ��Ȃ����Ƃ����I�_�ł��B�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@

�}.10 �߃}���K���_�J���E��KMnO4���n�t�ɂ���_���Ҍ��H��
�Ȃ��A���̓H��ŁA�\���ʂ̊_H2SO4�������闝�R�́A�_���������łȂ��ƁA�߃}���K���_�C�I��MnO4- ���}���K��(II)�C�I��Mn2+ �ɂȂ�Ȃ�����ł��B�������A���ӂƂ��āA���_HCl���Ɏ_HNO3�Ŏ_���ɂ��Ă͂����܂���B�Ⴆ�A���_HCl�Ŏ_���ɂ����ꍇ�́A���̂悤�ɁA�������C�I��Cl- ���߃}���K���_�C�I��MnO4- �ɂ���Ď_������܂��B
2Cl-�@���@Cl2�@�{�@2e-
���̔����́A���f�K�X�������邱�Ƃ��ł��锽���Ȃ̂ŁA����Ӗ��ŗL�p�ł͂���܂��B�������A�_���Ҍ��H��ɂ����ẮA�_���܂̓H��ʂ��ω����Ă��܂��ז��Ȕ����ł��B�܂��A��Ɏ_HNO3�́A�߃}���K���_�C�I��MnO4- �Ɏ_������邱�Ƃ͂���܂��A�Ɏ_�C�I��NO3- ���g���A���̂悤�Ɏ_���܂Ƃ��č�p���܂��B
NO3-�@�{�@3e-�@�{�@4H+�@���@NO�@�{�@2H2O
������ɂ��Ă��A�߃}���K���_�C�I��MnO4- �̓H��ʂ��ω����Ă��܂����߁A���_HCl��Ɏ_HNO3�ł͎_���ɂ��Ȃ��̂ł��B���Ȃ݂ɁA�������ʼn��f�K�X��������Ƃ��́A�߃}���K���_�C�I��MnO4- ���g�킸�ɁA�_���͂���i�K���Ƃ�����_���}���K��MnO2����p�����܂��B
MnO2�@�{�@4HCl�@���@MnCl2�@�{�@Cl2�@�{�@2H2O
���̂悤�ɂ��闝�R�́A���͂Ȏ_���͂����߃}���K���_�C�I��MnO4- �ł́A�������x���������Ĕ������\�����Ă��܂��\�������邩��ł��B���f�K�X�͗L�ŃK�X�ł��邽�߁A����������ۂ́A�������R���g���[���ł��鎎���I�����Ȃ���Ȃ�܂���B��_���}���K��MnO2�̏ꍇ�́A�_���͂��킸����Cl2��MnO2�ł��邽�߁A���f�K�X�������邽�߂ɂ́A���M������K�v������܂��B����͌���������A���M���~�߂�A���f�K�X�̔������Ɏ~�߂邱�Ƃ��ł���Ƃ������Ƃł��B���������āA�������ʼn��f�K�X��������Ƃ��́A���Ƃ��������x���x���Ƃ��A�_���͂̎ア��_���}���K��MnO2���g�p����̂ł��B
(ii) ���E�fI2�H��
�@�u���E�f�H��(iodimetry titration)�v�Ƃ́A���E�fI2�̓������R�j�J���r�[�J�[�ɊҌ��܂��r�����b�g����H�����A���E�fI2�̕����ʂ��ʓI�ɋ��߂�����ł��B���̎����ł́A���E�fI2�͎_���܂Ƃ��č�p���A�Ҍ��܂Ƃ��ẮA�`�I���_�i�g���E��Na2S2O3���n�t���悭�p�����܂��B
I2�@�{�@2S2O32-�@���@S4O62-�@�{�@2I-
���̓H��̏I�_���O�ɁA�w����Ƃ��ăf���v����������ƁA�������̃��E�fI2�����E�f�f���v���������N�����āA���F�ɒ�F���܂��B�����āA���E�fI2�����ׂď�����ƁA���F�����F�ɂȂ�A�������I�_�ƂȂ�̂ł��B�Ȃ��A���܂葁���i�K�Ńf���v���������Ȃ��̂́A���E�f�f���v�������̂ɑ���`�I���_�C�I��S2O32- �̊Ҍ������̔������x������������ł��B���E�f�H��ł́A�l�X�ȕ��@������܂����A�傫�����ނ���ƁA���E�f�H��͎���2��ނɂȂ�܂��B

�}.11 ���E�fI2�����ׂĔ������A���F�ɂȂ����Ƃ��낪�I�_�ł���
(ii-1) �_���܂̕����ʂ����߂�ꍇ
���E�f�H��ł́A�_���܂̕����ʂ����߂邱�Ƃ��ł��܂��B�u���E�fI2���g���_���܂Ȃ̂ɂǂ�����āH�v�Ǝv����������܂��A�H�v������2�i�K�̔������N�������ƂŁA�_���܂̕����ʂ��ԐړI�ɋ��߂邱�Ƃ��ł���̂ł��B�������A����ɂ͏����������āA�_���܂̎_���͂��A���E�fI2���������ꍇ�Ɍ����܂��B���Ȃ킿�A���E�����C�I��I- ���_���ł���_���܂łȂ���A���E�f�H�肪�ł��܂���B���Z�̉��w�ł悭���ɂ����̂́A���fCl2�̒�ʂł��B�܂��A�\���ʂ̃��E�����C�I��I- ���܂ސ��n�t�ɁA���f�K�X���z�������܂��B����ƁA���E�����C�I��I- �����fCl2�ɂ��_������āA���fCl2�̕����ʂƓ��������̃��E�fI2���������܂��B
Cl2�@�{�@2I-�@���@2Cl-�@�{�@I2
�����Ő����������E�fI2�ɁA�r�����b�g��p���āA�`�I���_�i�g���E��Na2S2O3���n�t��H�����Ă����܂��B�����āA���̓H��Ŕ��������`�I���_�i�g���E��Na2S2O3�̕����ʂ����߂�A�����������E�fI2�̕����ʂ�������܂��B�܂�A�u�����������E�fI2��mol=�������������fCl2��mol�v�Ȃ̂ŁA���ʂƂ��āA���E�f�H��Ŏ_���܂̕����ʂ�������̂ł��B
I2�@�{�@2S2O32-�@���@S4O62-�@�{�@2I-
(ii-2) �Ҍ��܂̕����ʂ����߂�ꍇ
�@���E�f�H��Ŏ_���܂̕����ʂ����߂�Ƃ��́A��x�_���܂̕����ʂ����E�fI2�̕����ʂɕϊ�����Ƃ����A��肭�ǂ����@�����܂����B�������A�Ҍ��܂̕����ʂ����߂�Ƃ��͒P���ł��B��Ƃ��āA�������fH2S�̕����ʂ��ʂ���ꍇ���l���܂��傤�B�܂��A�\���ʂ̃��E�fI2���܂ސ��n�t�ɁA�������fH2S���z�������A���S�ɔ��������܂��B����ƁA�������fH2S�����E�fI2�ɂ���Ď_������A�������fH2S�̕����ʕ������A���E�fI2�̕����ʂ������܂��B
I2�@�{�@H2S�@���@S�@�{�@2HI
�����ŁA�������̃��E�fI2�ɁA�r�����b�g��p���ă`�I���_�i�g���E��Na2S2O3���n�t��H�����Ă����A�������̃��E�fI2�̕����ʂ�������̂ł��B�܂�A�S�̂̔����ł́A�u���E�fI2��mol=�������fH2S��mol + 1/2 �`�I���_�i�g���E��Na2S2O3��mol�v�Ƃ������ƂɂȂ�܂��B
I2�@�{�@2S2O32-�@���@S4O62-�@�{�@2I-
�E�Q�l����
1) �ΐ쐳���u�V���n�̉��w(��)�v�x�䕶��(2005�N���s)
2) �m���g�f�u���w�̐V�����v�O�ȓ�(2013�N���s)
3) �����`�l�u���_���w�̕���ɂ�����v�l�͂Ƃ́v���w�Ƌ���68��8��(2020�N)