・第15族元素(窒素族元素)
【目次】
(1) 第15族元素
周期表において、第15族に属する窒素N・リンP・ヒ素As・アンチモンSb・ビスマスBiなどの元素を、総称して「窒素族元素」といいます。窒素族元素の原子は、最外殻電子配置がns2np3である元素(n=2,3,4・・・)です。窒素族元素の単体のうち、窒素N2のみが常温で気体であり、他はすべて固体です。窒素族元素のうち、窒素NとリンPの価電子は、混成軌道を形成するので、共有結合物質として振る舞います。一方で、ヒ素As・アンチモンSb・ビスマスBiの価電子は、混成軌道を形成するよりは、2個の電子が占有したs軌道と3個の電子で半閉殻したp軌道として振る舞うので、酸化数は+3と+5が安定です。
窒素Nでは、安定なπ結合を形成することができるので、多重結合を含む化合物が多く知られています。しかし、リンPでは、原子半径が大きすぎて安定なπ結合を形成することができず、リンPを含む化合物の種類は、窒素Nよりもずっと少なくなります。一方で、ヒ素AsやアンチモンSbの単体は、共有結合性と金属結合性との性質を併せ持つ物性を示します。このような物性を持つ単体は「半金属(semimetal)」と呼ばれ、半導体などの材料として使用されます。ビスマスBiでは、さらに金属結合性が強くなり、淡く赤みがかった金属光沢を示します。人工的に作ったビスマスBiの結晶は、表面の酸化被膜で光が干渉することによって多彩な着色を示すため、観賞用の結晶として市販されています。

図.1 ビスマスBiの結晶は、表面の酸化被膜で光が干渉することで、多彩な色を示す
(2) 窒素
(i) 窒素N2
「窒素(nitrogen)」の単体は、無色無臭の不活性ガスです。窒素分子は、常温では安定な二原子分子N2からなります。空気中の最多成分で、体積比では78.1%、重量比で75.5%を占めます。また、人体にも比較的豊富に含まれる元素で、重量比で5.1%を占めます。つまり、体重70 kgの成人には、3.6 kgの窒素原子Nが、生体成分として含まれていることになります。

図.2 空気(左)と生体内(右)の元素の割合
元素としての窒素Nは、1772年にスコットランドの化学者であるダニエル・ラザフォードが最初に発見しました。化学の世界で「ラザフォード」というと、1908年に放射性物質の研究でノーベル化学賞を受賞した科学者を思い浮かべる人が多いかと思いますが、こちらはニュージーランド出身のアーネスト・ラザフォードのことで、窒素Nを発見したダニエル・ラザフォードとは全くの別人です。
ダニエル・ラザフォードは、密閉した箱の中では、十分に餌があってもハツカネズミは長生きできないことを確かめました。次に、箱の中でロウソクなどの炭化水素を燃焼させ、生成する二酸化炭素CO2を除いた気体を得ました。得られた気体は燃焼せず、またその中でハツカネズミは生きることができませんでした。ダニエル・ラザフォードは、この気体を「有毒な空気(noxious air)」と名付けて発表しましたが、これが窒素N2の発見の瞬間だといわれています。「有毒な空気」もとい窒素N2中でハツカネズミが死ぬのは、酸素O2がなくて窒息するからです。直接的には、窒素N2に毒性はありません。ただし、高分圧の窒素N2を呼吸すると、「窒素酔い」と呼ばれる中毒症状になることがあります。圧縮空気を使うスキューバダイビングでは、必ずこの問題が伴います(溶液化学(溶液と溶解度)を参照)。

図.3 ダニエル・ラザフォードは、1772年に窒素N2を発見したことで知られる
液化した窒素N2は、液体空気の分留により、工業的に大量に製造されています。ちなみに分留とは、2種類以上の液体の混合物から、各成分物質の沸点の差を利用して、各成分物質を分離・回収する操作のことです。液体窒素は-196℃で沸騰し、-210℃で固化する大変冷たい液体で、1877年に初めて作られました。バラの花を液体窒素に浸すと凍結して、金槌で叩くとバラバラに割れてしまいます。液体窒素は、-196℃を保つ冷却材として、卵子や精子などの生物試料の凍結保存に利用されます。

図.4 液体窒素の温度は-196℃の低温である
液体窒素を扱う機会があれば、ぜひ「液体窒素に手を突っ込む」という実験をやってみて下さい。液体窒素の沸点は-196℃であり、普通に考えれば、突っ込んだ手は大変な凍傷になりそうです。しかし、実際には手を数秒入れただけでは、ほとんど冷たさすら感じません。この現象は、1756年に初めてこれを研究したヨハン・ゴットロープ・ライデンフロストの名にちなんで、「ライデンフロスト効果(Leidenfrost effect)」と呼ばれています。
ライデンフロスト効果は、身近なところでも観察することができます。例えば、高温に熱したフライパンに水滴を垂らすと、水滴は瞬時に蒸発することはなく、水滴はフライパンの上をコロコロと転がるように横滑りします。これは、液体がその沸点よりもはるかに高温に熱された固体に触れると、蒸気気体の被膜が液体と固体の間に生じて、液体が固体に直接接することを妨げ、熱伝導を遅らせるためです。そして、実はこれと同じような現象が、液体窒素と手の間にも起こっているのです。液体窒素の沸点(-196℃)に比べると、手の温度(約36℃)ははるかに高温です。液体窒素に手を突っ込んだ瞬間、生じた気体窒素の被膜が皮膚表面に生じて熱伝導を遅らせるため、凍傷には至らないのです。ただし、ライデンフロスト効果は熱伝導を遅らせるだけなので、手を突っ込むのは1〜2秒に留めておいた方がいいと思います。

図.5 液体窒素に手を突っ込んでも凍傷を起こさない
窒素Nは、アミノ酸や核酸塩基などの構成成分として、多くの生体物質中に含まれており、すべての生物にとっての必須元素でもあります。しかし、空気中に大量に存在している窒素分子N2は、熱力学的に極めて安定な分子であり、反応性が小さいので、そのまま利用することはできません。それ故に、体内に窒素Nをどう取り入れるかが、生命にとっては重要な意味を持ちます。
マメ科の植物の根に共生して、根粒を形成する「根粒菌」などの微生物は、常温常圧下で「窒素固定(nitrogen fixation)」によって空気中の窒素N2から、アンモニアNH3や硝酸塩などの窒素化合物を作り出すことができます。その窒素化合物を摂取することで、多くの生物は体内に窒素Nを取り込んでいます。また、雷による放電が起こると、空気中の窒素N2は窒素酸化物NOxとなり、雨となって地上に降り注ぎ、植物に吸収されます。「夏に雷が多いと、秋には米が豊作になる」とよくいわれますが、これは根拠のないことではありません。
根粒菌の体内で、このような反応を触媒している酵素は「ニトロゲナーゼ」といわれ、分子量は約30万もあり、モリブデンMoと鉄Feを活性中心に含む巨大な金属タンパク質です。反応機構は極めて複雑で、未だに完全に解明はされていません。人類がニトロゲナーゼのような効率の良い化学モデルを作り出すことができれば、食糧問題の解決につながるのではないかと考えられています。

図.6 根粒菌は、マメ科植物の根に根粒を形成し、その中で空気中の窒素N2を窒素化合物に変換している
1960年代の「緑の革命」により、農作物の生産量は飛躍的に増加しました。その生産量の増加に大きな役割を果たしたのが化学肥料であり、現代農業において、窒素肥料は不可欠なものとなっています。窒素肥料は、リン酸肥料やカリ肥料と並んで、「肥料の三要素」の一角を占めています。窒素N・リンP・カリウムKの成分は、植物の成長に多量に必要であるのにも関わらず、土の中では不足しがちになるので、作物として収穫する場合には、肥料により外部から補充する必要があります。また、肥料に含まれる窒素N・リンP・カリウムKの成分は、すべて過不足なく与える必要があります。例えば、必要量の窒素NやリンPを与えたとしても、必要な量の半分のカリウムKしか与えなかった場合には、窒素NとリンPも半分量しか消費されないのです。言い換えれば、肥料は最も不足している養分を施したとき、最も高い効果が得られます。これを「リービッヒの最小養分律」といいます。その中でも窒素肥料は、主に植物を大きく生長させる作用があり、根から吸収される必須栄養素の中では、最も多量に要求されます。
表.1 肥料の三要素
|
肥料 |
窒素肥料 |
リン酸肥料 |
カリ肥料 |
|
必要な時期 |
茎や葉の成長期 |
花芽が形成する時期 |
果実や種子が成長する時期 |
|
効果 |
植物の成長を促進 葉の青化に関与 |
果実の甘味の増加 根の発育促進 |
果実を太らせる |
|
例 |
NH4NO3、CO(NH2)2 |
過リン酸石灰 |
KCl、K2SO4 |
実験室で窒素N2の気体を得る場合には、亜硝酸アンモニウムNH4NO2の水溶液を約70℃で熱分解します。この反応は、身近なところでは意外なものに利用されており、硬式のテニスボールの製造に用いられます。テニスボールをよく見ると空気穴がありませんが、テニスボールにはこの反応で生じる窒素N2が充填されています。なお、実際には、亜硝酸アンモニウムNH4NO2には爆発性があって取り扱いが難しいので、亜硝酸ナトリウムNaNO2と塩化アンモニウムNH4Clの混合物をボールの中に入れ、これを熱分解することで、窒素N2を発生させているようです。
NH4NO2 → N2 + 2H2O
NaNO2 + NH4Cl → N2 + 2H2O + NaCl
窒素Nの酸化物には、一酸化二窒素N2Oや一酸化窒素NO、二酸化窒素NO2、四酸化二窒素N2O4など様々な化合物があります。窒素酸化物は、雷や微生物によっても生成し、自然界においても存在します。しかし、自然界において存在する以上の窒素酸化物が、自動車のエンジン中や石炭火力発電所などで起こる様々な反応によって生成し、大気中に放出されています。これら大気中に放出された窒素酸化物は、深刻な大気汚染を引き起こし、酸性雨の原因物質にもなっています。また、窒素Nのオキソ酸には、硝酸HNO3や亜硝酸HNO2が含まれます。次の図.7に、主な窒素酸化物及びオキソ酸の構造式を示します。
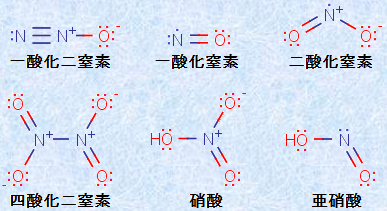
図.7 主な窒素酸化物及びオキソ酸の構造式
(ii) 一酸化二窒素N2O
一酸化二窒素(亜酸化窒素)N2Oは、香気と甘味のある無色気体です。後述のように麻酔作用があることから、「笑気ガス」と呼ばれることもあります。一酸化二窒素N2Oは、硝酸アンモニウムNH4NO3を約250℃で注意深く加熱することで生成します。「注意深く」加熱する必要があるのは、硝酸アンモニウムNH4NO3が爆発性を持った不安定な化合物だからです。
NH4NO3 → N2O + 2H2O
一酸化二窒素N2Oには様々な用途があり、自動車レースでは燃焼触媒として、半導体製造においては酸化剤として用いられています。その他、自動車のエアバッグや消臭剤、艶出しスプレーといった身近な家庭用品にも使われています。また、食品用の高圧ガスとしても使われており、エスプーマの噴射剤が一酸化二窒素N2Oであることはよく知られています。泡状にしたい食材と一酸化二窒素N2Oを特殊な容器に閉じ込めてよく振り、ノズルを開けると泡状になって噴き出してくるというものです。噴射剤には二酸化炭素CO2が使われることもありますが、二酸化炭素CO2には独特の酸味や食感があるため、食材の味や香りを損なわない一酸化二窒素N2Oが好まれて使用されます。なお、日本では後述の通り、医療用途以外の目的に一酸化二窒素N2Oを用いることが禁止されているため、二酸化炭素CO2で代用するのが一般的です。
![危険】泡立て器『エスプーマ』が爆発し女性が死亡する事故が発生…爆発の理由は!?過去に失明した被害者も!? | Pixls [ピクルス]](group-15-element.files/image009.jpg)
図.8 一酸化二窒素N2Oを使うことで、液状の食材を泡状にすることができる
「笑気ガス」という別名が示すように、一酸化二窒素N2Oには麻酔作用があり、高い濃度で吸入すると思考や感覚が麻痺し、ちょっとした幸福感が得られます。棒で突かれても分からず、火災報知器の音やパトカーのサイレンも、ささやき声のようにしか聞こえなくなります。かつて青少年の乱用が問題になったことがあり、一酸化二窒素N2Oで膨らませた風船を「ハッピーバルーン」と称して、パーティーやコンサート会場などで販売していたようです。日本では、2006年4月から一酸化二窒素N2Oがエスプーマ用の食品添加物として認められましたが、吸入による陶酔性を求めた事案が多発しました。そのため、2016年2月に厚生労働省が「指定薬物」に指定し、現在では医療用途以外の目的での製造や輸入などを禁止しています。

図.9 一酸化二窒素N2Oには麻酔作用があり、娯楽用に乱用されることもある
一酸化二窒素N2Oの麻酔作用に注目し、これを酸素O2と混合して初めて吸入麻酔薬として使ったのは、マサチューセッツ州ボストンで歯科医をしていたホーレス・ウェルズです。ウェルズが歯科治療をしていた19世紀、当時は虫歯になってもほとんどの人は抜歯をしませんでした。抜歯の痛みより虫歯の痛みの方が弱かったので、虫歯になっても、ただひたすら我慢していたのです。それでも抜歯をしなければならないときは、屈強な助手が患者を椅子に押さえつけて、大型ペンチさながらの鉗子で抜く歯を掴み、ねじりながら引き抜きました。これには激しい痛みが伴ったので、ウェルズは吸入麻酔薬があれば、患者の痛みを和らげることができると思ったのです。

図.10 ホーレス・ウェルズは、一酸化二窒素N2Oを初めて吸入麻酔薬として使ったことで知られる
1841年12月11日、ウェルズは自ら一酸化二窒素N2Oを吸入し、自分の親知らずを抜く実験を行いました。結果、ウェルズは針で刺されたほどの痛みも感じなかったので、「一酸化二窒素N2Oは麻酔に使える」と確信しました。そして、一酸化二窒素N2Oの麻酔効果を他の医師たちに披露しようと、ボストンにあるハーバード大学医学部付属マサチューセッツ総合病院で公開実験を行いましたが、ここでウェルズは大失敗をしてしまいます。麻酔が完全に効いていない状態で抜歯をしてしまい、患者が激痛を訴えて暴れ回ってしまったのです。これは現代だから分かることですが、一酸化二窒素N2Oだけでも痛みの感覚を緩和する効果はありますが、実はその効果はそれほど強くなく、ジエチルエーテルなどの他の麻酔薬とともに投与すると、効き目が良くなることが知られています。この一件で、ウェルズはイカサマだと周囲から批判され、歯科医としての面目を完全に失ってしまいます。その後、ウェルズは同じ麻酔薬のクロロホルム中毒になり、歯科医の仕事もほとんどしなくなって、公開実験から3年後の1848年に自ら命を絶っています。
(iii) 一酸化窒素NO
一酸化窒素NOは、無色無臭の気体です。実験室では、銅Cuに希硝酸HNO3を加えて発生させ、水に溶けにくいので、水上置換法で捕集します。反応が起こりにくい場合は、初めに少し加熱すると良いでしょう。ただし、一酸化窒素NOが発生し始めたら、すぐに加熱を止めます。また、銀Agに希硝酸HNO3を作用させても、一酸化窒素NOが発生します。一酸化窒素NOは中性気体なので、酸にも塩基にも吸収されません。よって、中性乾燥剤はもとより、酸性乾燥剤や塩基性乾燥剤による乾燥も可能です。
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
一酸化窒素NOは、窒素N2と酸素O2を火花放電などで高温にしても発生します。窒素N2は、N≡N原子間の結合エネルギーがかなり大きいため、低温では不活性です。しかし、1,000℃以上になると酸素O2とよく反応します。高温では、原子間の結合を切るのに十分なエネルギーが供給されるからです。したがって、自動車エンジンの燃焼室中では、一酸化窒素NOが生成しやすくなります。一酸化窒素NOをそのまま大気中に放出すると、大気汚染の原因となるので、石炭火力発電所から発生する一酸化窒素NOは、アンモニアNH3と反応させて窒素N2とし、無害化するようになっています。しかし、そのためのアンモニアNH3が高価で、公害防止のための費用は、発電コストの10%近くを占めるともいいます。
N2 + O2 → 2NO
6NO + 4NH3 → 5N2 + 6H2O
一酸化窒素NOは、生体内でもアミノ酸の一種であるアルギニンから酵素により合成され、血管拡張作用や神経情報伝達など、様々な生理活性を持つことが分かっています。一酸化窒素NOは、免疫系や神経系、循環器系など、あらゆる組織で多様な生理作用を発現することが明らかにされ、一酸化窒素NOの薬理作用を解明したアメリカの薬理学者であるルイ・イグナロらは、1998年のノーベル生理学・医学賞を受賞しています。
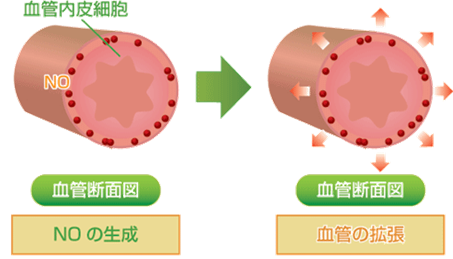
図.11 血管内皮細胞より一酸化窒素NOが分泌され、血管を拡張する
狭心症の発作を鎮める治療薬として、ダイナマイトの原料であるニトログリセリンが用いられていることは有名です。ニトログリセリンが狭心症に効くのは、これが体内で加水分解されて生じる一酸化窒素NOが、血管周囲の平滑筋を弛緩させ、動脈を拡張するためです。この効果は、偶然に発見されたといわれています。狭心症を持病とする工員が、ニトログリセリン製造工場で働いていたのだそうです。ところが、この工員は家では発作を起こすのに、工場では発作を起こしたことがないというのです。そこで原因を調べたところ、ニトログリセリンが狭心症の発作を抑えていたという訳です。
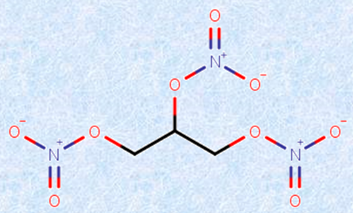
図.12 ニトログリセリンを初めて合成した化学者が、新物質を調べようと舐めてみたところ、こめかみがズキズキしたという記録が残っている
面白いことにヒルや蚊のような吸血生物は、血液を吸うときに一酸化窒素NOを放出して、ヒトの血管を広げて、血液を吸いやすくしているといいます。吸血生物も、一酸化窒素NOの薬理作用を利用して、巧みに生きているのです。また、新生児の肺動脈が開かず、生後すぐに亡くなる病気があるのですが、現在では一酸化窒素NOを利用して、肺動脈を拡張させることで治療できるようになりました。
(iv) 二酸化窒素NO2
一酸化窒素NOは無色の気体ですが、空気中では酸素O2とすぐに反応し、赤褐色の二酸化窒素NO2を生成します。二酸化窒素NO2は、常温常圧で赤褐色の液体、あるいは気体(b.p.21℃)として存在しています。二酸化窒素NO2は、人体に対して、呼吸器系統への毒性があります。実験室では、銅Cuまたは銀Agに濃硝酸HNO3を加えて発生させ、水に溶けやすくて空気より重いので、下方置換で捕集します。また、二酸化窒素NO2は酸性気体であるため、ソーダ石灰(CaO+NaOH)などの塩基性乾燥剤は用いることができません。
2NO + O2 → 2NO2
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Ag + 2HNO3 → AgNO3 + NO2 + H2O
二酸化窒素NO2は、その二量体である四酸化二窒素N2O4と平衡状態にあり、室温で両者は混合状態にあります。四酸化二窒素N2O4は、沸点が21.1℃の無色の液体です。両者の存在割合は温度によって変化し、四酸化二窒素N2O4の生成は発熱反応(ΔH<0)なので、低温では四酸化二窒素N2O4の方が安定です。そのため、二酸化窒素NO2と四酸化二窒素N2O4の混合物を冷却すると、平衡が右側に移動して二酸化窒素NO2が分解するため、赤褐色は薄くなります。
2NO2 ⇄ N2O4 ΔH =−53.5 kJ

図.13 低温では四酸化二窒素N2O4の生成方向に平行が移動し、二酸化窒素NO2の赤褐色が薄くなる
二酸化窒素NO2は、高温の水に溶かすと自己酸化還元反応を起こし、硝酸HNO3と一酸化窒素NOなります。二酸化窒素NO2が硝酸HNO3になるためには、窒素Nの酸化数が1だけ増加する必要があります。しかし、水中では適当な酸化剤が存在しないので、二酸化窒素NO2分子間で酸化還元反応を行う必要があります。酸化還元反応では、酸化数の増加量と減少量がつり合わなければならないので、2分子が硝酸HNO3に変化し、1分子が一酸化窒素NOに変化すれば、酸化数の増減が合うということになります。
3NO2 + H2O → 2HNO3 + NO
(v) 硝酸HNO3
硝酸HNO3は、常温常圧では揮発性のある無色の液体で、高校化学では代表的な強酸の1つです。手に硝酸HNO3がかかると、「キサントプロテイン反応(xanthoprotein reaction)」が起こって、皮膚のタンパク質が変成して黄変します(天然高分子化合物(タンパク質と核酸)を参照)。実験室では、チリ硝石NaNO3などの硝酸塩に濃硫酸H2SO4を加え、これを加熱して発生させます。硝酸HNO3には揮発性がある(b.p.83℃)ので、加熱することで硝酸HNO3が気化して追い出されるという原理です。
NaNO3 + H2SO4 → HNO3 + NaHSO4
工業的に硝酸HNO3を製造する場合は、アンモニアNH3を原料にして合成します。アンモニアNH3を酸化して得られる一酸化窒素NOを、空気酸化によって二酸化窒素NO2にし、これを温水に溶かすことによって生成させます。このような工業的製法を、開発者ヴィルヘルム・オストワルドの名を冠して、「オストワルド法(Ostwald process)」といいます(無機工業化学を参照)。ドイツの物理化学者であるオストワルドは、反応速度と触媒の研究で、1909年にノーベル化学賞を受賞した人物です。哲学や心理学、芸術にも造詣が深く、後世に多大なる影響を与えたことで知られます。グルタミン酸ナトリウムにうま味があることを発見した池田菊苗も、1899年から2年間オストワルドのもとで物理化学の研究に従事しています。純粋化学を追究しつつ、社会に貢献する研究にも積極的に取り組むオストワルドの姿に、池田は大きな影響を受けたといわれています。
NH3 + 2O2 → HNO3 + H2O
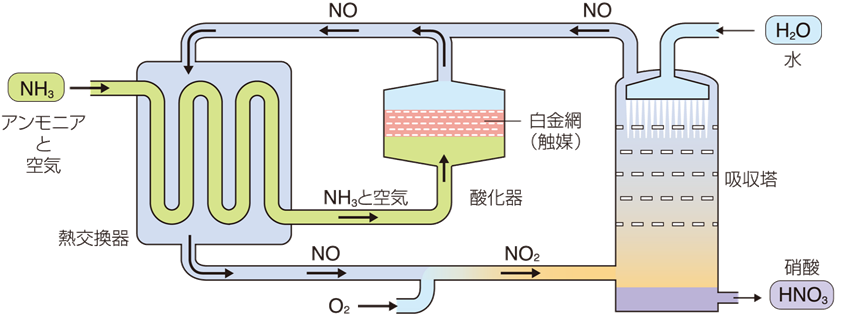
図.14 オストワルド法
古来より、硝酸HNO3は火薬の原料として重宝されていました。ほとんどの火薬は、硝酸塩やニトロ化合物、硝酸エステルからなるからです。しかし、代表的な硝酸塩である硝酸カリウムKNO3や硝酸ナトリウムNaNO3は、水溶性なので雨が降る場所では流れてしまったり、土中深くに潜り込んでしまったりします。また、硝酸塩は栄養素として植物にも吸収されてしまいます。そのため、雨の降る場所や植物の生えているところには、硝酸塩はごくわずかにしか存在しないので、地球上で硝酸塩が存在する場所は限定されます。
日本では、戦国時代の鉄砲の渡来に伴い、火薬の需要が高まりました。火薬の原料となる硝酸カリウム(硝石)KNO3は、降水量の多い日本ではほとんど採れなかったので、供給源は中国に依存していました。しかし、江戸時代になると、鎖国により供給が途絶えてしまいます。その間、日本では硝酸カリウムKNO3をどのように調達していたのでしょうか?

図.15 鉄砲の装薬として用いられた黒色火薬には、硝酸カリウムKNO3が不可欠だった
雨に濡れない小屋の中などで、動物の糞尿を腐敗させ、草木灰(炭酸カリウムK2CO3を豊富に含む)と混ぜ合わせます。それを麻畑の土と混ぜて山にし、ときどき攪拌しながら発酵させると、2年ほどで硝酸カリウムKNO3が析出します。これは、加賀藩(富山県五箇村)で伝統的に行われていた「土硝法」という方法です。アンモニアNH3から硝酸イオンNO3− を生産する硝化菌の働きで、硝酸カリウムKNO3を作り出したのです。当時は、「細菌」という概念自体ありませんでしたが、麻畑の土には硝化菌が多く含まれ、経験的に麻畑の土が選ばれていたようです。ただし、この方法はかなりの悪臭と暑さに苦しめられる作業で、硝酸カリウムKNO3を作成する者には様々な利益が与えられていました。例えば、加賀藩では硝酸カリウムKNO3を納めることで、年貢が免除になった上に、作業代が与えられたほどです。
古典落語において、金がないことを表す言い回しに、「もう床下の土も売っちまったし…」というものがあります。人が住んでいる場所には、垢や毛髪、その他のタンパク質を含んだ塵が出ます。これは床下に落ち、やがて硝化菌の働きで硝酸イオンNO3− になります。江戸時代には、人の集まる神社仏閣の床下の土を集める商売があったといいます。化学の体系もできあがっていない時代に、このような方法で硝酸塩を得ていたとは驚異的です。

図.16 富山県五箇村には、戦国時代から江戸時代にかけて硝石KNO3製造の歴史がある
市販の濃硝酸HNO3は、濃度60〜70%程度のものが多く、発煙性を示す無色の溶液です。蒸気圧が大きく、分解もしやすいため、濃度100%のものは一般には市販されていません。熱や光で一部が分解して、徐々に黄色を帯びるのを防ぐため、通常は褐色瓶に入れて、冷暗所に保存します。
4HNO3 → 4NO2 + O2 + 2H2O
硝酸HNO3には強い酸化作用があり、水素H2よりイオン化傾向の小さい金属(銅Cuや銀Agなど)を溶かすことが可能です。白金Ptや金Auを溶かすことはできませんが、濃硝酸HNO3と濃塩酸HClを1:3の体積分率で混合した「王水(aqua regia)」を作用させることにより、これらの金属も溶かすことが可能になります。このような強い酸化力を示す理由は、塩化ニトロシルNOClと塩素Cl2が生成するからです。塩化ニトロシルNOClは、酸化力が非常に強く、ほとんどの金属を酸化することができます。
3HCl + HNO3 → NOCl + Cl2 + 2H2O
Au + NOCl + Cl2 + HCl → H[AuCl4] + NO

図.17 王水と金Auの反応
しかし、アルミニウムAlやクロムCr、鉄Fe、コバルトCo、ニッケルNiなどの金属は、イオン化傾向が水素H2より大きいにも関わらず、濃硝酸HNO3には溶けません。これは、金属表面が濃硝酸HNO3により酸化され、厚さ数nm程度の緻密な構造を持つ酸化皮膜となり、金属内部を保護するようなるからです。このような状態は「不動態(passivity)」と呼ばれ、不動態になると、酸や塩基に対して耐久性を示すようになります。
(vi) アンモニアNH3
窒素Nの水素化物の代表は、アンモニアNH3です。アンモニアNH3の名称は、古代エジプトの太陽神アモン(Ammon)の礼拝者である「アンモニア人」に由来しているといわれています(諸説あります)。彼らは、後世の神がかりと同じように、儀式のときに塩化アンモニウムNH4Clを使いました。当時、塩化アンモニウムNH4Clは「アモンの塩(sal ammoniac)」と呼ばれていたようです。塩化アンモニウムNH4Clは、天然には火山の近くの割れ目で産出して、加熱すると分解して、アンモニアNH3を発生させます。
NH4Cl → NH3 + HCl
アンモニアNH3は、常温常圧で刺激臭のある無色の気体で、水に溶けると弱塩基性を示します。強い極性を持った分子であり、分子間にはファンデルワールス力に加えて、水素結合が働きます。そのため、水素結合の働きにより、アンモニアNH3は分子量から予想されるよりもずっと高い沸点を示します。水中では、窒素原子上の非共有電子対の働きで、金属錯体の配位子にもなります。特にアンモニアNH3が配位子の錯イオンは、「アンミン錯イオン」と呼ばれます。ジアンミン銀(I)イオン[Ag(NH3)2]+ などが有名です。
NH3 + H2O ⇄ NH4+ + OH−
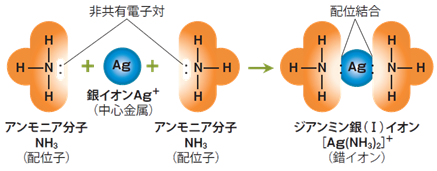
図.18 ジアンミン銀(I)イオン[Ag(NH3)2]+ の構造
工業的には、アンモニアNH3は「ハーバー・ボッシュ法(Haber-Bosch process)」により、大気中の窒素N2と水素H2から合成されています。この方法は、チリから硝酸塩(チリ硝石NaNO3)の供給を受けていたドイツが、第一次世界大戦のときに海上封鎖によりその供給を断たれたので、ドイツの化学者であるフリッツ・ハーバーが、空気から採取する方法として1908年に発明しました。ハーバー・ボッシュ法の成功は、人工的な窒素固定(空気中に多量に存在する不活性な窒素N2を、反応性の高いアンモニアNH3などに変換すること)を可能にし、窒素肥料の増産、ひいては食料の増産に寄与するという、人類にとって極めて重要な意味を持つものです。世界中で植物が1年で固定する窒素量は、約1.8億tといわれていますが、ハーバー・ボッシュ法で固定される窒素量は、約1.6億tにもなります。このハーバー・ボッシュ法だけで、世界中で消費されているエネルギーのほぼ1%を消費するともいわれており、どれだけ大規模に製造されているのかが伺えます。一方では、成功当時の戦時下にあって、爆薬の原料となる硝酸HNO3の大量生産をも可能にし、戦争を長引かせました (無機工業化学を参照)。
N2 + 3H2 → 2NH3
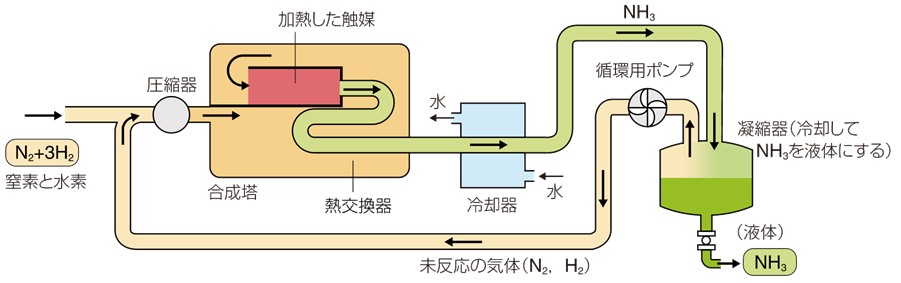
図.19 ハーバー・ボッシュ法
アンモニアNH3の用途は、肥料が全体の80%超と大きな割合を占めています。しかし、このアンモニアNH3の利用法が変化する兆しとなる、新たな研究が行われています。それは、アンモニアNH3の燃料としての利用です。アンモニアNH3の燃焼生成物は、水H2Oと窒素N2だけです。すなわち、アンモニアNH3は、燃焼による二酸化炭素CO2の生成がない「CO2フリー燃料」となります。その燃焼熱は380 kJ/molを有する可燃物ですが、化石燃料と比べると燃えにくく、これまではその利用は限定的なものでした。しかし、アンモニアNH3を燃料としたガスタービン発電が2015年に初めて成功し、アンモニアNH3がCO2フリー燃料として、発電に利用可能であることが示されました。これは、アンモニアNH3の利用法の革新的発見です。
4NH3 + 3O2 → 2N2 + 6H2O
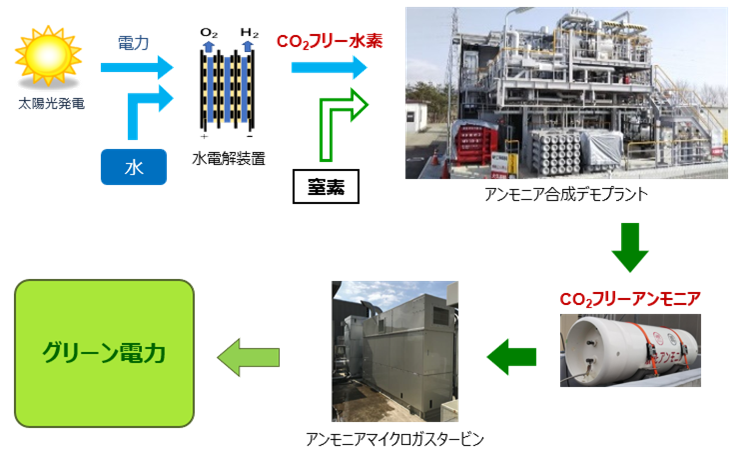
図.20 アンモニアNH3を燃料としたガスタービン発電
アンモニアNH3を実験室で発生させるときは、試験管に塩化アンモニウムNH4Clなどのアンモニウム塩と強塩基を入れ、この混合物を加熱します。発生したアンモニアNH3は水に溶けやすく、空気よりも軽い気体なので、上方置換法で捕集します。このとき、反応で生成した水H2Oが試験管の加熱部に流れると、急激な温度変化で試験管が割れることがあるので、試験管の口を少し下げます。乾燥したアンモニアNH3を得るには、ソーダ石灰(CaO+NaOH)などの塩基性乾燥剤の中を通して、水分を除きます。濃硫酸H2SO4や十酸化四リンP4O10などの酸性乾燥剤は、アンモニアNH3と中和反応を起こすので不適です。また、塩化カルシウムCaCl2は中性乾燥剤ですが、アンモニアNH3と反応して塩化カルシウム八アンモニア付加物CaCl2・8NH3を生成するので、これも乾燥には不適です。
2NH4Cl + Ca(OH)2 → 2NH3 + 2H2O + CaCl2

図.21 アンモニアの生成と捕集
上の図.21で濃塩酸HClを近づけているのは、アンモニアNH3が捕集されていることを確認するためです。アンモニアNH3と塩化水素HClの反応は、塩化アンモニウムNH4Clの微結晶による白煙を生じるので、互いの気体の検出に用いられます。また、微量のアンモニアNH3を検出する場合には、「ネスラー試薬(Nessler's reagent)」を用いることがあります。ネスラー試薬を試料に滴下して振り混ぜると、アンモニアNH3を含む場合には、褐色の沈殿を生じます。ネスラー試薬は、かつては水質検査では定番の試薬でしたが、水銀Hgが含まれており、その毒性や環境汚染の懸念から、現在は使われなくなりつつあります。
NH3 + HCl → NH4Cl
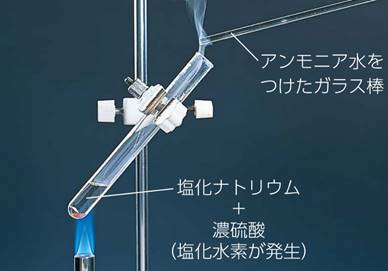
図.22 アンモニアNH3と塩化水素HClの反応
アンモニアNH3は沸点が-33℃なので液化しやすく、20℃でも8.46気圧まで圧縮すると、溶剤として働く性質を持った無色の液体となります。蒸発熱が約23 kJ/molと大きいことを利用して、冷凍装置の冷媒として使われています。その他、液化したアンモニアNH3は、ナトリウムNaやカルシウムCaなどの金属を溶かして、青い溶液になるという面白い性質があります。この色は、アンモニア分子NH3の間の隙間に捕らわれた、溶媒和電子e−[NH3]nによるものです。
Na + nNH3 → Na+ + e−[NH3]n
アンモニアNH3はタンパク質の代謝により、体内でも発生しています。魚類はそのまま水中に放出しますが、哺乳類は毒性の低い尿素(NH2)2COに変えて排出します。成人では、1日で約30 gほどの尿素(NH2)2COを排泄しています。これをアンモニアNH3に置き換えると、その量は約22 Lにもなります。尿は体外では直ちに腐り始め、尿素(NH2)2COはアンモニアNH3に分解されていきます。
(NH2)2CO + H2O → 2NH3 + CO2
(3) リン
(i) リンP
「リン(phosphorus)」は、遺伝子をコードする「デオキシリボ核酸(DNA)」や生体内のエネルギー通貨である「アデノシン三リン酸(ATP)」、そして骨や歯の主要物質であるヒドロキシアパタイトCa5(PO4)3(OH)などに含まれており、生命において非常に重要な元素です。リンPは長い年月をかけて循環しています。植物は土壌からリン酸塩を吸収し、その植物を動物が食べ、動物の排泄物や死骸は土壌へ戻ります。人類は、古くからこうしたリンPの循環を農業に活用してきました。
リンPを初めて発見したのは、ドイツの医師であるヘニッヒ・ブラントです。1669年のある日、「ドイツの錬金術師、冷たい火を発明」という見出しが、ドイツのハンブルク日報の一面を飾っていたかもしれません。ブラントは、本業のかたわら錬金術の実験に没頭しており、どうにかして金を作り出し、生命の秘密を解き明かそうと執念を燃やしていました。もちろん、「金」と「生命の神秘」には、何の関係もありません。しかし、当時は「金は永遠の金属」と見なされていました。金は決して腐食せず、変色もしないからです。金がなぜ不滅なのか、その秘密を解き明かすことができれば、その神秘を応用して、人間もまた永遠の生命を獲得することができるのではないか――ブラントは、この二重の秘密の答えを、人間の「尿」に求めました。尿のあの黄金色は、金を含んでいるせいだと考えたのです。そして、この貴重な金を、人間の尿から抽出する方法を模索し始めました。ブラントはまた、尿が血液からもたらされること、その血液が生命に不可欠であることも知っていました。ということは、生命の源である血液と同じ性質が、尿にもあるのではないでしょうか?
ブラントは、妻や友人から集めた大樽5個分(約5,500 L)の尿を4〜5週間かけて煮詰め、発生した蒸気は冷却して、再び液体に戻しました。ブラントは、蒸気が凝縮する様子を、胸を高鳴らせて観察しました。最初は、さぞ落胆したに違いありません。期待した金は、全く形成されなかったからです。蒸留物からは、「ロウのような物質」が得られただけでした。しかし、この失望のあとに歓喜が訪れました。尿から得られた「ロウのような物質」が、暗闇の中で神秘的に輝き始めたのです。今までそのようなものを見たことがなかったブラントは、それを「冷たい火(kaltes Feuer)」と名付けました。これがもしかすると、探し求めていた「不老不死の霊薬」かもしれません。ブラントは、現代まで生き延びてはいないので、それが「不老不死の霊薬」ではなかったことは確かです。しかしながら、その光輝く奇妙な物質は、好奇心旺盛な錬金術師に、不朽の名声を与えることとなりました。錬金術師ブラントが発見した物質はリンPであり、ブラントはリンPの発見者として、永遠に名を残したのです。
古代から中世の時代までに知られていた元素は、金Au、銀Ag、銅Cu、鉄Fe、鉛Pb、スズSn、水銀Hg、亜鉛Zn、ビスマスBi、炭素C、硫黄S、アンチモンSb、ヒ素Asの13種類でしたが、これらはすべて鉱物などとして、「人々が手に取って目で見ることのできる元素」でした。ブラントは、「日常的には見ることのできない元素」を目で見える形で取り出すことに、人類史上初めて成功したのです。リンPは、実験化学者によって発見された最初の元素となりました。ブラントによるリンPの発見は、自然界や生体中に元素が「目で見えない形」で存在していることを示すとともに、それらから新しい元素を発見できる可能性の扉を開けることとなりました。

図.23 ブラントは、大量の尿を煮詰めて凝縮させることで、フラスコの中に暗闇で青白く光る物質を得た
リンPは、常温常圧では固体です。結晶構造の異なるいくつかの同素体が存在し、黄リン(白リン)や赤リンなどが知られています。ブラントが作ったのは黄リンで、正四面体型の分子P4からなる淡黄色ろう状の固体です。水に溶けず、空気中で自然発火する(発火点が約34℃)性質があるので、通常は水の中で保存します。ニラに似た悪臭を発し、毒性が極めて強く、手に触れると皮膚を侵します。その急性毒性はLD50=10 mg/kgであり、青酸カリ(LD50=7 mg/kg)やニコチン(LD50=7 mg/kg)に匹敵するほどの猛毒です。
19世紀には、黄リンを扱う作業員の多くが、黄リンに侵されて死亡するという問題が生じました。黄リンの蒸気を恒常的に吸い込むと、歯の隙間から黄リンが体内に取り込まれ、神経伝達系などに作用して、毒性を示します。最初に顎の骨が壊疽を起こすので、当時は「燐顎(りんがく)」と呼ばれていました。ヒトの体内に取り込まれたリンPが、骨の再構築に関わる破骨細胞の働きを阻害して、骨に異常を生じさせると考えられています。
表.2 リンPの同素体の性質
|
|
構造 |
結合の安定性 |
反応性 |
保存法 |
毒性 |
溶解性 |
|
黄リン |
P4 |
不安定 |
大 |
水中 |
有 |
CS2に溶ける |
|
赤リン |
Px |
安定 |
小 |
空気中 |
無 |
CS2に溶けない |
※ 黄リンは精製すると白色になるため、「白リン」と呼ばれることもある
また、黄リンは暗所に置いておくと、青白色に弱く光る性質を持ちます。ブラントはこの光を見て、リンPの存在に気付いた訳です。この光を「燐光(phosphorescence)」といい、その原理は1974年に解明されました。黄リンが空気中の酸素O2と反応すると、表面に水酸化物と酸化物が一時的に形成されます。これらはすぐに分解するのですが、その際に発生するエネルギーが、青白い光として観察されるのです。実際、酸化の過程は制御できぬまま進行してしまうことが多く、反応が進むと空気中で自然発火することもあります。
リンの英語名である「phosphorus」の語源も、ギリシア語の「光をもたらすもの(phosphorus)」にちなんでいます。ただし、私たちが「燐光」と表現しているものは、すべてが実際にリンPによる発光とは限りません。例えば、海で見られる燐光は、生物発光バクテリアで酵素による化学反応が引き起こされるときに発生するのであって、そこにリンPは介在していません。同じような化学反応は、ホタルからヤコウタケまで、他の発光生物でも認められます。

図.24 黄リンは、空気中で自然発火するので、水中で保存する
一方で、赤リンは、粉末状の赤褐色の無定形高分子Pxです。多数のリン原子Pが共有結合してできた網目状構造を持つ分子で、その表記には組成式Pが用いられます。赤リンの製法は、1844年にフランスの化学者であるエミール・コップが発見しました。黄リンを窒素N2やアルゴンArなどの不活性ガス中で約250℃で熱すると、赤リンに変わります。発火点が約260℃なので容易に自然発火せず、毒性もほとんどないので、取り扱いは容易です。赤リンは、ガラス粉やニカワと混ぜてマッチ箱の側薬(赤褐色の部分)に使われたり、医薬品や農薬の原料などに用いられたりします。

図.25 赤リンは、自然発火しにくく、毒性もほとんどない
マッチの着火メカニズムには、赤リンが関わっています。マッチ棒の頭薬部分をマッチ箱の側薬部分に擦ると、マッチ箱の側薬に使われている赤リンが、マッチ棒の頭薬に付着し、これが摩擦熱により発火するという原理です。マッチ棒の頭薬には、塩素酸カリウムKClO3などの酸化剤と硫黄Sなどの可燃剤、およびガラス粉などの摩擦剤を混ぜたものが付けてあります。頭薬も赤色なので勘違いしやすいのですが、頭薬には赤リンは含まれていません。摩擦により発生した火が頭薬に移ると、酸化剤の塩素酸カリウムKClO3が分解し、可燃剤の硫黄Sに酸素Oを供給するので、燃焼が一層激しくなります。
なお、一度水に濡らしてしまったマッチは、完全に乾かしても着火しなくなります。この理由は、塩素酸カリウムKClO3が水に溶けやすい性質を持つためです。水に濡らしたマッチからは、塩素酸カリウムKClO3が流出してしまい、頭薬から酸化剤が失われます。マッチの着火には酸化剤が不可欠なので、マッチは水に濡らさないように管理する必要があります。
ちなみに、1830年代にフランスで開発された初期のマッチは、頭薬に黄リンや酸化剤、可燃剤などが全部一緒に塗ってある「黄リンマッチ」でした。頭薬は空気に触れないようにロウで覆われており、軽くこすってロウを剥がすと着火します。西部劇に登場するマッチはこちらの方で、靴底でこすって火を付ける場面をよく見ます。当時は、ある程度丈夫な木の箱にマッチを入れて、紙テープで1本ずつ固定してありました。しかし、踏み潰して火事になった例はいくらでもあったでしょう。「マッチ売りの少女」という19世紀のデンマークが舞台の童謡がありますが、少女が売り歩いていたマッチは、時代的に黄リンマッチであったと考えられます。黄リンマッチは安価で利便性が高いものでしたが、製造工場で働く人たちの劣悪な労働条件や黄リン毒が問題となって、各国政府が黄リン使用を相次いで禁止したことにより、1900年代には使用が激減しました。

図.26 マッチ箱の測薬には、赤リンが使われている
リンPは人体にも豊富に含まれており、体重70 kgの成人には700〜780 gも含まれています。歯や骨はその90%を占め、ヒドロキシアパタイトCa5(PO4)3(OH)が生体骨の主成分です。他にリンPを含む重要な生体分子としては、遺伝物質である核酸があげられます。核酸には、デオキシリボ核酸(DNA)とリボ核酸(RNA)の2種類があります(天然高分子化合物(タンパク質と核酸)を参照)。人体には豊富にリンPが含まれるので、墓地に土葬されていた遺体が分解されてリンPを含む化合物が生成すると、自然現象の放電で引火し、火の玉が生じることがあります。墓地という環境も相まって、このことが「幽霊は火の玉とともにでる」という伝承につながったと考えられています。

図.27 墓地に出現する火の玉は、リンPが原因かもしれない
動物の歯や骨には、ヒドロキシアパタイトCa5(PO4)3(OH)が含まれているため、19世紀初頭では、動物の歯や骨を原料にして、リンPが製造されていました。それでも足りないことが分かると、今度はヒトの歯や骨を求めて、戦場を漁る連中も出てきました。ヨーロッパ大陸で繰り広げられた戦争で「製造」された兵士の骨は、リンPの製造に使用されました。
しかし、後に世界各地でリン酸カルシウムCa3(PO4)2を主成分とするリン鉱石(燐灰石)を含む岩場が発見され、ようやく簡単に安く手に入るようになりました。リン鉱石Ca3(PO4)2からリンPを大量生産する方法は、1867年にエドワール・オーベルタンとレオポルド・ボブリークが確立しました。まず、リン鉱石Ca3(PO4)2をケイ砂SiO2やコークスCと混ぜて電気炉で加熱します。発生したリン蒸気を水中に導いて固化させると、リンPが得られます。こうして得られる単体は黄リンP4であり、空気のない条件で約250℃で加熱すると、徐々に赤リンPxに変わってきます。
2Ca3(PO4)2 + 6SiO2 + 10C → 6CaSiO3 + 10CO + P4
(ii) 十酸化四リンP4O10
リンPを過剰の乾燥空気、または酸素中で燃焼させると、十酸化四リンP4O10の白煙を生じます。十酸化四リンP4O10は、組成式にするとP2O5となるので、五酸化二リンと呼ばれることもあります。十酸化四リンP4O10は、吸湿性や脱水性の強い白色結晶で、強力な酸性乾燥剤として用いられます。硫酸H2SO4や硝酸HNO3を脱水することができ、それぞれから三酸化硫黄SO3や五酸化二窒素N2O5が得られます。
4P + 5O2 → P4O10
H2SO4 → SO3 + H2O
2HNO3 → N2O5 + H2O
(iii) リン酸H3PO4
十酸化四リンP4O10は、水H2Oに対する反応性が高く、音と熱を発しながら溶解し、リン酸H3PO4を生成します。工業的にリン酸H3PO4を得る場合は、細かく砕いたリン鉱石Ca3(PO4)2に硫酸H2SO4を1:3の割合で作用させます。このときに副生する硫酸カルシウムCaSO4は、ろ過により除去することができます。リン酸H3PO4は、分子間に水素結合を多く形成できる分子性物質であり、常温では白色固体(m.p.42℃)です。潮解性があり、水H2Oによく溶けて、中程度の酸性を示します。
P4O10 + 6H2O → 4H3PO4
Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
リン酸H3PO4は、生化学において最も重要なオキソ酸であり、DANやRNA、ATPを構成する成分として非常に重要です。生化学反応では、低分子化合物の代謝において、リン酸H3PO4が付加した化合物が中間体として用いられることが多いです。また、タンパク質の機能調節においても、リン酸化は重要です。この他、リン酸H3PO4は、肥料や洗剤の製造、清涼飲料水の酸味料など、その用途は幅広いです。
図.28 リン酸H3PO4はDNAを構成する成分として重要である
リン酸H3PO4には、渋味を伴う独特な酸味があり、コーラなどの清涼飲料水に添加されています。子供の頃、親から「コーラを飲むと骨が溶ける」と脅された経験がある人は少なくないのではないかと思います。しかし、「コーラを飲んでいて骨が溶けた」という話は、ほとんど聞いたことがありません。リン酸H3PO4を含むコーラのpHは2.2なので、抜けた歯や魚の骨などを長時間コーラに漬けておくと、酸性によって歯や骨からカルシウムイオンCa2+ が溶出してボロボロになります。しかし、酸を含んだ食べ物や飲み物が、人間の体内で骨に直接触れることはありません。また、口に含んだときも、歯に触れている時間が短い上、唾液による希釈や緩衝作用によって、歯は酸から守られています。「コーラに歯や骨を長時間漬けると溶ける」という現象から、「コーラを飲むと骨が溶ける」という都市伝説が生まれたのだと思われます。

図.29 「コーラを飲むと骨が溶ける」というのは都市伝説
しかしながら、リン酸H3PO4を含む清涼飲料水を摂り過ぎると、骨の合成に悪影響を及ぼす可能性があります。公益財団法人骨粗鬆症財団は、「コーラにはリン酸H3PO4が多く含まれており、大量に飲むとカルシウムCaの吸収を妨げる恐れがある」と指摘しています。大量にリン酸H3PO4を摂取すると、腸の中でリン酸カルシウムCa3(PO4)2の結晶となり、カルシウムCaが腸管で吸収されなくなってしまうのです。そのため、リンPの摂り過ぎには注意が必要で、カルシウムCaの2倍ぐらいまでが上限とされています。実際に2015年の国民健康・栄養調査を見てみると、栄養素等摂取量(1歳以上、男女計、年齢階級別)は、「カルシウム517 mg、リン990 mg」となっています。けれども、この調査では、食品添加物としてのリン酸H3PO4の量は加算されていません。私たちの実際のリンP摂取量は、これより多いと予想されます。現状、多くの現代人は、カルシウムCaの2倍以上のリンPを摂取している状態なのです。
(iv) ヒドロキシアパタイトCa5(PO4)3(OH)
ヒドロキシアパタイトCa5(PO4)3(OH)は、動物の歯や骨の主要な構成成分です。動物の歯や骨の組成は、概ね65%がヒドロキシアパタイトCa5(PO4)3(OH)で、25%がコラーゲンなどのタンパク質、残りの10%は水分になります。骨の構造は、よく建物の鉄筋コンクリートに例えられていますが、コラーゲンが鉄骨で、ヒドロキシアパタイトCa5(PO4)3(OH)がコンクリートです。ヒドロキシアパタイトCa5(PO4)3(OH)がコラーゲン繊維に付着することで、丈夫な骨ができるのです。動物の歯や骨は、カルシウムCaの塊だと思っている人が多いようですが、純粋なカルシウムCaは金属です。無機物質と有機物質の特徴を活かすように設計された骨や歯は、天然に存在する優れた無機/有機複合材料の好例といえます。
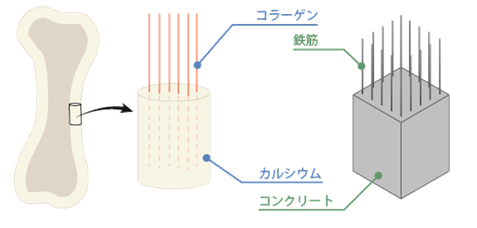
図.30 骨の構造は鉄筋コンクリートに似ている
ヒドロキシアパタイトCa5(PO4)3(OH)に含まれる水酸化物イオンOH− は、他の陰イオンと比較的容易に置換され、フッ化物イオンF− などに置換します。フッ化物イオンF− は、ヒドロキシアパタイトCa5(PO4)3(OH)の耐酸性を高めるとされています。歯磨き粉などにフッ化ナトリウムNaFが配合されているのは、この効果を狙ったものです。虫歯予防のために、水道水にフッ化ナトリウムNaFを0.6〜0.8ppm添加すると、虫歯が50〜60%減少するという社会研究もあります。実際にアメリカでは、虫歯予防のために、水道水に工業過程で副産するヘキサフルオロケイ酸ナトリウムNa2SiF6などのフッ化物を混ぜています。米国疾病予防センターは、「飲料水をフッ素化することは、20世紀における公衆衛生上の10の偉大な業績の1つである」と誇っています。そのため、「日本でも水道水をフッ素化してはどうか」という意見がよく出ますが、日本人が愛飲する緑茶には、比較的豊富にフッ素Fが含まれているので、フッ素化は不要と見られています。それに過剰なフッ素摂取は、代謝障害を引き起こす恐れがあるので注意が必要です。
Ca5(PO4)3(OH) + F− ⇄ Ca5(PO4)3F + OH−
また、キシリトールは、「虫歯を予防する糖」として有名です。多くのチューインガムがキシリトールを採用し、まるで「虫歯の特効薬」のように宣伝されています。しかし、キシリトールを摂取することで、虫歯を治療することはできません。というのも、キシリトールは、「口内細菌の作用によって、酸に変化することがない」というだけであって、虫歯の原因になることはなくても、虫歯を積極的に治療する力はないからです。しかしながら、キシリトールの甘味の強さは、グルコースとほぼ同じなのにも関わらず、カロリーは40%も少ないですから、多少のダイエット効果は期待できるかもしれません。

図.31 キシリトールは、甘味の質が良く、カロリーはグルコースより約4割も低い
(v) 過リン酸石灰
リン肥料として使われる「過リン酸石灰(superphosphate)」は、「農芸化学の父」ともいわれるユストゥス・リービッヒ(高校化学では、リービッヒ冷却器で有名)が、1840年に開発したものです。リービッヒは、従来肥料として用いていた骨粉Ca3(PO4)2に硫酸H2SO4を1:2の割合で作用させると、リン酸二水素カルシウムCa(H2PO4)2が生成し、肥料としての能力が増すことに気が付いたのです。1843年に建設された世界初の化学肥料工場では、ロンドンのガス工場で製造した硫酸H2SO4と、市内の食肉処理場で出た骨粉Ca3(PO4)2を反応させ、過リン酸石灰の顆粒を作っていました。
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
なお、過リン酸石灰は純物質ではなく、リン酸二水素カルシウムCa(H2PO4)2と硫酸カルシウムCaSO4の混合物です。リン酸カルシウムCa3(PO4)2は水に溶けにくい塩ですが、リン酸二水素カルシウムCa(H2PO4)2は水溶性の塩です。リン酸二水素カルシウムCa(H2PO4)2が水に溶けるとリン酸二水素イオンH2PO4− を電離して、これが植物に吸収されます。過リン酸石灰は、主成分が水溶性のため、即効性があります。ただし、過リン酸石灰は、日本のような火山性土壌では、アルミノケイ酸塩と結合して植物が吸収できなくなります。このため、有機肥料や土壌改良剤と一緒に使って、吸収されやすくなるようにします。

図.32 リン肥料として用いられる過リン酸石灰
・参考文献
1) 遠藤瑞己「化学と歴史のネタ帳 I. 酸とアルカリ」文彩堂出版(2024年発行)
2) 大東孝司「プラグマティック化学」河合出版(2017年発行)
3) 齊藤勝裕勝裕「最強の「毒物」はどれだ?」技術評論社(2014年発行)
4) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
5) 桜井弘「元素118の新知識 引いて重宝、読んでおもしろい」講談社(2017年発行)
6) 左巻健男「面白くて眠れなくなる元素」PHP研究所 (2016年発行)
7) セオドア・グレイ「世界で一番美しい元素図巻」創元社(2011年発行)
8) ジョー・シュワルツ「シュワルツ博士の化学はこんなに面白い」主婦の友社(2002年発行)
9) トレヴァー・ノートン「世にも奇妙な人体実験の歴史」文藝春秋(2012年発行)
10) 難波哲哉「アンモニア合成と利用における新たな展開」化学と教育67巻11号(2019年)
11) Peter W. Atkins著/千原秀昭・稲葉章訳「分子と人間」東京化学同人(1993年発行)
12) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)
13) メートランド・ジョーンズ「ジョーンズ有機化学(上)」東京化学同人(2000年発行)
14) 山北篤「現代知識チートマニュアル」新紀元社(2017年発行)
15) レスリー・デンディ/メル・ボーリング「自分の体で実験したい―命がけの科学者列伝―」紀伊國屋書店(2007年発行)