・溶液化学(溶液と溶解度)
【目次】
(1) 溶液とは何か?
ある液体に異なる1成分以上の物質が溶けた混合物のことを、「溶液(solution)」といいます。通常、溶かす方の主要な液体成分のことを「溶媒(solvent)」といい、溶ける方のその他の成分のことを「溶質(solute)」といいます。溶液は、溶媒分子と溶質分子とが、均一にかつ無秩序に分散している混合物のことです。放置しておくと沈殿を生じたり、濁っていたりする液体は、一般的に溶液とはいいません。例として、次の表.1に、身近な水溶液を示します。
表.1 身近な水溶液
|
水溶液 |
溶媒 |
主な溶質 |
|
食塩水 |
水 |
塩化ナトリウム |
|
炭酸水 |
水 |
二酸化炭素 |
|
塩酸 |
水 |
塩化水素 |
|
海水 |
水 |
塩化ナトリウム |
|
かん水 |
水 |
炭酸ナトリウム |
|
ウイスキー |
水 |
エタノール |
一般的に、牛乳や泥水などの濁っている液体は、水溶液とはいいません。これらの液体は、「コロイド(colloid)」と呼ばれる分散系です。コロイドは、直径が大体1 nm(10-9 m)~1 μm(10-6 m)程度の原子と比べて比較的大きな粒子が分散している系のことです。溶液では、溶質粒子が0.1 nm(10-10 m)の次元までバラバラに分散しているので、コロイドとは区別しています。コロイド粒子の大きさは、大体ろ紙を通過して、半透膜を通過しない程度の大きさです。この性質を使用すれば、分子とコロイド粒子を分けることができます。濁っていたり、粘りがあってドロドロとしていたりする液体のほとんどは、一般的にコロイドであることが多いです(コロイド化学を参照)。
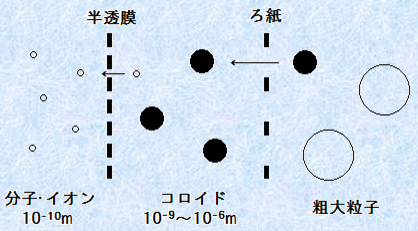
図.1 コロイド粒子の大きさ
また、溶媒に溶解したときに、陽イオンと陰イオンに分かれる物質を「電解質(electrolyte)」といい、この現象を「電離(ionization)」といいます。それに対して、溶媒中で溶解しても、イオンに電離しない物質を「非電解質(nonelectrolyte)」といいます。電解質を水などに溶かした溶液のことを電解質液といいますが、電解質液は、ある一定以上の電圧をかけると電気伝導性を示します。これは、電荷を持った陽イオンや陰イオンが、電荷のキャリアとして働くからです。電解質液に電流を流すと、陽極には陰イオンが集まり、陰極には陽イオンが集まり、電子e- の受け渡しが起こることにより、酸化還元反応が起きて、電気分解が起こります。
(2) 溶解とは何か?
水に塩化ナトリウムNaClの結晶を少量加えてかき混ぜると、塩化ナトリウムNaClは水に溶けて、均一な液体になります。このような現象を「溶解(dissolution)」といいます。溶質粒子は、多数の溶媒分子と「溶媒和(solvation)」して、均一に分散していくことにより溶解します。特に溶媒が水の場合の溶媒和を「水和(hydration)」といい、水和されたイオンを「水和イオン(hydrated ions)」と呼びます。このように、溶解するときに水和が起きる理由は、分散して不安定になっている溶媒中のイオンを安定化するためです。
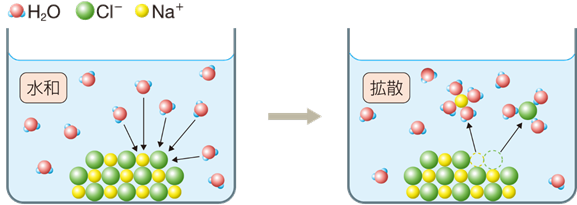
図.2 イオンの水和
電荷を持ったイオンが単独で存在するには、通常数千度の高温条件でなければいけません。水中でイオンが存在するからには、イオンに見合う電荷を持った物質が、イオンの周りに存在していなければならないのです。水中では、水分子がその役割を果たします。水分子H2Oは、酸素Oと水素Hとの共有結合間に極性があり、酸素原子は部分的に負の電荷を持ち、水素原子は部分的に正の電荷を持ちます。水和するときには、陽イオンに対しては酸素原子が相互作用し、陰イオンに対しては水素原子が相互作用することにより、部分電荷を互いに中和して、水中でもイオンが安定に存在できるようになるのです。
また、溶質がイオンに電離していなくとも、溶質の構造中で極性の大きな部分は水分子と相互作用するので、「親水基(hydrophilic group)」と呼ばれます。一方で、極性の小さな部分は溶媒の水分子とは相互作用しないので、「疎水基(hydrophobic group)」と呼ばれます。このような構造を両方持つ物質としては、エタノールC2H5OHなどの有機化合物があります。エタノールC2H5OHのヒドロキシ基(-OH)は親水性を示し、水分子と水素結合をすることにより水和されます。しかし、エチル基(-C2H5)は疎水性を示すので、水和は起きません。
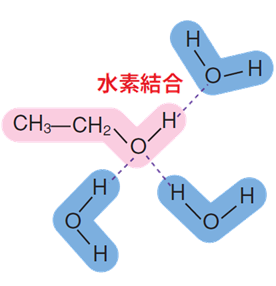
図.3 エタノールC2H5OHの水和
水H2Oなどの極性の大きな分子からなる溶媒を「極性溶媒(polar solvent)」といい、ベンゼンC6H6やヘキサンC6H14などの極性の小さな分子からなる溶媒を「無極性溶媒(nonpolar solvent)」といいます。一般的に物質の溶解性は、溶質粒子間の結合力と溶質粒子と溶媒粒子間の結合力の強弱で決まることが多く、極性の似たもの同士がよく混合します。例えば、塩化ナトリウムNaClなどのイオン結晶は、極性溶媒である水H2Oには溶けやすいですが、無極性溶媒であるベンゼンC6H6やヘキサンC6H14には溶けにくいです。一方で、ヨウ素I2などの無極性分子結晶は、極性溶媒である水H2Oには溶けにくく、無極性溶媒であるベンゼンC6H6やヘキサンC6H14に溶けやすいです。次の表.2に、溶媒による溶解性の違いを示します。
表.2 溶媒による溶解性の違い
|
|
極性溶媒 |
無極性溶媒 |
|
イオン結晶 |
溶けるものが多い |
溶けにくい |
|
分子性物質 |
極性分子は溶けるものが多い |
無極性分子は溶けるものが多い |
分子性物質の溶解性については、一般的には極性の大きな物質同士、極性の小さな物質同士では混合が起こりやすいのです。しかし、分子量の大きな分子では、分子の中に極性のある部分と無極性の部分が混在することが多く、溶けるか否かの判断が難しくなります。一般的には、ヒドロキシ基(-OH)やカルボニル基(-CO-)のような親水基1個当たりに3個の炭素までぐらいなら、水に溶ける力の方が強いです。また、塩化水素HClと水H2Oのように、溶質が溶媒と反応することによって、よく溶ける場合もあります。
表.3 分子性物質の溶解性
|
溶質 |
H2O(極性溶媒) |
CCl4(無極性溶媒) |
備考 |
|
CH3CH2CH2CH2CH3 |
× |
〇 |
ペンタンC5H12は無極性分子 |
|
CH3OH |
〇 |
× |
メタノールは極性分子CH3OH |
|
CH3CH2CH2CH2OH |
△ |
〇 |
-OH基1個に対してCが4個 |
|
CH3COCH3 |
〇 |
△ |
-CO-基1個に対してCが3個 |
|
HCl |
〇 |
× |
水と反応する(HCl+H2O→Cl-+H3O+) |
なお、イオン結晶の溶解性については、イオンと極性分子間の相互作用により安定化が起こるので、極性溶媒になら溶ける物質が多いです。ただし、すべてのイオン結晶が、水に溶けやすいという訳ではありません。塩化銀AgClや硫酸バリウムBaSO4のように、水に溶けにくいイオン結晶もあります。イオン結晶の水に対する溶解性は、かなり複雑な要因が絡み合っており、単純には論じられないのです(無機化学(沈殿生成反応)を参照)。
(3) 濃度
「濃度(concentration)」とは、注目している物質が、混合物中の基準量に対してどれだけ含まれているのかを示した値です。溶液の濃度の定義は何種類かあり、単位は使用目的に応じて、使いやすいものを使います。ただし、溶液の基準量を考えるとき、それが用意した溶媒の量なのか、できあがった溶液全体の量なのかで、考え方が変わってきます。濃度を扱うときは、単位に気を付けるとともに、基準量が何なのかを、しっかりと理解しておく必要があります。
(i) 質量百分率濃度〔%〕
溶液中に溶けている溶質の質量の割合を百分率で示した濃度を、「質量百分率濃度(percent concentration of mass)」といいます。質量百分率濃度は、溶液100 g中に含まれる溶質の質量を表します。質量百分率濃度を示す記号には、「%」または「wt%」を用います。
なお、大気中や河川中の汚染物質などのように、混合物中の微量成分の割合を表す場合などには、全体の100万分の1を表す記号である「ppm(百万分率:parts per million)」や、10億分の1を表す記号である「ppb(十億分率:parts per billion)」などもよく用いられます。「1 ppm」の濃度とは、家庭の浴槽に水を一杯に張っておいて、異物を1滴垂らして、かき混ぜたときの濃度です。「ppm」や「ppb」は、混合物中の微量成分の割合(微量成分の質量/混合物の質量)に106もしくは109を掛けることで求まります。また、血中アルコール濃度などを表すときには、「‰(千分率:permil)」を用いることもあります。
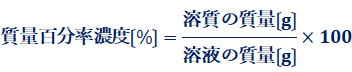
(ii) 体積百分率〔%〕
溶液中に溶けている溶質の体積の割合を百分率で示した濃度を、「体積百分率濃度(percent concentration of volume)」いいます。体積百分率濃度は、溶液100 cm3中に含まれる溶質の体積を表します。体積百分率濃度を示す記号には、「%」または「vol%」を用います。これは、溶質が固体ではなく、気体であるときなどによく用いられる濃度です。
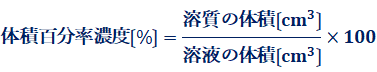
(iii) モル濃度〔mol/L〕
溶液1 L中に溶けている溶質の量を物質量molで示した濃度を、「モル濃度(molar concentration)」といます。モル濃度を示す単位には、「mol/L」を用います。例えば、c mol/Lの溶液がV mLあるとき、その溶液に含まれる溶質の物質量はcV /1000 molとなります。このように、モル濃度は溶液の体積を量ることで、溶液中の溶質の物質量が分かるという長所あり、化学ではよく用いられる濃度です。
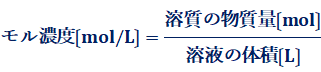
(iv) 質量モル濃度〔mol/kg〕
溶媒1 kg中に溶けている溶質の量を物質量molで示した濃度を、「質量モル濃度(molality)」といいます。質量モル濃度を示す単位には、「mol/kg」を用います。単位「mol/L」で表すモル濃度の方は、溶液の体積を用いるので、温度や圧力などが変化すると、溶液の体積が変化してしまい、濃度が微妙に変化してしまいます。しかし、単位「mol/kg」で表す質量モル濃度の方は、溶媒の質量が基準となっているので、温度や圧力の影響を受けません。したがって、沸点上昇や凝固点降下などの温度変化を伴う実験では、質量モル濃度の方が好まれて使われる傾向があります。
なお、溶媒の物質量に比べて、溶質の物質量がずっと小さな希薄溶液では、モル濃度(mol/L)と質量モル濃度(mol/kg)の値は、ほとんど等しくなります。具体的には、0.1 mol/L以下の濃度の希薄溶液では、そのモル濃度の値は、質量モル濃度とほとんど等しいと見なすことができます。
(4) 固体の溶解度
溶媒中に溶質の固体を入れて放置しておくと、一部が溶け出してきます。しかし、溶け出した粒子の中には、析出して元の固体に戻るものも出てくるので、固体が十分に存在していれば、いずれは溶解速度と析出速度がつり合い、見かけ上の変化がなくなります。この状態を「溶解平衡(solubility equilibrium)」といい、このときの溶液を「飽和溶液(saturated solution)」といいます。
例として、易溶性塩である塩化ナトリウムNaClと難溶性塩である塩化銀AgClが、それぞれSだけ水に溶けて、平衡状態になっているときを考えましょう。このときの平衡定数をKとすると、それぞれK=[Na+][Cl-]とK=[Ag+][Cl-]のように書けます([NaCl(固)]と[AgCl(固)]は固体なので、平衡定数Kの式には書きません)。溶解平衡が成り立っているときは、新たに結晶を加えても、溶解量Sは増えません。つまり、この溶解平衡では、[Na+][Cl-]と[Ag+][Cl-]は、次のような一定値S2と表せるのです。
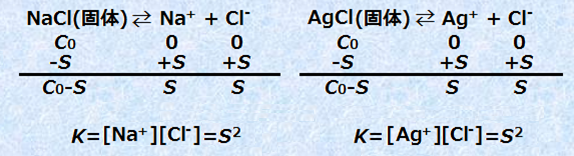
図.4 易溶性塩NaClと難溶性塩AgClの溶解平衡
よって、いずれの場合でも、物質の種類や溶けやすさによらず、平衡状態での変化量Sは一定となり、このSのことを一般的に「溶解度(solubility)」と呼びます。溶解度は、溶解平衡における変化量のことですが、分かりやすく言えば、「一定量の溶媒に溶ける溶質の限度量」のことを表します。ただし、溶解平衡では、2つのイオン濃度の積S2が一定値であるのだから、別の物質を加えて、一方のイオン濃度を増加させると、溶解度Sは減少してしまいます。例えば、[Ag+][Cl-]=10-10であるから、塩酸HClを0.1 mol/Lになるように加えると、溶解度Sは次のようになります。
[Ag+][Cl-]=S×(0.1+S )=10-10
∴ S≒10-9
塩化銀AgClは難溶性塩(S<<1)なので、S2≒0と近似できます。よって、塩化銀AgClの溶解度Sは、塩酸HClがなかったときのS=10-5 からS≒10-9 にまで減少します。一般的にある電解質の水溶液にその電解質を構成するイオンと同じ種類のイオンを生じる別の物質を加えると、元の電解質の溶解度や電離度は小さくなります。このような現象を、「共通イオン効果(common ion effect)」といいます。塩化銀AgClのような難溶性塩は、イオン濃度の積S2が小さいため、共通イオンがあると溶解度Sが大きく変わってしまうのです。
しかし、塩化ナトリウムNaClのような易溶性塩の場合は、[Na+][Cl-]=50のようにイオン濃度の積S2が非常に大きくなります。このような場合、共通イオンの効果は、溶解度Sに対してあまり効いてきません。そこで、易溶性塩については、共通イオンの効果を無視して、塩の溶解度は「ある温度では一定値を取る」と考えて計算を行います。このときの固体の溶解度は、一般的に溶媒100 gに溶ける溶質の限度量〔g〕で表します。
|
・難溶性塩の場合は、共通イオン効果の影響が強く、溶解度が大きく変わる ・易溶性塩の場合は、共通イオン効果の影響が小さく、溶解度はその温度でほぼ一定 |
なお、硫酸銅(II)五水和物CuSO4・5H2Oのように、結晶が水和水を持っている物質の溶解度は、溶媒100 gに溶ける無水塩の質量〔g〕で表します。これは、水和物が水に溶けると水和水が分離して、水和水が溶媒の水と一緒になるからです。
CuSO4・5H2O → CuSO4 + 5H2O
したがって、一種の塩を含む温度t℃の飽和溶液では、無水物であろうと水和物であろうと、一般的に次ような関係が成り立ちます。温度を変化させたりして、結晶が析出するような場合でも、この関係について同じ温度で比例式を作れば、計算で結晶の析出量を簡単に求めることができます。
|
t℃において、
※ t℃における溶解度を |
また、このような問題では、温度と溶解度の関係を示したグラフが与えられることが多く、次の図.5のようなグラフを「溶解度曲線(solubility curve)」といいます。
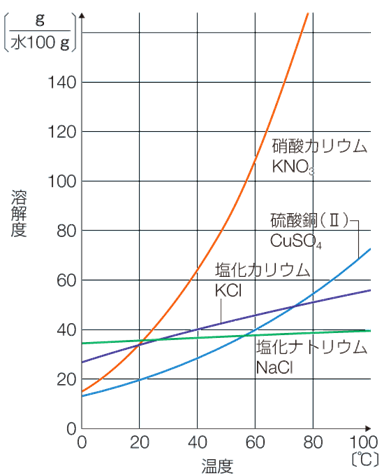
図.5 溶解度曲線
水に対する固体の溶解度は、温度の上昇と共に大きくなる場合が多いです。この理由は、固体の溶解反応の多くが、エネルギー的に不安定になる吸熱反応(ΔH>0)だからです。イオン結晶のような固体は、水に溶解すると、水和によりエネルギー的に安定になろうとします。しかし、その安定化の効果は、イオン結晶を構成する陽イオンと陰イオン同士のクーロン力による安定化には、遠く及びません。したがって、固体の溶解反応を表す次の平衡は、温度を上げると右へ移動するのです。
A(固) ⇄ A(aq) ΔH>0
ところで、図.5の溶解度曲線において、食塩NaClの溶解度は、温度を上げてもあまり変化しません。この理由は、食塩NaClの溶解エンタルピーが小さいからです。一方で、硝酸カリウムKNO3のように溶解エンタルピーが大きい物質は、温度を上げると、溶解度が大きく変化します。
NaCl(固) + aq → Na+aq + Cl-aq ΔH =4.2 kJ
KNO3(固) + aq → K+aq + NO3-aq ΔH =34.9 kJ
さらに、硝酸カリウムKNO3のような温度変化による溶解度変化の大きな物質では、高温の飽和溶液を冷却することにより、純粋な固体を析出させることができます。このとき、溶液中に不純物が少量存在しても、その濃度は小さいので、冷却したときに不純物は析出せず、高純度の硝酸カリウムKNO3の結晶だけが得られます。このように溶解度の差を利用することで、不純物を含む粗結晶を純結晶に精製することができるのです。この操作のことを「再結晶(recrystallization)」といいます。再結晶は、不純物を含む生成物を精製するときによく用いられる方法です。
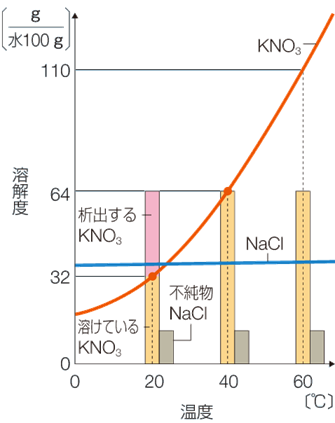
図.6 溶解度の差を利用する再結晶
再結晶を行うことで、粗結晶をより良質で不純物の少ない大きな純結晶にすることができます。これは、大きな結晶に比べて、小さな結晶の方の溶解速度が大きいことを利用したものです。小さな結晶の場合では、大きな結晶よりも全粒子数に対する表面粒子数の割合が大きいため、溶媒に接触している粒子数が相対的に多くなり、溶解速度が大きくなります。飽和溶液の温度を下げていき、結晶が析出し始めると、最初は大きな結晶も小さな結晶も析出してきますが、同時に析出した結晶が溶解する反応も起こります。このとき、小さな結晶の方が速く溶解していくため、小さな結晶は、大きな結晶が成長する材料となります。このように小さな結晶が溶解することで、大きな結晶だけが成長する現象を、「オストワルド熟成(Ostwald ripening)」といいます。

図.7 再結晶で析出した結晶
(5) 気体の溶解度
気体状態の物質A(気)が水に溶解して、A(aq)と平衡状態になったときを考えます。このときの平衡定数をKとすると、[A(aq)]は次のようになります。
A(気) ⇄ A(aq)
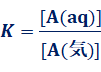
∴ [A(aq)]=K [A(気)] ・・・(1)
純物質の固体や液体では、分子やイオンなどの微粒子がぎっしりと詰まっているために、その濃度[A(固)]と[A(液)]は、事実上一定値となりました。しかし、気体の場合では、そのほとんどが空間であるために、濃度[A(気)]はほぼ任意の値を取ることができ、一定値と見なすことはできません。そこで、理想気体の状態方程式PV=nRTより、濃度[A(気)]を次のように表すことにします。
![]()
つまり、濃度[A(気)]は、その圧力PAに比例するということが分かります。さらに、式(2)を式(1)に代入すると、次のようになります。
![]()
気体定数Rと平衡定数Kは、温度Tが一定ならば一定値となるので、一定温度ならば、[A(aq)]は気体の圧力PAに比例すると見なすことができます。つまり、気体の溶解度は、溶解平衡の状態の圧力に比例するのです。このことは、一般的に「ヘンリーの法則(Henry's law)」で説明されます。ヘンリーの法則は、次のようなものです。
|
一定温度で一定量の溶媒に対して、溶解する気体の物質量は、溶解平衡の状態における圧力(混合気体の場合は、その成分の分圧)に比例する |
ただし、この法則は、溶媒に対する溶解度のあまり大きくない気体にしか適用することができません。この理由は、溶解度の大きい気体が溶解する場合、溶媒と溶質との相互作用が強すぎて、そもそものところ[A(溶液)]=K [A(気)]の平衡が成立しないからです。溶解度の大きい気体の場合、その溶解度は、圧力よりもそれ以外の溶媒和などの影響に依存するところが大きいのです。
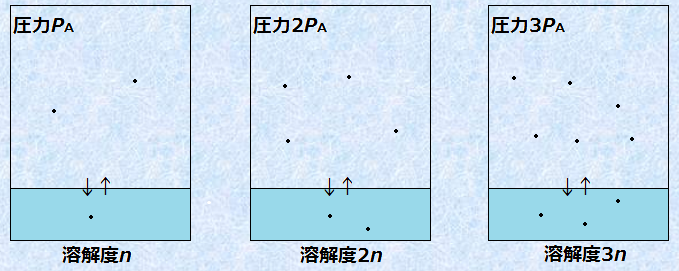
図.8 気体の溶解度は、溶解平衡の状態の圧力に比例する(ヘンリーの法則)
ヘンリーの法則は、「溶解する気体の物質量は溶解平衡時の圧力に比例する」ことを示すものです。しかしながら、物質量が比例するということは、「標準状態換算の体積とその質量も比例する」ということです。なお、ここで言う「標準状態換算の体積」というものは、溶液中に存在する分子を取り出して、標準状態(0℃, 1 atm)のもとで測定した体積のことです。標準状態においては、理想気体は1 molで22.4 Lの体積を占めるので、標準状態換算の体積が圧力に比例することは明白です。ヘンリーの法則では、物質量の代わりに、標準状態換算の体積を使うことも多いのです。
また、ヘンリーの法則の別表現として、「一定温度で一定量の溶媒に対して、溶解する気体の体積を溶解平衡時の圧力で表すと一定になる」というものもあります。これは、溶解する気体の体積を平衡時の圧力PAの状態で表すと、圧力PAによらず体積が一定値になるということを表現したものです。この表現は一見すると、先に説明した「溶解する気体の標準状態換算の体積が圧力に比例する」という事実に矛盾するように思えます。しかし、標準状態以外で気体の体積を決めるには、圧力と温度を決めなければならなかったことを思い出してください。
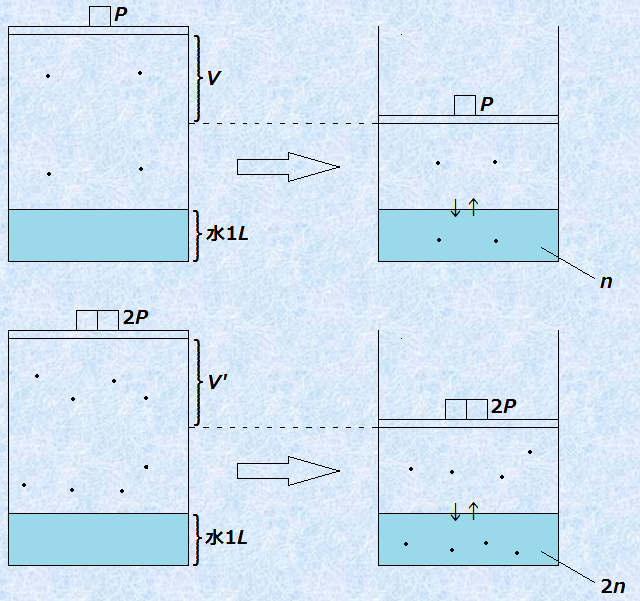
図.9 ヘンリーの法則の別表現
例えば、圧力Pかつ温度Tのもとで、気体Aが体積Vだけ溶解したとします。これが物質量nに相当したとして、理想気体の状態方程式PV=nRTより、体積Vを求めると次のようになります。
![]()
次に、圧力2Pかつ温度Tのもとで、気体Aが体積V’だけ溶解したとします。ヘンリーの法則より、溶解する気体の物質量は2倍になり、溶解量は2nと表せます。このときの体積V’は、次のようになります。
![]()
つまり、気体の圧力によらず、溶解する気体の体積の関係はV=V’となり、「どのような圧力でも溶ける体積は変わらない」という表現が、ヘンリーの法則と何ら矛盾していないことが証明できます。溶解する気体の物質量が2倍になっても、圧力が2倍になっている分で体積が1/2倍になってしまうので、これらが打ち消し合う結果、溶解する体積に差がなくなるのです。
|
一定温度で一定量の溶媒に対して、溶解する気体の体積を溶解平衡時の圧力で表すと、気体の体積は一定値となる |
(6) 潜水病
体内の組織や体液中に溶解していた気体が、環境圧の低下により、体内で気化して気泡を発生し、周辺組織を圧迫したり、血管を閉塞したりすることがあります。すると、疼痛や麻痺、めまいなどが発症し、死に至る場合もあります。このような障害を「潜水病(decompression sickness)」といいます。潜水病のメカニズムも、ヘンリーの法則で説明できます。ダイバーは水中で作業するとき、水深に従った高圧の空気を呼吸しなければなりません。すなわち、水圧は水深10 mごとに1 atmずつ増加するので、水深40 mでの圧力は5 atm、水深100 mでの圧力は11 atmなります。ちなみに、10 atmという値が示すのは、1 cm2当たりで約10 kgもの力がかかっているということです。
表.4 水深と水圧
|
水深 |
0 m |
10 m |
20 m |
30 m |
40 m |
50 m |
60 m |
70 m |
80 m |
90 m |
100 m |
|
水圧 |
1 atm |
2 atm |
3 atm |
4 atm |
5 atm |
6 atm |
7 atm |
8 atm |
9 atm |
10 atm |
11 atm |
通常の潜水で用いるボンベの中身は、酸素ではなく空気です。水深40 mの地点では、ダイバーは5×(1/5)=1 atmの酸素分圧の空気を吸うことになります。しかし、これは同時に5×(4/5)=4 atmの窒素を吸うことにもなります。このような高圧の状態では、血液中への空気の溶解度が増加しています。このうち、酸素はすぐに身体の組織で消費されますが、窒素はそのまま血液中に残り、やがて筋肉や脂肪組織にも蓄積されます。そして、窒素が体内の組織や体液中にたくさん溶解している状態で、深い水中から急浮上などをして、急速に周囲の圧力を低下させると、溶解していた窒素が溶けきれずに一気に気泡化し、血液は「死のシャンパン」と化してしまいます。
この窒素の気泡が、血液の流れを阻害するので、細胞に酸素や栄養分が行き渡らなくなります。また、血液中に気泡があると、血塊の形成を促す血小板の活動が刺激されます。組織の中に気泡ができると、細胞が変形したり裂けたりして、細胞が機能しなくなる恐れもあります。体内のどこの組織に気泡ができるかによって症状は異なりますが、最も一般的な症状は、膝や肩の関節に気泡が生じて、激痛が起こることです。特に、脳の毛細血管の血流が阻害されたりすると、脳細胞が壊死して、運動障害や知覚障害が生じるだけでなく、後遺症が残ることもあります。

図.10 深い水中から急浮上をすると、潜水病になる恐れがある
また、高分圧の窒素を摂取すると、血液に溶け込んだ窒素が、吸入麻酔薬と同じような働きをして、神経の情報伝達が阻害されます。このような症状を「窒素酔い」といいます。窒素酔いになると、アルコールに酔ったときと似ていて、気分が高揚します。そして、現実感を失い、手先の動きがおぼつかなくなって、理性を失った行動を取るようになります。高揚感は幻覚をもたらし、ダイバーを危険にさらします。自分のマウスピースを、目の前の魚に渡そうとしたダイバーもいるそうです。フランスの海洋学者であるジャック・クストーは、これを「深海の狂喜」と呼びました。「スキューバダイビングが感動的なのは、窒素酔いを引き起こすからだ」という説があるぐらいです。ダイバーの間では、「15 m深く潜るごとにマティーニを1杯飲んだ程度の麻酔効果が現れる」と昔から言われており、これを「マティーニの法則」と呼んでいます。つまり、15 m潜れば1杯、30 m潜れば2杯分のマティーニを飲んだときと同じような酩酊感が現れるのです。

図.11 マティーニは「カクテルの王様」とも呼ばれるジンベースのカクテル
スキューバダイビングなどをして、深いところまで潜水している場合は、体内の余分な窒素が呼吸によって排出されるまで、十分な時間をかけてゆっくりと浮上する必要があります。イギリスの生物学者であるジョン・スコット・ホールデンが確立した「ホールデンの原理(principle of Holden)」によれば、自分が潜水した最大深度の水圧の半分までは、急激に減圧しても安全であることが分かっています。つまり、ダイバーが減圧に注意する必要がない水深は、最大で10 m(水圧は2 atm)ということになります。それ以上深いところまで潜水した場合には、所定の水深で停止し、高い水圧によって血液中に溶け込んだ窒素を排出しながら、段階的に浮上しなければなりません。このように段階的な減圧が必要な理由は、8 atmから4 atmに減るときも、2 atmから1 atmに減るときも、体内に存在する気体の体積は同じだけ増えるからです。

図.12 ジョン・スコット・ホールデンは、勇敢な自己実験で生理学の礎を築いた
窒素酔いの危険性を考えると、深い水中で作業をする場合には、空気ボンベが使えません。圧縮空気を使う場合は、水深30 mまでが安全に潜水できる限度だとされています。それ以上深く潜るときは、供給する空気に含まれる窒素を、他のガスに置き換える必要があります。水深30 mより下では、一般に「ヘリオックス」と呼ばれる酸素とヘリウムの混合気体が使われます。ヘリウムは、水への溶解度が窒素の約40%と小さいので、血液中に溶ける量も少なく、生じる気泡の量が少ないのです。それに加えて、肺でのガス交換の速度が窒素よりも大きく、早く体外に排出されるので、窒素に比べて潜水病が起こりにくいという訳です。ただし、ヘリウムの欠点は、熱伝導率が高いことです。呼気を通じて大量の熱が体外へ逃げるため、ダイバーは身体を温めなければならない場合もあります。また、ヘリウムは空気よりも声帯を速く振動させるので、漫画のキャラクターのようにキーキーと甲高い「ドナルドダック・ボイス」になります。
ちなみに、スキューバダイビングによる世界記録は、エジプト人のアフメド・ガマル・ガブルが2014年9月に達成した332.35 mです。潜降を開始して15分でこの深度に達し、浮上には13時間35分を費やしました。ガマルは深度350 mを目標としていましたが、深海における高圧神経症候群に悩まされ、当初の目標を断念しました。水深が250 mより深くなると、そこは太陽に光も届かない暗闇の世界です。トレーニングをしていない一般人の素潜りでは、深度5 mあたりが限度でしょうから、この深度まで達するとは驚異的です。深度が100 mを超えると、そこの世界は、フランス語で「雄大な青」を意味する「グラン・ブルー」と呼ばれます。人類史上、初めて素潜りで100 mを超えたのは、フランス人のジャック・マイヨールです。マイヨールの自伝をもとに作成された映画「グランブルー(1998年)」は、世界的に大ヒットしました。

図.13 スキューバダイビングによる世界記録は332.35 mである
(7) 溶解の熱化学
気体の溶解度と温度の関係については、固体の場合と逆になります。すなわち、固体の溶解度は、温度の上昇と共に大きくなる場合が多いですが、気体の溶解度は、温度の上昇と共に溶解度が小さくなるのです。これは、溶媒の温度が高くなるほど、溶液中に溶けている気体分子の熱運動が激しくなり、溶液中から飛び出しやすくなるためです。さらに、このことは、気体の溶解反応が発熱反応(ΔH<0)であることを示しています。
A(気) ⇄ A(aq) ΔH<0
ちなみに、南国の海が透明なのは、気体が水に溶ける反応が発熱反応(ΔH<0)だからです。南国の海は水温が高いので、酸素の溶ける量が少なく、このためプランクトンも多くは生きられません。それ故に、南国の海水は透き通って見えるという訳です。一方で、北国の海は水温が低いので、比較的多くの酸素が溶けています。そのためにプランクトンが繁殖しやすく、海水が濁って見えるという訳です。その結果、プランクトンを食べる魚も、水温が低いほど豊富に育ちます。巨大なクジラが北極や南極の海に住んでいるのも、水温の低い方がエサとなるプランクトンが多いからです。
表.5 気体の溶解度(数値は水1 Lに溶ける標準状態換算の体積)
|
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
60℃ |
80℃ |
100℃ |
|
水素H2 |
0.0219 |
0.0197 |
0.0182 |
0.0172 |
0.0166 |
0.0164 |
- |
- |
|
窒素N2 |
0.0238 |
0.0190 |
0.0159 |
0.0138 |
0.0125 |
0.0111 |
- |
- |
|
酸素O2 |
0.0493 |
0.0383 |
0.0312 |
0.0265 |
0.0233 |
0.0198 |
- |
- |
|
二酸化炭素CO2 |
1.713 |
1.194 |
0.878 |
0.665 |
0.530 |
0.359 |
- |
- |
|
アンモニアNH3 |
476.8 |
392.2 |
318.9 |
257.0 |
205.9 |
130.4 |
81.6 |
50.6 |
|
塩化水素HCl |
510 |
480 |
453 |
432 |
419 |
349 |
- |
- |
気体が水などの溶媒に溶解すると、気体分子と溶媒分子が引き合って、エネルギー的に安定になります。したがって、気体の溶解反応は、エネルギー的に有利な発熱反応(ΔH<0)なのです。しかし、気体が溶解すると、自由に運動できていた状態がかなり制限を受けることになるため、乱雑さは減少してしまいます。つまり、この発熱による有利な効果と、乱雑さの減少による不利な効果がつり合って、溶解反応は平衡状態となるのです。また、固体の場合は、気体の場合と逆になります。すなわち、固体の溶解反応は、エネルギー的には不利な吸熱反応(ΔH>0)ですが、乱雑さは増加する反応です。
A(固) ⇄ A(aq) ΔH>0
A(気) ⇄ A(aq) ΔH<0
ル・シャトリエの法則によれば、系の温度を上げると、それを緩衝する方向へ平衡は移動します。つまり、一般的に溶解度は、温度の上昇と共に固体では増加し、気体では減少します。ただし、固体の場合では、反応エンタルピーが負の値(発熱反応)であるために、溶解度が温度の上昇と共に減少する物質もあります。このような物質としては、水酸化カルシウムCa(OH)2や酢酸カルシウム(CH3COO)2Ca、炭酸リチウムLi2CO3などが知られています。これらの物質の溶解反応は発熱的(ΔH<0)に起こるので、温度が上昇すると、気体と同じように溶解度が小さくなります。
Ca(OH)2 + aq → Ca2+aq + 2OH-aq ΔH =-16.7 kJ
ちなみに、水酸化ナトリウムNaOHの溶解は発熱的(ΔH<0)に起こりますが、温度が高いほど溶解度は大きくなります。この理由は、水酸化ナトリウムNaOHが、水に溶解するプロセスを考えると理解することができます。水酸化ナトリウムNaOHが水に溶けるときは、まず無水物が含水結晶になり、この含水結晶が水に溶解するというプロセスで起こります。私たちがいつも考えている水酸化ナトリウムNaOHの溶解は、この2つのプロセスを1つにまとめたものです。実はこの2つのプロセスで、含水結晶が溶解する反応は吸熱反応(ΔH>0)なのですが、無水物が含水結晶になる反応は発熱反応(ΔH<0)なのです。そして、無水物が含水結晶になるプロセスの発熱量が大きいので、全体として見かけ上は発熱反応(ΔH<0)に見えるという訳です。しかし、含水結晶が水に溶解する反応は吸熱反応(ΔH>0)なので、その溶解度は温度の上昇と共に大きくなります。
表.6 水酸化ナトリウムNaOHの溶解度
|
温度 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
60℃ |
80℃ |
|
溶解度〔g/100 g水〕 |
83.5 |
103 |
109 |
119 |
129 |
233 |
288 |
(8) 溶解度積
塩化ナトリウムNaClなどの易溶性塩の場合、その溶解度は共通イオン効果を無視して、「塩の溶解度はある温度で一定」と考えても問題ありませんでした。しかし、塩化銀AgClなどの難溶性塩の場合、その溶解度は共通イオンがあると大きく変わってしまうので、共通イオン効果を無視することはできません。したがって、難溶性塩については、塩の溶解度は溶解平衡の式を使って計算を行います。例として、イオン結晶MxNyが、水溶液中で溶解平衡の状態にあるときを考えます。
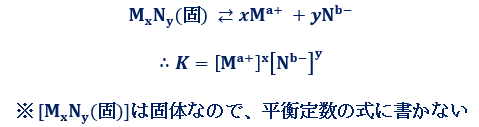
上式のように、溶解平衡においては、温度一定なら平衡定数K は一定値となり、これをイオン結晶MxNyの「溶解度積(solubility product)」といいます。一般的にKは、溶解平衡を表す場合はKspと表すことが多いです。
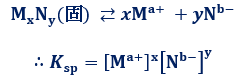
表.7 難溶性塩の溶解度積Ksp
|
化合物 |
温度〔℃〕 |
溶解度〔g/L〕 |
溶解度積Ksp |
|
AgCl |
25 |
1.93×10-3 |
[Ag+][Cl-]=1.8×10-10 |
|
AgBr |
25 |
1.35×10-4 |
[Ag+][Br-]=5.2×10-13 |
|
AgI |
20 |
3.4×10-5 |
[Ag+][I-]=2.1×10-14 |
|
CdS |
25 |
2.11×10-8 |
[Cd2+][S2-]=2.1×10-20 |
|
CuS |
25 |
2.44×10-13 |
[Cu2+][S2-]=6.5×10-30 |
|
PbS |
25 |
1.4×10-3 |
[Pb2+][S2-]=3.4×10-11 |
|
ZnS |
- |
1.43×10-7 |
[Zn2+][S2-]=2.2×10-18 |
|
Cu(OH)2 |
25 |
2.9×10-3 |
[Cu2+][OH-]2=1.1×10-13 |
|
Fe(OH)3 |
- |
3.6×10-8 |
[Fe3+][OH-]3=3.5×10-37 |
|
Zn(OH)2 |
25 |
1.2×10-2 |
[Zn2+][OH-]2=7.0×10-12 |
|
CaCO3 |
25 |
0.82 |
[Ca2+][CO32-]=6.7×10-5 |
|
PbSO4 |
25 |
4.52×10-2 |
[Pb2+][SO42-]=2.2×10-8 |
|
BaSO4 |
25 |
2.23×10-3 |
[Ba2+][SO42-]=9.1×10-11 |
|
Ag2CrO4 |
25 |
3.2×10-2 |
[Ag+]2[CrO42-]=3.6×10-12 |
|
PbCrO4 |
25 |
1.7×10-4 |
[Pb2+][CrO42-]=2.8×10-13 |
ちなみに、溶解度積Kspの値は、表.7の溶解度を使って求めることができます。例えば、25℃における塩化銀(I) AgClの溶解度は1.93×10-3 g/Lです。モル質量はAgCl=143なので、このときの溶解度積Kspは次のようになります。
AgCl(固) ⇄ Ag+ + Cl-
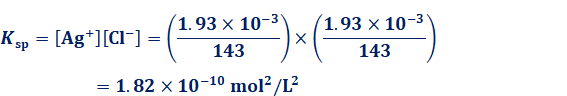
溶解度積Kspは、溶解平衡のときに成り立つ値です。溶解度積Kspの値を用いると、難溶性塩の沈殿が生じているときの溶液中の各イオン濃度が求められます。これを言い換えれば、溶液中で沈殿が生じているときは、必ず[Ma+]x[Nb-]y=Kspの関係が成り立つということです。つまり、溶液中の各イオン濃度の値から、沈殿が生じるかどうかの判断をすることができるのです。例として、a mol/LのMa+ 溶液V1 mLと、b mol/LのNb- 溶液V2 mLを混合したとします。このときに、「溶液中に沈殿は生じない」と仮定します。また、溶液の全体積は(V1+ V2) mLになるので、混合後のMa+ の濃度[Ma+]ifとNb- の濃度[Nb-]ifは、次のように求められます。
![]()
![]()
ここで、[Ma+]ifx[Nb-]ify=K’とすると、この値K’は溶解度積Kspと比較して、K’>Ksp・K’=Ksp・K ’<Kspのいずれかになります。溶解度積Kspは、沈殿が生じているときに成り立つ値なのだから、K’がKspよりも大きくなるということはありえません。したがって、K’>Kspならば、溶解平衡時に比べてイオンが多すぎるのであるから、K’=Kspになるまで余分な量が沈殿し、逆にK’≦Kspならば、溶解平衡にまだ達していないということになるので、沈殿は生じないということになります。
表.8 K’とKspについて
|
大小関係 |
沈殿の有無 |
溶液中のイオン濃度 |
|
K’>Ksp |
沈殿が生じる |
[Ma+]x[Nb-]y=Kspより求める |
|
K’=Ksp |
沈殿は生じない |
[Ma+]ifxと[Nb-]ifyに等しい(飽和溶液) |
|
K ’<Ksp |
沈殿は生じない |
[Ma+]ifxと[Nb-]ifyに等しい |
物質や条件が違うときに、沈殿が生じたり溶解したりするのは、溶解度積Kspが違ったり、Ma+とNb- の濃度が他の物質やpHの影響で変化したりするからです。溶解度積Kspは、難溶性塩の溶解度を教えてくれる値です。一般的に溶解度積Kspの値が小さいほど沈殿が生じやすく、溶解度積Kspの値が大きいほど塩の溶解度は大きくなります。
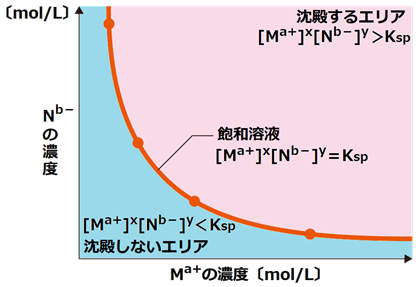
図.14 溶解度積Kspによる沈殿生成の判定
・参考文献
1) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
2) 卜部吉庸「化学の新研究」三省堂(2013年発行)
3) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
4)トレヴァー・ノートン「世にも奇妙な人体実験の歴史」文藝春秋(2012年発行)
5) F・アッシュクロフト 著/矢葉野薫 訳「人間はどこまで耐えられるのか」河出書房新社(2008年発行)
6) 山﨑昌廣「人体の限界」SBクリエイティブ株式会社(2018年発行)
7) 渡辺正/北條博彦 共著「高校で教わりたかった化学」日本評論社(2008年発行)