・遷移元素(亜鉛族元素)
【目次】
(1) 第12族元素
周期表において、第12族に属する亜鉛ZnやカドミウムCd、水銀Hgなどの元素を、総称して「亜鉛族元素」といいます。亜鉛族元素の原子は、いずれも最外殻電子配置がns2(n=4,5,6・・・)となります。内殻のd軌道は満たされているため、遷移金属の性質を示さず、どちらかというと典型元素の金属としての性質を示します。亜鉛族元素のd軌道は閉殻しているため、かつては典型元素に分類されていたこともありました。しかし、IUPACの最近の勧告では、遷移元素に12族が含まれるようになっているので、現在の定義では「第12族元素も遷移元素に含める」としています。
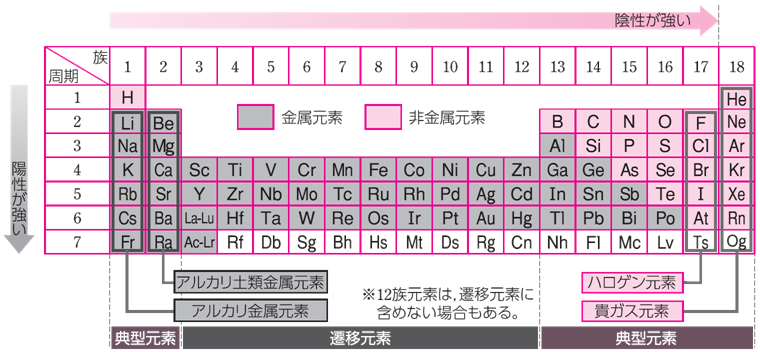
図.1 現在の定義では、第12族元素も遷移元素に含める
第12族の亜鉛族元素は、+2の酸化状態が最も安定です。亜鉛(II)イオンZn2+ とカドミウム(II)イオンCd2+ は性質がよく似ており、特にイオン半径が近いため、類似の塩を生成します。その一方で、水銀Hgは亜鉛ZnやカドミウムCdと異なり、金属としては室温で唯一液体です。また、亜鉛ZnやカドミウムCdが「卑金属(base metal)」であるのに対して、水銀Hgはイオン化傾向が水素H2より小さい金属という定義に従い、「貴金属(precious metal)」に分類されることもあるといった特徴を持ちます。水銀Hgでは、水銀(II)イオンHg2+ に加えて、水銀(I)イオンHg22+ ([Hg-Hg]2+)という状態も見られます。
その他、亜鉛族元素に共通する数少ない特徴としては、他の金属よりも蒸気圧が高く、揮発性が高いことがあげられます。周期表中で最上段の亜鉛Znは、原子半径が小さくて多少は金属結合が強いのですが、それでも融点は420℃で、沸点は907℃です。沸点が低いということは、冶金が難しいということでもあります。還元剤である木炭やコークスなどと一緒に加熱すると、温度は容易に1,000℃を超えてしまい、生成した亜鉛Znはすべて気体となって飛散してしまいます。ということで、亜鉛Znの単体がこの世界に現れたのは、17世紀の後半とかなり遅くなります。煙突の途中を水冷することによって、亜鉛Znを析出させる工夫は大発明でした。
(2) 亜鉛
(i) 亜鉛Zn
「亜鉛(zinc)」は、青味を帯びた銀白色の金属固体です。英語元素名「zinc」の原型である「zincum」という言葉は、16世紀の錬金術師であるパラケルススによって、亜鉛鉱石を炉で溶かしたときの堆積の様子から、「尖った先端」を意味する古代高地ドイツ語の「zink」に由来するとされています。亜鉛Znの単体は沸点が907℃と低く、冶金が難しかったため、得られたのは17世紀の後半です。原子は、価電子を2個持ち、2価の陽イオンになりやすいです。亜鉛Znは、イオン化傾向が比較的大きく、高温水蒸気と反応して、水素H2を発生させます。また、亜鉛Znは「両性元素」であり、酸や強塩基とも反応して、水素H2を発生させます。
Zn + H2O → ZnO(白) + H2
Zn + 2H+ → Zn2+(無色) + H2
Zn + 2OH- + 2H2O → [Zn(OH)4]2-(無色) + H2
工業的に亜鉛Znの単体を得る際には、まず閃亜鉛鉱ZnSなどを酸化して、酸化亜鉛(II) ZnOを生成させます。そして、酸化亜鉛(II) ZnOをコークスで還元するか、硫酸H2SO4に溶かして電気分解することで、亜鉛Znの単体を製造します。亜鉛Znは鉄Feよりもイオン化傾向が大きく、酸化されやすいので、鋼材に亜鉛めっきをして「亜鉛めっき鋼板」とすると、鋼材の防食になります。特に薄い鉄板に亜鉛めっきを施したものは、ポルトガル語の「tutanaga(亜鉛)」にちなんで「トタン」と呼ばれ、主に建築資材などとして利用されています。トタンは機械的な強度を高めるため、波状に加工してあるものを用いることが多いです。

図.2 トタンは、簡易な建築物の屋根や外壁に使われる
また、亜鉛Znの単体は、その「酸化のされやすさ」を活かして、電池の負極や犠牲陽極としての用途もあります。亜鉛Znは、水素過電圧が0.6〜0.7 Vと比較的大きくて、水素H2を発生させにくいので、電池の負極材料として適しています。イタリアの物理学者であるアレッサンドロ・ボルタが電池を作った(1800年)のは、亜鉛Znが小規模ながら工業的に生産され始めて間もない頃でした(電気化学(電池)を参照)。
「犠牲陽極(sacrificial anode)」というのは、鋼鉄製構造物に付けられた固体亜鉛の塊または厚板のことです。橋梁や鉄道道路、大型船の船体などの全体をめっきするのが困難な鋼鉄製構造物に、電気的に接続されます。亜鉛Znはイオン化傾向が鉄Feよりも大きいため、亜鉛Znの方が酸化されやすいです。亜鉛Znが酸化されるとき、亜鉛Znは鉄Feに対して電子e−を供与します。すなわち、亜鉛Znは鉄Feに対して還元剤として作用することで、鉄Feの内部で生じる電流を引き受け、鉄Feが錆びるのを防ぎます。亜鉛Znが持てる力をすべて使い果たしてボロボロになると、新しい犠牲陽極が再び取り付けられます。
Zn → Zn2+ + 2e−
Fe2+ + 2e− → Fe

図.3 亜鉛Znの犠牲陽極が優先的に錆びることで、鉄Feの酸化を防ぐ
亜鉛Znと銅Cuの合金は、「真鍮(黄銅)」として知られています。含有率は銅Cuの方が多く、亜鉛Znは下限で5%程度から、上限で30〜40%程度まで様々です。延展性に優れて加工性も良いので、精密機械や水洗便所の給水管、金管楽器、鉄道模型、仏具、弾丸の薬莢(やっきょう)などの素材として広く使用されています。また、日本で発行されている5円玉の素材としても使われています。金Auに似た美しい黄色の光沢を放つことから、金Auの代用品としても利用されます。日本の時代劇において、小道具として使われる偽の小判は、ほとんどが真鍮製のものです。

図.4 真鍮でできたトランペット
生体中の亜鉛Znの含量は、金属としては鉄Feに次いで多いです。例えば、体重70 kgの成人の体には、2.0 gの亜鉛Znが含まれています。現在までに、200種類を超える酵素の活性に関与しており、酵素の構造形成、およびその維持に不可欠な元素です。植物にとっても不可欠な元素で、豆を栽培する農家が、それまで亜鉛めっきした鉄パイプで給水していたのを、プラスチック製パイプで給水するように変えたところ、亜鉛不足になって大変な不作に陥ったという話があります。土壌中に亜鉛Znが少ない地域では、亜鉛めっきから溶け出す量でも、収穫量に大きな影響を与えるという好例です。
亜鉛Znの必須性は、1934年に動物での欠乏症が報告されましたが、ヒトに関しての確認は、1960年代以降になってからです。1961年にイランやイラクの農村部で、亜鉛欠乏症によって小児の成長が止まる「小人症」が発見されました。この病気は、臨床実験からパンなどに多く含まれる「フィチン酸」が胃の中で亜鉛Znと結合して、不溶性の物質を生成するために、亜鉛Znが体内に吸収されなくなって起こると理解されました。ただし、よほど偏った食事をしなければ、食物にフィチン酸が含まれていても、亜鉛Znの吸収が大きく抑制されることはないので、先進国ではまれな病気です。

図.5 イランでは、ピタ(平らな小麦粉のパン)だけを食べている地域で小人症が報告された
現在では、亜鉛Znの欠乏により、第二次性徴の発現不全や鉄欠乏性貧血、味覚障害、嗅覚障害などが生じることも明らかになっています。ヒトが1日に必要とする亜鉛Znの量は10〜15 mg程度ですが、不足がちになる金属イオンであり、亜鉛Znを含む錠剤や自然食品が販売されています。亜鉛欠乏症には、先天性の腸性肢端性皮膚炎や免疫異常、味覚異常などが知られています。また、2005年に日本人の血清亜鉛濃度が測定された結果、加齢と共に亜鉛Znが減少していることが明らかにされました。亜鉛Znを多く含む食品としては、カキ、カニ、寒天、海苔、レバー、そば粉、玄米、大豆、小豆などが挙げられます。

図.6 カキには、亜鉛Znをはじめとした様々な栄養素が多量に含まれ、「海のミルク」と呼ばれる
男性の場合では、適度な亜鉛Znの摂取は、精子形成の増加、および性欲増進の効果が見られます。それ故に、ときどき亜鉛Znの重要性を殊更に誇張して、「亜鉛は性のミネラル」などといったような文句で、亜鉛サプリの宣伝がなされることがあります。しかし、亜鉛Znの多量摂取により、男性機能が高まるという報告はありません。このような症状を強く感じても、それが亜鉛Znの摂取によるものであるとは断定できず、恐らく「プラセボ効果(偽薬効果)」によるものでしょう。あまりに亜鉛Znを摂り過ぎると、逆に亜鉛中毒を起こす恐れもあります。亜鉛中毒は、発育不良を引き起こし、皮膚を変質させ、脱毛などの症状をもたらすので、摂り過ぎには注意が必要です。
(ii) 水酸化亜鉛Zn(OH)2
亜鉛(II)イオンZn2+ を含む水溶液に、2当量の塩基を加えると、無定形のコロイド状の白色沈殿が得られます。この白色沈殿は、水酸化亜鉛(II) Zn(OH)2であり、「両性水酸化物」なので、酸にも塩基にも溶けて、無色の水溶液になります。
Zn2+ + 2OH- → Zn(OH)2↓(白)
Zn(OH)2 + 2HCl → ZnCl2(無色) + 2H2O
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4](無色)
また、水酸化亜鉛(II) Zn(OH)2の沈殿は、過剰のアンモニア水NH3にも、テトラアンミン亜鉛(II)イオン[Zn(NH3)4]2+ となって溶け、無色の水溶液となります。
Zn(OH)2 + 4NH3 → [Zn(NH3)4]2+(無色) + 2OH-

図.7 亜鉛イオンZn2+ の反応
(iii) 酸化亜鉛ZnO
亜鉛Znを空気中で加熱すると、速やかに酸化されて、白色の酸化亜鉛ZnOとなります。酸化亜鉛ZnOは、「亜鉛華」とも呼ばれ、水に溶けにくい白色粉末です。毒性の小さい白色顔料として、絵の具や化粧品、皮膚病や火傷の治療用の外用医薬品の原料、ベビーパウダーなどに用いられます。亜鉛Znを原料としたおしろいが使われるようになる前は、有毒な鉛Pbや水銀Hgを原料としたおしろいが主流であり、しばしば金属中毒を引き起こしていました。安全な酸化亜鉛ZnOのおしろいの登場は、毎日厚化粧をする歌舞伎役者や遊女にとって、福音だったに違いありません。酸化亜鉛ZnOもまた両性酸化物であり、酸にも塩基にも溶けて、無色の水溶液になります。
2Zn + O2 → 2ZnO (白)
ZnO + 2HCl → ZnCl2(無色) + 2H2O
ZnO + 2NaOH + H2O → Na2[Zn(OH)4](無色)
酸化亜鉛ZnOは、工業的なメタノールCH3OHの合成触媒としても用いられます。メタノールCH3OHは、酸化亜鉛ZnOを主体とする触媒を用いて、一酸化炭素COと水素H2から合成されています。メタノールCH3OHは重要な化学品であり、世界のメタノールCH3OH製造量は、年間でおよそ1,100万tにも達しています(アルコールを参照)。

図.8 工業的なメタノールCH3OHの合成反応
(iv) 硫化亜鉛ZnS
亜鉛(II)イオンZn2+ を含む水溶液に、硫化水素H2Sを通じると、硫化亜鉛ZnSの白色沈殿が生じます。硫化亜鉛ZnSは、天然では、「閃亜鉛鉱」として産出します。ただし、硫化亜鉛ZnSは、強酸性条件では[S2-]が小さくなるので、沈殿しません(無機化学(無機化学反応)を参照)。硫化亜鉛ZnSが沈殿するのは、中性〜塩基性条件下です。
Zn2+ + H2S → ZnS↓(白) + 2H+
(3) カドミウム
(i) カドミウムCd
「カドミウム(cadmium)」は、銀白色で軟らかく、延展性に富む金属です。比較的錆びにくく、美しい金属光沢を持ちますが、湿気の多い空気中では、徐々に酸化されて灰色になり、光沢を失います。カドミウムCdの化学的挙動は、亜鉛Znと非常によく似ており、亜鉛鉱にも約1%含まれています。そのため、カドミウムCdは、亜鉛精錬時の副産物として回収されます。なお、カドミウムCdは両性元素ではないので、酸には溶けますが、強塩基には溶けません。
Cd + 2H+ → Cd2+(無色) + H2
人体に対して有害な物質の多くは、体が受け付けずに、体内から速やかに排出されるのが普通です。しかし、カドミウムCdは、人体に不可欠な元素である亜鉛Znと化学的性質が似ているため、体内に蓄積しやすい性質を持ちます。体内に吸収されたカドミウムCdは、最初に肝臓に蓄積します。それからゆっくりと腎臓へ輸送され、肝臓障害や骨軟化症などを引き起こします。普通の人でも、カドミウムCdは血液中で0.0052 mg/Lが検出されますが、3〜330 mgの摂取によって中毒症状が現れ、致死量は1.5〜9 g程度です。日常の食事から摂取される量は0.007〜3 mgで、体重70 kgの人からは約50 mgのカドミウムCdが検出されます。カドミウムCdの生物学的半減期は、ラットやマウスで100〜300日、イヌで250〜500日、サルで4年、ヒトで10〜30年ほどです。
カドミウムCdの毒性によって腎臓に障害が出ると、尿からカルシウムCaが流出してしまい、骨が弱くなってしまいます。1910年代から1970年代にかけて、骨や関節が脆弱となる「イタイイタイ病」が大きな社会問題となりました。イタイイタイ病は、富山県神通川流域や群馬県安中市で発生した公害病です。カドミウム中毒によって症状が進行した患者が、骨の病変に伴う激痛のために「イタイ、イタイ」と訴えることから、その名が付けられました。この病気の原因は、神通川上流の神岡鉱山の亜鉛生産の副産物として産出するカドミウムCd、および安中市の亜鉛精錬所などから排出されたカドミウムCdであると考えられています。鉱山や精錬所から川に流出したカドミウムCdは、その水を使用する田畑に至り、土壌に蓄積されて農作物に吸収され、これらの農作物を食べた人が、カドミウムCdに汚染されたのです。

図.9 イタイイタイ病が大きな社会問題となった富山県神通川
カドミウムCdは、このように恐ろしい元素ではありますが、実用的な用途もいくつかあります。亜鉛Znと同様に水素過電圧が大きくて、水素H2を発生させにくいので、電池の負極材料に適しているのです。ニッケルカドミウム電池(ニッカド電池)の負極材料として、カドミウムCdは大量に用いられてきました。しかし、近年では、軽量で強力かつ低毒性であるニッケル水素電池やリチウムイオン電池の普及が進んでいるため、ニッカド電池の利用は徐々に減りつつあります。しかし、歴史が長く取り扱いのノウハウが豊富であること、電池がタフであること、生産コストが低いことなどの理由から、ラジコンやホビーの分野で、ニッカド電池は現在も広く使用されています。

図.10 ニッカド電池はラジコンやホビーの分野で人気の電池だが、需要は減りつつある
また、カドミウムCdは、めっき材料として、自動車関連業界で古くから用いられてきました。一般的な金属部品のめっきならば、亜鉛Znのめっきで十分です。しかし、「その金属部品が錆びないこと」が何よりも優先される場面では、カドミムCdの反応性の低さが重宝され、現在も利用されています。
(ii) 硫化カドミウムCdS
硫化カドミウムCdSは、水に溶けにくい黄色固体です。光を当てると電気伝導率が高くなる性質があり、光電素子として広く使われてきました。硫化カドミウムCdSは、カドミウム(II)イオンCd2+ を含む水溶液に、硫化水素H2Sを通じることで得られます。この反応は、強酸性条件でも起こるため、硫化カドミウムCdSは、塩酸HClなどを加えて強酸性にしても不溶です。
Cd2+ + H2S → CdS↓(黄) + 2H+
硫化カドミウムCdSは、深みのある鮮やかな黄色を呈し、耐熱性や耐光性にも優れるため、「カドミウムイエロー」として黄色の顔料に用いられます。道路の中央に引いてある黄線は、今でも硫化カドミウムCdSを用いています。日光にも酸性雨にも耐える黄色顔料は、硫化カドミウムCdSしかありません。水溶性が低く、カドミウム(II)イオンCd2+ が溶け出すことはほとんどないので、環境汚染の心配もありません。

図.11 道路の黄線に用いられる硫化カドミウムCdS
顔料としての硫化カドミウムCdSの魅力は、様々な不純物の添加量に応じて異なる、少しくすんだ若葉色から、黄色や橙色、鮮やかな赤色、深みのある赤色、濃い栗色まで、青色を除いた虹のほぼすべての色を作り出せるところにあります。これらの優れた色は、画家にとって欠かせないものとなりました。モネやゴッホ、ゴーギャンなどの印象派の画家たちは、硫化カドミウムCdSを巧みに利用しました。硫化カドミウムCdSの新しい色が開発されるたびに、まずはモネの「積みわら、夕陽(積みわら、日没)」に見られる繊細な黄色(カドミウムイエロー)、次にゴッホの「アルルの寝室」に見られる明るい橙色(カドミウムオレンジ)、さらにマティスの「赤のアトリエ」に見られる力強い赤色(カドミウムレッド)といった表現が、次々と生み出されていきました。
![積みわら(日没)》クロード・モネ|MUSEY[ミュージー]](group-12-element.files/image013.jpg)
図.12 硫化カドミウムCdSを用いることで、モネはキャンバス上で自然光を捉えた作品を制作した(積みわら、夕陽)
その他の黄色顔料には、「クロムイエロー」として知られるクロム酸鉛(II) PbCrO4があります。同じ黄色顔料である硫化カドミウムCdSとクロム酸鉛(II) PbCrO4を混合すると、一体何色になるでしょうか?混合してもしばらくは変化しませんが、徐々に黒ずみ、最終的には真っ黒になってしまいます。これは、黒色の硫化鉛(II) PbSが生成するためです。油絵具のカタログには、「混合禁止の組み合わせ」が表記されています。重金属化合物と硫化物の組み合わせは、金属硫化物が生成するためにすべて不可になっています。
CdS + PbCrO4 → PbS↓(黒) + CdCrO4
(4) 水銀
(i) 水銀Hg
「水銀(mercury)」は、古代からよく知られていた金属の1つです。ヨーロッパで紀元前1〜4世紀に書かれた本には、すでに水銀Hgに関する記述があったといいます。英語元素名の「mercury」は、ローマ神話の商売の神「メルクリウス(mercurius)」に由来します。この神は翼を持ち、神々の使者として、天地を自在に駆け巡ります。また、同名の「水星(Mercury)」は太陽に最も近く、天空を速く運行するため、俊足の神の名前が与えられています。水銀Hgは流動性に富む液体の金属(m.p.-39℃)であり、こぼした水銀Hgは生物のように駆け巡るため、この性質に由来して命名されました。元素記号の「Hg」は、ラテン語の「hydrargyrum(水のような銀)」に由来します。日本語名の「水銀」という語は、中国古代から使用されていたものであり、元素記号と同じ由来です。

図.13 水銀Hgの単体
水銀Hgは、室温で液体の状態(m.p.-39℃)にある唯一の金属です。表面張力が大きいため、机の上でこぼすと、均一に広がらずに球形となって散らばります。液体の金属水銀は、消化器からの吸収が遅いので、摂取しても弱い毒性を持つにとどまります。しかし、水銀蒸気や水銀化合物は、体内に非常に吸収されやすいので毒性が強く、多くの生物にとって猛毒です。特に水銀原子にメチル基(-CH3)が結合したメチル水銀は、1950年代半ばに熊本県水俣湾周辺地域で「水俣病」を、1965年に新潟県阿賀野川下流地域で「新潟水俣病」を引き起こした原因物質として有名です。メチル水銀は、アミノ酸の一種である「システイン」と結合体を作ることで毒性を発現します。この結合体は、必須アミノ酸である「メチオニン」と構造が似ているため、メチオニンの代わりにタンパク質の一部として合成されてしまい、そのタンパク質が正しく機能することを阻害します。

図.14 メチル水銀は、「水俣病」や「新潟水俣病」を引き起こした原因物質である
化学工場からの廃液に含まれていたメチル水銀は、最初にプランクトンの体内に入ります。次にそれを食べる小型の魚に、さらにそれを食べる大型の魚にと、水中の諸生物間の食物連鎖を経由することによって、食物連鎖の上位の魚介類へ高度に再濃縮されます。そして、その有毒化魚介を反復大量に摂取した人々の中から、水俣病や新潟水俣病を発病する人が現れました。水俣湾がメチル水銀で汚染されていた頃、周辺に住む漁師たちは、有毒化魚介を毎日食べるせいで、毎日約3.3 mgのメチル水銀を摂取していた計算になるそうです。1971年にはイラクでも、小麦の種子の防腐剤に含まれていたメチル水銀により、これを用いて作ったパンを食べた人に、多くの中毒患者が出ました。
メチル水銀は、脂溶性の化合物であるため、「血液脳関門(脳の働きに大切な神経細胞を有害物質から守るバリア)」の透過性が非常に高いです。中毒は約25 mgの摂取で起きる知覚異常から始まり、摂取量が増えるにつれて、運動失調、発話障害、難聴といった症状が現れます。これらの症状は、すべてメチル水銀が脳組織に蓄積して、中枢神経系に対して、不可逆的な損傷を与えるためです。摂取量が約200 mgに達すると、致死量となって高確率で死に至ります。また、メチル水銀には、胎盤透過性もあり、母親が妊娠中にメチル水銀を摂取したとき、母親に症状が現れなくとも、胎児に重篤な症状(胎児性水俣病)が現れることがあります。なお、メチル水銀は、単一の化合物の名称ではなく、水銀原子にメチル基(-CH3)が結合している化合物の総称です。

図.15 胎児性水俣病の患者を抱きかかえる女性
2003年に「海洋の高次捕食者であるマグロの体内には、食物連鎖によって生物濃縮されたメチル水銀が多量蓄積されている」と厚生労働省が発表し、一時話題になりました。マグロの体内のメチル水銀と同じ濃度のメチル水銀を、ラットに注射すると死んでしまうことが分かったので、大騒ぎになったのです。しかし、マグロは悠々と生きているし、人がマグロを食べても別に何ともありません。研究を続けると、マグロの体内には、セレンSeがメチル水銀とほぼ同じ濃度で存在していることが分かりました。セレンSeには、メチル水銀の解毒作用があることが明らかになっています。ラットにメチル水銀と同時にセレンSeを与えてみると、100%生き残るという結果が出ているのです。イルカなどの小型のハクジラ類には、有毒なメチル水銀を無機化して、さらに「セレン化水銀HgSe」の形で固定する代謝機構が備わっているようなので、マグロなども同様の機構を備えているものと考えられます。セレンSeはヒトの必須元素ではありますが、過度に摂取すれば毒にもなります。セレンSeとメチル水銀との関係は、「毒を以て毒を制す」の好例でしょう。

図.16 マグロの体内には高濃度のメチル水銀が濃縮されている
水銀Hgの単体は、北海道のイトムカ鉱山や奈良県の大和水銀鉱山などのように、まれに天然に遊離状態で見出されることがありますが、主に天然に産出する赤色鉱物の「辰砂(しんしゃ)」から製造されています。古代中国の「辰州(現在の湖南省近辺)」で多く産出したことが、名前の由来です。古来より日本では、辰砂のことを「丹(に)」と呼んでおり、地名に「丹」という文字が付いているところの大半には、かつて辰砂の鉱山がありました。三重県多気町にあった丹生鉱山に隣接する遺跡からは、粉砕した辰砂を利用した縄文土器が発掘されています。辰砂は、鮮やかな赤色をしているため、朱肉や神社などに使われる赤色顔料として利用されてきました。ちなみに、広義の辰砂には、赤色の辰砂以外に黒色の「黒辰砂」が含まれます。黒辰砂は、成分は辰砂とほとんど変わらないのですが、結晶構造の違いで変色していると考えられています。

図.17 辰砂の名前の由来は、中国の辰州(現在の湖南省近辺)で多く産出したことによる
辰砂の主成分は、赤色の硫化水銀(II) HgSです。辰砂に空気を通じながら500〜700℃で加熱すると、水銀Hgの蒸気と二酸化硫黄SO2が生じます。そして、この水銀Hgの蒸気を冷却して、凝縮させることで、単体の水銀Hgを精製します。
HgS + O2 → Hg + SO2
辰砂は血の色を持ち、長年姿を変えることがないことから、古代中国では「不老不死」の象徴として考えられ、漢方薬としても利用されていました。辰砂の人気は非常に高かったようで、司馬遷の「史記」巻128貨殖列伝にも、その鉱脈を発見した者が、数代にも渡る金持ちになったという記述があります。古代中国では、仙人は「丹薬」という薬を飲み、不老不死の体を手にしていると信じられていました。そして、丹薬を作るために、辰砂などの水銀化合物が使われました。しかし、現代化学から見れば、この丹薬は、不老不死の薬であるどころか、毒物の類に等しいものでした。

図.18 古代中国では、不老不死の体を手に入れるために「丹薬」の研究をしていた
中国の唐の時代(618年〜907年)には、歴代の皇帝21世のうち6人が、不老不死を追い求め、丹薬を飲み続けていたという記録が残っています。彼らは、遂には水銀中毒になって、命を落としていきました。例えば、11代皇帝の憲宗は、安史の乱によって傾いた国勢を立て直すべく手腕を振るいましたが、丹薬の飲み過ぎが原因と見られる精神異常をきたし、宦官によって暗殺されています。16代皇帝の武宗などは、81人もの道士に呪術を行わせて丹薬を飲み、そのために肌艶が消えて喜怒の表現もままならず、言葉も話せなくなって死んだとされています。史上空前の繁栄を誇った唐が、最後はあっけなく滅亡した陰には、丹薬という毒物の存在が、少なからず影響しているのではないでしょうか。
それにしても、なぜ猛毒の水銀化合物を不老不死の薬などと、彼らは勘違いしたのでしょうか。それは、水銀化合物の特殊性にあると考えられます。水銀Hgは美しい銀色の光沢を持ち、流動性に富んで、まさしく活力溢れる「生命」のようです。しかし、水銀Hgは約350℃で長時間加熱すると、徐々に赤い酸化水銀(II) HgOに変わります。さらに焼くと黒くなりますが、放置して温度が下がれば、再び赤くなります。彼らは、これを水銀Hgが一度「死んだ」と解釈しました。ところが、酸化水銀(II) HgOは500℃以上に加熱すると、再び液体水銀Hgに戻って蒸留されます。すなわち、水銀Hgが「再生」したのです。
2Hg + O2 → 2HgO
2HgO → 2Hg + O2
これは、まさしく「フェニックス(不死鳥)の再生」です。輝く水銀Hgが醜い固体になり、再度輝く水銀Hgに戻る――水銀Hgは「フェニックス」そのものに違いない。これを飲めば、自分もフェニックスのようになれると考えたのでしょう。悲しいほどに愚かで、単純な思い込みです。中国の皇帝たちは、その不思議な力を妄信し、迷わずこの丹薬を飲み続けました。その結果、皮膚は茶色に皺が寄り、目は生気を失い、声はしわがれ、時折発作的に凶暴性を発揮するという、まさしく人間離れした「皇帝らしい」性質を発現することになったのです。

図.19 唐の11代皇帝の憲宗は、明晰かつ決断力に富んだ人物であったと伝えられているが、丹薬による中毒で、33歳で崩御した
水銀Hgは、室温で液体(m.p.-39℃)であるという特異な性質を持つため、この性質を生かした製品が、古くから利用されてきました。ガラスへのぬれ性が悪く、膨張係数が広い温度範囲に渡ってほぼ一定であるため、温度計や体温計などに昔から利用されています。水銀Hgの温度計は、18世紀にドイツの物理学者であるガブリエル・ファーレンハイトが、水H2OやエタノールC2H5OHを使用していた当時の温度計の欠点を改良する目的で採用したもので、温度の精密計測を可能にしました。
また、水銀Hgの炎色は、近紫外線である254 nmに最大の光成分を持ちます。そこで、内面に紫外線を吸収させると可視光を放射する塗料(蛍光塗料)を塗ったガラス管に、微量の水銀蒸気HgとアルゴンArを封入して放電すると、放電により流れる電子が水銀原子Hgに衝突して、水銀原子Hgを励起状態(高エネルギーの状態)にします。そして、励起状態から安定な基底状態(エネルギーの低い状態)に戻ろうとするときに、余分なエネルギーを紫外線として放射して、蛍光塗料を光らせるのです。これが、蛍光灯の仕組みです。

図.20 蛍光灯の内部には、水銀Hgの蒸気が封入されている
水銀Hgは、多くの金属を溶かして、「アマルガム(amalgam)」と呼ばれる合金を作ります。アマルガムにすると軟らかいペースト状になることが多いことから、この名称はギリシア語の「malagma (軟らかい物質)」に由来します。アマルガムは、水銀Hgが大半を占める場合には液体、水銀Hgの量が少なければ固体という性質があります。鉛Pb、スズSn、ビスマスBiのアマルガムは鏡面、亜鉛ZnやカドミウムCdのアマルガムは標準電池、銀AgやスズSnのアマルガムは歯科用に用いられています。歯科用のアマルガムは、日本では1970年代まで歯科修復材料として頻繁に使われていましたが、近年では水銀Hgの害が問題視されるようになり、あまり使用されていません。
アマルガムは、金属精錬にも利用されます。砂金採掘の際に、水銀Hgを用いてアマルガム化して金Auを抽出し、これを加熱して水銀Hgだけを蒸発させることによって、高純度の金Auを得ることが行われています。この方法(アマルガム法)は高度な装置や技術を必要としないので、古代地中海で繫栄したフェニキア人とカルタゴ人は、2700年前からスペインの水銀鉱山で採取された水銀Hgを使って、金Auを抽出していたといわれています。19世紀の米カリフォルニアで起きた「ゴールドラッシュ」の際には、水銀Hgのアマルガムが大々的に使用され、その後20世紀になっても使用が続きました。北米と南米で土壌中の水銀量が以上に高い地域(特に汚染の激しい地域では、最高で土壌1 g当たり0.5 mgに及ぶ)が散在するのは、金Auの抽出に水銀Hgが広く使用されていたからだと考えられています。
最近では、ブラジルのアマゾン川流域において、1970年代の終わり頃から、川底やジャングルの堆積土中の砂金採掘が盛んに行われ、金Auの精錬に使用された水銀Hgによる汚染が深刻化しているといいます。タンザニア、フィリピン、インドネシア、中国などの国々でも、同様の汚染が起きています。近年の金相場上昇を背景に「儲かる商売」として、1,000万人以上が従事しているともいわれるアマルガム法による金採掘は、世界最大の水銀Hgの用途になっています。アマルガム法は、単にそれが環境破壊や健康被害に繋がっているだけでなく、その地方の唯一の生計手段として経済的にその社会に取り込まれてしまっている点が、問題を複雑化しています。

図.21 砂金から金Auを取り出す際に、水銀Hgが使われている
8世紀に建立された奈良東大寺の大仏は、もしかしたら日本の公害の最初の例かもしれません。高さ15 mにも及ぶ奈良の大仏は青銅製ですが、完成した当初は、全身が金めっきで覆われていました。そのめっき方法として、金アマルガムが使われたのです。まず、金アマルガムを製造して、大仏の表面に均一に塗ります。そして、金アマルガムを炭火で加熱して、水銀Hgだけを蒸発させることで、大仏を金めっきにするのです。続群書類従完成会の「東大寺大仏記」によれば、水銀58,620両(約50 t)と金10,446両(約9 t)を用いたとあります。大仏殿も同時に建設されたことから、この作業は屋内で行われたことになり、高濃度の水銀蒸気が充満した大仏殿内は、非常に危険な状態であったであろうと想像されます。水銀蒸気は、肺のガス交換機能により体内に取り込まれやすく、気管支炎や肺炎、腎細尿肝障害、むくみ、場合によっては尿毒症も発症し、全身のだるさ、手の震え、運動失調などを引き起こします。大仏建立は752年ですが、その後ほどなくの784年の平城京から長岡京への遷都理由の1つには、水銀中毒蔓延があるという説もあります。

図.22 奈良の大仏の金めっきには、金アマルガムが使用された
また、水銀Hgのイオンでは、水銀(II)イオンHg2+ に加えて、水銀(I)イオンHg22+ ([Hg-Hg]2+)という状態も見られます。[Hg-Hg]2+ のような共有結合が安定なのは、Hg+ の電子親和力が大きいことに関連すると考えられています。すなわち、Hg+ 同士が不対電子を1個ずつ出し合って、共有結合を形成することで、電子親和力の分だけ安定化することができるのです。
(ii) 塩化水銀(II) HgCl2
塩化水銀(II) HgCl2は、「昇コウ」とも呼ばれる強い毒性を持つ白色固体です。「コウ(汞)」といのは、中国語で水銀のことです。水銀(II)イオンHg2+ には強い毒性があり、生体内外の表面に接触した場合、その細胞をただれさせる作用があります。かつては消毒薬や防腐剤として使われていましたが、その強い毒性のため、現在ではほとんど使われていません。
スズ(II)イオン Sn2+ を還元剤にすると、塩化水銀(II) HgCl2を単体の水銀Hgにまで還元することができます。水銀(II)イオンHg2+ と水銀(I)イオンHg22+ の酸化還元反応は容易であり、塩化スズ(II) SnCl2によって、塩化水銀(I) Hg2Cl2の白色沈殿が生じます。そして、塩化水銀(I) Hg2Cl2はさらに塩化スズ(II) SnCl2によって還元され、水銀Hgの単体が析出します。塩化水銀(I) Hg2Cl2は水に溶けにくいのに対し、塩化水銀(II) HgCl2は水によく溶けます。それ故に、塩化水銀(II) HgCl2は、体内に取り込んだ際の吸収率が非常に高く、塩化水銀(I) Hg2Cl2よりも強い毒性があります。
2HgCl2 + SnCl2 → Hg2Cl2(白)↓ + SnCl4
Hg2Cl2 + SnCl2 → 2Hg + SnCl4
猛毒の塩化水銀(II) HgCl2は、かつて梅毒の治療薬として使われていました。梅毒は「スピロヘータ」と呼ばれるらせん状の病原体による感染症で、ヨーロッパでは1495年に初めて確認されています。大航海時代のスペイン人が、アメリカ大陸から持ち込むとともに世界中に運んでしまったことで、16世紀初頭にパンデミックを引き起こしました。「近代医学の父」と呼ばれたスイスの医師パラケルススは、「水銀は梅毒の治療に有効だ」と記しています。塩化水銀(II) HgCl2に油を加えて軟膏を作り、それをただれた皮膚に塗り込むという治療法が行われました。毒素の症状が顕著に現れるので、人々はそれを見て、「効果が高い証拠だ」と考えたようです。塩化水銀(II) HgCl2を服用すると、唾液が真夏のセント・バーナード並みに大量に分泌されるため、毒素が排出されている兆候だと見なされたのです。その副作用で起こる水銀中毒は、非常に恐ろしいものでしたが、梅毒の方が死に至る可能性が高いのだから、イチかバチか水銀療法をやってみる価値はありました。
他にも、当時は水銀Hgの蒸気を吸い込むと体に良いとされており、裸の患者を水銀Hg入りの釜に入れて、上蓋の穴から頭を出させ、釜の下から火を着けて水銀Hgを蒸発させる方法も取られました。16世紀のイタリアの医師ジローラモ・フラカストロは、このような治療法を行ったあとに、こう記しています。――「病気をもたらす発酵体が口の中に溶け出し、唾液に混ざって流れ出てくるだろう」と。当時の患者は、こうした治療を死ぬまで続けなければなりませんでした。現在では、試験管内での実験結果から、水銀Hgがバクテリアを死滅させられることが確認されています。それと同時に科学者たちは、試験管の中で効果があったからといって、人間の体に良いとは限らないことも知っています。医薬として用いるには、水銀Hgの毒性はあまりに強すぎるのです。

図.23 水銀Hgの釜に入れられた梅毒患者
(iii) 塩化水銀(I) Hg2Cl2
塩化水銀(I) Hg2Cl2は、「甘コウ」とも呼ばれる甘味を持つ白色固体です。塩化水銀(I) Hg2Cl2も塩化水銀(II) HgCl2程ではありませんが、慢性的に摂取した場合には毒性が現れます。幼児は歯が生え始めるころに、「歯ぐずり」といって、歯茎に痛みやかゆみを感じます。1950年代までは、親はその痛みを緩和させようとして、塩化水銀(I) Hg2Cl2を含んだ薬を幼児の歯茎に塗っていました。その結果起こったのは、「先端疼痛」という手足に激しい痛みを伴う水銀中毒です。幼児は、両手で頭を何度も叩き、髪を掻きむしり、叫び声を上げ、近寄ろうとする人を誰彼構わず乱暴に引っかこうとしました。
また、塩化水銀(I) Hg2Cl2を電極として用いると、安定な起電力が得られるため、標準電極電位を測定する際の基準電極としても用いられています。塩化水銀(I) Hg2Cl2は、実験室では硝酸水銀(I) Hg2(NO3)2の水溶液に塩酸HClを加えると、沈殿として得られます。ここで得られる沈殿は白色ですが、アンモニア水NH3を加えると黒変します。
Hg2(NO3)2 + 2HCl → Hg2Cl2(白)↓ + 2HNO3
・参考文献
1) アン・ルーニー著/八木元央訳「元素から見た化学と人類の歴史」シナノ印刷(2019年発行)
2) 大東孝司「プラグマティック化学」河合出版(2017年発行)
3) 元素学たん著/左巻健男編『身近にあふれる「元素」が3時間でわかる本』明日香出版社(2021年発行)
4) 齋藤勝裕「へんな金属すごい金属」技術評論社(2009年発行)
5) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
6) 桜井弘「元素118の新知識 引いて重宝、読んでおもしろい」講談社(2017年発行)
7) 佐藤健太郎「世界史を変えた薬」講談社(2015年発行)
8) 左巻健男「面白くて眠れなくなる元素」PHP研究所(2016年発行)
9) 鈴木勉「毒と薬【すべての毒は「薬」になる!?】」新星出版社(2015年発行)
10) セオドア・グレイ「世界で一番美しい元素図巻」創元社(2011年発行)
11) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)
12) -「元素をめぐる美と驚き アステカの黄金からゴッホの絵具まで〔下〕」早川書房(2017年発行)
13) 船山信次「毒の科学-毒と人間のかかわり-」ナツメ社(2013年発行)
14) 山崎幹夫「面白いほどよくわかる 毒と薬」日本文社(2004年発行)
15) 山崎幹夫「新化学読本-化ける、変わるを学ぶ」白日社(2005年発行)
16) リディア・ケイン/ネイト・ピーダーセン「世にも危険な医療の世界史」文藝春秋(2019年発行)