・無機化学(無機化学反応)
【目次】
(1) 分解反応
ある物質が常温で安定であるとき、その理由としては、2つが考えられます。1つは、分解した状態より、もとの物質の方がエネルギー的に安定であることです。もう1つは、活性化エネルギーが大きく、常温では分解した状態に至らないことです。前者の場合は、その状態を「熱力学的(thermodynamic)」に安定であるといいます。この場合、その物質を高温にすると、系は一般的に吸熱方向へ移動するので、分解反応が起こります。一方で、後者の場合は、その状態を「速度論的(kinetic)」に安定であるといいます。この場合、触媒を加えて活性化エネルギーの小さい反応経路を作るか、温度を上げて活性化エネルギーを超える運動エネルギーを持つ分子を増やしてやれば、分解反応が起こります。
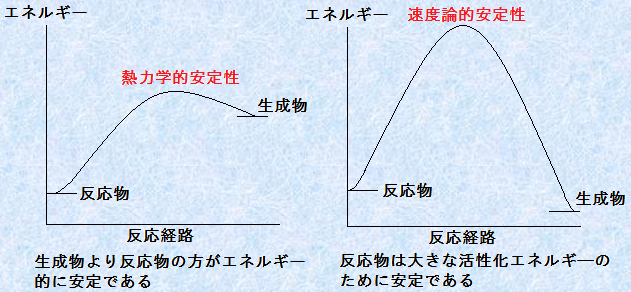
図.1 反応が起こりにくくなる2つの要因
分解反応の特徴は、その式の形にあります。つまり、A→B+Cのように、左辺の反応物が1つに限られる反応は、ほとんど分解反応と見なしてよいです。また、分解反応というものは、反応において、物質がバラバラになることに注目し、命名された反応です。それ故に、分解反応は、一般的に分子数が増加し、「乱雑さ(randomness)」が大きくなる反応です。乱雑さは、温度に比例して大きくなり、また乱雑さが大きいほど、その系は安定になります。したがって、反応温度が高くなるほど、分解反応が起こりやすくなるのです。したがって、どんな物質でも、反応温度を上げていけば、必ず次々と分解し、最終的には原子の状態になっていきます。分解反応は、無限といってよいほどたくさんあります。だから、ここでとりあげる反応は、よく見かけるという程度の意味しかありません。
さて、「原子状態」というゴールに向かって進んで行く一連の分解反応の中で、考えられる途中分解物としては、どんなものが考えられるでしょうか?まず、ゆるく結合した物質、すなわち、配位子や水和水などの物質が、バラバラになる反応が考えられます。例えば、塩化カルシウム六水和物CaCl2・6H2Oを加熱すると、配位結合していた水和水が取れて、塩化カルシウム無水物CaCl2になります。
CaCl2・6H2O → CaCl2 + 6H2O
次に、発熱的に起こった反応が、逆戻りする反応が考えられます。例えば、炭酸カルシウムCaCO3を加熱すると、二酸化炭素CO2が抜けて、酸化カルシウムCaOとなります。
CaCO3 → CaO + CO2
さらに、酸化数的にやや無理のある状態から、無理の少ない状態になる反応も考えられます。例えば、亜硝酸アンモニウムNH4NO2を加熱すると、窒素N2と水H2Oに分解します。このとき、アンモニウムイオンNH4+ の窒素Nの酸化数は-IIIで、亜硝酸イオンNO2- の窒素Nの酸化数+IIIですが、生成物である窒素N2の酸化数は0です。
NH4NO2 → N2 + 2H2O
これらの分解反応では、たいていエネルギー的に安定な気体が、分解物の1つとなっています。安定な気体が少しでも生じて、それらが系から逃げ去ると、反応が戻れなくなります。それ故に、この安定な気体が生じるような分解反応が、どんどん進行するとも考えられます。次の(i)〜(vi)に、よく出てくる分解反応を物質別に整理します。
(i) 含水塩の分解
CaCl2・6H2O → CaCl2・4H2O → CaCl2・H2O → CaCl2(乾燥剤)
CuSO4・5H2O(青) → CuSO4・3H2O → CuSO4・H2O → CuSO4(白)
水和水を持った含水塩は、加熱すると無水塩と水H2Oに分解します。含水塩をゆっくりと加熱すると、何段階かに分かれて、水H2Oが出ていくことが多いです。特に無水硫酸銅(II) CuSO4は、エタノール中の微量の水H2Oの検出に使えます。無水硫酸銅(II) CuSO4を加えて青くなれば、エタノールに水H2Oが含まれているということです(遷移元素を参照)。

図.2 硫酸銅(II)五水和物CuSO4・5H2Oの熱分解
(ii) 金属水酸化物の分解
2Al(OH)3 → Al2O3 + 3H2O
2AgOH → Ag2O + H2O
金属水酸化物は、加熱すると金属酸化物と水H2Oに分解します。特に水酸化銀(I) AgOHの場合は、この物質はエネルギー的に非常に不安定です。室温程度の熱でも、この分解反応が起こって、酸化銀(I) Ag2Oと水H2Oに分解します。また、水酸化ナトリウムNaOHや水酸化バリウムBa(OH)2のような強塩基の場合は、加熱しても融解するだけで、分解しにくいものが多いです。
(iii) 炭酸塩の分解
CaCO3 → CaO + CO2
MgCO3 → MgO + CO2
炭酸塩は、加熱すると金属酸化物と二酸化炭素CO2に分解します。ただし、炭酸ナトリウムNa2CO3や炭酸カリウムK2CO3のようなアルカリ金属炭酸塩の場合は、加熱しても融解するだけで、分解しにくいものが多いです。
(iv) 炭酸水素塩の分解
2NaHCO3 → Na2CO3 + H2O + CO2
Ca(HCO3)2 ⇄ CaCO3 + H2O + CO2
炭酸水素塩は、加熱すると炭酸塩と水H2O、二酸化炭素CO2に分解します。例えば、炭酸水素カルシウムCa(HCO3)2を含んだ水溶液を加熱すると、二酸化炭素CO2が発生して平衡が右へ移動し、炭酸カルシウムCaCO3の微粒子が水中に分散したコロイドとなります。
この反応は、鍾乳洞形成の原理となっています。すなわち、二酸化炭素CO2を含む弱酸性の雨水により、炭酸カルシウムCaCO3を主成分とする石灰岩が浸食され、このような浸食によって、石灰岩体の内部に多くの空洞が生じます。そして、石灰岩中の微細な割れ目などを満たした雨水が、洞窟内に滲出すると、二酸化炭素CO2を含む雨水と炭酸カルシウムCaCO3との化学反応が可逆的であることから、二酸化炭素CO2が抜けます。そして、平衡が右に移動すると、炭酸カルシウムCaCO3が方解石として晶出し始め、それが長い年月をかけて沈積して、鍾乳洞などの洞窟生成物が形成されるのです(第2族元素(アルカリ土類金属など)を参照)。
(v) HCOOHや(COOH)2の分解
HCOOH → H2O + CO
(COOH)2 → H2O + CO + CO2
ギ酸HCOOHに濃硫酸H2SO4を加えて加熱すると、一酸化炭素COと水H2Oに分解します。また、シュウ酸(COOH)2に濃硫酸H2SO4を加えて加熱しても、一酸化炭素COが発生します。これらの反応は、一酸化炭素COの実験室的な合成法として利用されています。
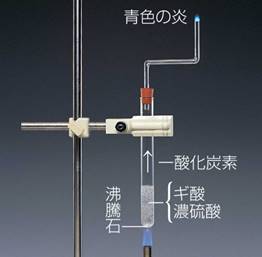
図.3 ギ酸HCOOHと濃硫酸H2SO4の化学反応
(vi) NH4NO2の分解
NH4NO2 → N2 + 2H2O
亜硝酸アンモニウムNH4NO2は非常に不安定であり、亜硝酸アンモニウムNH4NO2を、窒素N2と水H2Oに分解する反応は発熱反応です。亜硝酸アンモニウムNH4NO2に少量の水を加え、70℃に加熱すると、窒素N2が発生します。この反応で加熱をする理由は、反応速度を上げるためです。この反応は、窒素N2の実験室的な合成法として利用されています。
(vii) KClO3やH2O2の分解
2KClO3 → 2KCl + 3O2
2H2O2 → O2 + 2H2O
塩素酸カリウムKClO3はイオン結晶であるから、水中ではカリウムイオンK+ と塩素酸イオンClO3- となって溶解します。この状態になってしまうと、分解反応は起こりにくいです。したがって、塩素酸カリウムKClO3の分解は、水に溶かさずに行います。そうすると、塩素酸カリウムKClO3も二酸化マンガンMnO2も固体なので、反応を起こすために加熱が必要になってきます。一方で、過酸化水素H2O2は、水溶液中でも解離しません。そして、分子のまま自由に動けて、触媒表面と大いに接触できるので、二酸化マンガンMnO2を加えるだけで反応は進行します。
(2) 酸塩基平衡
(i) 弱酸遊離反応
酢酸ナトリウムCH3COONaはイオン結合性の塩であり、水中では酢酸イオンCH3COO- とナトリウムイオンNa+ とに完全電離しています。そして、この水溶液に希塩酸HClを加えると、水溶液中の水素イオンH+ が増加し、式(II)の平衡が右へ移動します。
CH3COONa → CH3COO- + Na+ ・・・(I)
CH3COO- + H+ ⇄ CH3COOH ・・・(II)
つまり、酢酸イオンCH3COO- は塩酸HClと反応すると、酢酸CH3COOHになるのです。また、この反応全体では、次のように表せます。
CH3COONa + HCl → CH3COOH + NaCl
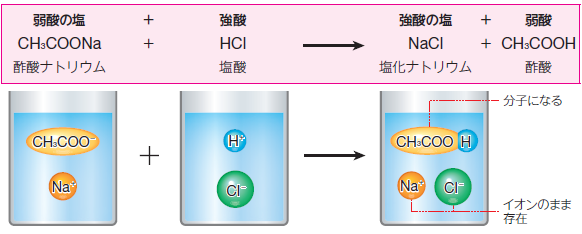
図.4 弱酸遊離反応
これは、弱酸由来の塩と強酸の反応です。この反応がほぼ100%起こる原因は、式(II)の平衡が、大きく右へ傾いているためです(K=104.75)。生成する酢酸CH3COOHは弱酸であり、加えた塩酸HClは強酸なので、この平衡で逆反応が進むことはほぼありません。また、酢酸ナトリウムCH3COONaは弱酸由来の塩なので、水溶液中では加水分解して、弱塩基性を示します。つまり、この反応は、酢酸ナトリウムCH3COONaと塩酸HClの酸塩基反応と見なすこともできるのです。そこで、このような反応を、一般的に次のようにまとめることができます。
弱酸由来の塩 + 強酸 → 弱酸 + 強酸由来の塩
(ii) 弱塩基遊離反応
塩化アンモニウムNH4Clはイオン結合性の塩であり、水中ではアンモニウムイオンNH4+ と塩化物イオンCl- とに完全電離しています。そして、この水溶液に水酸化ナトリウムNaOH水溶液を加えると、水溶液中の水酸化物イオンOH- が増加し、式(IV)の平衡が右へ移動します。
NH4Cl → NH4+ + Cl- ・・・(III)
NH4+ + OH- ⇄ NH3 + H2O ・・・(IV)
つまり、アンモニウムイオンNH4+ は水酸化ナトリウムNaOHと反応すると、アンモニアNH3になるのです。また、この反応全体では、次のように表せます。
NH4Cl + NaOH → NH3 + H2O + NaCl
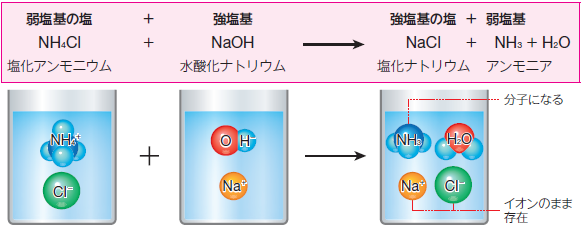
図.5 弱塩基遊離反応
これは、弱塩基由来の塩と強塩基の反応です。この反応がほぼ100%起こる原因は、式(IV)の平衡が、大きく右へ傾いているためです(K=104.75)。生成するアンモニアNH3は弱塩基であり、加えた水酸化ナトリウムNaOHは強塩基なので、この平衡で逆反応が進むことはほぼありません。また、塩化アンモニウムNH4Clは弱塩基由来の塩なので、水溶液中では加水分解して、弱酸性を示します。つまり、この反応は、塩化アンモニウムNH4Clと水酸化ナトリウムNaOHの酸塩基反応と見なすこともできるのです。そこで、このような反応を、一般的に次のようにまとめることができます。
弱塩基由来の塩 + 強塩基 → 弱塩基 + 強塩基由来の塩
(iii) 揮発性酸遊離反応
揮発性の酸由来の塩に、濃硫酸H2SO4などの不揮発性酸を加えて加熱すると、揮発性の酸が遊離します。例えば、塩化ナトリウムNaClの固体に、濃硫酸H2SO4を加えて加熱すると、揮発性の塩化水素HClが遊離します。
NaCl(固) ⇄ Na+ + Cl- ・・・(V)
Cl- + H2SO4 ⇄ HSO4- + HCl↑ ・・・(VI)
硫酸H2SO4は極性分子であるから、濃硫酸H2SO4中には、ほんの少量ですが水H2Oも溶けています。したがって、塩化ナトリウムNaCl(固)に濃硫酸H2SO4を加えてかき混ぜると、塩化ナトリウムNaCl(固)は、濃硫酸H2SO4中に含まれるわずかな水H2Oに溶けて、溶解平衡状態(V)になります。また、硫酸H2SO4は、塩化水素HClより少し強い酸であるから、(VI)式のような平衡状態ができます。生じた塩化水素HClは、濃硫酸H2SO4中によく溶けているので、この状態では、溶液中から塩化水素HClはほとんど出てきません。しかし、この溶液を加熱すると、気体である塩化水素HClの溶解度が減少し、揮発性の塩化水素HClだけが、溶液中から遊離してきます。そこで、(VI)式の平衡は、どんどん右に移動することになるので、反応全体では、次のように表せます。
NaCl(固) + H2SO4(conc) → NaHSO4 + HCl↑
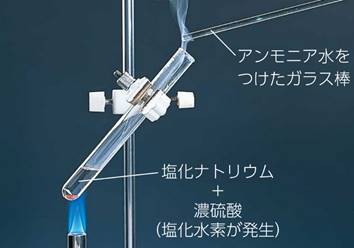
図.6 塩化ナトリウムNaClと濃硫酸H2SO4の反応
これと同様な反応として、次の2つがよく問題にされます。例えば、硝酸カリウムKNO3の固体に、濃硫酸H2SO4を加えて加熱すると、硝酸HNO3が遊離します。また、フッ化カルシウムCaF2の固体に、濃硫酸H2SO4を加えて加熱すると、フッ化水素HFが遊離します。
KNO3(固) + H2SO4(conc) → KHSO4 + HNO3↑
CaF2(固) + H2SO4(conc) → CaSO4 + 2HF↑
揮発性の酸由来の塩に、濃硫酸H2SO4を加えて加熱すると、塩化水素HClや硝酸HNO3、フッ化水素HFなどが生じてくるのは、結局のところ、濃硫酸H2SO4が不揮発性のために、これが出ていかないことに原因があります。そこで、このような反応を、一般的に次のようにまとめることができます。
揮発性の酸由来の塩 + 不揮発性の酸 → 不揮発性の酸由来の塩 + 揮発性の酸
(3) 気体発生反応
(i) 実験室での主な発生方法
表.1 主な気体物質の製法
|
|
実験室での主な製法 |
工業的製法 |
|
|
単 体 |
水素 H2 |
Zn + 2HCl → ZnCl2 + H2↑ 2CH3OH + 2Na → 2CH3ONa + H2↑ |
水の電気分解 石油の熱分解 |
|
窒素 N2 |
NH4NO2 → 2H2O + N2↑ C6H5N2Cl + H2O → C6H5OH + HCl + N2↑ |
液体空気の分留 |
|
|
酸素 O2 |
2KClO3 → 2KCl + 3O2↑ 2H2O2 → 2H2O + O2↑ |
水の電気分解 液体空気の分留 |
|
|
オゾン O3 |
3O2 → 2O3↑ |
|
|
|
塩素 Cl2 |
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑ CaCl(ClO)・H2O + 2HCl → CaCl2 + 2H2O + Cl2↑ |
食塩水の電気分解 |
|
|
酸 化 物 |
一酸化炭素 CO |
HCOOH → H2O + CO↑ |
炭素の酸化 |
|
二酸化炭素 CO2 |
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ |
CaCO3 → CaO + CO2↑ |
|
|
一酸化窒素 NO |
3Cu + 8HNO3(dil) → 3Cu(NO3)2 + 4H2O + 2NO↑ |
オストワルド法 (4NH3 + 5O2 → 6H2O + 4NO) |
|
|
二酸化窒素 NO2 |
Cu + 4HNO3(conc) → Cu(NO3)2 + 2H2O + 2NO2↑ |
オストワルド法 (2NO + O2 → NO2) |
|
|
二酸化硫黄 SO2 |
Cu + 2H2SO4(conc) → CuSO4 + 2H2O + SO2↑ Na2SO3 + H2SO4(dil) → Na2SO4 + H2O + SO2↑ |
S + O2 → SO2↑ 4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑ |
|
|
水 素 化 物 |
塩化水素 HCl |
NaCl + H2SO4(conc) → NaHSO4 + HCl↑ |
H2 + Cl2 → 2HCl |
|
硫化水素 H2S |
FeS + 2HCl → FeCl2 + H2S↑ |
H2 + S → H2S↑ |
|
|
アンモニア NH3 |
2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3↑ |
ハーバー・ボッシュ法 (N2 + 3H2 ⇄ 2NH3) |
|
|
アセチレン C2H2 |
CaC2 + 2H2O → Ca(OH)2 + C2H2↑ |
2CH4 → 3H2 + C2H2↑ |
|
|
エチレン C2H4 |
C2H5OH → H2O + C2H4↑ |
石油の熱分解 |
|
|
メタン CH4 |
CH3COONa + NaOH → Na2CO3 + CH4↑ |
天然ガスの分離 |
|
(ii) 捕集方法
実験室的な気体の捕集方法には、「水上置換法(water replacement method)」や「上方置換法(upward displacement method)」、「下方置換法(downward displacement method)」があります。この中で水上置換法は、主に水に溶けにくい気体の捕集に用いられます。また、少し水溶性があっても、気体の毒性や引火性が高い場合は、安全のために水上置換法を用いることがあります。初めに発生口から出る気体は、気体を発生させる装置内の空気なので、しばらく待ってから気体を容器に集めます。水上置換法は、空気の混入も少なく、気体の捕集量の計測にも使われます。それに対して、上方置換法は、主に水に溶けやすく空気(密度1.3 g/L、平均モル質量29 g/mol)より軽い気体の捕集に用いられます。この方法では、空気の混入があるため、容器の口から気体が出てくるまで集めます。下方置換法は、主に水に溶けやすく空気より重い気体の捕集に用いられます。下方置換法も、空気の混入は避けられません。
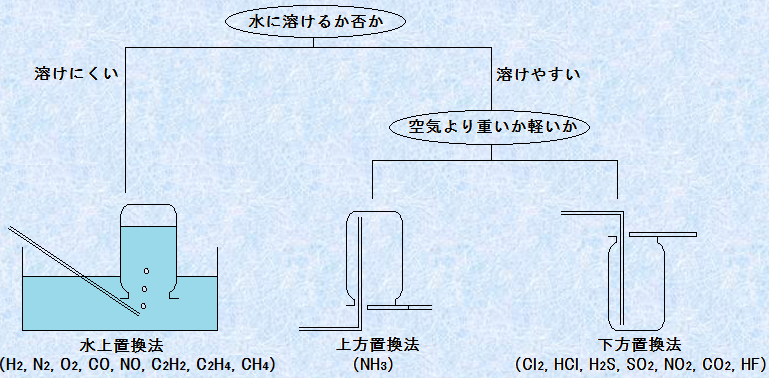
図.7 主な気体の捕集方法
ちなみに、フッ化水素HFの分子量は20ですが、一般的に下方置換法で集めます。これは、フッ化水素HFが気体状態では、分子間水素結合で会合して(HF)nの形で存在し、見かけ上の分子量が空気よりも大きくなり、空気より重くなるためです。
また、気体を水上置換法で捕集すると、捕集された気体は、水蒸気が飽和した混合気体になっています。したがって、捕集気体の分圧は、捕集気体の全圧から水蒸気の分圧を引いた値になります。このときの混合気体の全圧は、大気圧と等しいです。すなわち、捕集気体の分圧は、大気圧からその温度における水蒸気圧を引いた値になります。
捕集気体の分圧 = 大気圧 – 水蒸気圧
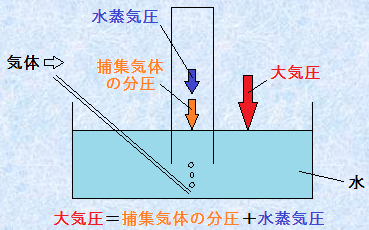
図.8 水上置換法では、見かけの捕集気体の圧力は、水蒸気圧の分だけ大きくなっている
(iii) 乾燥方法
水上置換法で気体を捕集した際には、捕集した気体は、水蒸気との混合気体であるから、混合気体から水分を取り去る操作が必要になります。目的のものから水分を除去することを「乾燥(drying)」といいます。気体を乾燥させるには、固体乾燥剤を詰めたガラス管に捕集した混合気体を通過させるか、濃硫酸H2SO4を入れたガス洗瓶に捕集した混合気体を通過させます。

図.9 気体の乾燥
固体乾燥剤には、通常、塩化カルシウムCaCl2や十酸化四リンP4O10、ソーダ石灰CaO+NaOH、シリカゲルSiO2・nH2Oなどが用いられます。これらの乾燥剤は、水分子を選択的に吸着して、混合気体を乾燥させます。また、濃硫酸H2SO4は水H2Oとの親和性が非常に強く、水H2Oと次のような反応をして、混合気体を乾燥させます。
H2SO4 + H2O → H2SO4・H2O ΔH =−27.8 kJ
H2SO4 + H2O → HSO4- + H3O+ ΔH =−73.4 kJ
ただし、いずれにしても、乾燥剤と目的の気体が化学反応をするような場合は、乾燥剤として用いることができません。乾燥剤を選択する際には、乾燥させる気体と中和反応や酸化還元反応などが起こらないようしなければなりません。例えば、濃硫酸H2SO4は、アンモニアNH3などの塩基性の気体とは、中和反応を起こしてしまうので、乾燥には不適です。また、濃硫酸H2SO4は、硫化水素H2Sを酸化するので、こちらも乾燥には不適です。次の表.2に、乾燥剤と乾燥に不適当な気体の組み合わせを示します。
表.2 乾燥剤と乾燥に不適当な気体の組み合わせ
|
乾燥剤 |
乾燥剤の性質 |
酸性 |
中性 |
塩基性 |
||||||
|
CO2 |
NO2 |
Cl2 |
HCl |
H2S |
H2 |
N2 |
O2 |
NH3 |
||
|
十酸化四リンP4O10 |
酸性 |
〇 |
〇 |
〇 |
× |
〇 |
〇 |
〇 |
〇 |
× |
|
濃硫酸H2SO4 |
酸性 |
〇 |
〇 |
〇 |
〇 |
× |
〇 |
〇 |
〇 |
× |
|
塩化カルシウムCaCl2 |
中性 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
× |
|
ソーダ石灰CaO+NaOH |
塩基性 |
× |
× |
× |
× |
× |
〇 |
〇 |
〇 |
〇 |
塩化カルシウムCaCl2は中性の乾燥剤なので、酸性の気体と塩基性の気体のどちらも乾燥することができます。しかし、アンモニアNH3とは反応し、塩化カルシウム八アンモニア付加物CaCl2・8NH3を生成するので、乾燥には不適です。
(iv) 気体の性質
表.3 主な気体の性質
|
有色の気体 |
O3(淡青)、F2(淡黄)、Cl2(黄緑)、NO2(赤褐) |
|
臭いのある気体 |
刺激臭:F2、Cl2、NH3、HCl、NO2、SO2、HF 腐乱臭:H2S 特異臭:O3 |
|
水溶液の液性 |
酸性:CO2、NO2、H2S、Cl2、HCl、SO2、HF 塩基性:NH3 |
|
有毒の気体 |
CO2を除く酸性・塩基性の気体 O3(強い酸化力を持ち、腐食性がある) CO(血中のヘモグロビンと結合する) |
(v) 気体の検出方法
表.4 主な気体の検出方法
|
気体 |
検出方法 |
化学反応 |
|
CO2 |
石灰水に通すと白濁 |
CO2 + Ca(OH)2 → CaCO3↓ + H2O |
|
NH3 |
塩酸を近付けると白煙 |
NH3 + HCl → NH4Cl |
|
NO |
空気中で徐々に赤褐色になる |
2NO + O2 → 2NO2 |
|
H2S |
酢酸鉛(II)の水溶液に通すと黒色沈殿 |
(CH3COO)2Pb + H2S → PbS↓ + CH3COOH |
|
二酸化硫黄と水中で白濁 |
2H2S + SO2 → 3S↓ + 2H2O |
|
|
SO2 |
硫化水素と水中で白濁 |
2H2S + SO2 → 3S↓ + 2H2O |
|
Cl2 |
湿ったリトマス紙を赤変のあとに脱色 |
塩素水の持つ漂白作用(HClOの酸化作用) |
|
ヨウ化カリウムデンプン紙を青変 |
2KI + Cl2 → I2↓ + 2KCl |
・参考文献
1) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
2) 化学同人編集部「続 実験を安全に行うために-基本操作・基本測定編-」化学同人(2007年発行)