・カルボニル化合物(カルボン酸誘導体)
【目次】
(1) カルボン酸誘導体
カルボン酸のカルボキシ基(-COOH)のヒドロキシ基(-OH)部分を、他の置換基で置換した化合物を、「カルボン酸誘導体(carboxylic acid derivatives)」といいます。「エステル(ester)」は、オキソ酸のヒドロキシ基(-OH)部分を、アルコキシ基(-OR)で置換した誘導体です。
例えば、硝酸エステルの一種である「ニトログリセリン」は、爆薬(ダイナマイト)や心臓病の治療薬として用いられています。ニトログリセリンは、1846年にイタリア人の化学者であるアスカニオ・ソブレロにより発見されましたが、わずかな熱や衝撃によって強い爆発性を持つので、多くの事故を起こし、当時は「気狂い油」として人々に恐れられていました。黒色火薬の約7倍もの爆破威力があるため、取り扱いが非常に難しく、ニトログリセリンを爆薬に利用しようという者は、なかなか現れませんでした。
しかし、スウェーデンの発明家であるアルフレッド・ノーベルは、ニトログリセリンを珪藻土に染み込ませることによって、安全に運用できることを発見しました。ダイナマイトの誕生です。ノーベルは、すぐに50カ国で特許を獲得し、巨額の富を得て、「ダイナマイト王」と呼ばれるようになりました。しかし、あるときにフランスの新聞が、間違ってノーベルの死亡記事を書きます。そこには、「かつてない速さでかつてないほど多くの人間を殺す方法を発見した死の商人が昨日死んだ」と書かれていました。これを機に、ノーベルは死後の評価を気にするようになり、遺産を平和のために活用することを考えるようになったといいます。ノーベルは、その巨額な遺産の大部分を、「ノーベル賞」の創設のために使いました。現在、ノーベル財団には、400億円もの基金があり、安全な有価証券に投資したときの利子で、受賞者に賞金を与えています。

図.1 ノーベルは、生涯で350もの特許を取得し、中でもダイナマイトの特許が最も有名である
ちなみに、ニトログリセリンは、舐めると甘い味がします。小林照幸の「床山と横綱―支度部屋での大相撲五十年」によれば、ダイナマイトは表皮を剥くとオレンジ色の塊が現れ、食べると羊羹のようにねっとりと甘い味がするとあります。戦時中、ひもじい日本兵は、ダイナマイトをナイフで輪切りにして食べ、酒の肴にしていたという話が伝わっています。しかし、ニトログリセリンには血管拡張作用があるため、健康な人がダイナマイトを食べると、急激な血圧降下が起こって、立ち眩みや失神などが起こる可能性があります。
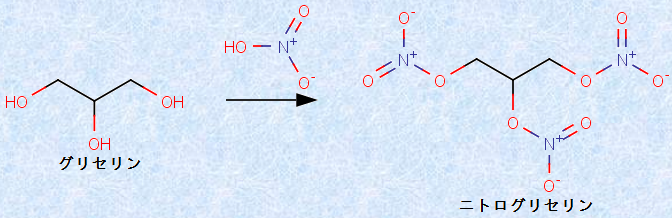
図.2 ニトログリセリンには、強い甘味があり、「爆弾糖」の異名がある
オキソ酸の一種であるカルボン酸もまた、多くのヒドロキシ基(-OH)とエステルを作ります。カルボン酸エステルは、多種多様なものが自然界に存在しており、それを学ぶことは、非常に重要なことです。ここでは、カルボン酸誘導体として、「カルボン酸エステル」を中心に学んでいきます。
例として、次の図.3に、様々なカルボン酸エステルの構造式を示します。低分子量のカルボン酸エステルは、果実の香り成分であり、複数のエステルをブレンドして、香料として利用されているものが多いです。バナナの香りの主成分は、「酢酸ペンチル」というエステルであり、リンゴの香りの主成分は、「酪酸メチル」というエステルです。これらのエステルは、日本酒の中にも含まれ、日本酒のフルーティーな香りに関与するといわれています。
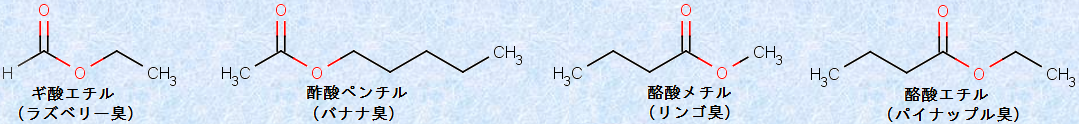
図.3 様々なカルボン酸エステル
また、アミノ基(amino group, -NH2)を持つ化合物を「アミン(amine)」といい、アミンとカルボン酸の脱水縮合物を「アミド(amide)」といいます。例えば、酢酸CH3COOHとアニリンの反応生成物は「アセトアニリド」であり、アセトアニリドは、色素や医薬品の合成原料として用いられます。次の図.4に、アセトアニリドの合成反応を示します。

図.4 アセトアニリドの合成
(i) エステルの命名法
RCOOR'の構造を持つエステルは、RCOOHのカルボン酸の慣用名のあとに、-R'の炭化水素基名を付けて命名します。次の図.5に、エステルにおけるICPACシステムの適用例を示します。「酢酸エチルCH3COOC2H5」と「プロピオン酸メチルC2H5COOCH3」は、メチルCH3とエチルC2H5を変換した一対の構造異性体ですが、名称が全く異なっていることに注意してください。
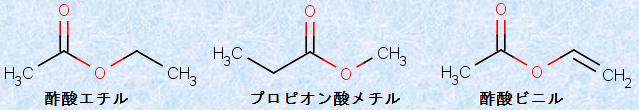
図.5 エステルにおけるICPACシステムの適用例
先にも説明したように、低分子量のエステルは、一般的に良い香りのする物質であり、数多くの果実や、花の芳香の香気のもとになっています。炭化水素基の種類によって、エステル分子の形や大きさに違いが生じて、嗅覚受容体との相互作用の仕方が異なり、特有の臭いを感じるのでしょう。例えば、酢酸エチルCH3COOC2H5は、天然にはパイナップルやイチゴなどに含まれ、果実のような甘い芳香がします。次の表.1に、代表的なエステルの香りを示します。
表.1 代表的なエステルの香り
|
化学式 |
名称 |
香り |
|
HCOOC2H5 |
ギ酸エチル |
モモ臭 |
|
CH3COOC2H5 |
酢酸エチル |
パイナップル臭 |
|
CH3COOCH2CH(CH3)2 |
酢酸イソブチル |
メロン臭 |
|
CH3COO(CH2)4CH3 |
酢酸ペンチル |
バナナ臭 |
|
CH3COO(CH2)2CH(CH3)2 |
酢酸イソペンチル |
ナシ臭 |
|
CH3COOC8H17 |
酢酸オクチル |
オレンジ臭 |
|
C3H7COOCH3 |
酪酸メチル |
リンゴ臭 |
|
C3H7COOC2H5 |
酪酸エチル |
パイナップル臭 |
|
C3H7COOC5H11 |
酪酸ペンチル |
洋ナシ臭 |
|
C4H9COOC5H11 |
吉草酸ペンチル |
リンゴ臭 |
|
C5H11COOC2H5 |
カプロン酸エチル |
リンゴ臭 |
|
C6H4(OH)COOCH3 |
サリチル酸メチル |
ヒメコウジの油 |
|
C9H19COOC2H5 |
デカン酸エチル |
ナッツ臭 |
しかしながら、天然物の香気成分は、極めて複雑なものが多いです。例えば、洋ナシの1種であるバートレットナシの揮発成分は、53種類以上ものエステルを含んでいることが確認されています。このように、エステルは純物質としてではなく、通常は混合物として、香水や人工香料に用いられています。
(ii) アミドの命名法
一般式RCONH2で表される第一級アミドは、酸RCOOHの名称の語尾「oic acid」を「amide」に置き換えて命名します。日本語では、同じ炭素数のアルカンの名称に「アミド」を付け加えて命名します。例として、次の図.6に、アミドにおけるICPACシステムの適用例を示します。なお、慣用名も( )内に示しておきます。
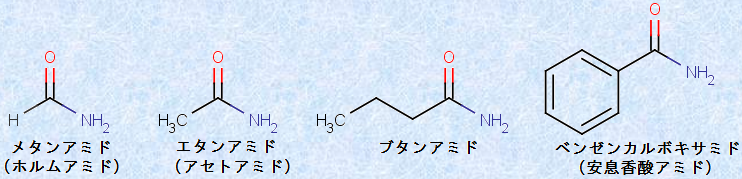
図.6 アミドにおけるIUPACシステムの適用例
(2) エステルの合成
(i) フィッシャーのエステル化反応
カルボン酸とアルコールを、濃硫酸H2SO4などの酸触媒存在下で加熱すると、エステルを得ることができます。濃硫酸H2SO4の代わりに塩化水素HClを使うこともできますが、この反応は可逆的な平衡反応なので、希塩酸HClを使った場合には、含まれる水分によって図.7の平衡が左側へ戻されてしまうので、生成するエステルの収率が悪くなります。
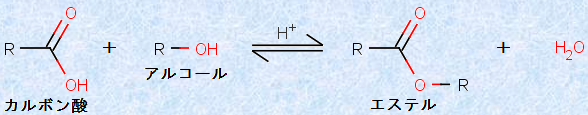
図.7 フィッシャーのエステル化反応により、エステルを合成する
この反応方法は、ドイツの有機化学者エミール・フィッシャーが開発したものであり、その名にちなんで、「フィッシャーのエステル化反応(Fischer esterification)」と呼ばれています。フィッシャーのエステル化反応を用いれば、種々のエステルを簡単に合成することができます。
ただし、この反応は、収率があまり良くないので、通常は収率を良くするために、アルコールかカルボン酸のいずれか値段の安い方を大過剰に用いたり、生成するエステルや水H2Oを蒸留などにより、反応系から取り除いたりします。このようにすることで、ル・シャトリエの法則より、平衡が右側に移動して、エステルを効率よく得ることができるのです(有機反応機構IV(カルボン酸とその誘導体の反応)を参照)。
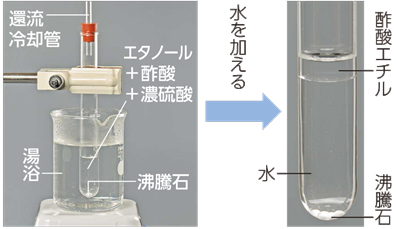
図.8 酢酸エチルCH3COOC2H5の合成
(ii) 酸無水物とアルコールの反応
酸無水物は、アルコールと反応して、エステルを与えます。酸無水物は、カルボン酸よりもアルコールに対する反応性が高く、エステルを合成するときは、カルボン酸の代わりに酸無水物を用いることも多いです。例えば、無水酢酸は、サリチル酸と反応して、「アスピリン(アセチルサリチル酸)」を与えます。この反応では、フェノール性のヒドロキシ基(-OH)が、酢酸エステル(-OCOCH3)に変換されます。このように、有機化合物中のヒドロキシ基(-OH)の水素原子を、アセチル基(-COCH3)に置換することを「アセチル化(acetylation)」といいます。酢酸CH3COOHの代わりに、無水酢酸(CH3CO)2Oを用いてアセチル化を行った場合は、水H2Oではなく酢酸CH3COOHが副生成物として生じることに注意が必要です。
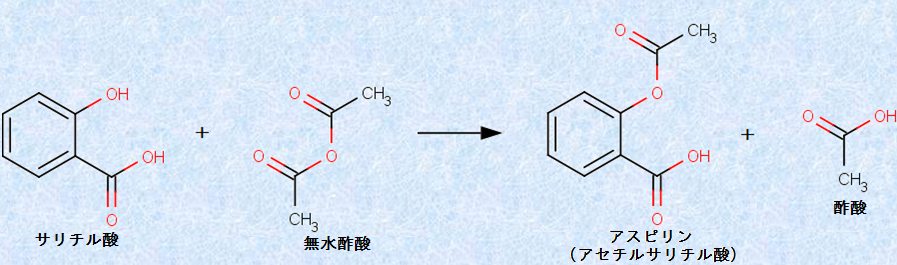
図.9 無水酢酸(CH3CO)2Oを用いたアスピリンの合成
このアセチル化は、医薬品の改良などによく用いられる手法であり、分子中のヒドロキシ基(-OH)を酢酸エステル(-OCOCH3)にするだけで、薬の薬理活性が大きく変化することがあります。この例で代表的なものが、モルヒネを無水酢酸(CH3CO)2Oでアセチル化することにより生成する「ヘロイン」です。ヘロインは、ドラッグの中でも特に危険性が高く、「ドラッグの王様」の異名を持ちます。
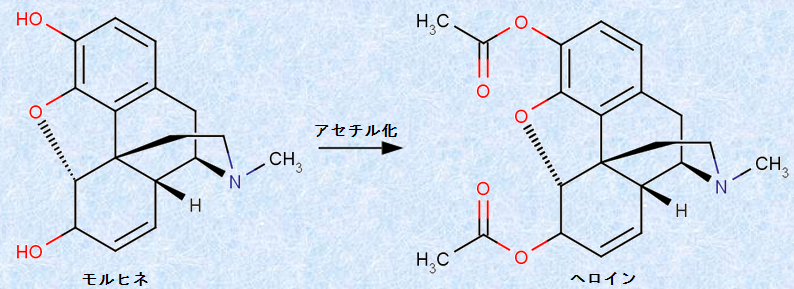
図.10 ヘロインは、モルヒネよりもはるかに強い毒性を現す
しかし、なぜ分子にアセチル基(-COCH3)を導入しただけで、薬の薬理活性が大きく変化するのでしょうか?モルヒネやヘロインのような薬物は、脳に作用点を持つ薬物です。しかし、脳は「血液脳関門」と呼ばれる、自身を護る障壁のようなものを持っています。したがって、薬物は脳内に侵入しようと思っても、通常はこの血液脳関門に阻まれて跳ね返されてしまい、強い毒性を現すことはありません。
しかし、中にはこの血液脳関門を突破してしまうような薬物も存在しています。このような物質は、一般的に「低分子」で「脂溶性」の物質が多いです。この理由は、脳の神経細胞が、油に溶けやすい脂溶性の「リン脂質」でできており、血液脳関門が、細胞の間隔が極めて狭いことによる「物理的な障壁」であるためです。
ヘロインは、親水性のヒドロキシ基(-OH)が酢酸エステル(-OCOCH3)となっており、分子の脂溶性が極めて高くなっていいます。そのため、血液脳関門の通過率は、モルヒネのなんと約30倍にも達することが知られています。このような理由で、ヘロインは、モルヒネよりもはるかに強い毒性を現すと考えられています(薬物乱用の科学を参照)。
(3) エステルの加水分解
(i) 酸を用いた加水分解
エステルに希硫酸H2SO4などの酸触媒を加えて長時間加熱すると、エステルの「加水分解反応」が進みます。これは、フィッシャーのエステル化反応が平衡反応であることを利用したものです。すなわち、これはフィッシャーのエステル化反応の「逆反応」です。ただし、加水分解反応の速度も同様に遅いので、反応を有利に進めるためには、十分な量の水H2Oを加えてやる必要があります。
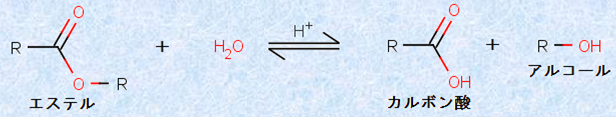
図.11 酸触媒によるエステルの加水分解
また、アミドを希塩酸HClと反応させると、すべてが加水分解してしまいます。この理由は、アミドを加水分解して生じるアミンが、塩酸HClと中和して、塩となるからです。生成したアミンは、塩酸HClによって反応系から除かれるので、加水分解反応の平衡は、積極的に右に移動することになります。したがって、アミドを加水分解するときの塩酸HClは、「触媒量」ではなく、アミンを中和して平衡を右に移動させるために、「化学量論量」加える必要があります。例として、次の図.12に、「アセトアニリド」の加水分解を示します。
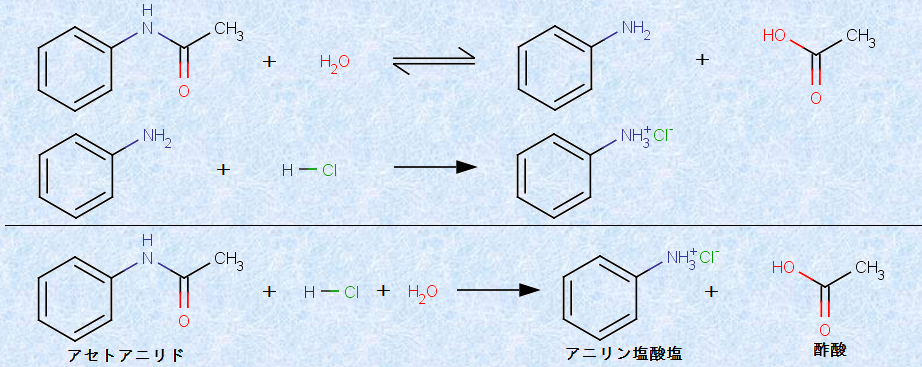
図.12 アセトアニリドの加水分解
(ii) 塩基を用いた加水分解
エステルに水酸化ナトリウムNaOH水溶液などの強塩基を加えて加熱すると、加水分解反応が進み、アルコールとカルボン酸の塩が生成します。塩基によるこのようなエステルの加水分解反応を、特に「けん化(saponification)」といいます。この名前の理由は、油脂を原料とする「セッケン」の製造において、同様の反応が用いられるからです。この反応は、一般式で次の図.13のように表されます。

図.13 エステルのけん化
ここでは、生じたカルボン酸が塩基によって中和されるため、最終生成物はカルボン酸塩になります。また、けん化は、酸を用いる加水分解と違って、可逆的ではありません。その理由は、最終生成物であるカルボン酸塩が、中和反応の分だけエネルギー的に安定になり、反応を右方向にしか進行させないからです。けん化は、天然物から単離されたような未知のエステルの構造決定を行う際に、エステルをその構成成分のカルボン酸とアルコールに切断する手段として、特に有用です。
(4) 油脂と洗剤
グリセリンC3H5(OH)3と高級脂肪酸RCOOHのトリエステルを、「油脂(oil)」といいます。油脂に水酸化ナトリウムNaOH水溶液を加えて熱すると、けん化が起きて、グリセリンと高級脂肪酸のナトリウム塩(セッケン)に加水分解されます。油脂は、動物では皮下組織や内臓の周辺に、植物では種子中に多く含まれ、エネルギーの効率的な貯蔵体および断熱などの役割を果たしています。
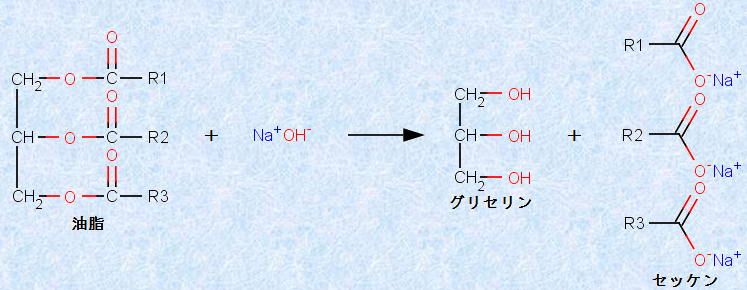
図.14 油脂のけん化
天然の油脂を構成する脂肪酸には、炭素原子数が16と18の高級脂肪酸が多いです。例えば、オリーブ油を加水分解すると、オレイン酸C17H33COOHが83%とリノール酸C17H31COOHが7%得られ、パーム油を加水分解すると、パルミチン酸C15H31COOHが43%とオレイン酸C17H33COOHが43%、リノール酸C17H31COOHが8%得られます。炭素数が「偶数」である高級脂肪酸が多い理由は、生体内の高級脂肪酸は、炭素数が2の酢酸CH3COOHの活性体である「アセチルCoA」を原料にして、生合成されているからです。
また、構成脂肪酸に「飽和脂肪酸」の割合が比較的多い油脂は、室温で固体のものが多く、「不飽和脂肪酸」の割合が比較的多い油脂は、室温で液体のものが多いです。この理由は、炭素鎖の不飽和度が増す(分子中のC=C結合が多くなる)ほど、構造の不規則性が増し、分子全体が結晶のようにきちんと配列することができなくなるからです。不飽和脂肪酸は折れ曲がった形をしているので、その分子の上に他の分子が積み重なりにくくなり、結晶化しづらくなります。一方、飽和脂肪酸の割合が比較的多い油脂では、炭素鎖の単結合の回転があるために、分子が規則正しく配列することができ、空間を充填しているので、融点が高くなります。

図.15 飽和脂肪酸と不飽和脂肪酸の分子の形
バターやラードなどの動物性油脂は、飽和脂肪酸が多くて固体のものが多く、オリーブ油やパーム油などの植物性油脂は、不飽和脂肪酸が多くて液体のものが多いです。一般的には、室温で固体の油脂を「脂肪(fat)」、液体の油脂を「脂肪油(fatty oil)」といいます。特に不飽和脂肪酸を多く含む脂肪油は、貯蔵中に周囲の環境によって加水分解や酸化を受け、より炭素原子数の少ない脂肪酸に変わり、酸性を示すようになることがあります。このような現象を、油脂の「酸敗(rancidity)」といいます。
表.2 油脂と脂肪油の違い
|
|
油脂 |
脂肪油 |
|
室温の状態 |
固体 |
液体 |
|
構成脂肪酸 |
飽和脂肪酸が多い |
不飽和脂肪酸が多い |
|
原料 |
動物性が多い |
植物性が多い |
|
例 |
バター、ラード |
大豆油、オリーブ油 |
また、不飽和脂肪酸を高い比率で含有する植物油は「乾性油(drying oil)」といって、空気中に曝されると、徐々に流動性を失って固形になります。亜麻仁油などは、その性質を利用して、油絵の材料や塗料などに利用されます。これは、油脂中の二重結合が空気中の酸素O2によって酸化され、互いに重合して分子量の大きな網目状の高分子を作り、塗られた物体の表面に被膜を作るからです。一方で、空気中に放置しても固化しないものを「不乾性油(non-drying oil)」といいます。
(i) 植物性油脂の水素添加
多くの植物性油脂は、構成脂肪酸における不飽和脂肪酸の割合が比較的多いため、室温で液体のものが多いです。そこで、液体の植物性油脂を固体に変換するために、ニッケルNiを触媒として、すべての二重結合、またはその一部を接触的に水素添加する方法が用いられます。この過程は「硬化(hardening)」と呼ばれ、このようにして生じた油脂を、「硬化油(hardened oil)」といいます。液体油の水素添加(硬化)は、1901年にドイツの化学者ウィルヘルム・ノーマンが発明した技術で、1990年代の初めには、数万点の食品に水素添加油脂が使われるようになりました。例えば、マーガリンはサラダ油や大豆油、ピーナツ油、コーン油などの植物性油脂を、ちょうどバター程度の固さになるまで水素添加したものに、牛乳や着色剤を加えて練り、バターのような香りと外観を持たせた商品です。

図.16 マーガリンは、代表的な硬化油である
自然界では、「シス型」の折れ曲がった構造を持つ不飽和脂肪酸が多いです。しかし、これに水素添加すると、飽和脂肪酸になり切れなかった一部の不飽和脂肪酸のシス型の結合が、熱力学的に安定な「トランス型」の結合に変化し、直線状の構造を持つようになります。このような不飽和脂肪酸を、「トランス脂肪酸(trans unsaturated fatty acids)」といいます。
トランス脂肪酸は、シス型と異なり分子が重なりやすいため、常温でも固体です。また、シス型よりも酸化されにくく、常温での保存期間がバターなどの動物性脂肪に比べてかなり長いです。かなりの高温でなければ燃えないため、油からほとんど煙が出ず、頻繁に取り換える必要がないなどの長所があります。トランス脂肪酸は、マーガリンに含まれる脂肪酸の数%、一部の製品では十数%にも達するといわれています。
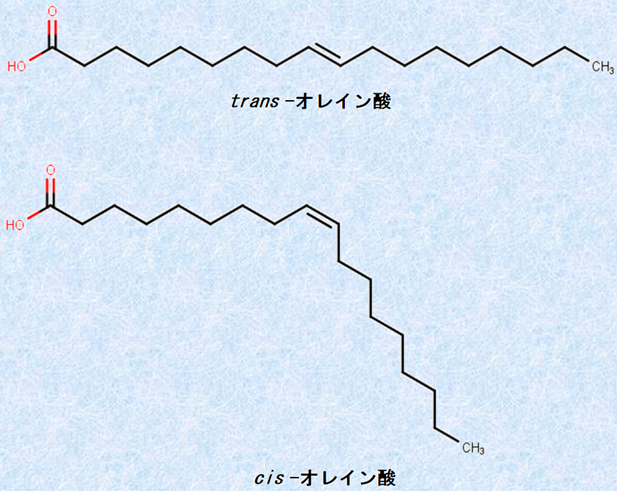
図.17 トランス脂肪酸は、水素H2を添加して硬化油を製造する過程で多く生成される
トランス脂肪酸は天然には少なく、それを消化する酵素は少ないです。すなわち、代謝されにくいので蓄積しやすく、心筋梗塞や狭心症などのリスクを高めることが分かりました。このため、2003年にWHO(世界保健機関)では、集団におけるトランス脂肪酸の平均摂取量は、最大でも「総エネルギー摂取量の1%未満」に抑えるようにと、各国に勧告を出しました。しかし、日本人が1日に摂取するトランス脂肪酸の平均は、全カロリー中0.3%であり、これはWHO勧告にある1%未満をクリアしています。日本では、一部の人たちが猛烈に反対運動をしていますが、日本におけるトランス脂肪酸の摂取量は少なく、健康への影響は小さいと思われます。
また、トランス脂肪酸のことを、「自然界には存在しない危険な油」などと記述する本などがよくありますが、実際には、自然界にも少なからぬ量のトランス脂肪酸が存在しています。例えば、ウシやヒツジなどの反芻動物の脂には、5%程度のトランス脂肪酸が含まれています。これは、彼らの胃に棲んでいる細菌が、植物成分を代謝してできるものです。また、空気による油の酸化、加熱調理の際などにも、シス型からトランス型への変化が起こります。このため、マーガリンなどの製品をすべて避けたとしても、トランス脂肪酸の摂取は0にはできない――それどころか、天然の油脂からの摂取の方が、むしろ多いという推計もあるぐらいなのです。トランス脂肪酸に関してWHOの発表した見解が「1%以下にするよう勧告」であり、「0%にするよう規制」ではないのは、これが完全排除できないリスクであることを、彼らがよく理解しているからだと思います。
(ii) 油脂のけん化とヨウ素価
油脂1 molには3 molのエステル結合が含まれるので、けん化に必要な水酸化ナトリウムNaOHは3 molです。したがって、一定質量の油脂のけん化に必要な塩基が多いことは、油脂の分子量が小さいことを意味します。油脂1 gを完全にけん化するとき、必要な水酸化カリウムKOHの質量をmg単位で表した数値を、「けん化価(saponification)」といいます。例えば、油脂1 molをけん化するのに、3 molの水酸化カリウムKOHが必要になるので、油脂の平均分子量をM、けん化価をSとすると、次式が成立します。(式量KOH=56)
![]()
![]()
これより、けん化価と油脂の平均分子量は反比例しており、その大小関係は逆になります。つまり、けん化価の大きな油脂は、平均分子量が小さく、低級脂肪酸を多く含むということが分かります。それに対して、けん化価の小さな油脂は、平均分子量が大きく、高級脂肪酸を多く含みます。
表.3 けん化価と平均分子量
|
けん化価 |
油脂の平均分子量 |
|
大 |
小 |
|
小 |
大 |
また、油脂中の炭素-炭素二重結合1個には、ヨウ素分子1個が付加するので、一定質量の油脂に付加するヨウ素I2の質量は、油脂にどの程度不飽和結合が含まれているかを知る目安となります。油脂100 g中の二重結合にヨウ素I2を付加させるとき、必要なヨウ素I2の質量をg単位で表した数値を、「ヨウ素価(iodine value)」といいます。油脂の平均分子量をM、油脂1分子中に含まれる二重結合の数をn、ヨウ素価をiとすると、次式が成立します。(分子量I2=254)
![]()
![]()
これより、ヨウ素価の大きい油脂は、その油脂の中に存在する不飽和結合が多いということが分かります。すなわち、この油脂を構成する脂肪酸には、不飽和脂肪酸が多く含まれているのです。ヨウ素価の大きい油脂は、空気中に放置されると、不飽和結合が酸化されて、徐々に固化していきます。これは、油脂の分子が酸素原子を介して結びつけられた架橋構造を形成し、分子量の大きな網目状の高分子となるからです。一般に分子内に含まれる二重結合が3個以上になると、特に空気中で固まりやすくなります。
表.4 ヨウ素価と不飽和結合の数
|
ヨウ素価 |
不飽和結合の数 |
|
大 |
多 |
|
小 |
少 |
(iii) セッケンの製造とその働き
油脂を強塩基(水酸化ナトリウムNaOHや水酸化カリウムKOHなど)の水溶液中で加熱すると、エステル結合の加水分解反応が進み、グリセリンと高級脂肪酸塩が生成します。例として、次の図.18に「トリステアリン」のけん化を示します。
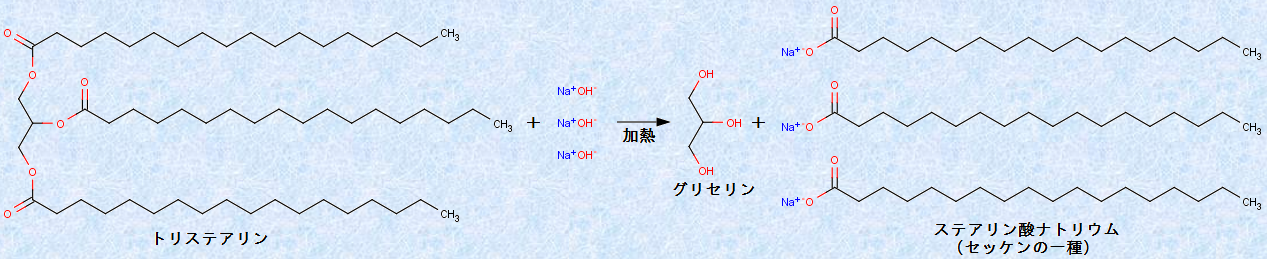
図.18 トリステアリンのけん化
この高級脂肪酸のアルカリ塩は、「セッケン(soap)」と呼ばれます。セッケンの歴史は古く、古代ケルト人やローマ人によって、2,300年以上も昔から製造されてきました。山羊などから得た動物性油脂をアルカリ性の木灰と煮ることによりセッケンを製造する技術は、最も古い化学製品製造法の1つです。古代ローマ時代の初期、「サポー(sapo)」という丘にある神殿では、羊を焼いて神に捧げるという風習があり、このとき滴り落ちた羊の脂と木灰が混じり合い、それが染み込んだ土は汚れを落とす不思議な力があるとして珍重されていました。英語の「セッケン(soap)」は、これが由来になっているといわれています。セッケンは、土壌や河川中に生息している微生物によって生分解されやすく、水を汚染する心配がないので、自然に最も優しい洗剤です。
現在では、セッケンの製造は、その大部分が油脂のけん化ではなく、油脂の加水分解によって得られる高級脂肪酸の中和などによって行われています。実験室で合成する場合は、まずは油脂に水酸化ナトリウムNaOHなどの強塩基を加えて、温めながらよくかき混ぜ、油脂をけん化します。けん化後の反応液を塩化ナトリウムNaClの飽和水溶液に加えると、セッケン分子を水和している水分子が塩化ナトリウムNaClに奪われて、セッケンが分離・析出します(この操作を塩析といいます)。これをろ過して回収し、乾燥させると、セッケンが得られます。

図.19 セッケンの合成
よく米のとぎ汁を洗剤代わりに使っている人がいますが、これは生活の知恵です。米のとぎ汁には、炭酸カリウムK2CO3などの塩基が含まれているため、食器に付着している植物性油脂や動物性油脂がけん化され、セッケンになるのです。そのため、米のとぎ汁を使うと、油汚れが落ちやすくなります。また、南スーダンのヌエル族は、ウシの尿で髪を洗う習慣がありますが、これも同じ原理です。尿から遊離したアンモニアNH3により皮脂がけん化され、セッケンになるのです。イギリスでも、19世紀までは毛織物の洗濯に腐らせた尿を使用していました。羊毛や絹のようなタンパク質繊維が塩基に弱いことを考えると、セッケンよりも塩基性の弱いアンモニア水を使用していたのは、かなり理にかなった方法だったといえるでしょう。
現在では、世界のセッケン年産量は、年間600万tをはるかに超えています。セッケンは、疎水性の炭素数11〜21程度の炭化水素基Rと親水性の原子団(-COONaや-COOK)からなります。炭素数の少ない脂肪酸(炭素数10以下)は水への溶解性は良いのですが、洗浄力が弱くなります。一方で、炭素数の多い脂肪酸(炭素数12以上)だと洗浄力は強いのですが、水への溶解性が悪いので、セッケンには使いにくいです。ラウリン酸やミリスチン酸はヤシ油、パルミチン酸やステアリン酸、オレイン酸は牛脂などから得られます。二重結合を含むオレイン酸は、炭素数が多いにも関わらず水に溶けやすいです。これは、二重結合が単結合に比べて、水に対する親和性が高いためです。
表.5 主な脂肪酸とセッケンにした場合の性質
|
名称 |
分子式 |
セッケンにした場合の性質 |
|||
|
冷水に |
洗浄力 |
泡立ち |
皮膚刺激 |
||
|
ラウリン酸 |
C11H23COOH |
溶けやすい |
やや大 |
大 |
中 |
|
ミリスチン酸 |
C13H27COOH |
溶ける |
大 |
大 |
弱 |
|
パルミチン酸 |
C15H31COOH |
溶けにくい |
大 |
やや大 |
弱 |
|
ステアリン酸 |
C17H35COOH |
溶けない |
特大 |
中 |
弱 |
|
オレイン酸 |
C17H33COOH |
溶けやすい |
大 |
大 |
微弱 |
セッケンは、水溶液中ではその一部が加水分解して、弱塩基性を示します。油汚れは塩基性になると落ちやすくなるため、セッケンとは相性が良いです。例として、次の図.21にセッケンではありませんが、酢酸ナトリウムCH3COONaの加水分解を示します。
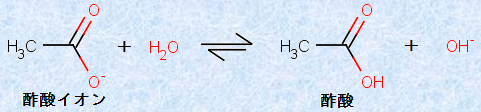
図.20 酢酸ナトリウムCH3COONaの加水分解
セッケンは、カルシウムCaやマグネシウムMg、鉄Feなどのイオンが水中に含まれると、これらと反応して、水に不溶の塩(石鹸かす)を作ります。したがって、これらのイオンを多く含む硬水や海水では、沈殿が生じてしまい、セッケンの泡立ちが悪くなります。日本の水道水にもこれらのイオンが微量含まれているので、浴室の鏡やタイルを汚す原因になり、衣類や毛髪の表面に薄膜となって付着すると、色調をぼかす原因にもなります。セッケンを使用している家庭のタオルなどがゴワゴワになり水を弾くのも、この石鹸かすが原因です。
2RCOONa + Ca2+ → (RCOO)2Ca↓ + 2Na+
また、水溶液中のセッケン濃度を上げていくと、ある濃度以上では、セッケンの脂肪酸イオン約40〜60個が集合し、疎水性部分を内側、親水性部分を外側にしたコロイド粒子を作ります。このコロイド粒子を、セッケンの「ミセル(micelle)」といいます。セッケン分子中の親水性の分子末端は、ミセル表面に並んで水接しているため、ミセルの表面は負に帯電しています。ミセル全体を1つの粒子として見れば、ミセル表面は、親水基(-COO-)によって親水性なので、セッケンのミセルは水に溶けるようになります。
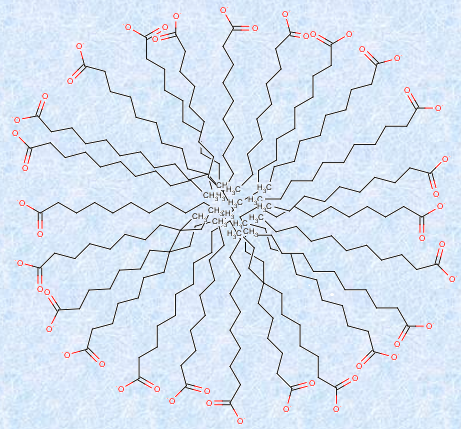
図.21 セッケンのミセル
油脂や灯油をセッケン水に入れて振ると、微細な小滴となり、溶液中に分散します。これは、セッケン分子が疎水性の炭化水素基部分を油に向けて、その小滴を取り囲むようにして安定化するからです。このような現象を「乳化(emulsify)」といい、乳化によってできた分散液を「エマルション(emulsion)」といいます。また、安定なエマルションを作るために用いるセッケンのような物質を「乳化剤(emulsifier)」といいます(コロイド化学を参照)。
・参考文献
1) 佐藤健太郎『「ゼロリスク社会」の罠』光文社(2012年発行)
2) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
3) メートランド・ジョーンズ「ジョーンズ有機化学(下)」東京化学同人(2000年発行)
4) 山北篤「現代知識チートマニュアル」新紀元社(2017年発行)
5) 山崎幹夫「新化学読本-化ける、変わるを学ぶ」白日社(2005年発行)