・カルボニル化合物(カルボン酸)
【目次】
(1) カルボン酸
有機酸のうちで最も代表的なものは、「カルボン酸(carboxylic acid)」です。官能基はカルボキシ基(carboxyl group, -COOH)であり、この名称は、2つの構成成分であるカルボニル基(carbonyl group, -CO-)と、ヒドロキシ基(hydroxyl group, -OH)の名称を合わせて、縮めたものです。
カルボン酸のうち、鎖状の炭化水素の末端にカルボキシ基(-COOH)1個が結合したものを、特に「脂肪酸(fatty acid)」といいます。さらに、脂肪酸のうち、炭化水素基がすべて単結合のものを「飽和脂肪酸(saturated fatty acids)」、炭素-炭素二重結合などのように、不飽和結合を含むものを「不飽和脂肪酸(unsaturated fatty acids)」といいます。カルボン酸は、一般的に慣用名で呼ばれるものが多いです。次の表.1に例を示します。
表.1 様々なカルボン酸
(i) カルボン酸の命名法
カルボン酸は、自然界に豊富に存在しています。そのため、最も早期から、有機化学者たちによって研究されている化合物の1つです。したがって、慣用名を持つカルボン酸は、数多く存在しています。これらの慣用名は、一般的に酸の派生源を示すラテン語、またはギリシャ語に由来することが多いです。次の表.2には、炭素数1〜10までの直鎖状カルボン酸の慣用名と、IUPAC名が示してあります。
表.2 脂肪族カルボン酸の慣用名とIUPAC名
|
炭素数 |
構造式 |
語源(含有物) |
慣用名 |
ICPAC名 |
|
1 |
HCOOH |
蟻 (ラテン語, fornica) |
ギ酸 (formic acid) |
メタン酸 (methanoic acid) |
|
2 |
CH3COOH |
食酢 (ラテン語, acetum) |
酢酸 (acetic acid) |
エタン酸 (ethanoic acid) |
|
3 |
CH3CH2COOH |
ミルク (ギリシャ語, protos pion) |
プロピオン酸 (propionic acid) |
プロパン酸 (propanoic acid) |
|
4 |
CH3(CH2)2COOH |
バター (ラテン語, butyrum) |
酪酸 (butyric acid) |
ブタン酸 (butanoic acid) |
|
5 |
CH3(CH2)3COOH |
吉草根 (ラテン語, valere) |
吉草酸 (valeric acid) |
ペンタン酸 (pentanoic acid) |
|
6 |
CH3(CH2)4COOH |
山羊 (ラテン語, caper) |
カプロン酸 (caproic acid) |
ヘキサン酸 (hexanoic acid) |
|
7 |
CH3(CH2)5COOH |
ブドウの花 (ラテン語, onanthe) |
エナンチン酸 (enanthic acid) |
ヘプタン酸 (heptanoic acid) |
|
8 |
CH3(CH2)6COOH |
山羊 (ラテン語, caper) |
カプリル酸 (caprylic acid) |
オクタン酸 (octanoic acid) |
|
9 |
CH3(CH2)7COOH |
テンジクアオイ (ギリシャ語, pelargos) |
ペラルゴン酸 (pelargonic acid) |
ノナン酸 (nonanoic acid) |
|
10 |
CH3(CH2)8COOH |
山羊 (ラテン語, caper) |
カプリン酸 (capric acid) |
デカン酸 (decanoic acid) |
カルボン酸のIUPAC名を書くには、対応するアルカン(alkane)の末尾の「e」を接尾語「oic」に置き換えたあと、「acid」を付け加えて命名します。日本語では、同じ炭素数のアルカンの名称のあとに「酸」を付け加えて命名します。
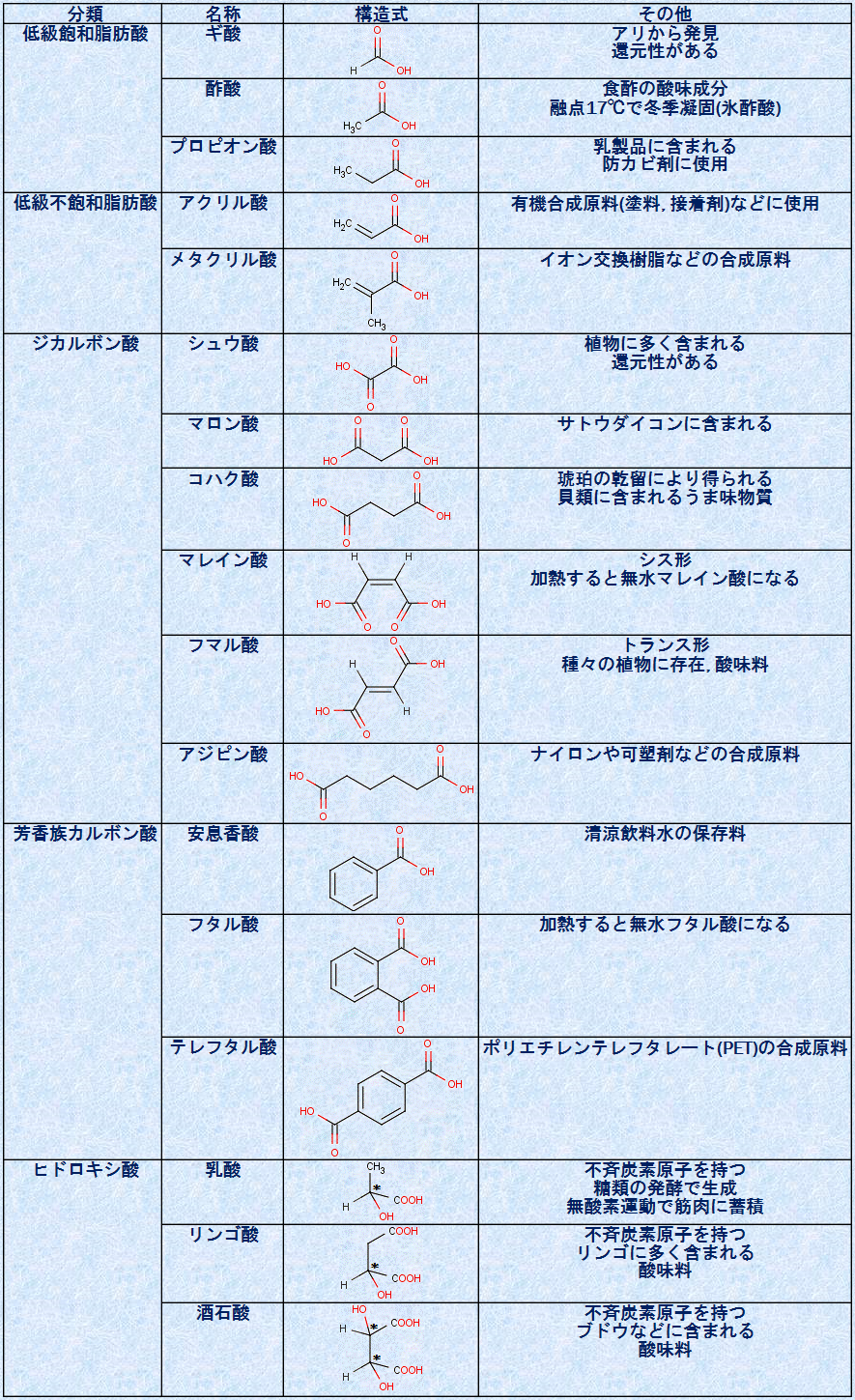
置換基のあるカルボン酸の命名法には、次の2つがあります。IUPAC命名法では、カルボキシ基(-COOH)を含む最も長い炭素鎖を選び、カルボキシ炭素を番号1として、位置番号を付けていきます。もう1つの方法は、慣用名を用いるときに、カルボキシ炭素の隣の炭素をα (アルファ)位として、順番にギリシャ文字で、β (ベータ)、γ (ガンマ)、δ (デルタ)、ε (イプシロン)、ς (スティグマ)、ζ (ゼータ)、η (イータ)、θ (シータ)、ι (イオタ)・・・・・・と位置番号を付けていく方法です。この2つの命名法は、混同して使用することはできません。
また、命名に際しては、カルボキシ基(-COOH)は、アルコール・アルデヒド・ケトンなどの官能基に優先します(カルボキシ基>アルデヒド基>ケトン基>ヒドロキシ基>炭素-炭素二重結合>炭素-炭素三重結合)。カルボン酸に、アルデヒド基(-CHO)やケトン基(-CO-)が共存する場合は、それらカルボニル酸素の位置を、「オキソ(oxo)」いう接頭語で表現する約束になっています。
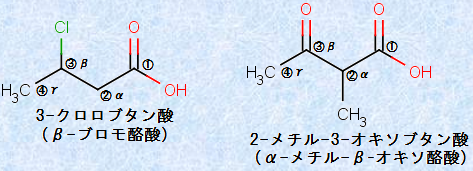
図.1 カルボン酸におけるICPACシステムの適用例
IUPAC命名法に従うと、カルボキシ基(-COOH)を2つ持つ「脂肪族ジカルボン酸」には、「二酸(dioic acid)」という接尾語を付けることになっています。次の図.2に、ジカルボン酸におけるICPACシステムの適用例を示します。「マレイン酸」ならびに「フマル酸」という慣用名で呼ばれる2種類の2-ブテン二酸は、幾何異性体の発見に、重要な役割を果たしたことでも知られています。
図.2 ジカルボン酸におけるICPACシステムの適用例
(ii) カルボン酸の物理的性質
炭素原子数の少ないカルボン酸は、かなり不快な刺激臭を持つ無色の液体です。「酢酸CH3COOH」は、食酢に3〜5%含まれ、食酢特有の臭いと風味を与えています。「酪酸C3H7COOH」は、腐敗したバターの不快臭のもとであり、臭すぎて虫も付かないといいます。山羊酸(カプロン酸C5H11COOH・カプリル酸C8H17COOH・カプリン酸C10H21COOH)は、山羊のような臭いがして、汗の悪臭の原因となっています。汗は本来無臭ですが、細菌が皮脂を分解することで、カプロン酸などのカルボン酸を生じさせるのです。なお、いわゆる「鉄の臭い」も、鉄そのものの臭いではなく、鉄イオンと汗の酸性によって、皮脂が分解してできたアルデヒドなどの臭いであることが分かっています。次の表.3には、主なカルボン酸の物理的性質が示してあります。
表.3 カルボン酸の物理的性質
|
名称 |
化学式 |
沸点(℃) |
融点(℃) |
水への溶解性 (g/100 g水, 25℃) |
|
ギ酸 |
HCOOH |
101 |
8 |
∞ |
|
酢酸 |
CH3COOH |
118 |
17 |
∞ |
|
プロピオン酸 |
CH3CH2COOH |
141 |
-22 |
∞ |
|
酪酸 |
CH3CH2CH2COOH |
164 |
-8 |
∞ |
|
吉草酸 |
CH3CH2CH2 CH2COOH |
187 |
-34 |
3.7 |
構造式から分かるように、カルボン酸は極性を持った化合物であり、アルコールと同じように、カルボン酸の分子間や他の分子と水素結合をします。その結果、カルボン酸の沸点は分子量から予想されるよりもかなり高くなり、対応する分子量のアルコールよりも高くなります。例えば、酢酸CH3COOHと1-プロパノールCH3CH2CH2OHの分子量は60で同じ値ですが、沸点はそれぞれ118℃と97℃です。
また、カルボン酸は、水素結合2つで互いにしっかりと結びついた、「二量体(dimer)」を形成することも分かっています。そのため、カルボン酸の分子量は、見かけの上では、実際よりもかなり大きくなります。
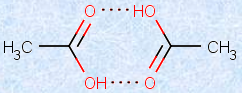
図.3 酢酸CH3COOHの二量体
同じく水素結合を考えることによって、水素結合をしている水分子1つを、低分子量のカルボン酸分子で置き換えることは容易であるため、低分子量のカルボン酸が、水溶性であることを説明できます。中でも炭素数が4以下のカルボン酸は、水によく溶けます。
(iii) カルボン酸の酸性度
カルボン酸(pKa=3〜5)は、アルコール(pKa=15〜17)やアルデヒド、およびケトン(pKa=15〜20)よりも、はるかに強い酸です。例えば、酢酸CH3COOHのpKa値は4.7ですが、エタノールC2H5OHのpKa値は16です。つまり、酢酸CH3COOHは、エタノールC2H5OHよりも約1011倍も強い酸なのです。この理由は何でしょうか?
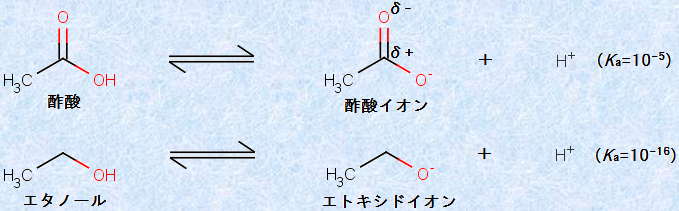
図.4 酢酸CH3COOHとエタノールC2H5OHの酸性度
両者の構造的な唯一の違いは、エタノールC2H5OHのメチレン基(-CH2-)が、酢酸CH3COOHでは、カルボニル基(-CO-)に置き換わっていることです。つまり、極性の高いカルボニル基(-CO-)は、酸素電子が電子を求引して炭素原子上に部分正電荷を帯びるため、プロトン解離により、酸素原子上に生成する負電荷を静電気的に安定化することができるのです。一般的に、共役塩基の構造が安定であるほど、酸の酸性度は強くなります。したがって、酢酸CH3COOHはエタノールC2H5OHよりも、はるかに強い酸になります。
もう1つの理由として、エトキシドイオンC2H5O- では、負電荷が1つの酸素原子上だけに局在化していますが、酢酸イオンCH3COO- では、負電荷は共鳴によって、非局在化していることがあげられます。

図.5 酢酸イオンCH3COO- の共鳴安定化
ここでは、負電荷が電気陰性度の大きな2つの酸素原子に等しく分布できるので、酢酸イオンCH3COO- の各酸素原子は、実際には負電荷を半分しか持っていません。すなわち、酢酸CH3COOHでは、非常に共鳴安定化された酢酸イオンCH3COO- が生成するため、カルボン酸の酸性度は、アルコールよりも強くなるのです。
(2) カルボン酸の反応
(i) 酸としての反応
カルボン酸は、水酸化ナトリウムNaOHなどの強塩基と中和し、カルボン酸の塩と水H2Oを生じます。例えば、酢酸CH3COOHは水酸化ナトリウムNaOHで処理すると、酢酸ナトリウムCH3COONaになります。カルボン酸と強塩基の塩は、水溶液で弱塩基性を示します。
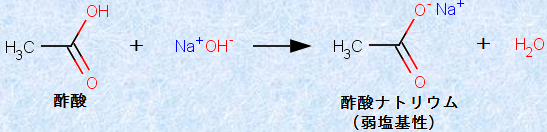
図.6 酢酸CH3COOHと水酸化ナトリウムNaOHの中和反応
中和させたあとに水を蒸発させると、塩が単離されます。カルボン酸塩の中には、セッケンや洗剤として使用されているものがあります(カルボニル化合物(カルボン酸誘導体)を参照)。また、カルボン酸は、塩酸HClや硫酸H2SO4よりは弱い酸なので、カルボン酸塩の水溶液に希塩酸HClなどを加えると、弱酸のカルボン酸が遊離します。

図.7 強酸によるカルボン酸の遊離反応
カルボン酸(pKa=3〜5)は、炭酸(pKa=6.4)より強い酸なので、炭酸塩や炭酸水素塩の水溶液にカルボン酸を加えると、弱酸の二酸化炭素CO2が遊離します。例えば、酢酸CH3COOHは炭酸水素ナトリウムNaHCO3と、次のように反応します。一般的には、炭素C・水素H・酸素Oからなる化合物で、炭酸水素ナトリウムNaHCO3水溶液を加えて「発泡」したら、それはカルボン酸であると考えて問題ありません。
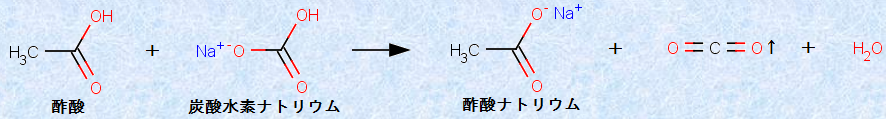
図.8 酢酸CH3COOHによる二酸化炭素CO2の遊離反応
(ii) 分子間脱水
カルボン酸は比較的安定な化合物ですが、十酸化四リンP4O10などの脱水剤とともに強熱すると、極めて反応性の高い「酸無水物(acid anhydride)」に変化します。酸無水物は、2つのカルボキシ基(-COOH)から水H2Oを取り去って、互いに結合させた構造を持ちます。例として、次の図.9に「無水酢酸(CH3CO)2O」の生成反応を示します。

図.9 無水酢酸(CH3CO)2Oの生成反応
無水酢酸(CH3CO)2Oは、刺激臭のある中性の液体(b.p.140℃)で、水には溶けにくいですが、水とは徐々に反応して、酢酸CH3COOHに戻ります。カルボン酸無水物は高い反応性のため、様々な反応に利用されます。最もよく用いられるのは無水酢酸(CH3CO)2Oで、アルコールと反応させてエステルを合成したり、アセテート繊維や医療品の原料になったりします。
(iii) 分子内脱水
適当な距離を隔てて、2つのカルボキシ基(-COOH)を持つジカルボン酸は、加熱すると容易に脱水して、安定な環構造(5員環または6員環)を持った環状の酸無水物を与えます。最も代表的な酸無水物は、「無水マレイン酸」と「無水フタル酸」です。マル酸とマレイン酸は、「虎(trans)に踏ま(フマル酸)れて稀(マレイン酸)に死す(cis)」と覚えると良いでしょう。
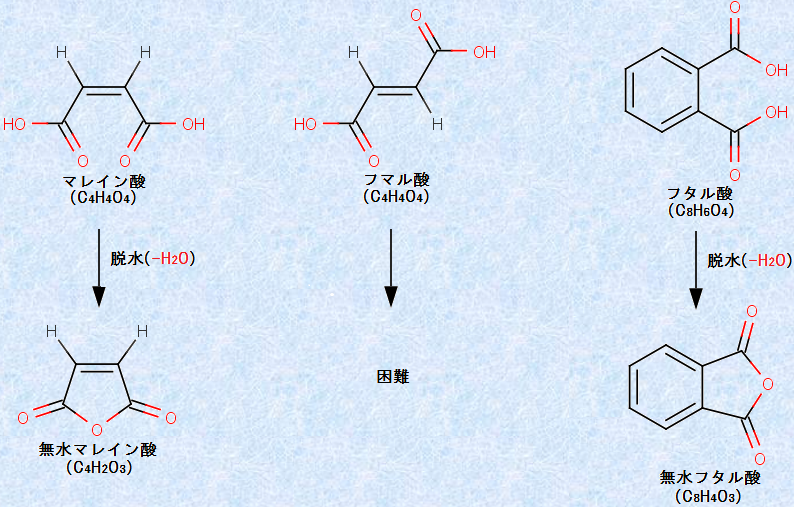
図.10 無水マレイン酸と無水フタル酸の生成反応
マレイン酸とフマル酸は、2-ブテン二酸の幾何異性体です。マレイン酸を160℃で熱すると、分子内脱水が起こって、環状の「無水マレイン酸」になります。フマル酸では、2つのカルボキシ基(-COOH)の立体的な位置が遠く離れているので、このような反応は容易に起こりません。ただし、フマル酸を減圧下で230℃以上にして長時間加熱した場合には、二重結合のπ結合が切れ、シス形に異性化した後、最終的には無水マレイン酸が生成することが知られています。ちなみに、フマル酸は、入浴剤などに配合されており、炭酸水素ナトリウムNaHCO3と反応することで発泡します。フマル酸は無極性分子なので、極性分子であるマレイン酸と比較して溶解度が低く、ゆっくりと反応するために、入浴剤に適しているのです。
また、フタル酸を熱すると、分子内脱水が容易に起こって、酸無水物である「無水フタル酸」が生成します。無水フタル酸は、無色針状の結晶で、昇華性があり、水やアルコールに溶けます。無水フタル酸は、合成樹脂や染料、色素、医薬品の原料、可塑剤などに用いられています。
(iv) カルボン酸塩の熱分解反応
酢酸ナトリウムCH3COONaを水酸化ナトリウムNaOHなどの強塩基とともに加熱すると、カルボキシ基(-COOH)が取れて、メタンCH4が生成します。この反応は、炭酸イオンCO32- が抜ける形で反応が進行するため、「脱炭酸反応(decarboxylation reaction)」と呼ばれます。この反応は、生化学でも利用されており、私たちの身体は、アミノ酸のカルボキシ基(-COOH)を取って、アミンを生成しています。

図.11 酢酸ナトリウムCH3COONaの脱炭酸反応
さらに、酢酸カルシウム(CH3COO)2Caを乾留すると、炭酸イオンCO32- が抜けて、アセトンCH3COCH3を生じます。この反応は、実験室的にアセトンCH3COCH3を合成する反応として利用されています。

図.12 酢酸カルシウム(CH3COO)2Caの乾留によるアセトンCH3COCH3の合成反応
(3) カルボン酸の合成とその利用
(i) ギ酸HCOOH
ギ酸HCOOHは、飽和脂肪酸の中で最も簡単な化合物であり、比較的強い酸性を示します(pKa=3.8)。刺激臭のある無色の液体(m.p.8℃, b.p.101℃)で、ホルムアルデヒドHCHOの酸化で得られます。水によく溶け、腐食性と高い浸透性があるため、皮膚に付くと水脹れができて、激しい痛みを感じます。また、ギ酸HCOOHはカルボン酸に分類されますが、分子中にアルデヒド基(-CHO)の構造を持っているので、次の半反応式のように還元性を示します。
HCOOH → CO2 + 2H+ + 2e-
ギ酸HCOOHは、「蟻酸」と書くこともあるように、アリが生産するカルボン酸です。1671年、大量のアリの死体を蒸留するという実験で発見させました。分類学的には、アリはハチの中の1分類群であり、実はほとんどの種で尾端に毒針を持っています。この毒針を使って、巣の防衛や、獲物に対する攻撃を行います。通常、日本で人家の周囲にいるようなアリの多くは、針を持っていないか、もしくは針が弱いために人を刺しません。しかし、系統的には、毒針を持つアリが多数派です。熱帯には、ヒアリのように刺されるとスズメバチのような激しい症状を引き起こす種もいて、日本でもオオハリアリやクシケアリが、かなり強力な毒針を持っています。針を持つ種は、ハチと同様に針を使って毒液を注入したり、水鉄砲のように毒液を外敵に吹きかけたりして、攻撃を行います。ただし、毒液の主成分は種によって異なり、必ずしもギ酸HCOOHであるとは限りません。

図.13 南米大陸原産のヒアリは、アルカロイド系の強力な毒を持つ
カラスやムクドリなどの一部の鳥類は、自らの羽にアリを擦り付けることがあり、これを「蟻浴」といいます。アリの代わりにヤスデなどが用いられることもあります。アリの巣の上に座り込み、全身にアリをたからせ、ときにはアリを加えたまま羽毛をすいて、満遍なく擦り付ける様子が観察されています。これは、アリが分泌するギ酸HCOOHなどの化学物質を利用して、ダニなどの羽に付く寄生虫を駆除する行動と考えられています。

図.14 蟻浴をするカラス
(ii) 酢酸CH3COOH
酢酸CH3COOHは、刺激臭のある無色の液体(m.p.17℃, b.p.118℃)です。昔は、酢酸CH3COOHを精製するのに、カルシウム塩を利用していました。木材を乾留すると、「木炭」が得られるのと同時に、一酸化炭素COやメタンCH4を主成分とする「木ガス」が発生し、「木タール」と「木酢」が得られます。木タールは、乾溜液の下層部の液体のことで、フェノール類をはじめ様々な化合物が含まれています。木酢は、乾留液の上層部の液体のことで、アセトンCH3COCH3やメタノールCH3OHなどとともに5〜6%の酢酸CH3COOHが含まれています。この木酢中の酢酸CH3COOHを発見したのは、17世紀のドイツの化学者ヨハン・ルドルフ・グラウバーでした。

図.15 グラウバーは、様々な化学物質の製法を発明・発見し、特に蒸留器などの改良を行ったため、「世界初の化学工学者」と呼ばれる
グラウバーは、木酢を蒸留して得られた液に、どろどろに溶いた水酸化カルシウムCa(OH)2を加え、酢酸CH3COOHを酢酸カルシウム(CH3COO)2Caに変化させました。そして、液を蒸発乾固し、これに硫酸H2SO4を加えて蒸留を繰り返していくと、揮発性の低い硫酸カルシウムCaSO4は残り、ほぼ純粋な酢酸CH3COOHが得られます。
2CH3COOH + Ca(OH)2 → (CH3COO)2Ca + 2H2O
(CH3COO)2Ca + H2SO4 → 2CH3COOH + CaSO4
ちなみに、純粋な酢酸CH3COOHの融点は17℃ですから、純粋なものは、冬の日の低温で氷のような美しい結晶となり、瓶の中で固まります。それ故に、純粋な酢酸CH3COOHは、「氷酢酸」とも呼ばれます。火を付けると、氷酢酸は、美しい青白い炎を上げて燃えます。
また、2分子の酢酸CH3COOHが脱水縮合すると、無水酢酸(CH3CO)2Oになります。ただし、無水酢酸(CH3CO)2Oは、酢酸CH3COOHとは全く別の化合物であるから、氷酢酸とは全くの別物であるということに注意してください。
2CH3COOH → (CH3CO)2O + H2O
酢酸CH3COOHは水によく溶け、食酢中に3〜5%含まれます。強い酸味と刺激臭を持ち、食酢に特有の風味を与えています。酢酸CH3COOHは、工業品としても重要であり、アセトアルデヒドCH3CHOを酸化して製造され、合成樹脂や医薬品、染料などの原料になります。

図.16 アセトアルデヒドCH3CHOの酸化による酢酸CH3COOHの合成反応
(iii) クレオパトラの真珠のイヤリング
酢に関する有名なエピソードとして、古代エジプトの女王クレオパトラが真珠を飲んだ話があります。愛人のガイウス・ユリウス・カエサルを失って、ローマからエジプトに帰っていたクレオパトラは、大軍を率いてタルソスに攻め込んできたマルクス・アントニウスからの呼び出しを受けます。紀元前41年の夏の末のことでした。アントニウスは、クレオパトラが自分の敵であるディオ・カッシウスに手を貸したことで、怒っていたのです。そこで、クレオパトラは饗応の限りを尽くし、タルソス滞在の間、毎日のように豪華な宴を催しては、アントニウスをなだめました。アントニウスは、実際にエジプトの富の底知れなさを目のあたりにして驚嘆し、クレオパトラの美しさに溺れました。そしてあるとき、どれほどの費用をかけ、どれほどの贅沢な宴会ができるものかと、クレオパトラに聞きました。クレオパトラは、「今までの饗宴に使ったすべての費用をたった1回の宴会で使い果たすことだってできる」と答えました。

図.17 クレオパトラは、「絶世の美女」として知られ、人をそらさない魅力的な話術と、小鳥のような美しい声であったと伝えられている
あくる日、アントニウスはクレオパトラに招かれて、彼女の船を訪れました。クレオパトラは、夢のように飾り立てたガレー船を、エジプトから連ねてきていました。しかし、アントニウスの目の前の食事は、何の変哲もありません。アントニウスは勝ち誇ったように、「約束が違うではないか」といいました。すると、クレオパトラはその言葉を待っていたように艶然と笑い、召使に小さな杯を持たせました。そして、クレオパトラは自分の両耳から大粒の真珠のイヤリングをそっと外すと、杯の中に放り込んだのです。驚くアントニウスの前で、真珠は杯に入っていた酢に溶けてしまいました。世界最大とも謳われたほどの真珠です。今の金額で言えば、数十億円にも相当する非常な貴重品でした。クレオパトラは、泰然として真珠を溶かしてしまうと、唖然とするローマ人たちの前で、それを一気に飲み干したのです。こうして、アントニウスは、クレオパトラの美しさと機知の虜となってしまいました。
真珠の正体は、炭酸カルシウムCaCO3です。したがって、酢酸CH3COOHに溶けるのは、ごく当たり前のことです。しかし、一息で飲める程度の酢に落とした真珠が、あっという間に溶けたということになると、この話もやや眉唾になります。酢酸CH3COOHの濃度が10%以上はないとまず真珠は溶けませんが、一般的な酢は3〜5%、クレオパトラの時代の強いワインビネガーでも7%ほどだったと思われます。クレオパトラは、その酢をワインや水で薄めて飲んだのかもしれませんし、溶けずとも、酢に真珠を放り込んで見せた様子が、さらに誇張されて語られたのかもしれません。詰まるところ、この話は、物語としては面白いという程度に留まるでしょう。
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
・参考文献
1) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
2) メートランド・ジョーンズ「ジョーンズ有機化学(下)」東京化学同人(2000年発行)
3) ジョーシュワルツ「シュワルツ博士の化学はこんなに面白い」主婦の友社(2002年発行)
4) 山崎幹夫「新化学読本-化ける、変わるを学ぶ」白日社(2005年発行)