�E�R���C�h���w
�y�ڎ��z
(i) �a���R���C�h�̋Ð�(DLVO���_)
(1) �R���C�h�Ƃ͉����H
�@1861�N�A�X�R�b�g�����h�̉��w�҂ł���g�[�}�X�E�O���A���́A���̒��Ńf���v����^���p�N���Ȃǂ̗��q���g�U���鑬�x���x�����Ƃ����A������u�R���C�h(colloid)�v�Ɩ��t���܂����B�u�R���C�h���q(colloidal particle)�v�Ƃ́A���a�����1 nm(10-9 m)�`1 ��m(10-6 m)���x�̌��q�Ɣ�ׂĔ�r�I�傫�ȕ��U���q�̂��Ƃł��B�R���C�h�Ƃ́A�R���C�h���q�������ɕ��U�����n�S�̂̂��Ƃ��w���܂��B�g�߂ȗ�ł����A������D���Ȃǂ��R���C�h�ł��B�����̂悤�ȕ��U�����t�̂̃R���C�h�n�t�́A��ʓI�Ɂu�G�}���V����(emulsion)�v�Ƃ����܂��B����ɑ��āA�D���̂悤�ȕ��U�����ő̂̃R���C�h�n�t�́A��ʓI�Ɂu�T�X�y���V����(suspension)�v�Ƃ����܂��B�R���C�h�̕��U�}�́A��Ƃ��ĉt�̂��邢�͌ő̂̏ꍇ�������ł��B�������A���U�}���C�̂̏ꍇ������A���̂悤�ȃR���C�h�́u�G�A���]��(aerosol)�v�Ƃ����܂��B�u�]��(sol)�v�Ƃ����̂́A���������������R���C�h�̂��Ƃł��B����ɑ��āA���M���p�Ȃǂ̉��炩�̌����ŁA�]���������������������̂��u�Q��(gel)�v�Ƃ����܂��B�g�߂ȃQ���̗�Ƃ��ẮA���V��[���[�A�����Ȃǂ�����܂��B
�\.1 �g�߂ȃR���C�h
|
���U�� |
���U�} |
���� |
��̗� |
|
�t�� |
�C�� |
�G�A���]�� |
���A�X�v���[ |
|
�ő� |
�C�� |
�G�A���]�� |
�ق���A�� |
|
�C�� |
�t�� |
�A |
�V�F�[�r���O�z�[�� |
|
�t�� |
�t�� |
�G�}���V���� |
�����A�}���l�[�Y�A�o�^�[ |
|
�ő� |
�t�� |
�T�X�y���V���� |
�D���A�h�� |
|
�C�� |
�ő� |
�ő̃R���C�h |
�N�b�L�[�A������v |
|
�t�� |
�ő� |
�ő̃R���C�h |
�����z����������v |
|
�ő� |
�ő� |
�ő̃R���C�h |
���F�v���X�`�b�N�A���F�K���X |
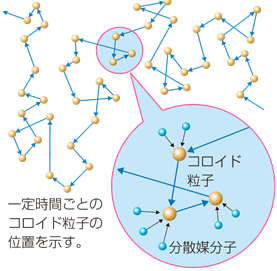
�R���C�h���q�̑傫���́A��̒��a��1 nm�`1 ��m�͈̔͂ł��B����́A�뎆��ʉ߂��Ĕ�������ʉ߂��Ȃ����x�̑傫���ɂȂ�܂��B���̐������g�p���邱�ƂŁA���q�ƃR���C�h���q���邱�Ƃ��ł��܂��B�܂��A�R���C�h���q�̌`����A����̂��̂���_����A�@�ۏ�A����̂��̂܂ŁA�l�X�Ȍ`��ő��݂��Ă��܂��B
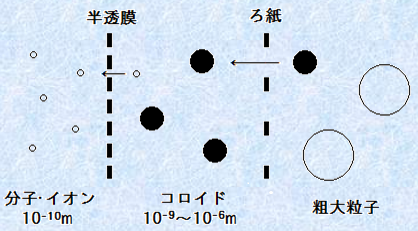
�}.1 �R���C�h���q�̑傫��
�R���C�h���q�́A���w�������ł́A���������Ċώ@���邱�Ƃ��ł��܂���B�������A���O�������ⓧ�ߌ^�d�q������(TEM)�Ȃǂ��g���A�R���C�h���q���ώ@���邱�Ƃ��ł��܂��B���O�������́A����ȏƖ����u�ɂ��A�����q�̎U����(�`���_����)���ώ@���āA�����q�̓��������錰�����̂��Ƃł��B�܂��A���ߌ^�d�q�������́A�����̑���ɓd�q�����Ǝ˂��āA�Ώۂ��ώ@����d�q�������̂��Ƃł��B������ɂ��Ă��A�R���C�h���q�͔��ɏ������̂ŁA�ώ@����ɂ͓���ȑ��u���K�v�ƂȂ�܂��B

�}.2 ���O�������Ŋώ@�����R���C�h���q
�R���C�h�́A���̍\���ɂ��A�u�����q�R���C�h(polymer colloid)�v��u��R���C�h(association colloid)�v�A�u���U�R���C�h(dispersed colloid)�v�ɕ��ނ��邱�Ƃ��ł��܂��B�����q�R���C�h�́A���U�}�ɕ��U�������q1�̑傫�����A�R���C�h�����̕��U�n�ł��B�R���C�h���w�̏����ɂ́A�����q�R���C�h�̌������R���C�h�̎嗬�ł����B�R���C�h�����̐��҂ł������g�[�}�X�E�O���A�����ŏ��Ɏ������R���C�h�́A�����猩��Ƃ�������V�R�����q�ɑ��Ȃ�܂���B���݂ł́A�u�����q���w(polymer chemistry)�v�Ƃ����ʂ̊w�╪�삪�ł��オ���Ă���̂ŁA�����q���R���C�h���w�ň������Ƃ́A�قƂ�ǂ���܂���B��R���C�h�́A�����̕��q���W�܂��āA�R���C�h�̑傫�������悤�ɂȂ������U�n�̂��Ƃł��B��܂Ȃǂ̊E�ʊ����ܕ��q�́A�n�t���ł���Z�x�ȏ�ɂȂ�ƁA�u�~�Z��(micelle)�v�ƌĂ���̂����܂��B���U�R���C�h�́A�n�}�ɂ͖{���n�����Ȃ��s�n�������̕��U�n�̂��Ƃł��B�{���n������͂��̂Ȃ����������U���Ă���̂�����A���U�R���C�h�͔M�͊w�I�ɂ͕s����Ȍn�ł��B���U�R���C�h�͕s����Ȍn�Ȃ̂ŁA�ȒP�ɔj�邱�Ƃ��ł��܂��B���Ȃ݂ɕ\.1�Ŏ������R���C�h�͂��ׂĕ��U�R���C�h�ł���A���U�R���C�h�͍ł��g�߂Ɉ��Ă���R���C�h�ɂȂ�܂��B
�\.2 �R���C�h�̕���
|
���� |
�����q�R���C�h |
��R���C�h |
���U�R���C�h |
|
�\�� |
�����q1�� |
�����̗��q�̉ |
��n���̔����q |
|
�� |
�y�f�A�f���v���Ȃ� |
�Z�b�P���Ȃ� |
Au�A���_���S(III)�A�D�Ȃ� |
(2) �a���R���C�h�Ɛe���R���C�h
���U�R���C�h�́A�s�n���̗��q�����U���Ă���n�̂��Ƃł����āA���q���n�����Ă���n�t�Ƃ́A���m�ɋ�ʂ���Ă��܂��B���Ȃ킿�A�n�t�́A��������{�\���P�ʗ��q�̎����܂ł��ɂȂ��āA�n�}�ɗn���Ă����Ԃł���̂ɑ��āA�R���C�h�́A103�`109���x�̌��q���W�܂���1�̑傫�ȗ��q�ƂȂ�A����炪���U���Ă����Ԃł��邩��ł��B�����q�R���C�h�Ȃǂ̗�O�͂���܂����A�R���C�h�ƌ�������A��ʓI�ɂ́u���q�̏W���̂����U�}�ɕ��U���Ă���n�v���Ǝv���Ηǂ��̂ł��B���������āA�R���C�h�̕��U������ۂ��߂ɂ́A�������̏������K�v�ɂȂ�܂��B
���ɂ́A�R���C�h���q������ɏ����ȗ��q�܂ŁA���ɂ���邱�Ƃ��Ȃ����Ƃł��B�Ⴆ�A�H��NaCl��V����C12H22O11�ŃR���C�h�̑傫���̗��q������Ă��A�����͐����ł́A����Ƀi�g���E���C�I��Na+ ��V����C12H22O11���q�Ȃǂ̏����ȗ��q�ƂȂ��āA���U���Ă����܂��B����ł́A�ő��R���C�h�Ƃ͂����Ȃ��Ȃ��Ă��܂��܂��B
�����đ��ɂ́A�R���C�h���q���m���Փ˂��ċÏW���A�傫�ȗ��q�ɂȂ�Ȃ����Ƃł��B���U�R���C�h�́A�M�͊w�I�ɂ͕s����Ȍn�ł��B���̂��߁A���U�R���C�h�ɂ́A����ɂȂ낤�ƋÏW����X��������܂��B�R���C�h���q���ÏW���đ傫�ȗ��q�ɂȂ�ƁA�P�ɕ��������ނ��Ƃ�����ԂɂȂ��Ă��܂��A�ő��R���C�h�ł͂Ȃ��Ȃ��Ă��܂��܂��B
|
�@ �R���C�h���q������ɏ����ȗ��q�܂ł��ɂ���Ȃ����� �A �R���C�h���q���m���Փ˂��ċÏW���A�傫�ȗ��q�ɂȂ�Ȃ����� |
���U�R���C�h���ÏW���Ȃ��悤�ɂ���ɂ́A2�̕��@������܂��B���̕��@�́A�R���C�h���q�̕\�ʂ�ѓd�����邱�Ƃł��B�Ⴆ�A�R���C�h���q�̕\�ʂɑѓd�������Ƃ��܂��B���̂Ƃ��A�n�t�͓d�C�I�ɂ͒����ł��邩��A�\�ʓd�ׂƓ����ʂ̗z�C�I�����A�R���C�h���q����芪���Ă��܂��B���̂悤�ȕ\�ʓd�ׂƔ��Ε����̃C�I�����u�C�I��(counter ion)�v�Ƃ����܂��B�����āA���̐}.3�̂悤�ȏ�Ԃ��u�d�C��d�w(electric double layer)�v���ł��Ă���Ƃ����܂��B�}.3�̃R���C�h�ł́A�C�I���ł���z�C�I���́A���̕\�ʓd�ׂɈ����t�����Ă͂�����̂́A�t�������R�ɓ����ĉ����܂ōL�����Ă������Ƃ��ł��܂��B����̂ɁA2�̗��q���ÏW���悤�Ɛڋ߂��Ă��A�܂��O���ɂ���C�I�����m���Ԃ��荇���A���̌��ʂƂ��ăN�[�����͂̔����������āA���q�̋ÏW��W����悤�ɂȂ�̂ł��B
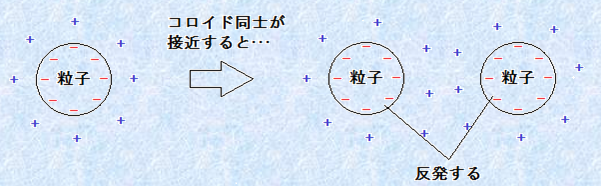
�}.3 �d�C��d�w�̐���(��)�Ɠd�C��d�w�����R���C�h�Ԃ̔���(�E)
���U�R���C�h���ÏW���Ȃ����߂̑��̕��@�́A�R���C�h���q�̕\�ʂ��ׂ��Ƃ�Ɨn�}���q�ŕ����Ă������Ƃł��B�R���C�h���q���݂��ɐڋ߂��Ă��A�\�ʂ��Ă���n�}���q������Ȃ���A�R���C�h���q�Ԃ̐ڐG��W���邱�Ƃ��ł��܂��B
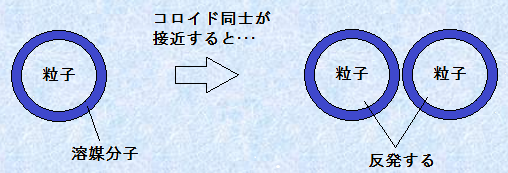
�}.4 ���a����Ă���R���C�h�Ԃ̔���
�R���C�h���q�̂����A��ɑ��̕��@�݂̂Ő����ŕ��U���Ă���ꍇ�A������u�a���R���C�h(hydrophobic colloid)�v�Ƃ����܂��B���ɑ��ĕs�n�ł���A�{�����~���ׂ��������R���C�h���q�̑傫���ɂȂ�����ɁA���炩�̗��R�ŕ\�ʂ��ѓd���Ă��܂������߂ɁA�R���C�h���q�����U��ԂɂȂ��Ă���̂ł��B����ɑ��āA���̕��@���傽�闝�R�Ő����ɕ��U���Ă���ꍇ�A������u�e���R���C�h(hydrophilic colloid)�v�Ƃ����܂��B�R���C�h�\�ʂɗn�}�ł��鐅���q���ׂ��Ƃ�Ƃ������ė���Ȃ��̂́A���ꂾ�����ɑ��Đe�a������������ł��B��ʓI�ɑa���R���C�h�ɂ͕��U�R���C�h�������A���̑唼�����@�����ł��B����ŁA�e���R���C�h�ɂ͕��q�R���C�h���R���C�h�������A���̑唼���L�@�����ł��B
�\.3 �R���C�h�̕���
|
���� |
�a���R���C�h |
�e���R���C�h |
|
���� |
���Ƃ̐e�a�����Ⴂ |
���Ƃ̐e�a�������� |
|
��� |
���U�R���C�h |
���q�R���C�h�A��R���C�h |
|
��̗� |
Au�AAgCl�AS�A���_���S(III)�Ȃ� |
�Z�b�P���A���V�A�^���p�N���Ȃ� |
(i) �a���R���C�h�̋Ð�(DLVO���_)
�a���R���C�h�ɏ��ʂ̓d�����������ċÏW�����邱�Ƃ��A��ʓI�Ɂu�Ð�(precipitation)�v�Ƃ����܂��B���̋Ð͂́A�P�ɑa���R���C�h�̓d�ׂ̒��a�ɂ��Ód�����͂̑r������N�����ł͂���܂���B�Ð͂̃��J�j�Y����������Ă݂܂��傤�B
�a���R���C�h�̕��U���Ă���n�t�ŁA�d�C��d�w������2�̃R���C�h���q���ڋ߂����Ƃ��܂��B����ƁA�d�C��d�w�̊O���̑C�I���̏d�Ȃ肪�N���āA�R���C�h���q�ɂ͔����͂������܂��B�������Ȃ���A�R���C�h���q���m�����Ȃ�߂��܂Őڋ߂����Ƃ��ɂ́A���q�Ԃɕ��q�ԗ͂������āA���������ċÏW����͂��ł��B���̂��߁A�����ɂ�2���q�Ԃ̋��������鏊�܂ł͔����͂������A��������߂������ł͋t�Ɉ��͂��������ƂɂȂ�܂��B����r�������ꂽ���q�Ԃ̃|�e���V�����G�l���M�[E (r)�Ƃ��̓_�ɓ�����f (r)�ɂ́Af (r)��-dE (r)/dr�̊W������܂��B
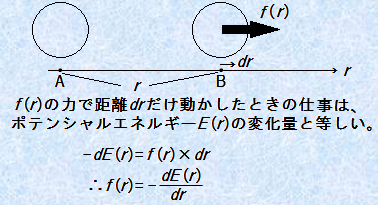
�}.5 ���q�Ԃɓ�����f (r)�ƃG�l���M�[E (r)�̊W
���������āA�����͂ƈ��͂̑傫�����������Ȃ闱�q�Ԃ̋�����r0�Ƃ���ƁAr��r0�ł�dE (r)/dr��0�ƂȂ���f (r)��0�̔����͂������Ar��r0�ł�dE (r)/dr��0�ƂȂ���f (r)��0�̈��͂������͂��ł��B���ۂɗ��_�v�Z������ƁA���̐}.6�̂悤��r��r0��E (r)���ɑ�ɂȂ�Ȑ��������܂��B���q�Ԃ̃|�e���V�����G�l���M�[E (r)�͑傫���قǕs����ɂȂ�̂ŁA�R���C�h���q�ɂ͖����ɉ������邩�A�ÏW���邩�̂ǂ��炩�̑I���������Ȃ��̂ł��B
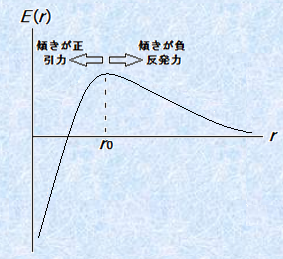
�}.6 ���q�Ԃ̃|�e���V�����G�l���M�[E (r)�Ȑ�
���āA�R���C�h���q�Ԃɓ������q�ԗ͂̑傫���́A�R���C�h���\�����镨���ɌŗL�̂��̂ł��邩��A�ȒP�ɂ͕ς��邱�Ƃ͂ł��܂���B���̈���ŁA�R���C�h���q�Ԃɓ��������͂̑傫���́A�d�C��d�w�̌����ɂ��̂ŁA���͂̃C�I���̕��z��ω������邱�ƂŁA���̔����͂����������邱�Ƃ��ł��܂��B�Ⴆ�A�a���R���C�h�̕��U���Ă���n�t�ɉ���������ƁA�R���C�h���q����芪���Ă���C�I���́A�Ód�����͂ɂ�藱�q�\�ʂ̋߂��ւƉ�������܂��B���Ȃ킿�A�d�C��d�w�̌�������������̂ł��B���̑C�I�������������ʂ́A���������̒��ŁA�C�I���Ɠ��������̃C�I�������Ɍ����Ă��܂��B�܂�A�\�ʓd�ׂƔ��Ε����̃C�I�����A�����L���ɍ�p����̂ł��B�����āA���̃C�I���̉������傫���Ȃ�ƁA���̓����͊i�i�ɍ��܂�܂��B�ÏW�ɕK�v�ȉ��̔Z�x�́A�C�I��������6��ɔ���Ⴗ�邱�Ƃ��A������蕪�����Ă��܂��B���̌��ۂ́A�����҂̖��O������āu�V�����c�F��n�[�f�B�[�̌��q���@��(Schulze Hardy of valence law)�v�ƌĂ�Ă��܂��B�������āA�d�C��d�w�̌��������������R���C�h���q�́A�u���E���^���̍ۂɌ݂��ɐڋ߂ł���悤�ɂȂ�܂��B����ƁA�R���C�h���q�Ԃŕ��q�ԗ͂���������(r��r0)�ɓ��荞��ł��܂��A�R���C�h���q���m���ÏW���āA�Ð͂��N����̂ł��B
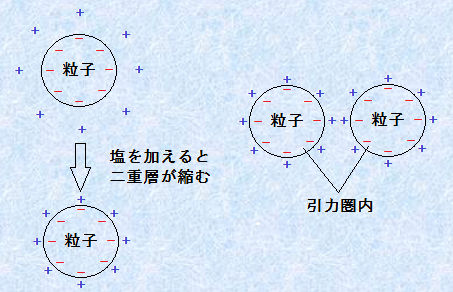
�}.7 DLVO���_�ɂ��ÏW�̃��J�j�Y��
�a���R���C�h�̕��U�ƋÏW���ۂɂ��āA�R���C�h���q�Ԃ̓d�C��d�w�ɂ�锽���͂ƕ��q�ԗ͂ɂ���Đ����ł���Ƃ������_���A�uDLVO���_(Derjaguin-Landau-Verwey-Overbeek theory)�v�Ƃ����܂��B�uDLVO�v�Ƃ́A���\�A�̉��w�҂ł���f�����[�M���ƃ����_�E�A�I�����_�̉��w�҂ł���t�F���E�F�C�ƃI�[�x���r�[�N��4�l�̌����҂̓������ɗR�����Ă��܂��B
(ii) �e���R���C�h�̉���
�e���R���C�h�̃R���C�h���q�\�ʂɂ́A�e�����̊��\��(-OH��-COOH�A-CO-�A-NH2�Ȃ�)����������܂��B���̐e��������q��\�ʂɋ��������t���Ă��邽�߂ɁA���a�������̏�Q�ɂȂ��āA�R���C�h���q���m�̋ÏW�͖W�����Ă��܂��B���������āA�e���R���C�h���ÏW�����邽�߂ɂ́A�\�ʂł̐��f�������A�R���C�h���q���Ă��鐅�a����\�ʂ��甍�����Ȃ���Ȃ�܂���B
�����R���C�h�n�t�ɉ�����ƁA���͐����ł̓C�I���ɓd�����܂��B�����̃C�I���́A�e����������������q�ƈ��������̂ŁA�e���R���C�h�ɉ����i�g���E��NaCl�Ȃǂ̉���������A���_��͐��a���������āA�e���R���C�h�͒��a����͂��ł��B�������A�����i�g���E��NaCl�̔Z�x��1 mol/L���炢�ɂ��Ă��A�Ȃ��Ȃ��R���C�h���q�͒��a���܂���B�Ȃ��Ȃ�A���n�t�ɂ͖�1000/18��56 mol/L�̎��R�Ȑ����q�����݂��A���i�g���E���C�I��Na+ �≖�����C�I��Cl- �̃C�I���́A1�����肹������4���炢�̐����q�����������t�����邾���ł��邩��ł��B���������āA���̔Z�x��1 mol/L���x�ł́A�C�I���̐������Ȃ����āA�e����Ɛ����q�̐��f�������Ɏ���Ȃ��̂ł��B���Ȃ킿�A�e���R���C�h�͏��ʂ̉��������������ł͋ÏW���N���炸�A�����i�g���E��NaCl�̔Z�x��5�`10 mol/L���炢�ɂȂ��āA���߂Đe����Ɛ����q�̐��f��������A�e���R���C�h�̋ÏW���N����܂��B���̂悤�ɐe���R���C�h�ɑ��ʂ̓d�����������ċÏW�����邱�Ƃ��A��ʓI�Ɂu����(salting out)�v�Ƃ����܂��B
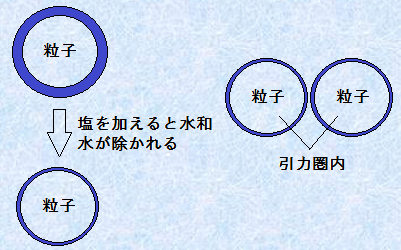
�}.8 �e���R���C�h�̋ÏW�̃��J�j�Y��
�Z�b�P���̃R���C�h�n�t�ɖO�a�H�����������ăZ�b�P����͏o��������A�^���p�N���̃R���C�h�n�t�ł��铤���Ƀj�K��MgCl2�◰�_�J���V�E��CaSO4�������ē������������肷��̂́A���͂𗘗p�������̂ł��B

�}.9 �Z�b�P���̐���
�܂��A�e���R���C�h��a���R���C�h�ɉ�����ƁA�a���R���C�h���Ð͂��ɂ����Ȃ邱�Ƃ�����܂��B���̂Ƃ��ɉ�����e���R���C�h���A�u�ی�R���C�h(protective colloid)�v�Ƃ����܂��B����́A�a���R���C�h�̎����ی�R���C�h�����͂݁A����ɂ��̎���𐅕��q�����a���Ă��邽�߁A�a���R���C�h�̕\�ʂ��e��������邩��ł��B�ی�R���C�h��������ƁA�a���R���C�h�͓d�����ɑ��Ĉ���ɂȂ�܂��B�Ⴆ�A�ԐF�A���J�������R���C�h�ɑ��āA�[���`���͓��ɋ����ی��p�������܂��B���̑��̗�Ƃ��ẮA�n�`�̃j�J����}���l�[�Y�̗����́A��\�I�ȕی�R���C�h�ł��B�������A���̕ی��p�̋����͕����̎�ނ����łȂ��ApH�⒲���@�Ȃǂɒ������e�����܂��B
(3) ��R���C�h(�~�Z��)�̓���
�u�~�Z��(micelle)�v�Ƃ́A�E�ʊ����܂̕��q�܂��̓C�I���̏W���̂̂��Ƃł��B�E�ʊ����܂́A���q���ɐe����Ƒa����̗����������߁A���e�}�����q�ƌĂ�邱�Ƃ�����܂��B���̐}.10�ɑ�\�I�ȊE�ʊ����܂ł���X�e�A�����_�i�g���E��C17H35COONa�̍\�����������܂��B�E�ʊ����܂̓��f�������āA�ȒP�ɏ������Ƃ������ł��B
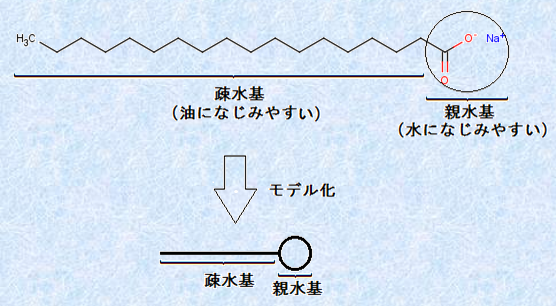
�}.10 �X�e�A�����_�i�g���E��C17H35COONa�̍\����
���n�t���̊E�ʊ����܂̔Z�x���グ�Ă����ƁA���n�t���ŊE�ʊ����܂��W�����āA�傫�ȃ~�Z�����`�����܂��B�������A�~�Z���͊E�ʊ����܂̐��n�t���ŁA���ł��ł����ł͂���܂���B���n�t���ɗn�����Ă���E�ʊ����ܕ��q�́A���q���ɑa������邽�߁A�����ł͕s����ł��B���̂��߁A�E�ʊ����܂𐅂ɗn�����Ă��A�ŏ��͂킸���ɗn�����邾���ŁA���̐}.11��A�̂悤�ɁA�唼�̊E�ʊ����܂͐��n�t�\�ʂւƋz������̂ł��B�a�������C�Ɍ����ċz�����闝�R�́A��C���\�������ȕ��q(���fN2��_�fO2�A�A���S��Ar)���A�a�����ł��邩��ł��B�܂��A���Ƌ�C�ł͂Ȃ��A���Ɩ��̂悤�ȏł��A�E�ʊ����܂͂��̊E�ʂւƋz�����܂��B�E�ʊ����܂��A�\�ʂ܂��͊E�ʂւƋz�����悤�Ƃ���E�ʋz���\�́A�E�ʊ����܂̏d�v�ȕ�����1�ł��B�����āA���n�t���̊E�ʊ����܂̔Z�x���X�ɏグ�Ă����A����Z�xC0�ɒB����ƁA����ȏ�͋z���ł��Ȃ���ԂƂȂ�܂��B���̏�Ԃ́A�\�ʂ��E�ʊ����ܕ��q�Ŗ����ɂȂ�A���̐}.11��B�̂悤�ɁA�\�ʋz�����O�a���Ă��܂�����ԂȂ̂ł��B�������čs����̂Ȃ��Ȃ����E�ʊ����܂́A���q���m�őa������d�ˍ��킹�A�e������O��(����)�Ɍ����Č݂��ɏW�܂邱�Ƃɂ��A���̐}.11��C�̂悤�ɁA����ȏW���̂����̂ł��B���̏W���̂��~�Z���ł��B
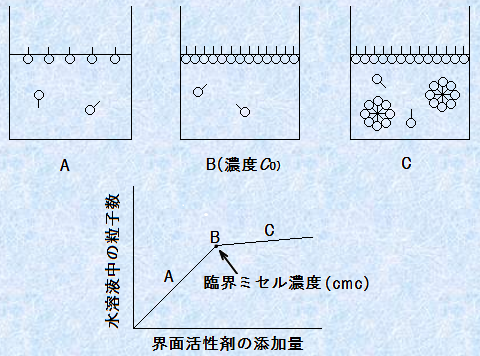
�}.11 �E�ʊ����܂̐����ւ̗n����
���̃~�Z���̑傫���ƌ`��́A���a�����q�̒����̖�2�{�̋��q�ł���A�R���C�h�͈̔͂ɓ���܂��B���������āA�E�ʊ����܂̔Z�x��C0�ȏ�ɂȂ��ď��߂āA�E�ʊ����܂̐��n�t�̓R���C�h�ɂȂ�̂ł��B�E�ʊ����܂̐��n�t�́AC0�ȉ��̔Z�x�ł̓R���C�h�ɂ͂Ȃ�Ȃ��̂ŁA�Z�x�ɂ���ăR���C�h�ɂȂ�����A�����łȂ��Ȃ����肷�鋻���[�������������܂��B�����āA���̃~�Z���͔Z�x��C0�ȏ�ɂ���A���R�Ɛ������܂��B���̂ɓ��ʂȑ���͕s�v�Ȃ̂ł��BC0�Ƃ����Z�x�́A�R���C�h�ł��邩�Ȃ�������ʂ���d�v�Ȓl�ł����āA�E�ʊ����܂��~�Z�����`�����n�߂邱�̔Z�x�̂��Ƃ��A�u�ՊE�~�Z���Z�x(critical micellar concentration)�v�Ƃ����܂��B�ՊE�~�Z���Z�x�́A���̉p��̓�����������āA�P�Ɂucmc�v�ƌĂԂ��Ƃ������ł��B
�@�Ƃ���ŁA���̊E�ʊ����܂��g���ƁA���Ɩ��̂悤�Ɍ݂��ɍ����荇��Ȃ������̈�����A�����ɕ��U�����邱�Ƃ��ł��܂��B����́A�E�ʊ����܂��~�Z�����`�����āA�~�Z�����ɂ��̕�������荞�܂�邩��ł��B���̂悤�ɂ��āA����t�̂ɗn���ɂ����������A�E�ʊ����܂̑��݉��ł��̉t�̂ɗn����悤�ɂȂ錻�ۂ��A�u�n��(solubilization)�v�Ƃ����܂��B�E�ʊ����ܗn�t�ւ̉n���́A�ՊE�~�Z���Z�x�ȏ�ŋN����܂��B���̏ꍇ�̉n���ʂƊE�ʊ����܂̔Z�x�Ƃ̊Ԃɂ́A��ʓI�Ɏ��̐}.12�̂悤�ȊW������܂��B���̃O���t����A�t�ɗՊE�~�Z���Z�x���ԐړI�ɋ��߂邱�Ƃ��ł��܂��B
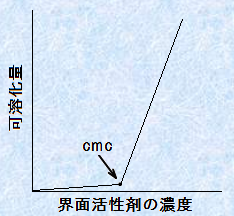
�}.12 �n���ʂ̊E�ʊ����ܔZ�x�ˑ���
�n���ʂ������ƁA�~�Z���͖c���ł����܂��B���̎U���\�́A�~�Z�����c��ނƑ��債�A�t�͔������ɂȂ��ē���������A�������Č������肵�܂��B�����ŁA���̌��ۂ��E�ʊ����܂́u������p(emulsifying action)�v�Ƃ����܂��B�}���l�[�Y����t�Ȃǂɂ͊E�ʊ����܂��g���Ă���A���̓�����p�̂��߂ɁA���������Č�����̂ł��B
(4) �R���C�h�n�t�̐���
(i) ����
�R���C�h���q�́A�뎆�̌���菬�����̂ŁA�뎆�ŏW�߂悤�Ǝv���Ă��A�뎆��f�ʂ肵�܂��B�������A�Z���n������R���W�I�����̌����͑傫���̂ŁA�����̔������͒ʉ߂ł��܂���B����ŁA�R���C�h���q��菬���ȃC�I���╪�q�́A���̃Z���n�����̌������ʂ邱�Ƃ��ł��܂��B�����ŁA���̐}.13�̂悤�ȑ��u���g�����ƂŁA�����ȃC�I���╪�q�������A�R���C�h���q�݂̗̂n�t�ɂ��邱�Ƃ��ł���̂ł��B���̑�����u����(dialysis)�v�Ƃ����܂��B
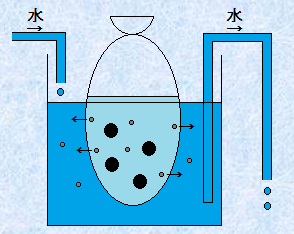
�}.13 ����
��w�����ł悭�o�肳���̂��A���͂𗘗p�������_���S(III)�R���C�h�̍쐬�ł��B�������ɉ����S(III) FeCl3���n�t��������ƁA�����������N����A�Ԋ��F�̐��_���S(III)�R���C�h�n�t���쐬�ł��܂��B�������Ƃ̔����ł́A�����̂��߂ɉ����������}���ɐi�݁A�t���ɑ��ʂɂł������_���S(III)�̏����Ȍ����j���A�傫�Ȓ��a���q�܂Ő��������ɁA�R���C�h���q�̑傫���Ő������X�g�b�v���Ă��܂��̂ł��B���_���S(III)�́A���w���ł�Fe2O3�nH2O�ƕ\����An��1��FeO(OH)��n��3��Fe(OH)3�Ȃǂ̍������ł��B���w�������Ƃ��ẮA���̔�����������₷���ł��B
FeCl3�@�{�@3H2O�@���@Fe(OH)3�@�{�@3HCl
�㎮����Fe(OH)3�����������R���C�h���q�ł����A�������W�����ăR���C�h���q�̑傫���ɂȂ������̂ƍl������̂ŁA�㎮�������̂悤�ɏ������Ƃ�����܂��B���̎��ł́A[Fe(OH)3]x�����������R���C�h���q��\���Ă��܂����A���ۂ̑g���͂����ƕ��G�Ȃ��̂ł��B�Ȃ��A���̃R���C�h�́A�n�t���̐��f�C�I��H+ �܂��͓S(III)�C�I��Fe3+ ���\�ʂɋz�����Ă���̂ŁA���ɑѓd�����a���R���C�h�ɂȂ��Ă��܂��B
xFeCl3�@�{�@3xH2O�@���@[Fe(OH)3]x�@�{�@3xHCl
�������R���C�h�n�t�����ł���Z���n���܂ɓ���āA�������ɐZ���āA���͂��s���܂��B����ƁA���f�C�I��H+ �≖�����C�I��Cl- �́A�g�U�̌����ɏ]���ăZ���n������ʉ߂��ďo�Ă����܂��B�������A���_���S(III)�̃R���C�h���q�́A���̑傫���̂��߂ɔ�������ʉ߂ł����A�Z���n�������ɗ��܂邱�ƂɂȂ�܂��B���̑���ɂ���āA���_���S(III)�̃R���C�h���A�Z���n���ܒ��ɐ����ł���̂ł��B

�}.14 �Ԋ��F�̐��_���S(III)�R���C�h�n�t
�܂��A���͂�L���ɗ��p���Ă���̂��A�������̑̂̒��ɂ���t���ł��B�t���ɂ́A���t���Ɋ܂܂��A�f(NH2)2CO�Ȃǂ̘V�p������菜������������܂��B�������A�t���a�ɂ��A�t���̋@�\���ቺ���Ă���ƁA�V�p����̊O�ɔr���ł��Ȃ��Ȃ�A�A�ŏǂɂ�萶���̊�@�Ɋׂ�܂��B�����������邽�߂ɁA�l�H���͂��s����̂ł��B�l�H���͂ɂ́A���̐}.15�̂悤�Ȍ��������킪�p�����܂��B�܂��A�̊O�Ɏ��o�������t������������ɒʂ��āA���������ƌ��������ɕ������܂��B�Ԍ����┒�����Ȃǂ̌��������͓��͖���ʉ߂��܂��A���������q�ł���A�f(NH2)2CO�͓��͖���ʉ߂���̂ŁA���������邱�Ƃ��ł���̂ł��B�����āA�������������̑���ɁA�V�N�Ȍ����������̓A���u�~���n�t���[���܂��B�l�H���͂́A�������Ƃ��Ă̍�p��������t���̓������A���̂悤�ɂ��Đl�H�I�ɍs�����Ö@�Ȃ̂ł��B

�}.15 ����������ɂ��A�l�H���͂��s��
(ii) �`���_������
�R���C�h�͕K�����������Ă���Ƃ͌��炸�A�����܂��͔������Ȃ��̂������ł��B�������A�����Ɍ����Ă��Ă��A�R���C�h�̉����狭�����Ă�ƁA���̒ʘH�������Č����܂��B����́A�R���C�h���q�̑傫�������̔g���Ƃقړ��������߁A���̕\�ʂŌ����悭�U������邽�߂ł��B�����ŁA���̌��ۂ��u�`���_������(Tyndall effect)�v�Ƃ����A���̌����u�`���_����(Tyndall light)�v�Ƃ����܂��B����̓R���C�h�̓�����1�ł���A�`���_�����ۂ̗L���ɂ��A�R���C�h���������邱�Ƃ��\�ɂȂ�܂��B

�}.16 �`���_������
�`���_�����ۂ́A���̎U���������ł��B�U���̋����́A���q�̑̐ς�2��ɔ�Ⴕ�܂��B����āA���q��C�I���̂悤�ȏ����ȗ��q�ł́A�����قƂ�ǎU�����܂��A�R���C�h���炢�̑傫���̗��q�ł́A�������Ȃ苭���U�������܂��B�Â��������̋�ɁA���̒ʘH�������邱�Ƃ�����܂��B����́A��C���ɕ��V���Ă�������q�ɂ���Č����U������A�`���_�����ۂ��N���邩��Ȃ̂ł��B�Ȃ��A�a���R���C�h�̃`���_�����ۂ́A��r�I�͂����茻��܂����A�e���R���C�h�̃`���_�����ۂ́A���܂�͂����茻��܂���B
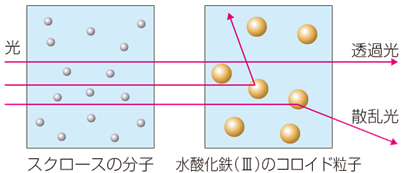
�}.17 �R���C�h���q�ɂ����̎U��
���Ȃ݂ɁA���̎U�����ۂ́A���q�̑傫���ɂ���ĕ��ނ�����Ă��܂��B��r�I�傫�ȗ��q�ł́u�~�[�U��(Mie scattering)�v���A��r�I�����ȗ��q�ł́u���C���[�U��(Rayleigh scattering)�v���K�p����܂��B�`���_�����ۂ́A��Ƀ~�[�U���ɂ����̂��傫���ł��B���C���[�U���́A���̔g���̈ˑ����������A�g���̒Z���F�̌��́A�ԐF�̌����������U������܂��B�g���̒������͗��q�ɂԂ���ɂ����A�g���̒Z�����قǗ��q�ɂԂ���₷������������̂ł��B�Ȃ��A�������闝�R�́A���C���[�U���������ł��܂��B����́A��C���̔����q�ɂ��A�F�̌��������U������邩��Ȃ̂ł��B�܂��A�~�[�U���́A�g���̈ˑ������Ⴂ�̂ŁA�ǂ̔g���̌��������x�ɎU�����܂��B�_������������̂́A�~�[�U���������ł�(�F�̉Ȋw���Q��)�B
�\.4 �~�[�U���ƃ��C���[�U���̈Ⴂ
|
|
�~�[�U�� |
���C���[�U�� |
|
���q�̑傫�� |
���̔g���Ɠ����x |
���̔g�����͂邩�ɏ����� |
|
�U���̂���� |
�ǂ̔g�����ϓ��ɎU�� |
�g�����Z���قǎU������₷�� |
|
�� |
�_�̐F |
��̐F |
(iii) �u���E���^��
�@�C�M���X�̐A���w�҂ł��郍�o�[�g�E�u���E���́A1827�N�ɐA���̉ԕ��𐅂ɕ����ׂČ������Ŋώ@�����Ƃ���A�ԕ��̒��ɂ���t�E���̔����q���s�K���ȉ^�������邱�Ƃ����܂����B���������A���̌��ۂ́u�ԕ��̐����͂Ɋ�Â����̂ł���v�Ǝv���܂������A�u���E���͖������̔����q�ł����l�̌��ۂ��N���邱�Ƃ��ώ@���āA�^���̐����N������ے肵�܂����B���̉^���́u�u���E���^��(Brownian motion)�v�Ɩ��t�����܂������A�����Ԃ��̌����͕s���̂܂܂ł����B
�������A1905�N�ɑ��ΐ����_�ŗL���ȃA���x���g�E�A�C���V���^�C�����A�u���E���^���̌�����˂��~�߂܂����B�A�C���V���^�C���́A�M�^������}�����q�̕s�K���ȏՓ˂ɂ��A�u���E���^���������N�������Ƃ������Ƃ��A���v�͊w����g���ė��_�I�ɐ��������̂ł��B�܂�A�}���ɕ����Ԕ����q�́A�₦�ԂȂ����ɑ����̔}�����q�ɏՓ˂���Ă��܂����A���̏Փ˂̓f�^�����ɋN����̂ŁA����u�Ԃɔ����q�����^���ʂ͂荇���܂���B���̕s�ύt�̂��߂ɁA�R���C�h���q�������Ƃ�����ł��B
�}.18 �u���E���^���̌���
�����A���q�̑��݂͊m��������Ă��炸�A�ڂŌ����Ȃ��u���q�v�Ƃ������̂��{���ɑ��݂���̂��A�����c�_�������Ă��܂����B�h�C�c�̕����w�҂ł��郋�[�g���B�b�q�E�{���c�}���́A�C�̕��q�̓������W�c�ōl���A���v�͊w�ɂ���ė\������Ƃ�����@(���q�^���_)��1890�N��Ɋm�����܂����B�������A���q��F�߂Ȃ��Ƃ����w�c����A���X�Ȓ�����U�����Ă��܂����B���̐�N�́A�Ɏ_�����@�Œm����h�C�c�̕������w�����B���w�����E�I�X�g�����h�ł���Ƃ������Ƃ́A�ӊO�ƒm���Ă��܂���(���@�H�Ɖ��w���Q��)�B
�}.19 �C�̕��q�̑��x�͓��v�͊w�ɂ���ė\���ł���
�I�X�g�����h�́A�u�����͘A���ł���v�ƐM���Ă��āA���q�̂悤�ȓƗ��������q�����������Ԃ𗝉����悤�Ƃ��܂���ł����B�I�X�g�����h�̓{���c�}���̍u����ɐ��肵�āA���q�̑��݂�M����҂�l�|�����茙���点�������肵���̂ŁA�{���c�}���͘_���ɔ��Đ��_��a�݁A���Ɏ��E���Ă��܂��܂��B�I�X�g�����h�����q�̑��݂����Ԃ��ԔF�߂��̂́A�A�C���V���^�C���̘_����ǂ�ł���̂��Ƃł��B�R���C�h���q�̃u���E���^��������ł�����̂́A����̕��U�}�̕��q�����q�Ƃ��đ��݂��A���ꂪ�������ɏՓ˂��邱�ƈȊO�ɍl�����Ȃ���������ł��B����ɂ���āA�u���q�͖{���ɑ��݂���̂��v�Ƃ��������������_���ɁA�A�C���V���^�C����������t���邱�ƂƂȂ�܂����B���q�_�ɔ����Ă����Ȋw�҂������A���q�̑��݂�F�߂���Ȃ��قǂ̊����ȗ��_�ł����B
���Ȃ݂ɁA�A�C���V���^�C�������������ɂ��ƁA�u���E���^���ɂ��R���C�h���q�̈ړ�����x�́A�C�̒萔��R�A��Ή��x��T�A���Ԃ�t�A�S�x�����A���q�̔��a��r�A�A�{�K�h���萔��NA��p���āA���̂悤�ɕ\����܂��B�t�����X�̕����w�҂ł���W�����E�y�����́A�����q���g���������ɂ��A�A�C���V���^�C���̎�����A�{�K�h���萔NA�����߁A���̒l��6�~1023�ƎZ�o���Ă��܂��B�y�����́A1926�N�ɂ́u�����̔�A�����ւ̍v���v�A�܂茴�q�̎��݂̏ؖ��ɂ���āA�m�[�x�������w�܂���܂��܂����B

�A�C���V���^�C���̓��������ɂ��ƁA�u���E���^���ɂ��g�U�̑����́A���a���������قǑ����A�܂����q�̕��ϑ��x�̓{���c�}�����z�ɏ]���A���x�������قNJg�U�̑����͑����Ȃ�܂��B�D���̂悤�ȃR���C�h�ɂ����āA�Ȃ��Ȃ��D�̔����q�����~���Ă��Ȃ��̂́A�����q���u���E���^�������Ă��邩��ł��B�d�͂ɂ���Ĕ����q�����~���Ă��A�u���E���^���ɂ���āA�����q�͂܂��㕔�ւƊg�U���Ă����܂��B�R���C�h���q�����~���ĉ����ɒ��ς��Ă��܂����A�t���ɕ��V���Ă��邩�ǂ����́A�}���̔S�x�ɂ����܂����A��Ƃ��ė��a�Ɉˑ����܂��B���a���傫�����̂͒��~���āA���a�����������̂͊g�U���Ă����܂��B��܂��ɂ����ƁA���a��100 nm�ȉ��ɂȂ�ƁA���~�͂��Ȃ�x���Ȃ�܂��B
(iv) �d�C�j��
�\�ʂ������邢�͕��ɑѓd���Ă���R���C�h���q�́A�d�ɂ����ēd����������ƁA�\�ʓd�ׂƔ��Ε����̋ɂւƈړ����܂��B������u�d�C�j��(electrophoresis)�v�Ƃ����܂��B���̌��ۂ���A�R���C�h���q�̕\�ʂ��A�����ǂ���ɑѓd���Ă���̂�������ł���̂ł��B�Ⴆ�A���_���S(III)�R���C�h�n�t��d�C�j��������ƁA���_���S(III)�̃R���C�h���q�́A�������ƉA�ɂ̕��ֈړ����܂��B���̂��Ƃ��A���_���S(III)�̃R���C�h���q�́A���ɑѓd���Ă��邱�Ƃ��������ł��B��ʂɐ��ɑѓd���Ă���R���C�h���q���܂ރR���C�h���u���R���C�h(positive colloid)�v�A���ɑѓd���Ă���R���C�h���q���܂ރR���C�h���u���R���C�h(negative colloid)�v�Ƃ����܂��B

�}.20 ���_���S(III)�R���C�h�n�t�̓d�C�j��
���q�̈ړ��́A���q�̑傫����`��A�\�ʓd�ׁA�������d���ApH�A���x�Ȃǂɂ���ĉe������A�قȂ�R���C�h���q���A�ړ����x�̍����g���ĕ������邱�Ƃ��ł��܂��B����́A�^���p�N���̕����Ȃǂɂ悭�p�������@�ł��B�Ȃ��A�a���R���C�h�̓d�C�j���̈ړ����x�͔�r�I�傫���ł����A�e���R���C�h�͐��a���̂��߂ɁA�ړ����x�͏������ł��B�܂��A�ŋ߂ł́A�ѓd�ɓd�C��ʂ��ēd�C�j�����s�����Ƃɂ��A��C���̃z�R�����������Ă����G�A�R�����o�ꂵ�Ă��܂��B
�E�Q�l����
1) �ΐ쐳���u�V���n�̉��w(��)�v�x�䕶��(2005�N���s)
2) �m���g�f����w�̐V������O�ȓ�(2013�N���s)
3) �哌�F�i�u�v���O�}�e�B�b�N���w�v�͍��o��(2017�N���s)
4) �k�����Y�u�R���C�h�̘b�v�|����(1984�N���s)
5) �k�����Y�u�E�ʁE�R���C�h���w�̊�b�v�u�k��(1994�N���s)
6) �|���h�l�u�l���Ō�鉻�w����v��g�V��(2010�N���s)