・遷移元素(ニッケル・銅・銀・金)
【目次】
(1) ニッケル
(i) ニッケルNi
「ニッケル(nickel)」は、強磁性を持つ銀白色の金属固体です。元素名は、ニッケルNiが分離された「砒ニッケル鉱(Kupfernickel)」に由来します。この名称は、ドイツ語で銅Cuを意味する「Kupfer」と小悪魔を意味する「Nickel」を結び付けたものです。ニッケル鉱石は、銅鉱石によく似ているにも関わらず、そこから銅Cuが得られないのは小悪魔のいたずらによるものだと考えられ、その鉱石名が付きました。

図.1 「砒ニッケル鉱」は、発見当初は銅の鉱石と考えられていたが、銅を抽出できなかったため、「悪魔の銅」と呼ばれた
遷移元素のうち、鉄Fe・コバルトCo・ニッケルNiの3つの元素を、総称して「鉄族元素」と呼ぶことがあります。これらは化学的性質が特に似通っているため、このように呼ばれています。鉄族元素は、常温常圧で強磁性を示すのが特徴です。ニッケルNiは、鉄Feよりもイオン化傾向が小さいので錆びにくく、鉄Feのめっきに用いられる他、形状記憶合金や硬貨の原料などにも使用されます。日本で発行されている50円硬貨や100円硬貨は、銅CuとニッケルNiの合金である「白銅」です。米国も5セント硬貨も白銅ですが、通称「ニッケル」と呼ばれています。
また、白銅だけでなく、純粋なニッケルNiも、硬貨の材料として用いられたことがあります。19世紀後半のヨーロッパで、ニッケルNiを硬貨の材料として用いていた理由は、ニッケルNiが薬莢の材料である白銅の原料として重要であるため、国家が平時では硬貨として流通させ、有事に際しては他の素材の硬貨や紙幣で代替して、ニッケルNiを回収するためです。日本でも、第二次世界大戦の直前の1933年から1937年にかけて、5銭と10銭の純ニッケル硬貨が発行されており、その名目で、軍需物資であるニッケルNiを輸入していました。ただし、戦後も純ニッケル硬貨は発行されていて、1955年から1966年まで発行されていた50円硬貨は、純ニッケル硬貨でした。

図.2 米国の5セント硬貨には、約25%のニッケルNiが含まれている
また、ニッケルNiは、触媒としての利用価値も高く、特に水素H2との親和性が高いです。有機化合物の炭素-炭素不飽和結合に対する水素付加の触媒として用いられます。ニッケルNiは、表面に水素ガスを吸着し、水素分子H2を金属表面に固定します。すると、水素分子H2から水素原子Hへの解離が起こり、解離吸着した水素原子Hは、非常に反応しやすい状態となるのです。そして、この水素原子Hが、炭素-炭素不飽和結合に付加することにより、対応する炭素-炭素飽和結合が生成します(脂肪族炭化水素(アルケン)を参照)。
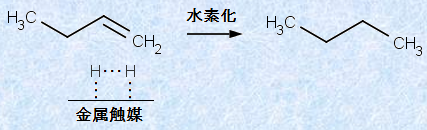
図.3 不飽和炭素結合の水素化
(ii) ニッケルNiの化合物
ニッケルNiには、多くの酸化状態が存在し、酸化数で-1から+4までの状態を取ります。最も安定な酸化数の状態のイオンは、ニッケル(II)イオンNi2+ です。ニッケルNiは、希塩酸HClや希硫酸H2SO4などの酸と反応して、水素H2を発生しながら溶けます。しかし、その反応は、鉄Feと比較すると極めて遅いです。水中では、ニッケル(II)イオンNi2+ は、緑色のアクア錯イオンとなっています。また、濃硝酸HNO3のような酸化力の強い酸に対しては、不動態を形成して、反応しにくくなります。
Ni + 2H+ → Ni2+(緑) + H2
この水溶液を塩基性にすると、緑色の水酸化ニッケル(II) Ni(OH)2が沈殿します。ただし、この沈殿にアンモニア水を過剰量加えると、ヘキサンアンミンニッケル(II)イオン[Ni(NH3)6]2+ となって、再溶解します。また、ニッケル(II)イオンNi2+ を含む水溶液に、中性〜塩基性条件で硫化水素H2Sを吹き込むと、黒色の硫化ニッケル(II) NiSが沈殿します。
Ni2+ + 2OH− → Ni(OH)2↓(緑)
Ni(OH)2 + 6NH3 → [Ni(NH3)6]2+(紫) + 2OH−
Ni2+ + H2S → NiS↓(黒) + 2H+
(2) 銅
(i) 銅Cu
「銅(copper)」は、特有の赤色光沢を持つ金属固体です。古代の銅鉱山の中で、特に有名なものが地中海の島「キプロス島(Cyprus)」にあったことから、元素名の語源はここにあると考えられています。周期表では、銀Agや金Auと同じく、第11族に属する遷移元素です。第11族元素は、第1族元素と同様に、最外殻に1個の電子を有します。しかし、内殻のd軌道と最外殻のs軌道とのエネルギー差は小さいので、内殻のd軌道電子も一部が励起して、金属結合に参加します。その結果、第11族元素の金属結合は、第1族元素よりはるかに強くなります。この高い金属結合性は、電気伝導性や延展性といった金属結合に起因する性質に強く影響します。
第11族の銅Cu・銀Ag・金Auは、すべて電気伝導率や熱伝導率が高く、延性や展性に富みます。金Auは、最も延性と展性に富む金属です。また、室温で最も電気伝導率の高い金属は銀Agであり、最も熱伝導率の高い金属もやはり銀Agです。銅Cuと金Auも、銀Agに次いで高い電気伝導率と熱伝導率を持ちます。これらの金属の電気抵抗の低さは、内殻のd軌道が10個の電子で満たされていることに関係します。すなわち、d軌道が空いていないことによって、結晶格子の中で動き回る伝導電子(4s軌道の電子)がd軌道に入れなくなり、それだけ散乱の確率が低くなることにより、電気抵抗が小さくなるのです。熱伝導性が良いのも、伝導電子が熱をよく運ぶからです。また、これらの金属は金属結合が強いので、単体からイオンになる反応は起こりにくくなり、イオン化傾向はいずれも水素H2よりも小さくなります。
表.1 金属の電気伝導率と熱伝導率(Agを100としたときの値)
|
金属元素 |
電気伝導率 |
熱伝導率 |
|
銀Ag |
100 |
100 |
|
銅Cu |
95 |
94 |
|
金Au |
72 |
75 |
|
アルミニウムAl |
59 |
55 |
銅Cuは、紀元前8,000年頃に中東で発見され、大昔から利用されていた人類最古の金属です。その頃に作られた銅製品のうち、現存する最古のものは、トルコのアナトリア地方で出土した銅製のビーズです。銅Cuは、金属製品や貨幣の材料として、多くの文化で使用されてきた歴史があります。現在の日本で用いられている硬貨は、5円玉は60〜70%、10円玉は95%、50円玉と100円玉は75%、500円玉は72%の銅Cuを含みます。現代でも、様々な場で使用されており、鉄Feに次いで重要な金属材料といえます。銅Cuは、手で持って使う工具や小型電動工具で加工できるぐらいに軟らかい一方、他の金属元素と混ぜて合金にすると、様々な用途に適した硬さになるという特徴を持ちます。
表.2 様々な銅合金と主な用途
|
名称 |
成分 |
特徴 |
用途 |
|
青銅(ブロンズ) |
Cu+Sn |
腐食しにくく、鋳造性に優れる |
美術品、10円玉 |
|
真鍮(ブラス) |
Cu+Zn |
黄色の金属光沢、加工性に優れる |
楽器、5円玉 |
|
白銅(キュプロニッケル) |
Cu+Ni |
白色の金属光沢、加工性に優れる |
50円玉、100円玉、500円玉 |
|
洋銀(ニッケルシルバー) |
Cu+Zn+Ni |
銀色の金属光沢、加工性に優れる |
食器、時計 |
|
ジュラルミン |
Al+Cu+Mg |
軽量で高い強度を持つ |
航空機の機体 |
特に銅CuとスズSnを混ぜた「青銅(ブロンズ)」は、重要な銅合金です。紀元前3,800年頃には、すでに人類は青銅を利用していました。銅Cuは、1,085℃以上の温度でなければ融けません。また、純銅Cuのままでは、柔らかくて道具になりません。ところが、ここにスズSnを混ぜると、融点が下がって700〜900℃で融け、しかも硬くなって道具の材料に使いやすくなります。世界の多くの地域で、鉄器文明より先に青銅器文明が発達したのは、青銅の融点が鉄Feの融点1,535℃よりも低く、成形がしやすかったためと考えられています。青銅は銅Cuよりも硬く、道具の材料としては格段に優れており、青銅を得たことで、人類の文明は飛躍的に発展しました。

図.4 青銅は、紀元前3,800年頃から使われていた合金である
亜鉛Znと混ぜた「真鍮(黄銅)」も重要な銅合金です。真鍮は、トランペットやサックスなど、金管楽器の材料になります。しかし、銅Cuと亜鉛Znの混合割合は色々あり、楽器として用いた場合には、それぞれに固有の音があるといいます。例えば、イエローブラスは大体Cu:Zn=70:30ぐらいであり、ゴールドブラスはCu:Zn=85:15、レッドブラスはCu:Zn=90:10ぐらいです。一般的には、亜鉛Znの割合が多いほど「硬く明るい音」になり、銅Cuの割合が多いほど「柔らかく温かみのある音」になるといいます。どの音色が良いかは演奏者の好みなので、一概に良し悪しはいえません。しかし、一般的に銅Cuの割合が多くなるほど、価格は高くなる傾向があります。また、管楽器ではありませんが、シンバルにも真鍮製のものがあります。真鍮の針金を渦巻き型に巻いてあの形にし、溶接してあの形にするのです。そうしないと、あの「シャリーン」という美しい音は出ないのだそうです。

図.5 イエローブラスでできたトロンボーン
銅Cuには、動脈硬化や心筋梗塞を予防する効果があることも確認されています。島根大学医学部とケンブリッジ大学が、長寿で知られる島根県の「隠岐島」の住民の白血球中の銅含有量を調べたところ、一般のケンブリッジ市民の2倍、動脈硬化症患者の6倍もあることが判明したのです。動脈硬化を起こす因子とされる血中コレステロール値は、隠岐島住民もケンブリッジ市民も同等であったのにも関わらず、隠岐島では心筋梗塞の発生が非常に少なく、逆にケンブリッジ市では死因のトップでした。海に囲まれた隠岐島は、銅Cuを多く含む新鮮な魚介類や海藻類に恵まれています。両大学は、「海の幸に恵まれた隠岐島の人々の食事を科学的に分析すれば、理想的な長寿食を作ることができる」とコメントしています。また、七面鳥の心筋梗塞による突然死が、銅化合物を与えることで予防できることも明らかにされていて、銅Cuには血管を正常な構造に保つ酵素の働きを助ける効果があるという仮説が立てられています。

図.6 海の幸に恵まれた隠岐島では、心筋梗塞の発生が非常に少ないことが知られている
(ii) 銅Cuの製法
銅Cuは、天然では黄銅鉱CuFeS2などの硫化物の形で産出することが多いです。しかし、銅鉱石中の銅濃度は、平均して0.6%ほどしかなく、この黄銅鉱CuFeS2から銅Cuを取り出すためには、まず銅鉱石を粉砕して、銅成分と鉄成分を分離させなくてはなりません。そのために、銅鉱石に燃料としてのコークスの他、石灰石CaCO3やケイ砂SiO2を加えて、溶鉱炉内で酸化しながら融解させます。このようにすることで、鉄成分はケイ酸鉄(II) FeSiO3としてスラグ(浮遊物)となり、銅成分は硫化銅(I) Cu2Sとなって、互いに分離されます。なお、このときに、石灰石CaCO3とケイ砂SiO2からケイ酸カルシウムCaSiO3が生成し、これが融剤として凝固点降下を引き起こし、銅鉱石の融点を下げます。
4CuFeS2 + 9O2 → 2Cu2S + 2Fe2O3 + 6SO2
2Fe2O3 + C + 4SiO2 → 4FeSiO3 + CO2
SiO2 + CaCO3 → CaSiO3 + CO2
そして、得られた硫化銅(I) Cu2Sを転炉の中に入れて、酸素O2を吹き込み、空気酸化しながら加熱します。すると、硫化物は酸化物へと変換され、硫黄分は完全に酸化除去されます。次に、酸化銅(I) Cu2Oを高温で加熱することで分解反応が起こり、銅含有率が約98%の粗銅が生成します。
2Cu2S + 3O2 → 2Cu2O(赤褐) + 2SO2
2Cu2O → 4Cu + O2
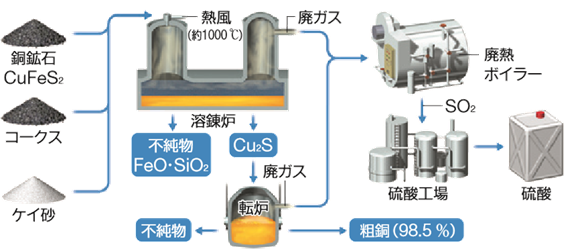
図.7 粗銅の製法
粗銅には、約2%の不純物が含まれているため、ここから銅Cuのみを取り出して、純銅にしなければなりません。粗銅を純銅にするためには、粗銅版と薄い純銅板を交互に並べ、粗銅板を電池の正極に繋ぎ、純銅板を電池の負極に繋ぎます。そして、50〜60℃の硫酸銅(II) CuSO4水溶液を電解液として、0.3〜0.4 V程度の低電圧で電気分解(電解精錬)します。このとき、分解電圧が高すぎると、陽極でイオン化傾向の小さい金属(AgやAuなど)まで溶け出してしまうので、電解精錬は比較的低い電圧で行われます。このように電気分解することで、粗銅板中の銅Cuから電子を奪って銅(II)イオンCu2+ として溶解させ、水溶液から純銅板へ銅(II)イオンCu2+ のみを析出させることができます。
陰極(純銅):Cu2+ + 2e− → Cu
陽極(粗銅):Cu → Cu2+ + 2e−
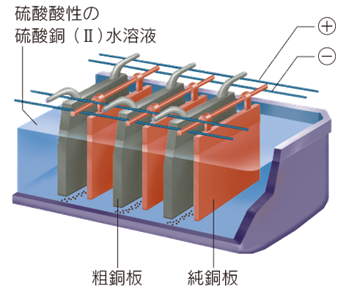
図.8 電解精錬の様子
銅Cuの電解精錬では、陽極にした粗銅板からは、銅Cuよりイオン化傾向の大きな亜鉛Znや鉄Fe、鉛Pbがまず酸化されて、溶け出していきます。電圧を低く保っておけば、銅Cuよりイオン化傾向の小さな銀Agや金Auがイオン化されることはありません。銀Agや金Auは、「陽極泥(anode mud)」として単体のまま陽極の下に沈殿させることができます。1 tの粗銅からは、銀Agが約1 kg、金Auが約30 g回収できるといいます。なお、このときに鉛Pbは鉛(II)イオンPb2+ となりますが、硫酸銅(II) CuSO4水溶液を使っているため、硫酸イオンSO42− と反応して硫酸鉛(II) PbSO4となり、陽極泥と一緒に沈殿します。一方で、水溶液中に銀(I)イオンAg+ は存在していないので、陰極で銀Agが析出することはありません。したがって、水溶液中で最もイオン化傾向の小さい銅(II)イオンCu2+ が、優先的に還元されていくことになります。
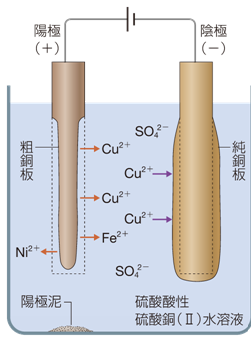
図.9 電解精錬により、純銅を生成する
(iii) 銅Cuの化合物
銅Cuは、酸化数で+1および+2の酸化状態が最も安定であり、銅(I)イオンCu+ および銅(II)イオンCu2+ を含む多くの化合物が知られています。銀(I)イオンAg+ より弱いものの、銅(II)イオンCu2+ にも抗菌および殺菌作用があります。一般社団法人日本銅センターと北里大学の研究チームは、ブドウ球菌や一般細菌などを用いて、銅板および真鍮板の存在があると、それぞれの菌がほとんど絶滅することを確認しています。また、レジオネラ菌や大腸菌O-157に対しても、同様の結果が得られているといいます。その他、雑菌によって生じるぬめりや臭いを防ぐ効果もあるので、靴下の防臭目的で、布地の中に銅線を織り込むことなどが行われています。

図.10 大腸菌に対する銅板の抗菌効果実験
銅Cuは、水H2Oとは反応しないものの、空気中の酸素O2とは徐々に反応して、表面に黒色の酸化銅(II) CuOの被膜を形成します。生じたサビによって、全体が酸化されてしまう鉄Feとは対照的に、銅Cuの表面に形成される酸化被膜は、さらなる酸化の進行を防止します。ただし、この酸化被膜は水には難溶ですが、塩基性酸化物なので、酸と反応すると溶けてしまいます。
2Cu + O2 → 2CuO(黒)
CuO + 2H+ → Cu2+(青) + H2O
また、酸化銅(I) Cu2Oは赤褐色の固体であり、フェーリング液をアルデヒドなどで還元すると生成します(カルボニル化合物(アルデヒドとケトン)を参照)。フェーリング反応における酸化剤は、銅(II)イオンCu2+ です。また、銅Cuを高温で加熱すると、加熱温度が1000℃未満の場合には酸化銅(II) CuOが生成しますが、加熱温度が1000℃以上の場合には酸化銅(I) Cu2Oが生成します。
RCHO + 2Cu2+ + 5OH− → RCOO− + Cu2O↓(赤褐) + 3H2O
4CuO → 2Cu2O(赤褐) + O2
酸化銅(I) Cu2Oは、船舶の塗装にも使われています。船底が一面真っ赤に塗られているのは、塗料にこの成分が含まれているからです。酸化銅(I) Cu2Oは、フジツボなどの水棲生物の忌避物質であり、これを塗ることで、船舶にフジツボなどの付着を防ぐことができるのです。

図.11 船舶の塗装に酸化銅(I) Cu2Oを使うことで、水棲生物の付着を防ぐことができる
銅Cuを湿った空気中に長時間放置したり、風雨にさらしたりすると、空気中の二酸化炭素CO2の作用により、緑色の「緑青(verdigris)」が生成します。緑青には、水酸化炭酸銅(II) CuCO3・Cu(OH)2などが成分として含まれ、自由の女神像や大阪城天守閣の屋根などのような、古い銅の建築物においてしばしば見られます。緑青は、長年毒性が高いと思われていました。しかし、最近になって、実は毒性の低いことが明らかになりました。銅Cuの精錬技術の低い頃には、ヒ素Asなどの有毒な物質が混ざり、その有毒性が緑青のものと間違えられたようです。銅屋根に生じた緑青は、水にも不溶であり、内部を保護する働きがあります。緑青の成分である水酸化炭酸銅(II) CuCO3・Cu(OH)2は、天然では「孔雀石(マラカイト)」として産出します。

図.12 大阪城天守閣の屋根は、緑青により緑色になっている
銅Cuは、イオン化傾向が水素H2よりも小さいため、塩酸HClや希硫酸H2SO4といった酸とは反応しません。しかし、硝酸HNO3や熱濃硫酸H2SO4のような酸化力の強い酸とは反応します。このときに発生する気体は水素H2ではなく、濃硝酸HNO3なら二酸化窒素NO2、希硝酸HNO3なら一酸化窒素NO、熱濃硫酸H2SO4なら二酸化硫黄SO2が発生します。
Cu + 2H2SO4(heat.conc) → CuSO4 + SO2 + 2H2O
3Cu + 8HNO3(dil) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3(conc) → Cu(NO3)2 + 2NO2 + 2H2O

図.13 銅Cuと各種酸の反応
硫酸銅(II)五水和物CuSO4・5H2Oは青色結晶で、加熱すると段階的に水和水を失って、無水物の白色粉末になります。5つの水H2Oのうち4つは、銅(II)イオンCu2+ に対して正方形の頂点方向から配位結合している「配位水(coordinated water)」です。硫酸銅(II)五水和物CuSO4・5H2Oが青色なのは、青色を呈するテトラアクア銅(II)イオン[Cu(H2O)4]2+ が構造中に存在するためです。この配位水は、加熱により比較的失われやすいです。また、この平面の上下方向には硫酸イオンSO42− があって、銅(II)イオンCu2+ に対して比較的ゆるく配位結合しています。残りの1つの水H2Oは、配位水と硫酸イオンSO42− の間にある「陰イオン水(anion water)」といわれるもので、硫酸イオンSO42− と水素結合をしているので、比較的失われにくいです。
CuSO4・5H2O(青) → CuSO4・3H2O → CuSO4・H2O → CuSO4(白)
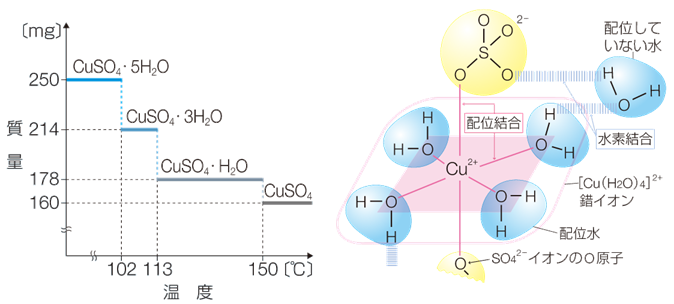
図.14 硫酸銅(II)五水和物CuSO4・5H2Oの質量変化と構造
硫酸銅(II) CuSO4の水溶液は青色であり、銅めっきや顔料、防腐剤、フェーリング液の原料などに用いられます。特に、無水物は強力に水H2Oを吸着するので、アルコール類を厳密に乾燥させるときの脱水剤としても用いられます。また、水溶液の溶解度が温度によって大きく変化するので、飽和水溶液の冷却による再結晶が容易であり、また五水和物の結晶が美しい青色を呈することから、結晶の成長実験が理科教育の実験教材として、しばしば取り上げられます。

図.15 再結晶により成長した硫酸銅(II)五水和物CuSO4・5H2Oの結晶
水1 Lに対して、硫酸銅(II) CuSO4を4.5 g、消石灰Ca(OH)2を4.5 gの割合でよく混合した溶液は、「ボルドー液(bouillie bordelaise)」と呼ばれています。ボルドー液は、銅(II)イオンCu2+ による殺菌力で、果樹や野菜などの幅広い作物の消毒に用いられ、有機農法での利用が可能になっています。消石灰Ca(OH)2は、葉への付着力を高めるために加えられています。ボルドー液は、100年以上の歴史を持つ伝統的な薬剤ですが、広範囲の病害に対する優れた予防効果と残効性を持ち、しかも安価であることなどから、現代でも農業において欠かすことのできない農薬です。

図.16 ボルドー液を散布したブドウの葉
銅(II)イオンCu2+ を含む水溶液に、硫化水素H2Sを吹き込むと、黒色の硫化銅(II) CuSが沈殿します。この沈殿は、水には溶けにくいですが、硝酸HNO3には溶けます。
Cu2+ + H2S → CuS↓(黒) + 2H+
CuS → Cu2+(青) + S + 2e−
青色の硫酸銅(II) CuSO4水溶液に、塩基を少量加えると、水酸化銅(II) Cu(OH)2の青白色沈殿が生じます。この沈殿は、比較的熱に不安定であり、加熱すると容易に脱水して分解し、黒色の酸化銅(II) CuOに変化します。
Cu2+ + 2OH− → Cu(OH)2↓(青白)
Cu(OH)2 → CuO(黒) + H2O
また、水酸化銅(II) Cu(OH)2は、アンモニア水を過剰量加えると、深青色溶液となります。これは、水酸化銅(II) Cu(OH)2が、アンモニア分子を配位子とするテトラアンミン銅(II)イオン[Cu(NH3)4]2+ となって、水溶性になったからです。
Cu(OH)2 + 4NH3 → [Cu(H2O)4]2+(深青) + 2OH−
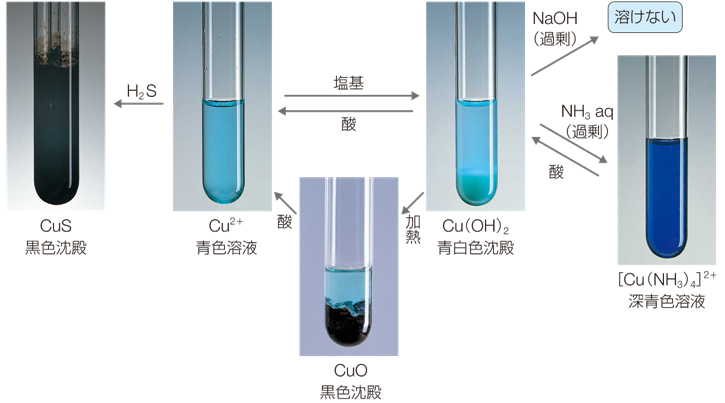
図.17 銅(II)イオンCu2+ の反応
(3) 銀
(i) 銀Ag
「銀(silver)」は古くから知られた金属で、旧約聖書にも銀Agの取引の記述があります。元素記号「Ag」の語源は、ギリシア語の「argyros(輝く、明るい)」に由来します。ただし、古代では金Auよりも高価なものとされていました。銀Agは、自然の中で金属単体の状態で存在することはまれで、金Auよりも発見しにくいからです。多くは化合物(輝銀鉱Ag2Sや角銀鉱AgClなど)として産出します。紀元前3600年頃の古代エジプトの法律によれば、銀Agは金Auの2.5倍の価値がありました。金Auに「銀めっき」をした宝飾品が発掘されることもありました。なお、当時の銀Agは、その中にかなりの金Auを含んでいたらしいです。その後、中世ヨーロッパの時代に至るまで、銀Agは金Auよりずっと高価なものでした。銀Agの価格が下落したのは、銀鉱石からの生産が増加して、新大陸から大量の銀Agが流入したことによります。

図.18 輝銀鉱Ag2S(左)と角銀鉱AgCl(右)
16世紀後半の戦国時代から江戸時代へ移り変わる頃、日本は世界屈指の銀産出国でした。国内で貨幣として用いられるだけでなく、明やマカオ、ポルトガル、オランダなどとの間で、国産の銀Agを媒介とした貿易が行われていました。その銀Agの中でも、世界遺産にも登録された石見銀山から産出する銀Agは、石見銀山の別名「佐摩銀山」にちなんで「ソーマ銀」と呼ばれ、有名な銘柄として取引されていたといいます。現在は閉山していますが、当時は世界に流通する銀Agの1/3は日本のもので、そのほとんどが石見銀山から採掘されたものでした。16世紀末にポルトガルの宣教師ルイス・ティセラによって作成された日本地図には、ラテン語で「Hivami Argenti fodinae(石見銀鉱山)」と記されています。この他にも、ヨーロッパで作成された複数の地図に「石見銀山」の地名が記されており、当時の主要土地として、海外で認知されていたことが分かります。

図.19 島根県大田市にある石見銀山は、戦国時代から江戸時代にかけて、最盛期を迎えた日本最大の銀山である
銀Agは、銀白色の金属固体です。室温における熱や電気の伝導率が、すべての金属の中で最も大きいです。延性や展性も金Auに次いで大きく、1 gあれば1,800 m以上の線に伸ばすことができ、0.0015 mmの極薄の箔も作れます。可視光の反射率も、金属中で最大です。白く輝くことから、「銀」を意味するラテン語名「Argentum」は、「白」を意味するサンスクリット語の単語「arjuna」に由来しています。研磨された銀の表面は、可視光スペクトル全域で一貫してほぼ100%の反射率を有するので、古くから鏡などの材料として用いられてきました。銀Agは、金Auと並ぶ貴金属の雄であり、多くの宝飾品に使われる他、導電性を活かして、エレクトロニクス産業でも重用されています。
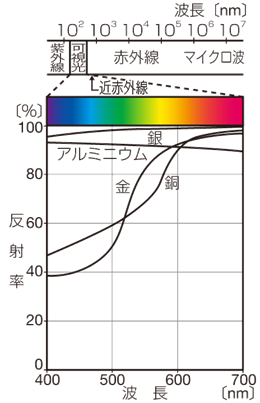
図.20 主な金属の可視光の反射率
銀Agは、貴金属の中では、比較的化学変化しやすいです。空気中に硫黄化合物が含まれていると、金属表面に黒色の硫化銀(I) Ag2Sが生成して、黒ずんできます。俗にいう「銀のサビ」とは、この物質のことです。特に銀Agの指輪が黒ずみやすいのは、皮膚には硫黄Sを含むシステインを構成成分とするタンパク質があるからです。また、硫化水素H2Sを成分として含む温泉に入ると、銀Agでできた宝飾品は硫化銀(I) Ag2Sに化学変化するため、温泉に入る前には外しておく方がいいでしょう。宝飾品を輪ゴムなどで束ねるのも、止めておいた方が無難です。ゴムに含まれる硫黄Sによって、銀Agが変質することがあります。
4Ag + 2H2S + O2 → 2Ag2S(黒) + 2H2O
しかし、くすんだ宝飾品を元通りにする方法があります。まず、くすんだ宝飾品を中性洗剤液に浸し、歯ブラシなどで軽くこすって、手垢を完全に取り除きます。そして、アルミニウム箔を敷いた容器に、重曹NaHCO3と沸騰水を入れて、くすんだ宝飾品を浸けておきます。熱水中で、重曹NaHCO3は二酸化炭素CO2を放出して、炭酸ナトリウムNa2CO3になります。ここで、炭酸ナトリウムNa2CO3水溶液中の硫化銀(I) Ag2SとアルミニウムAlで、一種の電池が作られるのです。電池の酸化還元反応により、負極のアルミニウムAlが酸化され、正極の硫化銀(I) Ag2Sが還元される結果、くすんだ宝飾品は元通りになります。
2Al + 3Ag2S → Al2S3 + 6Ag

図.21 重曹とアルミホイルがあれば、くすんだ指輪を綺麗にできる
銀Agは、古くから支配階級や富裕階級で、宝飾品だけでなく、食器用の材料としても用いられてきました。その理由の1つは、毒物である雄黄As2S3を食品に混入された場合に、硫黄Sとの化学変化による変色で、いち早く異変を察知できる性質があるからです。雄黄As2S3は無味無臭であるがために、歴史上の毒殺はほとんどこれによって行われました。雄黄As2S3は、輝きのある黄色を呈するため、中世頃までは黄色顔料として広く利用されていた物質です。しかし、現在では強い毒性のために、ほとんど利用されることはありません。日本でも、「キノコに銀Agの簪(かんざし)を刺して黒くなったら、それは毒キノコである」という言い伝えがあります。

図.22 雄黄As2S3は、現在は毒性のためにほとんど利用されていないが、「雄黄色」という言葉として名を残している
また、銀(I)イオンAg+ は、微生物などに対して強い毒性を示し、微生物の繁殖を防ぎます。人間にあまり害のない金属イオンで、微生物に対して最大の効果を持つものが、銀(I)イオンAg+ なのです。現在では、体臭の脱臭効果を狙ったデオドラントスプレーなど、広く殺菌剤として利用されています。体臭の多くは、体から分泌される有機物を、体表の細菌が分解することによって起こります。そのため、殺菌が体臭除去につながるということです。
ちなみに、加齢臭の原因は、2-ノネナールなどの有機物といわれます。2-ノネナールは、パクチーの香り成分でもあり、カメムシのような臭いがする物質です。低濃度であれば、ビールや蕎麦の芳香成分として好まれますが、高濃度では「おやじ臭」となります。2-ノネナールは、皮膚から分泌されるパルミトレイン酸などの不飽和脂肪酸が、細菌によって酸化的に分解されることによって生じます。パルミトレイン酸は、20〜30代の若い人ではほとんど検出されませんが、加齢に伴い40代くらいから皮脂中に増加することが分かっています。なお、2-ノネナールは、ゴキブリが嫌う化合物でもあるそうです。
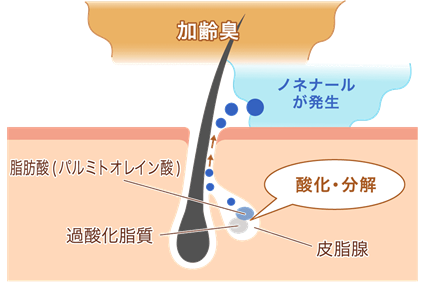
図.23 2-ノネナールは、低濃度であればビールや蕎麦の芳香成分であるが、高濃度では「おやじ臭」となる
この他にも、銀Agを水H2Oに浸しておくと、微量の銀(I)イオンAg+ を生じることから、単体が殺菌剤の用途で使われることもありました。西部開拓時代、開拓者たちは鮮度を保つために、牛乳の容器に銀貨を入れていたといわれています。その他、銀製の食器に料理を盛り付けると、腐敗しにくくなることも知られていました。生活の知恵として、銀(I)イオンAg+ の殺菌作用を利用していたのでしょう。なお、銀(I)イオンAg+ の殺菌効果は、酸化力の強さに由来するものではなく、多くの細菌が持つ硫黄Sとの、強力な親和性によるものであると考えられています。
(ii) 銀Agの化合物
単体の銀Agは、塩素Cl2などのハロゲンとは直接反応して、ハロゲン化銀を生成します。ハロゲン化銀には「感光性(photosensitive)」があり、光照射により、還元された金属銀Agを生成します。感光性は、塩化銀AgClや臭化銀AgBrではよく観察できますが、ヨウ化銀AgIではわずかに変化するだけです。フッ化銀AgFは、潮解性があって水に溶けやすいですが、塩化銀AgClや臭化銀AgBr、ヨウ化銀AgIは、いずれも水に溶けにくいです。
2Ag + Cl2 → 2AgCl(白)
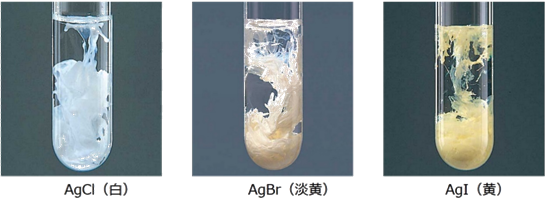
図.24 ハロゲン化銀の沈殿
また、臭化銀AgBrは、優れた感光性を利用して、写真のフィルムや印画紙に用いられたことがあります。最近では、すっかりデジタルカメラに取って代わられましたが、それ以前の写真は「銀塩写真」といい、臭化銀AgBrを用いたフィルムを使っていました。白黒フィルムの表面には、臭化銀AgBrをコロイド状に分散させた感光乳剤が塗られてあります。ここに光が当たると、光が当たった部分では、銀イオンAg+ の還元が起こって金属銀Agが遊離します。この銀Agは溶媒に溶けないので、適当な洗浄液(チオ硫酸ナトリウムNa2S2O3など)でフィルムに残った臭化銀AgBrを取り除くと、光の当たったところだけ銀Agの微粒子が析出して、黒くなって残るという訳です。今でも人気俳優の写真を「ブロマイド」と呼んだりするのは、英語の「臭化銀(silver bromide)」の名称の後半部分「臭化(bromide)」に由来します。
2AgBr → 2Ag + Br2
ヨウ化銀AgIは、結晶構造が氷に似ているため、人工降雨の材料に用いられることがあります。雨が降るためには、雲の温度が−15℃ぐらいにならなければなりません。これは、過冷却によって、0℃になっても水蒸気がなかなか氷滴にならないからです。そこで、大気中に強制的に氷滴を作るような物質を散布すれば、雨を降らせることができます。ヨウ化銀AgIは、水が結晶化する際の「種」となることができます。そのため、ヨウ化銀AgIの粒子を大気中に散布すると、それを核にして雲が発生し、雨を降らせることができます。ヨウ化銀AgIの場合は、地上に設置した発煙炉から煙状にして、雲に到達させる方法もあります。
雲ができて雨が降れば、雨雲は消えます。つまり、特定の場所や時間に雨を降らせたくなければ、雨雲がその場所に近付く前に雨を降らせて、雲を消してしまえばいいのです。この方法で、人工的な「晴れ」を強制的に作り出したのが、2008年に開催された北京オリンピックの開会式です。事前の天気予報では、当日夜の北京市内の天気予報は「雷雨」でした。そこで中国当局は、開会式の数時間前に、北京市内や周辺都市から合計1,000発以上のヨウ化銀AgIを含んだ小型ロケットを雨雲に打ち込み、ヨウ化銀AgIを散布して、強制的に雨を降らせる「人工消雨作戦」を実施しました。その結果、開会式の時間帯の北京市内は、見事に晴れたのです。ただし、ヨウ化銀AgIには毒性があるため、散布することにより環境に与える影響を懸念する声もあります。

図.25 北京オリンピック開会式当日、中国当局はヨウ化銀AgIを含んだ小型ロケットを雨雲に打ち込み、雨雲を消滅させた
ハロゲン化銀は、アンモニア水やチオ硫酸ナトリウムNa2S2O3水溶液、シアン化カリウムKCN水溶液には溶解して、無色の溶液となります。これは、ハロゲン化銀が錯イオンの塩となって、水溶性になったためです。ただし、ハロゲン化銀の中でも、ヨウ化銀AgIは共有結合性が特に強いため、溶解度が極めて小さいです。水1 Lに対して、10−8 mol程度しか溶解しません(Ksp=1×10−16)。そこへアンモニア水を加えても、0.1 mol/Lのアンモニア水1 Lに対し、10−5 mol程度までしか溶解度が上がらないので、事実上、ヨウ化銀AgIはアンモニア水には溶解しないと考えてよいでしょう。
表.3 ハロゲン化銀の溶解反応
|
|
+ NH3aq アンモニア |
+ Na2S2O3aq チオ硫酸ナトリウム |
+ KCNaq シアン化カリウム |
|
AgCl↓(白) |
[Ag(NH3)2]+ (無色) |
[Ag(S2O3)2]3− (無色) |
[Ag(CN)2]− (無色) |
|
AgBr↓(淡黄) |
[Ag(NH3)2]+ (無色) |
[Ag(S2O3)2]3− (無色) |
[Ag(CN)2]− (無色) |
|
AgI↓(黄) |
AgI↓(黄) |
[Ag(S2O3)2]3− (無色) |
[Ag(CN)2]− (無色) |
また、単体の銀Agは、酸に対して化学的に安定ですが、酸化力の強い硝酸HNO3や熱濃硫酸H2SO4には溶解して、銀(I)イオンAg+ を生成します。ただし、銀Agは「王水(aqua regia)」には溶けにくいです。王水は、濃塩酸HClと濃硝酸HNO3を3:1で混合したものであり、非常に強い酸化力を示します。しかし、王水に含まれる塩素Cl2と反応してできる塩化銀AgClが、金属表面に不溶性の酸化被膜を形成して、反応の進行を妨げため、銀Agは王水に溶けないのです。
2Ag + 2H2SO4(heat.conc) → Ag2SO4 + SO2 + 2H2O
3Ag + 4HNO3(dil) → 3AgNO3 + NO + 2H2O
Ag + 2HNO3(conc) → AgNO3 + NO2 + H2O

図.26 銀Agと酸の反応
無色の硝酸銀AgNO3水溶液に、塩基を少量加えると、暗褐色の酸化銀(I) Ag2Oが沈殿します。なぜ生成物が水酸化銀(I) AgOHではないのかというと、水酸化銀(I) AgOHは、熱力学的に不安定な化合物だからです。水酸化銀(I) AgOHは、室温程度の熱で容易に分解して、直ちに酸化銀(I) Ag2Oと水H2Oになってしまいます。また、酸化銀(I) Ag2Oを空気中で加熱すると、熱分解して、単体の銀Agが生成します。
2Ag+ + 2OH− → Ag2O↓(暗褐) + H2O
2Ag2O → 2Ag + O2
酸化銀(I) Ag2Oの沈殿は、アンモニア水などを過剰量加えることにより、沈殿が溶解して、無色の溶液となります。これは、沈殿がジアンミン銀(I)イオン[Ag(NH3)2]+ を含む錯イオンの塩となり、水に溶けやすくなったからです。
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]+(無色) + 2OH−
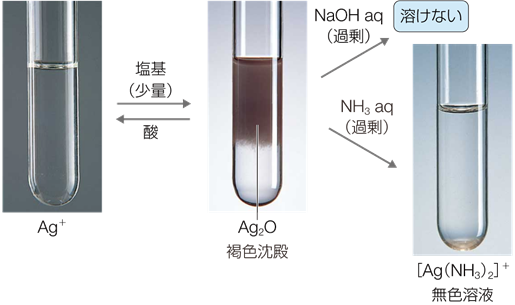
図.27 銀イオンAg+ の反応
(4) 金
(i) 金Au
「金(gold)」は、金色光沢のある黄色い金属固体です。英語名の「gold」は、インド・ヨーロッパ語の「ghel(輝く)」が語源です。元素記号の「Au」は、オーロラと同じ語源のラテン語「aurum(黄金、暁の女神)」に由来しています。人類の歴史上、最初に見つかった金属は、恐らく金Auなのではないでしょうか。天然では、岩の中の筋や川底の小さな塊として、広く分布しています。色が特別であること、錆びないこと、軟らかく重いことが、他のいかなるものとも異なる金属の性質として、実感されていたに違いありません。
金Auの最大の価値は、世界貨幣として、経済的に独特な地位を持っていることにあります。絶対に錆びることはないし、切断や接着などの加工は容易です。イギリスの貴金属調査会社トムソン・ライターGFMS社の統計によれば、これまでに採掘および精製加工された金Auの総量は、2019年時点で約20万tだといいます。これは、オリンピックで使用されるプールの容量(長さ50 m、幅22 m、深さ1.7 m)で換算すれば、およそ5杯分の量になります。そして、今後も最新技術を駆使しても、約5万tの金Auしか採掘できないといわれています。というのも、現在地球に埋蔵されている金Auの多くは、採掘が困難な場所にあるからです。希少性が高いからこそ、金Auは他の金属と比べて高価になります。
表.4 金属の値段(2017年7月の日本経済新聞商品市況等より)
|
金属名 |
1 kg当たりの値段 |
|
金Au |
4,530,000円 |
|
白金Pt |
3,410,000円 |
|
パラジウムPd |
3,150,000円 |
|
銀Ag |
62,000円 |
|
スズSn |
2,565円 |
|
ニッケルNi |
1,290円 |
|
銅Cu |
730円 |
|
亜鉛Zn |
336円 |
|
鉛Pb |
289円 |
|
アルミニウムAl |
260円 |
|
鉄Fe |
76円 |
金Auは貴金属の一種であり、銅Cuと共に人類が古くから利用していた金属です。化学的に非常に安定であるため、化合物を作らずに、そのままの形で自然界に存在しています。そのため、精練が必要な鉄FeやアルミニウムAlなどより、早くから人類が発見し、利用することができたのでしょう。旧約聖書などにも金Auに関する記述があり、イラク南部にある紀元前2600年頃の王墓からも、金Auを使った宝石細工が出土していることなどから、エジプトやメソポタミア地方では、早くから使われていたことが伺えます。また、中国においても、紀元前1300年頃には金Auの製法について、高い技術水準に達していたといわれています。
金Auは、延展性に非常に優れ、最も薄く延ばすことができる金属でもあります。平面上に延ばしたものを「金箔」といい、糸状に延ばしたものを「金糸」といいます。1 gの金Auは、約5,200 cm2まで広げることができ、糸状に延ばすと2,800 mの長さにもなるといわれています。金箔は、表面装飾に用いられることが多く、金閣寺に代表される建築物の外装や内装など、多くのものに対して利用されます。金箔の厚さは0.1 µmほどで、かざすと向こうが透けて見えるほどです。金Auは黄橙色を反射するので、透過光は青緑色になります。金糸は、豪華な衣装を作るために、綿や絹など一般的な繊維素材と併用されます。

図.28 金閣寺には、約20 kgの金箔が使用されている
金箔は、金Auを叩いて、薄く延ばして作ります。しかし、ただ叩けばよいというものではありません。極少量の金Auの薄板を和紙の間に挟み、これを100枚程度重ねて束にしたものを、「箔師」と呼ばれる伝統技能士が箔打機で叩くのです。すると、金Auは薄く一様に広がって、美しい輝きを持った金箔になります。金Auの薄板を挟むこの和紙は、「箔打紙」という30 cm角ほどのものですが、ただの和紙ではありません。特別に漉いた美濃紙を、わら灰や卵白、柿渋などを調合した水に半年ほど漬け込み、それを乾燥させたものを用います。この和紙は、一度作ってしまえば、何回でも繰り返して使うことができます。そして、弱っていよいよダメだということになると、最後の出番が待っています。10 cm角ほどに切られて祇園に行き、舞妓や芸妓の化粧を落ち着かせる「油取り紙」になるのです。金属を叩けば薄くなるのは道理ですから、金Auを挟む紙は、特別なものでなくともよいであろうということで、上質のコピー用紙に挟んで金Auを叩いた実験があります。しかし、ボロボロの穴だらけになって、金箔といえる代物ではなかったといいます。

図.29 箔打紙の束に金Auの薄板を挟み、箔打機で連打すると、金箔ができ上がる
金Auのイオン化傾向は、あらゆる金属の中で最も小さく、空気中では浸食されません。熱や湿気、酸素O2、その他ほとんどの化学的腐食に対して非常に強く、永遠に美しく輝き続けるものは、金Au以外にはありません。生体に対する反応性も低いので、身に着ける装飾品としても適しています。歯科の治療には、金Auを用いるのが最も安全といわれるのは、これが理由です。
金Auは電気伝導性も高く、変質しないので、最良の電気接点となります。それ故に、精密電子機器には金Auが必ず使われており、そうした機器から金Auを取り出すリサイクル事業も、ビジネスとして成立します。国立研究開発法人国立環境研究所の資源循環・廃棄物研究センターによると、1 tのパソコン基盤からは、約140 gの金Auが取り出せるということです。実際の金鉱山から採掘した場合、1 tの金鉱石からは約3〜5 g程度の金Auしか取ることができないので、「都市鉱山」は無視できない存在です。2008年に独立行政法人物質・材料研究機構が行った調査によると、日本でこのような都市鉱山として存在する金Auの総量は、なんと約6,800 tにもなるそうです。これは、全世界の金Auの現有埋蔵量の約16 %にも及ぶ量です。

図.30 都市鉱山という観点でみると、日本は世界有数の資源大国である
また、金Auは純粋な金属として用いられる他、別の金属を混ぜて合金とされることもあります。その際、金Auの含有量を表す指標として、「K(カラット)」が用いられます。これは、純金を24 Kとして、金Auの純度を表したものです。例えば、21.6 Kの金貨ならば純度は90%(21.6/24=0.90)、18 Kの装飾具ならば純度は75%(18/24=0.75)、14 Kの万年筆の金ペンならば純度は58.3%(14/24=0.583)で、残りは別の金属という訳です。純金は、硬度がそれほど高くないので、金Auの実用品は、18 Kのものが有名です。ちなみに、「カラット」はギリシア語の「イナゴ豆」に由来し、イナゴ豆の乾燥種子の重さが約0.2 gで均一なため、重さの単位になっていたことによります。

名古屋城は、天守閣の金シャチホコで有名です。名古屋城が最初にできたときの金シャチホコは、一対で慶長大判1,940枚分を鋳潰したもので、純度は20 K、金Auの質量は320 kgもあったといわれています(2017年の価格で約14億円)。しかし、その後、尾張藩の財政が逼迫すると、質の悪い金Auに取り換えられて行きました。最後は10 Kだったとも、8 Kだったともいいます。すなわち、名古屋城の金シャチホコは、尾張藩の「貯金箱」でもあったのです。金シャチホコは、第二次世界大戦の名古屋大空襲で焼け落ち、その際に融解した金Auは、進駐軍によって接収されました。1967年になって名古屋市に返還されましたが、そのときの質量は、わずか6.6 kgに過ぎませんでした。現在の金シャチホコは、18 Kの薄板を張ったもので、金Auの重量は、一対で88 kgといいます。

図.31 名古屋城の金シャチホコは、尾張藩の財政悪化のため、何度か質の悪い金Auに取り換えられた
金Auのもう1つの特色は、重いということでしょう。金Auの比重は19.3であり、銀Ag(比重10.5)の2倍もあります。ギリシア時代の科学者アルキメデスが、純金製であるはずの王冠に銀Agが混ぜられていることを証明するのに、密度を用いたという話があります。これは、金Auと銀Agでこのような比重の違いがあるからこそ、できた証明法といえます。2007年には、日本でこの密度を逆手に取った犯罪がありました。タングステンWの塊に金めっきしたものを、金塊として売ったというものです。これは、タングステンWの比重が、金Auと同じ19.3であることを悪用したものです。タングステンWの偽金塊を見抜くためには、蛍光X線検査や、超音波が内部を伝わる速さの検査などが必要になります。

図.32 タングステンWを純金で覆うと、通常の鑑定では見破りにくくなる
ちなみに、空気中の窒素N2からアンモニアNH3を合成するハーバー・ボッシュ法で知られるドイツの化学者フリッツ・ハーバーは、ドイツの国家財政を改善するため、海水から金Auを回収する計画を立てていました。当時、ドイツは第一次世界大戦で敗れ、多額の賠償金に苦しんでいました。ハーバーは、賠償金の支払いとその後の復興資金を得るためには、50,000 tの金Auが必要と見積もりました。そして、この金Auを取り出すために、1920年に極秘の研究室を作り、世界中の海水を採取して調査しました。しかし、調査の結果、海水に含まれる金Auの量は、当時推定されていた値よりはるかに少なく、採算が取れないことが明らかになりました。そのため、この計画は1926年には中止されています。なお、海水はモル濃度でほぼ10-11 mol/Lの金Auを含み、一辺が約80 mの立方体の海水に金Auが1 gほど含まれている計算になります。

図.33 ハーバーはドイツの国家財政を改善しようと、海水から金Auを取り出そうとした
(ii) 金Auの化学反応と化合物
金Auは、酸化力の強い熱濃硫酸H2SO4や硝酸HNO3に対しても安定であり、ほとんど反応しません。しかし、王水には反応して、溶解します。これは、王水中で塩化ニトロシルNOClと塩素Cl2が生成するからです。塩化ニトロシルNOClは、酸化力が非常に強く、ほとんどの金属を酸化することができます。
3HCl + HNO3 → NOCl + Cl2 + 2H2O
Au + NOCl + Cl2 + HCl → H[AuCl4] + NO

図.34 金Auと王水の反応
王水と金Au にまつわるエピソードとして、こんなものがあります。1930年代になると、ドイツにいるユダヤ人科学者に対するナチスによる弾圧が強まり、多くのユダヤ人科学者が移住したり、外国の研究所に避難したりしていました。ナチス・ドイツに批判的な立場を取っていた2人のユダヤ人科学者、マックス・フォン・ラウエとジェイムス・フランクもそうでした。ちなみに、ラウエはX線回折を発見した業績で1914年にノーベル物理学賞を、フランクはエネルギーの量子化を実験的に確認した業績で1925年にノーベル物理学賞を受賞しています。2人はドイツを離れる際、自分のメダルをデンマークのコペンハーゲンにある理論物理学研究所のニールス・ボーアに預けて、保管してもらっていました。ちなみに、ボーア自身も1922年に原子構造とその放射に関する研究で、ノーベル物理学賞を受賞しています。
そして1940年4月9日、ナチス・ドイツはデンマークに進軍し、デンマークを保護国下に置きました。ボーアのメダルは、ナチス・ドイツに没収され、戦争資金調達のための競売にかけられてしまいました。ボーアは、ナチス政権に反対していた2人のメダルをどこに隠そうかと悩みました。自分の実験室で見つかったら、すでに不審と思われていた2人の立場が、ますます危うくなります。メダルには、受賞者の名前が刻まれているし、金製なので国外への持ち出しは法律違反に問われます。
コペンハーゲンでボーアと仕事をしていたハンガリーの化学者であるゲオルク・ド・ヘヴェシーは、メダルをどこかに埋めたらどうかと提案しましたが、ボーアはそれではすぐに見つかりそうだと感じました。そこで、ナチスの兵士が街中に溢れる中、ヘヴェシーはメダルを王水に溶かすことにしました。――ヘヴェシーがあとで振り返ったところによると、この方法は少々苦労したようです。金Auの量が多く、あの強力な酸をもってしても、なかなか反応しようとしなかったからです。ナチスは理論物理学研究所を占拠し、ボーアの実験室を入念に調べましたが、棚にあった褐色の液体入り瓶の中身については不問に付し、瓶は戦争中もずっとそのままでした。終戦後、ボーアはスウェーデン王立科学アカデミー宛てに、メダルの金Auの返却とその経緯を説明する手紙を書きました。すると、ノーベル財団は、その溶液から取り出した金Auを使ってメダルを復元し、2人に改めてメダルを贈りました。ノーベル財団の粋な計らいです。

図.35 ゲオルク・ド・ヘヴェシーは、ノーベル物理学賞の金メダルを王水に溶かして隠すことにした
金Auでは、酸化数で+1と+3の状態が安定であり、特に酸化数+3が安定です。金(I)イオンAu+ には、水酸化物やハロゲン化物が存在します。金(I)イオンAu+ は、水溶液中で不均化反応を起こして、安定な金(III)イオンAu3+ と金Auに変化しやすいです。一方で、金(III)イオンAu3+ では、水酸化物や酸化物、ハロゲン化物などが知られています。金化合物は一般的に不安定であり、光の作用により分解して、単体の金Auを遊離します。
3Au+ → Au3+ + 2Au
また、金Auは人体に対して、良くも悪くも影響しないといわれていました。食用の金箔があるのは、反応性が低いために消化液とは全く反応せず、体内を素通りして、そのまま排泄されるからです。しかし、近年になって、「金チオリンゴ酸ナトリウム(商品名シオゾール)」や「オーラノフィン(商品名リドーラ)」のような、金化合物の医薬品が使われるようになりました。これらは、いずれも抗リウマチ薬であり、服用すると関節組織のうち、関節腔中で潤滑油の役割をしている滑液中に蓄積します。リウマチ性関節炎は、滑液が存在する関節腔内の炎症と、軟骨のコラーゲンなどの細胞間物質の崩壊が原因して、関節軟骨が障害されて、関節の機能が失われていく自己免疫疾患です。この症状に対して、金化合物の医薬品は、コラーゲンなどに結合してその分解を抑えたり、炎症を起こす物質に直接結合してそれらを不活性化したり、関節の骨膜のリソソームにある加水分解酵素の作用を抑制して炎症に関連する物質の生成を抑えたり、免疫機能に関係するリンパ球の活性化を抑制するなどして、その治療効果を現していると考えられています。
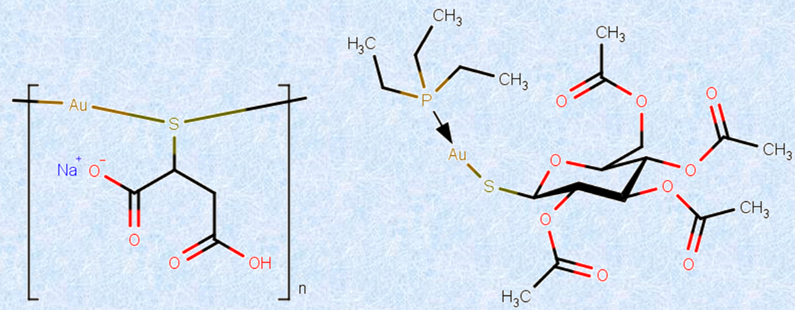
図.36 抗リウマチ薬として用いられる金チオリンゴ酸ナトリウム(左)とオーラノフィン(右)
最近では、オーストラリアのアデレード大学の研究チームが、金塊を生み出す細菌を発見したということで、話題になりました。この細菌は、コマモナス科デルフチア属に属する「デルフチア・アシドボランス」という真正細菌です。普通の土壌や水中にも生息する細菌なのですが、奇妙なことに、しばしば小さな金塊の表面でも発見されていました。金イオンは強い酸化力を持つため、ほとんどの生物に対して毒性を示します。このため、デルフチア・アシドボランスが、なぜ有毒な金イオンに対して、並外れた耐性を持っているのかは謎でした。しかし、その後、デルフチア・アシドボランスは、「デルフチバクチン」という化合物を分泌し、これが水に溶けた金イオンから生体を保護し、また金イオンを無毒な金Auの単体に変える能力を持つことが判明しました。そしてこの細菌は、自分で作った金の粒子の中に住むらしいのです。まさに「黄金の宮殿」です。金Auの生体鉱物化は、世界初の発見です。この細菌を使えば、金Auの採掘や電子機器のリサイクルなどを効率化できる可能性があるとして、現在研究が進んでいます。

図.37 デルフチア・アシドボランスは、生物に有毒な金イオンに対して耐性を持ち、また金イオンを微小な金塊に変える能力を持つ
・参考文献
1) 卜部吉庸「化学の新研究」三省堂(2013年発行)
2) 大東孝司「プラグマティック化学」河合出版(2017年発行)
3) 斉藤勝裕「最強の「毒物」はどれだ?」技術評論社(2014年発行)
4) 齋藤勝裕「へんな金属すごい金属」技術評論社(2009年発行)
5) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
6) 桜井弘「元素118の新知識 引いて重宝、読んでおもしろい」講談社(2017年発行)
7) 佐藤健太郎「化学で「透明人間」になれますか?」光文社新書(2014年発行)
8) 佐藤健太郎「世界史を変えた新素材」新潮社(2018年発行)
9) 左巻健男「面白くて眠れなくなる元素」PHP研究所 (2016年発行)
10) 清水隆『我々の生活に不可欠で魅力的で不思議な金属,「銅」とそれをつくる「銅製錬」のはなし』化学と教育66巻11号(2018年)
11) セオドア・グレイ「世界で一番美しい元素図巻」創元社(2011年発行)
12) 平尾一之/田中勝久/中平敦 共著「無機化学」東京化学同人(2013年発行)
13) -「元素をめぐる美と驚き アステカの黄金からゴッホの絵具まで〔上〕」早川書房(2017年発行)
14) -「元素をめぐる美と驚き アステカの黄金からゴッホの絵具まで〔下〕」早川書房(2017年発行)
15) 山口幸夫「理科がおもしろくなる12話」岩波書店(2001年発行)