・カルボニル化合物(アルデヒドとケトン)
【目次】
(1) アルデヒドとケトン
分子内にカルボニル基(carbonyl group, -CO-)を持つ化合物を、「カルボニル化合物(carbonyl compound)」といいます。カルボニル基(-CO-)は、有機化学における最も重要な官能基であり、カルボニル化合物は工業的にも、また生物学的過程においても、重要な役割を果たしているものが多いです。
カルボニル化合物のうち、カルボニル基(-CO-)に結合する置換基2個が、共に有機基であるものを「ケトン(ketone)」といいます。また、置換基の一方、または両方が水素原子で、アルデヒド基(aldehyde group, -CHO)を持つものを「アルデヒド(aldehyde)」といいます。アルデヒド基(-CHO)は、示性式を結合順に書くと「-COH」となりますが、ヒドロキシ基(-OH)との混同を避けるため、わざと「-CHO」と書くのが習慣となっています。
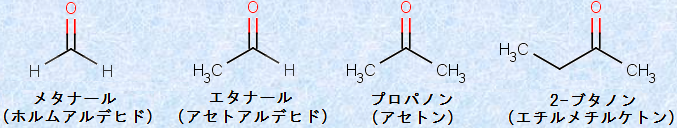
図.1 様々なアルデヒドとケトン
(i) アルデヒドの命名法
炭素数が4以下のアルデヒドには、通常は慣用名が用いられますが、それ以上の場合は、IUPAC命名法に従って、論理的に命名されます。IUPAC命名法では、母体となるアルカン(alkane)の末尾の「e」を除いた語幹に接尾語「al」を付けて、「アルカナール(alkanal)」と命名します。この命名法の適用例を、次の図.2に示します。なお、慣用名も( )内に示しておきます。

図.2 アルデヒドにおけるICPACシステムの適用例
アルデヒドの慣用名は、今でもよく用いられているので、覚えておく必要があります。また、置換基のあるアルデヒドでは、次の図.3に示すように、アルデヒド基(-CHO)の炭素から出発して、炭素鎖に番号を付けていきます。位置番号を付けたり、接尾語を選ぶときには、アルデヒド基(-CHO)は、二重結合(C=C)やヒドロキシ基(-OH)よりも優先します。
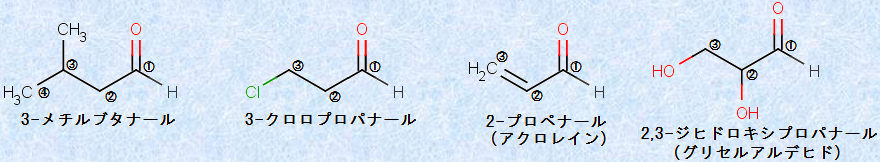
図.3 置換基のあるアルデヒドにおけるIUPAC命名法の適用例
環状アルデヒドには、「カルボアルデヒド(carbaldehyde)」という接尾語を用います。芳香族アルデヒドは、慣用名を持つことが多いです。次の図.4に、環状アルデヒドにおけるIUPAC命名法の適用例を示します。
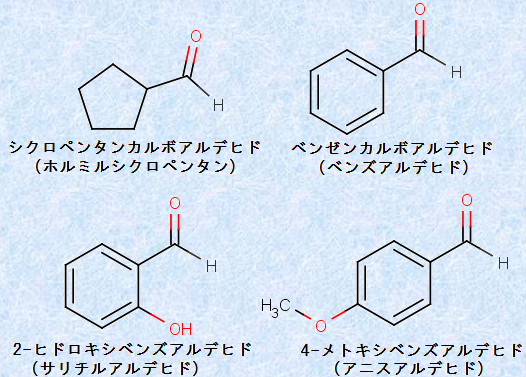
図.4 環状アルデヒドにおけるIUPAC命名法の適用例
(ii) ケトンの命名法
ケトンにも、多くの慣用名がありますが、現在ほとんど使われなくなっています。しかし、最も単純なケトンであるプロパノンCH3COCH3には、「アセトン」という慣用名が、例外的に使用されています。
IUPAC命名法の規則は簡単で、母体となるアルカン(alkane)の末尾の「e」を除いた語幹に接尾語「one」を付けて、「アルカノン (alkanone)」と命名します。炭素鎖の番号の付け方は、カルボニル炭素にできるだけ小さい番号が付くようにします。また、カルボニル炭素に結合している有機基をアルファベット順に並べたあと、「ケトン」という単語を追加して、命名する慣用名が用いられることも多いです。この命名法の適用例を、次の図.5に示します。なお、慣用名も( )内に示しておきます。
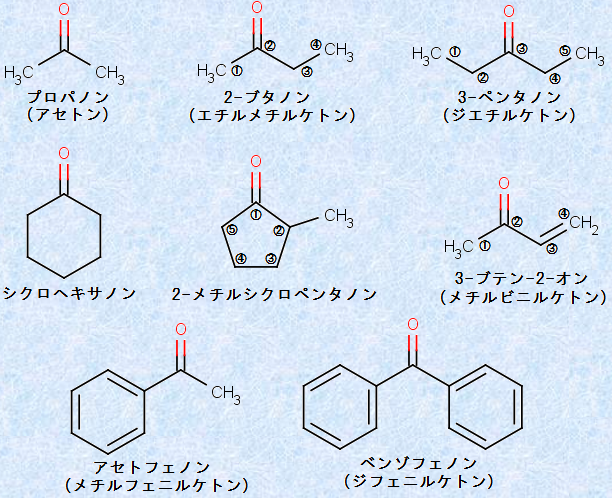
図.5 ケトンにおけるICPACシステムの適用例
(iii) アルデヒドとケトンの物理的性質
カルボニル基(-CO-)のC=O結合の極性は、カルボニル化合物の物理的な性質に大きな影響を及ぼしています。例えば、カルボニル化合物は、同程度の分子量を持つアルカンと比べて、高い沸点を持ちますが、対応するアルコールよりは、沸点が低いです。
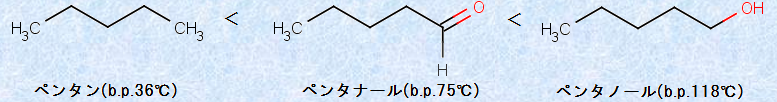
図.6 有機化合物の沸点
有機化合物の沸点が、このような順になるのは、アルカンが一時的にしか分極できないのに対して、カルボニル化合物は永久分極しているC=O結合を持ち、分子同士がより強く引き合って、会合する性質があるからです。このようなカルボニル化合物で見られるファンデルワールス力は、特に「双極子相互作用」とも呼ばれ、無極性分子同士に作用する「ロンドン分散力」より強いものの、アルコール同士に作用する「水素結合」ほど強くありません。したがって、カルボニル化合物は、双極子相互作用によりアルカンよりも強く引き合いますが、アルコールとは異なり、水素結合ができないので、沸点の順序は、アルカン<カルボニル化合物<アルコールとなるのです。
また、カルボニル基(-CO-)の極性は、アルデヒドやケトンの溶解性にも影響を与えます。例えば、低分子量で、炭化水素部分の割合が小さいカルボニル化合物は、水溶性です。アセトアルデヒドCH3CHOやアセトンCH3COCH3は、水とどのような割合でも混じり合います。この理由は、カルボニル化合物同士では、水素結合を形成できませんが、OHまたはNH結合を持つ他の化合物とは、水素結合を形成できるからです。カルボニル基(-CO-)のような親水基1個あたりに、3個の炭素までぐらいなら、水に溶ける力の方が強くなります。
表.1 主なアルデヒドやケトンの物理的性質
|
化学式 |
名称 |
沸点(℃) |
融点(℃) |
密度(g/mL) |
|
HCHO |
ホルムアルデヒド |
-21 |
-92 |
0.815 |
|
CH3CHO |
アセトアルデヒド |
20.8 |
-121 |
0.783 |
|
C6H5CHO |
ベンズアルデヒド |
178.6 |
-26 |
1.04 |
|
CH3COCH3 |
アセトン |
56.2 |
-95.4 |
0.789 |
|
CH3COC2H5 |
ブタノン |
79.6 |
-86.3 |
0.805 |
|
C6H10O |
シクロヘキサノン |
155.6 |
-16.4 |
0.948 |
|
C6H5COCH3 |
アセトフェノン |
202.6 |
20.5 |
1.03 |
|
C6H5COC6H5 |
ベンゾフェノン |
305.9 |
48.1 |
1.15 |
(2) アルデヒド基の検出反応
アルデヒドは、塩基性条件で極めて酸化されやすいです。これは言い換えれば、「アルデヒドは塩基性条件で強い還元力を持つ」ということです。アルデヒドを塩基性条件で酸化すると、同じ炭素原子数のカルボン酸イオンになります。塩基性条件では、アルデヒドから生成するカルボン酸は、直ちに中和されてカルボン酸塩となるため、平衡の反応系から除かれます。すると、ル・シャトリエの法則より、次の図.7で示すようなアルデヒドの酸化反応が進みやすくなると考えられます。
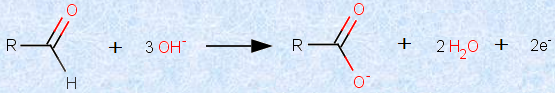
図.7 アルデヒドの酸化反応
この性質を利用した有名な検出反応として、フェーリング液を還元する「フェーリング反応(Fehling's reaction)」と、トレンス試薬を還元する「銀鏡反応(silver mirror reaction)」があります。フェーリング液を還元する反応では、銅(II)イオンCu2+ が還元されて、酸化銅(I) Cu2Oが生成します。一方で、トレンス試薬を還元する反応では、銀(I)イオンAg+ が還元されて、銀Agが生成します。
このような反応を示す物質は、還元性が強い物質と言えますが、有機化学の分野では、アルデヒド基(-CHO)を含んでいるのが通常です。したがって、フェーリング反応に陽性、または銀鏡反応に陽性な物質は、一般的に分子内にアルデヒド基(-CHO)を含むと推測できるのです。ただし、最近の報告によれば、脂肪族アルデヒドでは分子内の炭素数が5以上になると、フェーリング液の還元反応が顕著に進行しにくくなるといいます。炭素数によっては、アルデヒド基(-CHO)を含んでいても、フェーリング反応が陰性になる場合もあるので注意が必要です。
(i) フェーリング反応
「フェーリング液(Fehling's solution)」にアルデヒドを加えて熱すると、銅(II)イオンCu2+ が還元されて、赤褐色の酸化銅(I) Cu2Oが沈殿します。このとき、アルデヒドは酸化されて、カルボン酸イオンになっており、溶液中に溶解しています。
RCHO + 2Cu2+ + 5OH− → RCOO− + Cu2O↓(赤褐) + 3H2O
酸化反応:RCHO + 3OH− → RCOO− + 2H2O + 2e−
還元反応:2Cu2+ + 2e− + 2OH− → Cu2O↓(赤褐) + H2O

図.8 フェーリング反応により、酸化銅(I) Cu2Oの沈殿が生成する
ちなみに、フェーリング液とは、硫酸銅(II) CuSO4や水酸化ナトリウムNaOH、酒石酸カリウムナトリウムKNaC4H4O6の混合物です。ここで、酸化剤は銅(II)イオンCu2+ であり、酒石酸イオンC4H4O62− は塩基性条件下で、銅(II)イオンCu2+ が水酸化銅(II) Cu(OH)2となって沈殿しないようにするために加えられています。酒石酸イオンC4H4O62− は、銅(II)イオンCu2+ と深青色の錯イオンを形成し、銅(II)イオンCu2+ 濃度を低く保ちながらも、溶液中のアルデヒドによって、還元されやすくなるように働きかけています。酒石酸イオンC4H4O62− のような共存イオンによる妨害を除去する目的で加えられる物質を、一般的に「マスキング剤(masking agent)」といいます。
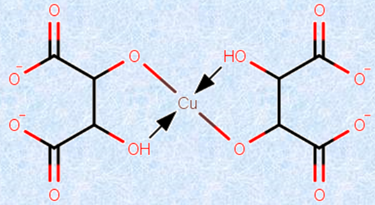
図.9 酒石酸イオンC4H4O62− は、塩基性条件下で銅(II)イオンCu2+ と錯イオンを作る
また、同じ原理を利用した試薬に「ベネジクト液(Benedict's reagent)」がありますが、こちらはグルコースやフルクトースなどの還元糖を検出するために用いられます。フェーリング液は、ベネジクト液よりも反応が鋭敏であり、還元糖以外の物質と反応したり、長期保存に耐えられなかったりといった欠点があるのです。特徴としては、ベネジクト液には、酒石酸塩の代わりにクエン酸ナトリウムが加えられています。ベネジクト液は、化学の実験の他、糖尿病の簡易診断に使われています。
(ii) 銀鏡反応
アンモニア性硝酸銀水溶液(トレンス試薬)にアルデヒドを少量加えて、60℃に保つと、還元された銀Agの微粒子が析出し、ガラス器壁の表面などに付着して、綺麗な銀鏡が生じます。このとき、アルデヒドは酸化剤のジアンミン銀(I)イオン[Ag(NH3)2]+ によって酸化されて、カルボン酸イオンになっており、溶液中に溶解しています。
RCHO + H2O + 2[Ag(NH3)2]+ → 2Ag↓(銀) + RCOO− + NH3 + 3NH4+
酸化反応:RCHO + H2O + 3NH3 → RCOO− + 3NH4+ + 2e−
還元反応:[Ag(NH3)2]+ + e− → Ag↓(銀) + 2NH3

図.10 銀鏡反応により、銀Agがガラス器壁に析出し、文字通り鏡ができ上がる
「トレンス試薬(Tollens’ reagent)」とは、硝酸銀(I) AgNO3水溶液にアンモニア水を十分に加えて、ジアンミン銀(I)イオン[Ag(NH3)2]+ にしたものです。硝酸銀AgNO3水溶液にアンモニア水を加えると、暗褐色の酸化銀(I) Ag2Oの沈殿を生じますが、さらに過剰のアンモニア水を加えることで、錯イオン[Ag(NH3)2]+ となって溶解するのです。銀鏡反応は、フェーリング反応よりも鋭敏であり、この反応は、工業的にも銀メッキの手法として利用されています(アルコールと関連物質の性質を参照)。
(3) ヨードホルム反応
塩基性条件で、アセトンCH3COCH3とヨウ素I2を反応させると、特異臭を持つ「ヨードホルムCHI3」の黄色結晶が生じます。この反応を「ヨードホルム反応(iodoform reaction)」といい、アセチル基(acetyl group, CH3CO-)を持つ化合物の検出反応になっています。ヨードホルムCHI3は殺菌消毒剤としての用途もあり、昔の病院では、消毒用のヨードホルムCHI3が大量に使われていました。融点がちょうど119℃であり、消毒剤の「病院臭」がするので、「救急車119番」と覚えていたものです。
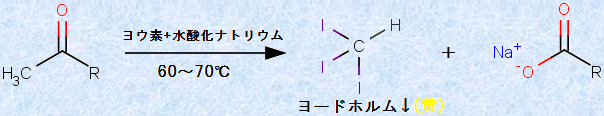
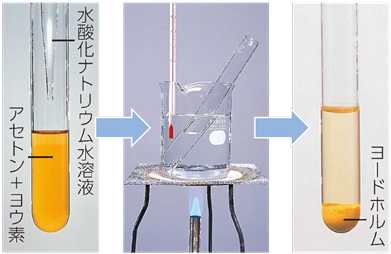
図.11 ヨードホルム反応
ただし、アセチル基(-COCH3)に結合しているR基は、必ず「炭素原子C」か「水素原子H」でなければなりません。したがって、酢酸CH3COOHやアセトアミドCH3CONH2は、ヨードホルム反応陰性です。この理由は、酢酸CH3COOHでは、塩基性条件で中和反応が進行して、共鳴混成体の酢酸イオンCH3COO− となり、アセトアミドCH3CONH2では、アミド結合(-NHCO-)が共鳴した共鳴混成体となっており、いずれも「アセチル基(-COCH3)のある構造」の寄与が、他よりも小さくなっているからです。
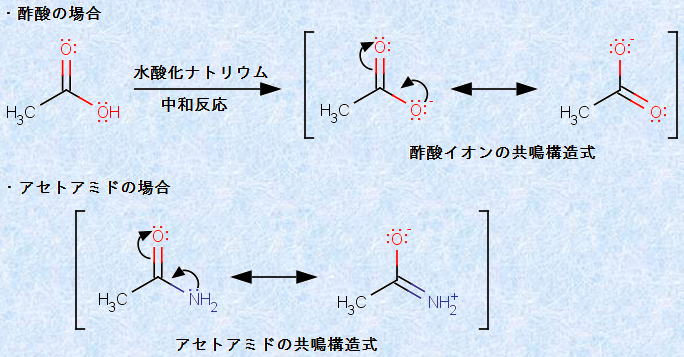
図.12 ヨードホルム反応陰性の物質
また、酸化されてアセチル基(-COCH3)になる構造を持つアルコールも、ヨードホルム反応陽性です。ヨードホルム反応では、ヨウ素I2が酸化剤の役割をします。このようなアルコールには、エタノールC2H5OHや2-ブタノールCH3CH(OH)CH2CH3があります。これらのアルコールは、酸化された構造では、分子内にアセチル基(-COCH3)の構造を持つので、結局のところ、同じ結果を与えるのです。
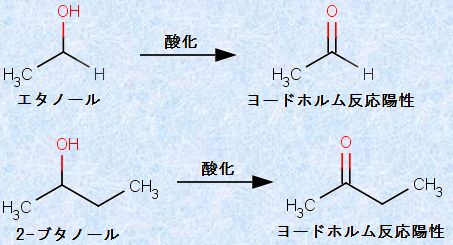
図.13 ヨードホルム反応陽性の物質
つまり、アセチル基(CH3CO-)もしくは1-ヒドロキシエチル基(CH3CH(OH)-)に結合している原子が、炭素原子Cもしくは水素原子Hなら、ヨードホルム反応に対して陽性であると考えれば良いのです。また、大学入試では、ときどきヨードホルム反応の反応式を示せという問題が出題されます。ヨードホルム反応の反応式は、一般的に次のように表せます。
CH3COR + 3I2 + 4NaOH → CHI3 + RCOONa + 3H2O + 3NaI
(4) アルデヒドの利用と合成
(i) ホルムアルデヒドHCHO
ホルムアルデヒドHCHOは、最も簡単なアルデヒドであり、メタノールCH3OHの酸化で、工業的に大量に製造されています。ホルムアルデヒドHCHOの世界中の年間生産量は、360万tにも達しています。
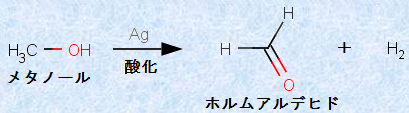
図.14 工業的なホルムアルデヒドHCHOの合成反応
実験室的には、熱した銅線を熱いうちにメタノールCH3OHの液面に近付けて合成します。すると、酸化銅(II) CuOの酸化作用により、メタノールCH3OHが酸化されてホルムアルデヒドHCHOが生成します。このとき、酸化銅(II) CuOは還元されて銅Cuに戻るので、銅線は触媒として働いていることになります。
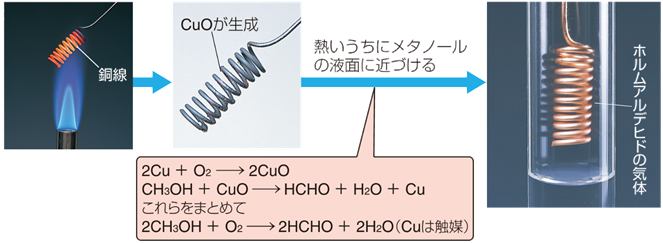
図.15 実験室的なホルムアルデヒドHCHOの製法
ホルムアルデヒドHCHOは、刺激臭・催涙性のある気体(m.p.-92℃, b.p.-19℃)であり、重合しやすいため、そのままの状態では保存できません。したがって、ホルムアルデヒドHCHOは、一般的に「ホルマリン(formalin)」と呼ばれる37%水溶液として供給されています。ホルマリンは、生物試料の保存用に使われる他、10%に薄めても殺菌力があり、羊毛や獣毛の処理のときに、殺菌剤としても使われます。
図.16 魚のホルマリン標本(左からクロアナゴ、クロイソ、ネコザメ、サケガシラ)
また、ホルムアルデヒドHCHOは、木材を不完全燃焼させたときに出る煙の中にも含まれ、食品を燻製にして保存するとき、細菌除去の主役を演じる物質です。ホルムアルデヒドHCHOは、食物の表面にあるタンパク質中の-NH-基や-NH2基とたちまち反応を起こし、隣り合ったタンパク質の分子鎖をつなぎ合わせ、その物質を硬くして、タンパク質の分子を不活性化します。煙が目に染みるには、この反応が起こるからです。これと同様な型の反応は、合成樹脂や接着剤の生産にも使われています(合成高分子化合物を参照)。

図.17 燻煙により、煙中の殺菌成分が食品に浸透し、保存性が高まる
新築の住居では、倦怠感や眩暈、頭痛、喉の痛みなどを伴う「シックハウス症候群(Sick House Syndrome)」が起こることがあります。新品の自動車でも同様の症状が起こることがあり、こちらは「シックカー症候群」と呼ばれます。これらの症状は、接着剤や塗料などに含まれるホルムアルデヒドHCHOが原因であるとされています。
(ii) ガンはホルマリン漬けの肉の臭い?
病気には「特有の臭い」があることが、昔から知られています。例えば、イギリスの哲学者フランシス・ベーコンは、ヨーロッパで流行したペストについて、「腐った柔らかいリンゴのような臭いだ」と書き残しています。その他にも、現場の医療従事者からは、様々な報告が上がっています。ガンは「ホルマリン固定された肉の臭い」、リュウマチは「独特の酸っぱい臭い」、糖尿病は「甘酸っぱい臭い」、重度の鬱病は「埃っぽい臭い」、貧血は「アンモニア臭」がするといいます。日本語には「小便臭い小娘」という言い回しがありますが、思春期の女の子は生理が安定せずに貧血になることが多いため、あながち先人の知見は間違いではなかったということになります。
そもそも、ヒトは病気になると、体内で特異的な代謝が起こるようになり、健康時には生じないような揮発性物質が生成することがあります。これが体循環によって全身を回り、汗や吐息などに混じって、特有の臭いとなるのでしょう。血液検査やレントゲン検査といった客観的な検査法がなかった時代、臭いは病気を見極める重要な判断材料でした。患者の体臭を嗅いで病気を診断する「嗅診」は、日本でも明治時代までは当たり前のように行われていたといいます。
表.2 病気による体臭の変化
|
病名 |
体臭の特徴 |
|
ガン |
ホルマリン固定された肉の臭い |
|
リュウマチ |
独特の酸っぱい臭い |
|
糖尿病 |
甘い臭い、甘酸っぱい臭い |
|
痛風 |
古いビールの臭い |
|
重度の鬱病 |
埃っぽい臭い |
|
歯周病 |
ゴミが腐った臭い |
|
慢性副鼻腔炎 |
ゴミが腐った臭い |
|
ペスト |
青リンゴの腐った臭い |
|
メープルシロップ尿症 |
メープルシロップの臭い |
|
トリメチルアミン尿症 |
魚が腐った臭い |
|
フェニルケトン尿症 |
カビの臭い |
|
胃の障害 |
酸っぱい臭い、卵の腐った臭い |
|
肝機能の障害 |
ネズミ臭、ドブのような臭い |
|
貧血 |
アンモニア臭 |
|
ひどい便秘 |
便の臭い |
ちなみに、ガンの臭いについては、昔から「手術で患部を開けると特有の臭いがする」と外科医が報告していたようです。「ガン患者が多い病棟に行くと特殊な臭いがする」と話す医師もいました。ガンを臭いで検出したという最初の報告は、1989年に皮膚科の医師からされたものです。足にあざができた女性に犬がやたら執着するため、同部位を皮膚生検したところ、悪性黒色腫だったというのです。最近では、ガンの臭いを診断に役立てようという動きもあり、尿や便の臭いを嗅ぐことで、ガンがあるかどうかを高確率に嗅ぎ分けられる「ガン探知犬」をガン診断に活用しようという試みがあります。2011年にイギリスの医学雑誌「Gut」に掲載された論文によると、ガン探知犬は大腸ガンを呼気では91.6%、便では97.3%とという精度で、正解を嗅ぎ分けることに成功したといいます。
また、九州大学の廣津崇亮らの研究グループは、「C・エレガンス(Caenorhabditis elegans)」という線虫によって、ガンの有無を高い精度で検診する方法を研究しています。このC・エレガンスという線虫は、体が透明で観察しやすく、飼育もしやすいことなどから、生物学者にモデル動物として、広く愛用されています。多細胞生物として、初めて全ゲノム配列が解読された生物でもあります。廣津は、線虫の嗅覚を長年研究しており、線虫がガンの臭いに対して、「正の走性」があることを発見したのです。線虫は、体長わずか1 mmほどの生物ながら、イヌの1.5倍の嗅覚受容体を持ちます。線虫には、好きな臭いに寄って行き、嫌いな臭いから逃げるという走性行動があり、反応を容易に調べられるのです。検診の方法は極めてシンプルで、シャーレに患者の尿を1滴垂らし、線虫がどのように反応するかを観察するだけです。尿を垂らしてから数十分経って、線虫が尿に集まっていれば「ガンの疑いが高い」、線虫が遠ざかれば「ガンの疑いが低い」というようになります。この検診では、ガンの種類までは特定できないものの、コストはわずか数百円程度であり、95.8%という極めて高い感度で診断できるといいます。この診断システムは、早期発見の難しい膵臓ガンを含む様々なガンを発見できるため、ガン診断にかかる時間やコストを大幅に削減できると考えられています。
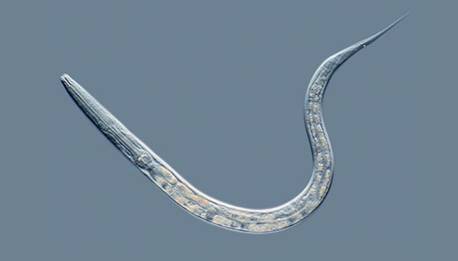
図.18 C・エレガンスは、ガンの臭いを好み、ガンの臭いに対して正の走性がある
(iii) アセトアルデヒドCH3CHO
アセトアルデヒドCH3CHOは、特有の刺激臭・催涙性のある無色液体(m.p.-124℃, b.p.20℃)です。俗にいう「酒臭さ」の原因物質であり、飲酒すると息がアルコール臭くなるのでは、エタノールC2H5OHが代謝されて生成したアセトアルデヒドCH3CHOによるものです。重合しやすく、水や有機溶媒によく溶けます。自然界では、植物の正常な代謝過程で産生され、特に果実などに多く含まれています。
また、ニコチンの吸収や効果を増幅する作用があるため、タバコ製造会社によって、少量のアセトアルデヒドCH3CHOがタバコに加えられています。実験室で製造する際は、エタノールC2H5OHを二クロム酸カリウムK2Cr2O7の硫酸酸性溶液で酸化するか、エタノールC2H5OHの蒸気を空気中で熱した銅Cuに触れさせます。
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3CHO + Cr2(SO4)3 + K2SO4 + 7H2O
2Cu + O2 → 2CuO
C2H5OH + CuO → CH3CHO + H2O + Cu
体内では、「アルコールデヒドロゲナーゼ(アルコール脱水素酵素)」という主に肝臓にある酵素によって、エタノールC2H5OHから生産されます。アルコールデヒドロゲナーゼは、私たちがお酒を飲んだときに、エタノールC2H5OHが最初に代謝されていく過程で、最初に作用する酵素です。体の大きな人では、一般に肝臓も大きいので、エタノールC2H5OHの代謝も、循環系から除去されるのも、普通の人よりも速くなります。
アセトアルデヒドCH3CHOには強い毒性があり、悪酔いや二日酔いの原因物質です。本来、アセトアルデヒドCH3CHOは、「アセトアルデヒドデヒドロゲナーゼ(アセトアルデヒド脱水素酵素)」の働きによって、直ちに無害な酢酸CH3COOHに変わり、さらに二酸化炭素CO2と水H2Oに分解されます。お酒に弱い人は、アルコールデヒドロゲナーゼではなくて、このアセトアルデヒドデヒドロゲナーゼの活性が低いために(活性酵素の487番のグルタミン酸がリシンに変位した低活性酵素になっている)、体内にアセトアルデヒドCH3CHOが蓄積して、頭痛や吐き気などの症状が出るとされます。
私たちが飲むお酒には、エタノールC2H5OHとは異なる様々な夾雑物が含まれるため、それらがエタノールC2H5OHの代謝に影響を与えます。エタノールC2H5OHと夾雑物との間で、競合が起こって代謝が遅くなるのです。お酒に含まれる夾雑物は、糖がエタノールC2H5OHになるまでの発酵プロセスで少量生成するもので、メタノールCH3OHのようなアルコールや、その他に様々な有機化合物も含まれます。ウイスキーやワイン、テキーラ、ブランデーなどは皆、ウォッカやジンのような透明な蒸留酒よりも夾雑物を多く含みます。蒸留酒は、ろ過と蒸留を繰り返して製造するため、その成分のほとんどが水H2OとエタノールC2H5OHなのです。2009年、夾雑物の含量が異なる酒類について、二日酔いに対する影響が調べられました。その結果、バーボンを飲んだ人は、夾雑物の少ないウォッカを飲んだ人よりも、より酷い二日酔いになる可能性が高かったといいます。

図.19 ウォッカは、成分のほとんどが水H2OとエタノールC2H5OHなので癖が少なく、カクテルのベースにされることが多い
また、工業的には、パラジウム-銅触媒を用いて、エチレンC2H4を選択的に直接酸化する「ワッカー酸化(Wacker oxidation)」により、アセトアルデヒドCH3CHOを製造しています。この反応は、ドイツのヘキスト社とワッカー・ケミー社が、1959年に発見しました。ワッカー酸化が登場する前は、水銀Hg触媒を用いてアセチレンC2H2を水和し、ビニルアルコール経由で、アセトアルデヒドCH3CHOを合成する方法が用いられていました。日本では、かつてこの過程で生成したメチル水銀が無処理で排出され、「水俣病」の原因になりました(脂肪族炭化水素(アルキン)を参照)。ワッカー酸化の登場により、アセチレンC2H2の水和によるアセトアルデヒドCH3CHOの製造は、日本では化学工業としては消滅しました。ワッカー酸化は、比較的安全な触媒を使い、原料はエチレンC2H4と酸素O2だけで、副生成物がないクリーンな反応です。

図.20 工業的なアセトアルデヒドCH3CHOの合成反応
アセトアルデヒドCH3CHOの世界における製造量は、年間100万tを超えています。工業的に製造されたアセトアルデヒドCH3CHOの約半分は、酢酸CH3COOHに酸化され、残りは、防腐剤や還元剤などとして使用されています。

図.21 アセトアルデヒドCH3CHOの酸化による酢酸CH3COOHの合成反応
(5) ケトンの利用と合成
アセトンCH3COCH3は、最も簡単なケトンであり、無色の液体(m.p.-95℃, b.p.56℃)で、水とは任意の割合でよく混じり合います。また、有機化合物をよく溶かすので、有機溶媒としての用途もあります。実験室的には、アセトンCH3COCH3は、酢酸カルシウム(CH3COO)2Caを「乾留(dry distillation)」することで合成できます。「乾留」というのは、空気を断った状態で有機物を加熱して、熱分解をすることです。熱分解の結果、水H2Oや二酸化炭素CO2、可燃性ガスなどが生成して留出し、不揮発性の物質が残ります。

図.22 酢酸カルシウム(CH3COO)2Caの乾留によるアセトンCH3COCH3の合成反応
工業的には、アセトンCH3COCH3は、「クメン法(cumene process)」でフェノールと同時に合成されます(酸素を含む芳香族化合物を参照)。他には、2-プロパノールCH3CH(OH)CH3の酸化でも得られます。
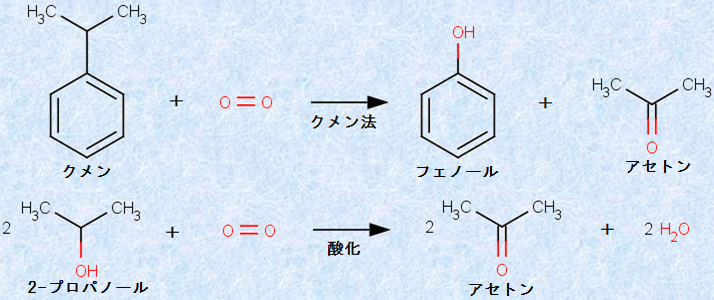
図.23 様々なアセトンCH3COCH3の合成反応
工業的に製造されたアセトンCH3COCH3の約30%は、直接使用されます。それは、アセトンCH3COCH3が完全に水と混じり合うだけでなく、多くの有機化合物(樹脂や塗料、染料、マニキュアなど)に対する、優れた溶媒であるからです。残りは、エポキシ樹脂の合成原料である「ビスフェノールA」など、他の化学薬品の製造に用いられています。
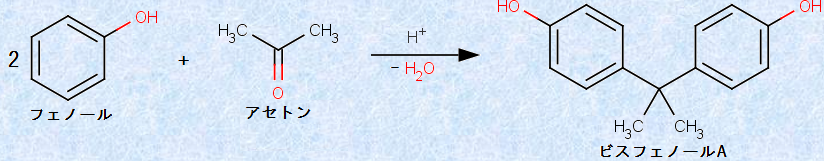
図.24 ビスフェノールAの合成
・参考文献
1) Andy Brunning著/高橋秀依・夏苅英昭訳「カリカリベーコンはどうして美味しいにおいなの?」化学同人(2016年発行)
2) 歌川明子/後飯塚由香里/桂田和子/井上正之「脂肪族アルデヒドによるフェーリング液の還元」化学と教育70巻4号(2022年)
3) 大東孝司「プラグマティック化学」河合出版(2017年発行)
4) 倉原優「本当にあった医学論文」中外医学社(2014年発行)
5) 佐藤健太郎「医薬品とノーベル賞 がん治療薬は受賞できるのか」角川新書(2016年発行)
6) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
7) Peter W. Atkins著/千原秀昭・稲葉章訳「分子と人間」東京化学同人(1993年発行)
8) メートランド・ジョーンズ「ジョーンズ有機化学(下)」東京化学同人(2000年発行)
9) 薬理凶室「悪魔が教える 願いが叶う毒と薬」三才ブックス(2016年発行)