・無機化学(沈殿生成反応)
【目次】
[規則1] NO3-・CH3COO-・HCO3-・H2PO4-・アルカリ金属イオン(Na+やK+ など)・NH4+ の塩は、沈殿しにくい
[規則2] F- を除くハロゲン化物イオン(Cl-・Br-・I- )は、Ag+・Pb2+・Hg22+ とは沈殿する
[規則3] SO42- は、アルカリ土類金属イオン(Ca2+・Sr2+・Ba2+)やPb2+ とは沈殿する
[規則4] CO32-・SO32-・C2O42-・PO43-・CrO42- (多価の弱酸のイオン)の塩は、アルカリ金属イオンとNH4+ 以外とはほとんど沈殿する
[規則5] OH- とO2- の化合物(塩基と金属酸化物)は、イオン化傾向Mg以下の金属とはほとんど沈殿する
[規則6] S2-と沈殿するか否かは、溶液の液性によって決まる
(1) 無機化学とは何か?
「無機化学(inorganic chemistry)」とは、端的にいえば、有機化合物を除くすべての物質、およびそれらを構成する元素の性質を扱う自然科学の一分野です。本来、化学の面白さは、物質を構成する個々の元素が持っている個性と、様々な化合物が示す独特の性質にあるといえます。この面白さは、無機化学に大いに反映されています。
1869年、ロシアの化学者であるドミトリ・イヴァノヴィチ・メンデレーエフが初めて提案した元素の周期律は、1913年にイギリスの物理学者であるヘンリー・モーズリーによって原子番号に基づいて理解すべきであるということが明らかにされ、その後の量子力学の発展により、原子の構造と周期律の関係が明確になりました。このようにして完成した「周期表」には、現在では100を超える元素が載せられています。これらの元素は、それぞれが原子構造に基づく個性を発揮して、非常に多くの興味深い現象を生み出しています。
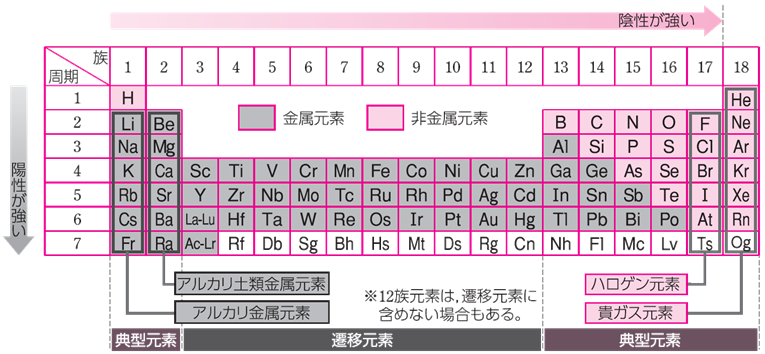
図.1 現在の周期表は、元素を原子番号の順に並べたものになっている
無機化学では、炭素以外の全周期表の元素を取り扱い、また炭素を含む化合物であっても、一般的に有機化合物とは見なされない二酸化炭素や炭酸塩などの化合物は、すべて無機化学に含まれます。有機化合物は、およそ地表のみに存在するのに対して、地球は内部を含めてそのほとんどが、無機化合物で構成されているといっても過言ではありません。そのため、無機化学には、さらに地球化学や鉱物化学、海洋化学、大気化学などの専門領域が存在しています。
(2) 沈殿生成反応
イオン結晶は、一般的に構成イオンが水和しやすいので、水に溶けやすいものが多いです。しかし、イオン結晶の中でも、塩化銀AgClや硫酸バリウムBaSO4などのように、水に難溶なものもあります。そこで、次のような沈殿生成反応が起こります。例えば、0.1 mol/Lの硝酸銀AgNO3水溶液に、0.1 mol/Lの希塩酸HClを加えると、塩化銀AgClの白色沈殿が生じます。
AgNO3 + HCl → AgCl↓(白) + HNO3
イオン結晶の水に対する溶解性は、かなり複雑な要因が絡み合っており、単純には論じられません。そこで、代表的な水に難溶なイオン結晶は、覚えるしかありません。次の表.1に、代表的なイオン結晶の組み合わせを示しました。表で空欄になっている部分は、その塩が存在しないか不確実なものなので、特に気にする必要はありません。「○」は比較的よく水に溶ける組み合わせであり、「↓」は水に溶けにくい組み合わせです。また、「( )」で示されているものは中間の性質を示すものであり、少しだけ溶けたり、少しだけ沈殿したりするものです。
表.1 代表的なイオン結晶の組み合わせ
|
|
NH4+ |
Li+ |
K+ |
Ca2+ |
Na+ |
Mg2+ |
Al3+ |
Zn2+ |
Fe2+ |
Fe3+ |
Ni2+ |
Sn2+ |
Pb2+ |
Cu2+ |
Hg2+ |
Hg22+ |
Ag+ |
|
|
NO3- |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
|
|
SO42- |
〇 |
〇 |
〇 |
↓ |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
|
↓ |
〇 |
|
|
(〇) |
|
|
Cl- |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
↓ |
〇 |
〇 |
↓ |
↓ |
|
|
CO32- |
〇 |
〇 |
〇 |
↓ |
〇 |
↓ |
|
↓ |
|
|
|
|
↓ |
↓ |
↓ |
|
↓ |
|
|
S2- |
酸性 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
|
〇 |
↓ |
↓ |
↓ |
↓ |
|
↓ |
|
中性〜塩基性 |
〇 |
〇 |
〇 |
〇 |
〇 |
〇 |
↓ |
↓ |
↓ |
|
↓ |
↓ |
↓ |
↓ |
↓ |
|
↓ |
|
|
OH- |
〇 |
〇 |
〇 |
(〇) |
〇 |
(↓) |
↓ |
↓ |
↓ |
↓ |
↓ |
↓ |
↓ |
↓ |
↓ |
|
↓(Ag2O) |
|
(3) 沈殿の可否に関する経験則
組成式MmNnで表される塩が、水に溶解する反応は、正確に書くと次のようになります。
MmNn(固) + aq → mMa+aq + nNb-aq ΔH =−E kJ (E>0)
この反応は、次に示す2つの段階に分離して、考えることができます。第一段階(I)は、結晶がイオンに電離する反応です。そして、第二段階(II)は、イオンが水和する反応です。
(I) MmNn(固) → mMa+ + nNb- ΔH =EI kJ (EI>0)
(II) mMa+ + nNb- + aq → mMa+aq + nNb-aq ΔH =−EII kJ (EII>0)
第一段階の反応では、クーロン力で引き合っている陽イオンと陰イオンを互いに引き離すのだから、反応には外部からのエネルギーが必要です。したがって、反応はEI kJ/molの吸熱(ΔH>0)となります。一方で、第二段階の反応では、イオンと水分子がクーロン力により互いに引き合うのだから、反応はEII kJ/molの発熱(ΔH<0)となります。
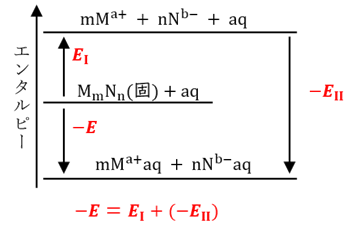
図.2 イオン結晶MmNnの溶解に関するエンタルピー変化
そこで、この溶解反応全体では、−E=EI−EIIのエンタルピー変化があります。もちろん、これはEの絶対値が大きいほど、発熱量が大きくなる(エンタルピー変化ΔHが小さくなる)訳だから、塩の溶解度も大きくなる傾向にあります。つまり、塩の溶解度については、EIの絶対値が小さいほど、またEIIの絶対値が大きいほど、塩の溶解度が大きくなるということができます。これらのエンタルピー変化の関係をもとに、沈殿の可否に関する経験的な規則について、少し考えてみましょう。
[規則1] NO3-・CH3COO-・HCO3-・H2PO4-・アルカリ金属イオン(Na+やK+ など)・NH4+ の塩は、沈殿しにくい
AgNO3 → Ag+ + NO3-
CH3COONa → CH3COO- + Na+
基本的には、1価のイオンは、沈殿を作りにくい傾向にあります。この理由としては、1価のイオンは、2価や3価などの多価のイオンに比べて、粒子間に作用するクーロン力が弱く、イオン結晶を電離させずに留めておく力が弱いことが考えられます。つまり、一般的に1価のイオンは、EIの絶対値が小さいために塩の溶解度は大きくなります。
ただし、1価のイオンが含まれるすべての塩の溶解度が大きい訳ではありません。例外も数多く存在し、例えば、酢酸銀(I) CH3COOAgは水に溶けにくい塩です。1つの要因だけで、溶解度の大小を予想することは一般的に困難であり、この規則は「溶けやすくなる」という1つの効果として考えましょう。
[規則2] F- を除くハロゲン化物イオン(Cl-・Br-・I- )は、Ag+・Pb2+・Hg22+ とは沈殿する
・覚え方・・・銀(Ag)の生(Pb)ハゲ(Hg)
Ag+ + Cl- → AgCl↓(白)
Pb2+ + 2Cl- → PbCl2↓(白)
17族元素は1価の陰イオンなので、[規則1]によれば、基本的にその塩は溶解しやすいはずです。しかし、17族元素の中でも、フッ化物イオンF- を除く塩化物イオンCl-・臭化物イオンBr-・ヨウ化物イオンI- は、銀(I)イオンAg+・鉛(II)イオンPb2+・水銀(I)イオンHg22+ とは、不溶性の塩を作って沈殿します。この理由をAgで説明すると、Agの電気陰性度は1.9であり、これは金属元素の中でも比較的大きな数値です。したがって、Agと塩化物イオンCl-・臭化物イオンBr-・ヨウ化物イオンI- からなるイオン結晶は、共有結合性が非常に高くなり、この結晶を完全なイオンとして電離させるためには、電荷を分離させるだけの大きなエネルギーEIが必要となるのです。つまり、一般的に塩の共有結合性が大きくなると、EIの絶対値が大きくなるため、塩の溶解度は小さくなります。その証拠に、Pbの電気陰性度は2.3であり、Hgの電気陰性度も2.0です。どちらも金属元素としては、比較的大きな電気陰性度になっています。

図.3 ハロゲン化銀の溶解性
ただし、Fの場合は、電気陰性度が4.0と他の17族元素と比べて、非常に大きな値です。それ故に、フッ化物イオンF- は、銀(I)イオンAg+ や水銀(I)イオンHg22+ とは通常沈殿を作りません(例外として、フッ化鉛(II) PbF2は水に溶けにくい)。また、塩化鉛(II) PbCl2は熱湯にはかなり溶け、塩化銀(I) AgCl・臭化銀(I) AgBr・ヨウ化銀(I) AgIは、感光性があるために光で分解します。
PbCl2 + aq → Pb2+aq + 2Cl-aq
2AgCl → 2Ag + Cl2
[規則3] SO42- は、アルカリ土類金属イオン(Ca2+・Sr2+・Ba2+)やPb2+ とは沈殿する
・覚え方・・・バ(Ba)カ(Ca)にする(Sr)な(Pb)硫酸塩
Ca2+ + SO42- → CaSO4↓(白)
Pb2+ + SO42- → PbSO4↓(白)
陽イオンと陰イオンのイオン半径の大きさは、溶解度にどのような影響を与えるでしょうか?陽イオンまたは陰イオンの一方が、いずれか一方に比べて非常に小さいとき、イオン結晶でいるときには、ほとんど影響を与えません。しかし、水に溶けて水和したときには、生じる水和エンタルピー−EIIが非常に小さくなります。これは、イオン半径が小さい方のイオンのクーロン力が極めて強くなり、生じる水和エンタルピー−EIIが小さくなるためです。一般的に遊離状態のイオンが水和する場合、その水和エンタルピー−EIIは、ほぼイオンの電荷zの二乗に比例し、イオン半径rに反比例する性質があります(1920年,ボルン)。
![]()
![]()
硫酸イオンSO42- は多原子イオンであり、そのイオン半径は約0.23 nmです。その一方で、硫酸イオンSO42-と沈殿を作るアルカリ土類金属イオンや鉛(II)イオンPb2+ のイオン半径は、いずれも約0.1 nm以上です。また、硫酸イオンSO42- とは水溶性の塩を作るマグネシウムイオンMg2+ や銅(II)イオンCu2+ のイオン半径は、いずれも約0.1 nm以下です。つまり、一般的にイオン半径の大きさが違うほど、−EIIは小さくなり、塩の溶解度は大きくなります。次の表.2を見ると、大まかに陽イオンの水和エンタルピーが−3,000 kJ/mol以下になると、水に可溶と見なすことができます。硫酸イオンSO42- が、アルカリ土類金属イオンや鉛(II)イオンPb2+ と沈殿を形成するのは、イオン半径の大きさの差が小さいからなのです。イオンの大きさが似たもの同士の組み合わせは、一般的に沈殿しやすい傾向にあります。
表.2 イオン半径と硫酸塩の水への溶解性
|
陽イオン |
イオン半径 |
水和エンタルピー |
硫酸塩の水への溶解性 |
|
Be2+ |
0.031 nm |
−8,850 kJ/mol |
可溶 |
|
Mg2+ |
0.065 nm |
−4,220 kJ/mol |
可溶 |
|
Ca2+ |
0.099 nm |
−2,770 kJ/mol |
難溶 |
|
Cu2+ |
0.087 nm |
−3,150 kJ/mol |
可溶 |
|
Sr2+ |
0.113 nm |
−2,430 kJ/mol |
難溶 |
|
Ba2+ |
0.135 nm |
−2,030 kJ/mol |
難溶 |
|
Pb2+ |
0.120 nm |
−2,290 kJ/mol |
難溶 |
[規則4] CO32-・SO32-・C2O42-・PO43-・CrO42- (多価の弱酸のイオン)の塩は、アルカリ金属イオンとNH4+ 以外とはほとんど沈殿する
・特にCrO42- についての覚え方・・・バ(Ba)ナナ(Pb)を(黄)銀貨(赤褐)で買うのに苦労(CrO42-)した
Ba2+ + CrO42- → BaCrO4↓(黄)
Pb2+ + CrO42- → PbCrO4↓(黄)
2Ag+ + CrO42- → Ag2CrO4↓(赤褐)
塩が水に溶けたとき、イオンにとっては、固体の中で身動きできない状態から、水中でかなり自由に動き回れるようになったのだから、自由になったという点からは、乱雑さ的に有利な反応です。その一方で、水分子にとっては、やってきたイオンの水和をするために、常にイオンの側にいなくてはならず、自由を失ったという点からは、乱雑さ的に不利な反応です。
このことは、実は非常に微妙な問題です。水分子にとっては、イオンと水和できるので、熱力学的にはかなり安定になります。そして、クーロン力による相互作用が大きいほど、熱力学的には安定化します。しかしながら、このとき一方では、自由の束縛が増えて、乱雑さ的に不安定になるのです。塩が溶解したときには、必ずこのように「水和によって熱力学的に安定になる寄与」と、「乱雑さ的に不安定になる寄与」が働いています。
さて、弱酸由来の陰イオンが、水溶液中に存在するときは、水H2Oと反応してもとの酸に戻る加水分解反応が起こります。そのため、水溶液の液性は、アルカリ性になりました。この現象をよく考察してみましょう。
CO32- + H2O → HCO3- + OH-
ところが、このように加水分解される陰イオンは、全体の中ではほんの少数です。残りの陰イオンは、周囲の水分子を強く引き付けて、水和されています。そこで、この水分子は、自由な動きを束縛されている訳であるから、陰イオンの存在は、乱雑さ的には水分子にとって邪魔な存在であり、陰イオンをその系から除外しようという働きが起こります。弱酸由来の陰イオン(特に多価の陰イオン)を含む塩の多くが沈殿するのは、水和によって熱力学的に安定化する寄与よりも、水和によって乱雑さ的に不安定化する寄与が上回り、結果として−EIIが大きくなって、イオンのまま溶解しているのが不安定になるからです。
CO32-aq + Ca2+aq → CaCO3↓(白) + aq (水の自由度増大)
CO32-aq + Ba2+aq → BaCO3↓(白) + aq (水の自由度増大)
[規則5] OH- とO2- の化合物(塩基と金属酸化物)は、イオン化傾向Mg以下の金属とはほとんど沈殿する
Al3+ + 3OH- → Al(OH)3↓(白)
Fe2+ + 2OH- → Fe(OH)2↓(淡緑)
Fe3+ + 3OH- → Fe(OH)3↓(赤褐)
金属Mの金属水酸化物M(OH)nや金属酸化物M2Onが水によく溶ける場合、溶液中には水酸化物イオンOH- が満ち溢れることになるので、液性は強塩基性になります。したがって、これらの溶解度の大小は、塩基性の強弱と対応しているのです。例えば、強塩基由来のアルカリ金属イオンやアルカリ土類金属イオンは、水酸化物イオンOH- や酸化物イオンO2- とは沈殿を作りにくいです。しかし、イオン化傾向でMg以上の金属では、ほとんどが沈殿を作ります。ただし、銀(I)イオンAg+ と水酸化物イオンOH- の反応では、生成する水酸化銀(I) AgOHは不安定なので、直ちに酸化銀(I) Ag2Oに分解します。
2Ag+ + 2OH- → Ag2O↓(暗褐) + H2O
[規則6] S2-と沈殿するか否かは、溶液の液性によって決まる
表.3 金属硫化物の溶解度はpHによって変化する
|
沈殿しない |
Li+、K+、Ca2+、Na+、Mg2+、※Al3+ |
|
中性〜塩基性で沈殿する |
Zn2+、Fe2+、Ni2+、(Mn2+) |
|
どんな液性でも沈殿する |
Sn2+、Pb2+、Cu2+、Hg2+、Ag+、(Cd2+) |
※ 塩基性条件ならAl2S3が加水分解して、Al(OH)3の白色沈殿を生じる

図.4 硫化物の沈殿
金属Mの金属硫化物MSについて、水溶液中で次のような溶解平衡があるとします。
MS(s) ⇄ M2+ + S2- ・・・(I)
一方で、硫化水素H2Sは、水溶液中で飽和していて、水溶液中で次のような平衡にあります。塩酸HClを加えて水溶液中の[H+]を増加させると、ル・シャトリエの法則より、この平衡が右に移動します。
S2- + 2H+ ⇄ H2S↑
そこで、硫化水素H2Sが生成して、水溶液中の[S2-]が減少するため、式(I)の平衡は右に移動し、金属硫化物MSの溶解度が大きくなります。つまり、強酸性中では、金属硫化物の溶解度は大きくなるのです。強酸性中では、硫化亜鉛ZnSや硫化鉄(II) FeS、硫化ニッケル(II) NiS、硫化マンガン(II) MnSは、ほとんど溶けて沈殿しません。ただし、硫化スズ(II) SnSや硫化銅(II) CuS、硫化水銀(II) HgS、硫化銀(I) Ag2S、硫化カドミウム(II) CdSは、強酸性中でも依然として溶解度が小さく、ほとんどが沈殿したままです。
例えば、0.1 mol/Lの銅(II)イオンCu2+ を含む水溶液と0.1 mol/Lの亜鉛イオンZn2+ を含む水溶液があり、それぞれともに塩酸HClを混ぜて、[H+]=1.0 mol/Lに調製されているとします。各水溶液に硫化水素H2Sを飽和させると、どちらに金属硫化物の沈殿が生じるでしょうか。硫化水素H2Sは2価の弱酸であり、水溶液中で次のように2段階に電離します。
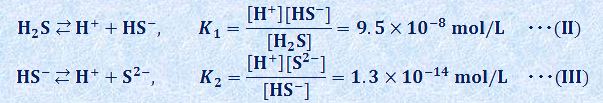
式(II)と(III)の各反応を組み合わせると、全体の反応は次の式(IV)のようになり、この反応平衡定数Kは、K1とK2を用いて、次のように表されます。
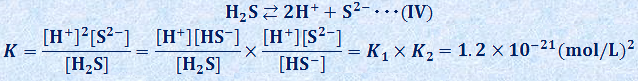
硫化水素H2Sの飽和水溶液では、[H2S]≒0.10 mol/Lであり、仮定より[H+]=1.0 mol/Lなので、水溶液の硫化物イオンの濃度[S2-]は、次式で求められます。
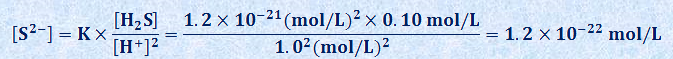
したがって、各水溶液では、次の関係が成り立ちます。
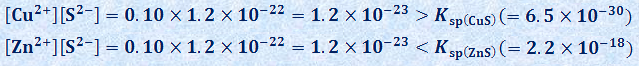
溶解度積Kspは、沈殿が生じているときに成り立つ値です。すなわち、金属イオンと硫化物イオンS2- の濃度の積の値が、溶解度積Kspの値を上回った場合に、余分なイオンが沈殿するのです。したがって、銅(II)イオンCu2+ を含む酸性水溶液では、硫化銅(II) CuSの黒色沈殿が生じ、亜鉛イオンZn2+ を含む酸性溶液では、金属硫化物の沈殿は生じません。このように、硫化スズ(II) SnSや硫化銅(II) CuS、硫化水銀(II) HgS、硫化銀(I) Ag2S、硫化カドミウム(II) CdSでは、溶解度積Kspの値が小さいので、水溶液の酸性が強くて硫化物イオンS2- の濃度が小さい場合でも、金属イオンと硫化物イオンS2- の濃度の積の値が溶解度積Kspの値を超えやすく、金属硫化物の沈殿が生じます。
(4) イオンや沈殿物の色
水溶液中でのイオンの色は、典型金属の場合と遷移金属の場合とで異なります。すなわち、典型金属を含むイオンは無色のものが多く、遷移金属を含むイオンは有色のものが多いです。遷移金属を含むイオンが有色になる理由は、遷移金属は電子が収容されているd軌道と空になっているd軌道をいくつか持ち、d軌道の電子遷移で吸収されるエネルギー(d−d遷移エネルギー)が、可視光領域に現れるからです。まず、遷移金属のイオンのまわりに、数個の配位子が結合してくると、配位子の電子軌道や静電場によって、同じエネルギー準位にあったd軌道は、不安定な高エネルギー準位と安定な低エネルギー準位の2組に分かれます。そして、電子はできるだけ安定な低エネルギー準位の軌道に収容されます。
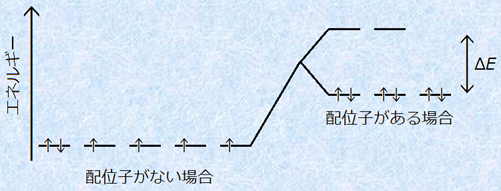
図.5 d軌道の電子遷移
この遷移金属を含むイオンに白色光を照射すると、特定の波長の光が吸収され、安定な低エネルギー準位にあったd軌道電子が、不安定な高エネルギー準位に励起されます。このとき、吸収された可視光の色の「補色(complementary color)」が、そのイオンの色になります。例えば、白色光から黄色の光を吸収されて除かれた場合は、見える色は、黄色の補色である青色になります。このように補色というものは、白色光からある色を除いたときに残る色のことをいいます(色の科学を参照)。
なお、励起されたd軌道電子は、再び低エネルギー準位に戻りますが、このときに放出されるエネルギーは、水H2Oなどが周囲で接触しているため、一般的に分子や原子の回転運動のエネルギーなどに使われ、発光スペクトルを作りません。したがって、イオンが何色に見えるのかということは、そのイオンがどの波長の光を吸収するのかということだけで、決定されます。次の表.4に、遷移元素を含むイオンの水中における色を示します。これらのイオンのほとんどは、水中では、水H2Oが配位しているアクア錯イオンになっています。
表.4 遷移元素を含むイオンの水中における色
|
6族 |
7族 |
8族 |
9族 |
10族 |
11族 |
|
[Cr(H2O)6]3+ (緑) CrO42- (黄) Cr2O72- (赤橙) |
[Mn(H2O)6]3+ (淡桃) MnO4- (赤紫) |
[Fe(H2O)6]2+ (淡緑) [Fe(H2O)6]3+ (黄褐) |
[Co(H2O)6]2+ (赤) [Co(H2O)6]3+ (濃青) |
[Ni(H2O)6]2+ (緑) |
[Cu(H2O)4]2+ (青) [Ag(H2O)2]+ (無色) |
さて、もしd軌道に電子が全くなかったら、当然励起される電子がないのだから、このようなことは起こりません。したがって、d軌道に電子を持っていないアルカリ金属やアルカリ土類金属、さらにアルミニウムイオンAl3+ などは、いずれも無色のイオンです。さらに、d軌道に電子が10個ある場合にも、軌道が満員なので励起が起こりません。そのため、銀イオンAg+ や亜鉛イオンZn2+ などの錯イオンも、すべて無色になります。
また、イオン結晶においても、陽イオンの周りには、何配位かで規則的に陰イオンが存在しており、これが陽イオンの最外殻にあるd軌道のエネルギーを分裂させます。したがって、水溶液中の陽イオンと同じような原理で、遷移金属のイオン結晶には有色なものが多く、典型金属のイオン結晶には無色のものが多いです。ただし、酸化物イオンO2-や硫化物イオンS2-、ヨウ化物イオンI- などを含むイオン結晶の場合、陰イオン中の電子が光を吸収して、電子が中心の陽イオンへ移動することがあり、その結果として、色を有することもあります。次の表.5に、主なイオン結晶(沈殿)の色を示します。
表.5 主なイオン結晶(沈殿)の色
|
ハロゲン化物 |
CaF2(白)、AgCl(白)、PbCl2(白)、AgBr(淡黄色)、AgI(黄) |
|
硫酸塩 |
CaSO4(白)、SrSO4(白)、BaSO4(白)、PbSO4(白) |
|
炭酸塩 |
CaCO3(白)、MgCO3(白)、BaCO3(白) |
|
水酸化物 |
Al(OH)3(白)、Fe(OH)2(淡緑)、Fe(OH)3(赤褐)、Cu(OH)2(青白) 、Cr(OH)3(灰緑)、Ni(OH)2(緑) |
|
酸化物 |
Al2O3(白)、ZnO(白)、MnO2(黒)、Ag2O(暗褐)、FeO(黒)、Fe2O3(赤褐)、Fe3O4(黒)、CuO(黒)、Cu2O(赤褐) |
|
クロム酸塩 |
BaCrO4(黄)、PbCrO4(黄)、Ag2CrO4(赤褐) |
|
硫化物 |
CuS(黒)、Ag2O(黒)、PbS(黒)、ZnS(白)、MnS(淡紅)、SnS(褐)、CdS(黄) |
・参考文献
1) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
2) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
3) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)