・天然高分子化合物(糖類)
【目次】
(1) 炭水化物とは何か?
「炭水化物(carbohydrate)」という学術用語は、これらの化合物の分子式が、炭素Cの水和物と見なして「Cn(H2O)m」で表示できるものが多いことに由来しています。例えば、グルコースは「C6H12O6」の分子式を持っていますが、これは「C6(H2O)6」というようにも表現できます。スクロースは「C12H22O11」の分子式を持っていますが、これは「C12(H2O)11」というようにも表現できます。このような分子式の表記法は、炭水化物を学ぶ上では、実はあまり役に立ちません。しかし、それでもこの古い名称が、未だに慣用的に使われています。
現在の定義によれば、炭水化物とは、分子中にアルデヒド基(-CHO)またはケトン基(-CO-)を1つと、ヒドロキシ基(-OH)を多数持つ化合物のことです。したがって、「炭水化物の化学」といえば、「ヒドロキシ基(-OH)とカルボニル基(-CO-)を同一分子内に持つ化合物の化学」ということになります。
炭水化物は、その構造によって、「単糖(monosaccharide)」・「オリゴ糖(oligosaccharide)」・「多糖(polysaccharide)」の3つに分類されます。「糖類(saccharide)」という言葉は、ラテン語で「糖」を意味する「saccharum」に由来します。単純な構造を持った炭水化物が、一般的に「甘味」を呈することが多いので、この名称があります。このように分類された3種類の炭水化物は、加水分解反応を中間に介して、互いに関連を持っています。
多糖 → オリゴ糖(二糖類や三糖類など) → 単糖
「単糖類」は、それ以上加水分解されない炭水化物のことです。「多糖類」は、極めて数多くの単糖単位で構成され、例外もありますが、同じ単糖単位だけで構成されているものが多いです。例えば、代表的な多糖類である「デンプン」と「セルロース」は、どちらもグルコース単位だけが多数つながった構造を持っています。「オリゴ糖類」は、一般的に2~20程度の単糖単位がつながったものです。結合している単糖単位の数によって、「二糖類(disaccharide)」や「三糖類(trisaccharide)」などと呼ばれることもあります。この場合、構成成分の単糖は、すべて同一のこともあるし、異なることもあります。例えば、二糖類の「マルトース」は、グルコース単位2つから構成されていますが、二糖類の「スクロース」は、グルコースとフルクトースという2つの異なる単糖が結合したものです。次の表.1に、糖類の分類とその例を示します。
表.1 糖類の分類とその例
|
分類 |
化合物の例 |
加水分解の性質 |
|
単糖類 |
グルコース(ブドウ糖) フルクトース(果糖) ガラクトース(脳糖) |
希硫酸を加えて熱しても加水分解されない |
|
二糖類 |
マルトース(麦芽糖) スクロース(ショ糖) ラクトース(乳糖) セロビオース |
希硫酸を加えて熱すると加水分解され、1分子の二糖類から2分子の単糖類を生じる |
|
多糖類 |
デンプン グリコーゲン デキストリン セルロース |
希硫酸を加えて熱すると加水分解され、1分子の多糖類から多数の単糖類を生じる |
(2) 単糖類
(i) グルコース
代表的な「単糖類」には、「グルコース(ブドウ糖)」・「フルクトース(果糖)」・「ガラクトース(脳糖)」などがあります。これらの分子式は、すべて「C6H12O6」で表すことができます。この中で、天然に最も広く分布しているのが、グルコースです。グルコースは、植物が光合成によって、二酸化炭素CO2と水H2Oから生合成する物質です。地球上の生物の体を作り、生きるためのエネルギーのもとになっている、最も基本となる有機化合物でもあります。グルコースが体内で代謝されると、アミノ酸や脂肪酸、核酸、タンパク質などの様々な生体成分に変換されます。生体内で余ったグルコースは、植物ではデンプンやセルロース、動物ではグリコーゲンなどに変換して貯蔵されます。
グルコースは、無色の結晶で爽やかな甘味があり、水によく溶けます。「グルコース(glucose)」の名は、ギリシア語で「甘い」を意味する「glykys」に由来します。これは、大阪市中央区の道頓堀にある看板「グリコポーズ」で有名な江崎グリコ株式会社の名前と同じ由来です。別名の「ブドウ糖」は、発見者であるドイツの化学者アンドレアス・マルクグラーフが、1747年に干しブドウの中からグルコースを発見したことに由来します。グルコースは、ブドウに多く含まれているため、その搾り汁に酵母を入れて、アルコール発酵させると、容易に「ブドウ酒」となります。

図.1 ブドウの甘味成分としては、グルコースとフルクトースがほぼ等量含まれている
グルコースは、人間を含めて、動物や植物が活動するためのエネルギー源となる、重要な物質の1つです。安静時、人間の肝臓では、毎時8 g程度のグルコースが産生され、消費を補うようになっています。そのうちの半分は、脳で消費されます。そのため、グルコースには脳の活性化や疲労回復に効果があるといわれています。グルコースは、糖類の中で最も吸収されやすく、小腸から直接吸収されるので、消化の必要がありません。すぐにエネルギー源として利用されるので、スポーツ選手がグルコースのトローチを舐めているのを目にすることがあります。
結晶中のグルコース分子は、炭素原子5個と酸素原子1個が、環状に結びついた6員環構造で存在し、「α -グルコース」と「β -グルコース」の2種類の立体異性体があります。水溶液中では、この2種類の他に少量の鎖状構造のグルコース分子も存在し、3種類の異性体が平衡状態にあります。鎖状構造のグルコース分子は、分子内にアルデヒド基(-CHO)を持ちます。そのため、水溶液は還元性を示し、フェーリング液を還元したり、銀鏡反応を示したりします(カルボニル化合物(アルデヒドとケトン)を参照)。ただし、結晶中のグルコースは、α -グルコースかβ -グルコースのどちらかになっているので、結晶状態では全く還元性を示しません。
結晶状態の「α型」あるいは「β型」のグルコースを水に溶かして水溶液にすると、鎖状型を経て、徐々にα型とβ型の「平衡混合物」になっていきます。ちなみに、α型とβ型では、甘味の強さが異なり、α型の方がβ型よりも1.5倍も甘いことが知られています。したがって、グルコースを溶かした直後の甘味度と、しばらく経ってからの甘味度を測定することで、結晶のグルコースが、α型とβ型のどちらであるのかが分かります。すなわち、溶かした直後の方が甘ければα型で、しばらくたってからの方が甘ければβ型です。
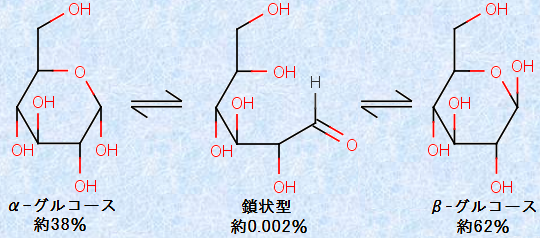
図.2 水溶液中のグルコース分子の構造変換
ちなみに、「糖尿病」になると、血液中のグルコース濃度(血糖値)が、正常な血糖値70~110 mg/dLの数倍以上になります。病名の由来は、近代的な医学検査法が生まれる前の時代、糖尿病の診断を下すのに、医師が患者の尿を舐めて、グルコースの有無を確かめていたことによります。糖尿病の原因は、膵臓のランゲルハンス島のβ細胞から分泌される「インスリン」というホルモンが、分泌されないことによります。インスリンは、血液中のグルコースを分解して濃度を下げる役割がありますが、インスリンの分泌量が少ないなどの理由でグルコースが分解されないと、筋肉や細胞に吸収されず、血液中にグルコースが残ってしまいます。
糖尿病は、主にI型とII型に分けられます。I型の糖尿病は、膵臓のランゲルハンス島でインスリンを分泌しているβ細胞が死滅する病気で、自分の免疫細胞が自らの肝臓を攻撃するために起こると考えられています。若年層で発病するのが特徴で、10万人に1.5人という珍しいケースです。一方で、II型の方が一般にいわれる糖尿病で、中高年層に多く発症し、運動不足や肥満、喫煙といった生活習慣が原因になります。インスリンの分泌低下と、インスリンの感受性低下の2つが発症因子とされています。日本人の糖尿病患者の9割以上が、II型の糖尿病です。
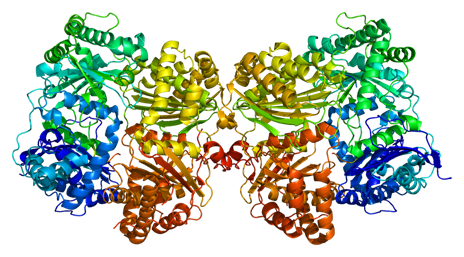
図.3 インスリンは、血液中のグルコースを取り込ませることによって、血糖値を下げる重要な役割を持つ
糖尿病になって血糖値が高くなる(空腹時で126 mg/dL以上)と、尿細管でのグルコースの再吸収が追い付かなくなります。すると、再吸収しきれなかったグルコースが、尿に混じって出てくるようになります。糖尿病が健康障害を引き起こす理由は、グルコース分子にあるアルデヒド基(-CHO)にあります。アルデヒド基(-CHO)は反応性が高いため、インスリンが上手く働かずに血糖値が高くなりすぎると、アルデヒド基(-CHO)が血管内皮のタンパク質と結合する「糖化反応」を起こしてしまうのです。人間の体の15%はタンパク質でできているので、高血糖の患者では、糖化反応を完全に防ぐことは不可能です。糖尿病が進行すると、体中の微小血管が徐々に破壊されていき、眼や腎臓を含む、体中の様々な臓器に重大な障害(糖尿病性神経障害・糖尿病性網膜症・糖尿病性腎症の微小血管障害)を及ぼす可能性が生じてきます。現在、先進国において、糖尿病は「10大疾病」となっており、他の国でも、その影響は増加しつつあります。2012年の全世界での糖尿病罹患率は8.3%であり、日本では5.1%です。
表.2 血糖値と大まかな症状
|
血糖値(mg/dL) |
症状 |
|
0 |
死亡 |
|
20 |
昏睡症状 |
|
30 |
意識障害 |
|
40 |
倦怠感、眠気、発汗、動悸 |
|
70~110 |
正常範囲 |
|
250 |
口渇、多尿、体重減少 |
|
800 |
意識障害 |
|
1,000 |
昏睡、死亡 |
(ii) フルクトース
「フルクトース」は、グルコースの構造異性体です。水溶性の無色の結晶であり、すべての糖の中で最も水によく溶けます。「フルクトース(fructose)」の名は、英語で「果物」を意味する「fruits」に由来し、名前の通り果物に多く含まれています。果物以外では、花の蜜に多く含まれるため、結果としてハチミツにも存在します。フルクトースは、質の良い甘味を呈し、しかもその甘味は、砂糖(スクロース)の1.2~1.7倍とされます。糖類の中では、特に甘味が強いです。フルクトースが、商業的に食品や飲料に使われる主な理由は、その強い甘味と低いコストにあるのです。
表.3 主な糖類の甘味度
|
糖類 |
甘味度※ |
|
スクロース |
1 |
|
グルコース |
0.64~0.74 |
|
フルクトース |
1.15~1.73 |
|
ガラクトース |
0.32 |
|
ラクトース |
0.2 |
|
イソマルトース |
0.4 |
|
ソルビトール |
0.5~0.7 |
|
キシリトール |
0.65~1 |
|
マンニトール |
0.5 |
※ スクロースを1としたときの甘味度
結晶中のフルクトース分子は、6員環の環状構造をしています。しかし、水溶液中では、ケトン基(-CO-)を持つ鎖状構造や、5員環の環状構造と平衡状態にあります。また、よく果実は冷やすと甘味が増すといいますが、これには化学的な理由があります。フルクトースの場合、「β型」の方が「α型」よりも3倍も甘味が強いのです。フルクトースは、温度変化によるα型とβ型の平衡移動の割合が大きく、温度が低いほど、甘味の強いβ型の割合が大きくなります。例えば、5℃ではスクロースの1.5倍程度の甘味を示しますが、60℃ではスクロースの0.8倍程度にまで甘味が低下します。そのため、フルクトースを多く含む果実やジュースの場合、冷やして食べることで甘味を強く感じます。
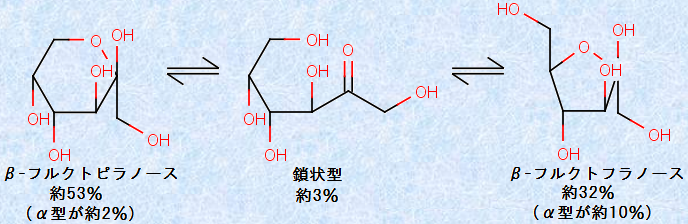
図.4 水溶液中のフルクトース分子の構造変換
フルクトースには、鎖状型構造にアルデヒド基(-CHO)がないので、還元作用を示さないように思えます。しかし、塩基性水溶液中では、鎖状型は次の図.5のような平衡状態にあり、結果としてアルデヒド基(-CHO)を形成することができるので、還元作用を示します。この異性化反応を、「ロブリー・ド・ブリュイン-ファン・エッケンシュタイン転位(Lobry de Bruyn–van Ekenstein transformation)」といいます。反応は複雑に見えますが、実は「ケト-エノール互変異性」の応用に過ぎません(有機反応機構(カルボニル化合物におけるα位の反応)を参照)。すなわち、ケト型のフルクトース(図.5左)が、ケト-エノール互変異性によりエノール型(図.5中央)になり、末端のヒドロキシ基(-OH)が水素イオンH+ を失って、別のケト型(図.5右)になることで、アルデヒド基(-CHO)が形成されるのです。
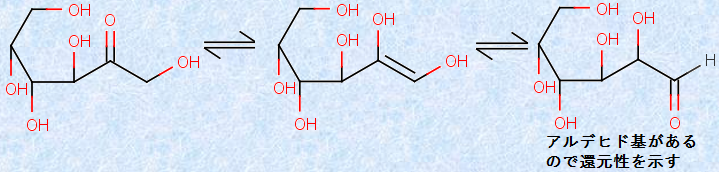
図.5 鎖状型フルクトースのロブリー・ド・ブリュイン-ファン・エッケンシュタイン転位
なお、一般的には「塩基性水溶液中でフルクトースには還元性がある」といわれています。しかし、フルクトースが異性化してアルデヒド基(-CHO)を持つ化合物になるとき、グルコースの鎖状型と全く同じ構造を取ることもあるのです。つまり、塩基性水溶液中では、フルクトースとグルコースは、平衡関係にあるともいえます。
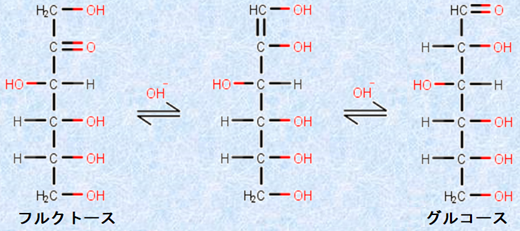
図.6 フルクトースとグルコースは、塩基性水溶液中で平衡関係にある
グルコースやフルクトースのような単糖類は、酵母が分泌する「チマーゼ」という酵素の働きによる「アルコール発酵(alcohol fermentation)」で、エタノールC2H5OHと二酸化炭素CO2になります。この反応を利用して、グルコースやフルクトースから、清酒やビールなどのアルコール飲料が生産されています。なお、人為的に作る酒の発祥は、「口噛み酒」であるといわれています。デンプンを含む食物を口に入れて噛むことで、唾液に含まれる酵素「アミラーゼ」が、デンプンをグルコースに加水分解します。それを吐き出して溜めておくと、野生酵母がグルコースを発酵して、アルコールを生成するという訳です。日本では、口噛み酒は神事の際に作られていたといい、原料を口で噛む人間としては、若い巫女や処女が選ばれていたといいます。2016年に公開された新海誠監督の映画「君の名は。」では、口噛み酒が物語の重要要素になっていました。
C6H12O6 → 2C2H5OH + 2CO2
また、世の中には珍しい病気があり、「ビール自動醸造症候群(Beer automatic brewing syndrome)」という症状があります。2015年、ニューヨーク市バッファローで、警察官がある女性を飲酒運転の疑いで逮捕しました。逮捕された女性は呂律が回らず、酒臭い上に、道路をフラフラと運転していたのだから、警察官として当然の行為でした。血液中のアルコール濃度は、法律で認められる濃度の4倍を超えていました。しかし、女性は裁判で無罪となりました。女性は酵母に感染しており、「体内でアルコールが勝手に作られてしまう」体質だったからです。「ビール自動醸造症候群」というこの症状は、パンやパスタなどの炭水化物を摂取すると、腸内で勝手にアルコール発酵が起こり、飲酒しなくても酷い二日酔いに悩まされることになります。驚いたことに、彼女がこの症状を発症したのは、ほんの数日前のことで、弁護士の調査で明らかになるまで、本人はこの病気に全く気が付いていませんでした。日本でも、このような症例がいくつか報告されており、抗生物質を服用して腸内細菌が死滅したあとにビールを飲んだりすると、酵母が腸内に定着して増殖することが稀にあるようです。

図.7 ビール自動醸造症候群に罹患すると、腸の中がビール醸造所のようになってしまう
アルコール発酵により発生する二酸化炭素CO2を、上手く利用した例もあります。蚊が呼気に含まれる二酸化炭素CO2に集まる習性を利用し、ペットボトルを加工した容器にブラウンシュガー、熱水、イースト菌を入れ、人間がいない場所で二酸化炭素CO2を発生させるのです。すると、蚊がそのペットボトルにおびき寄せられ、感染病の媒介となる蚊を集めることができます。この「蚊取りペットボトル」の効果は絶大で、フィリピンでは蚊取りペットボトルを利用した年から、デング熱感染が前年より55%も減少したといいます。
(iii) ガラクトース
「ガラクトース」は、グルコースの立体異性体です。乳製品やサトウダイコンなどに見出される他、ヒトの体内でも合成され、各組織で糖脂質や糖タンパク質の一部を形成しています。乳幼児の脳の成長に必須の成分といわれており、「脳糖」の別名があります。エネルギーとなる単糖でもあり、栄養性の甘味料であると考えられています。ただし、甘味はそれほど強くなく、砂糖の1/3程度とされています。水溶液中では、「α型」と「β型」の環状構造、および還元性を示す「鎖状型」と平衡状態にあります。
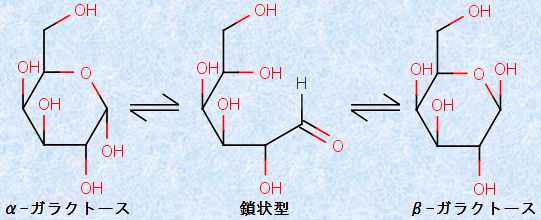
図.8 水溶液中のガラクトース分子の構造変換
「寒天」は、ガラクトースとアンヒドロガラクトースが多数結合してできた多糖類です。寒天の見た目は、ゼラチンとよく似ていますが、化学的には全く異なる物質です。寒天が「多糖類」であるのに対して、ゼラチンは「タンパク質」だからです。ゼラチンは、コラーゲンなどのタンパク質を主成分とするため、調理の際には特別な注意が必要になる場合があります。例えば、パイナップルやキウイフルーツには、タンパク質分解酵素である「プロテアーゼ」が大量に含まれています。そのため、多糖類からなる寒天にパイナップルやキウイフルーツを閉じ込めることは問題なくできるのに対し、ゼラチンにこれらの果物を閉じ込めることはできません。タンパク質であるゼラチンは、これらの果物に含まれるプロテアーゼによって加水分解されるため、上手く固まらなくなるのです。

図.9 寒天は、ガラクトースとアンヒドロガラクトースが多数結合してできた多糖類である。
(3) 二糖類
「オリゴ糖」は、一般的に2~20程度の単糖単位がつながったものです。最も一般的なオリゴ糖は、「二糖類」です。代表的な二糖類には、「マルトース(麦芽糖)」・「スクロース(ショ糖)」・「ラクトース(乳糖)」・「セロビオース」などがあります。これらの分子式は、いずれも「C12H22O11」で表すことができます。二糖類の分子は、2分子の単糖類分子「C6H12O6」から、水H2Oが1分子取れて縮合した構造(C6H12O6+C6H12O6-H2O=C12H22O11)を持ち、加水分解により、2分子の単糖類を生じます。また、二糖類に見られる単糖類分子同士のエーテル結合(-O-)を、特に「グリコシド結合(glycosidic bond)」といいます。グリコシド結合は、エーテル結合と同様の構造を持っていますが、普通のエーテル結合に比べて反応性が高く、加水分解されやすい特徴を持ちます。
表.4 主な二糖類の構造とその性質
|
名称 |
構成単糖類 |
還元性 |
加水分解酵素 |
所在 |
|
マルトース (麦芽糖) |
α -グルコース グルコース |
あり |
マルターゼ |
水飴 |
|
スクロース (ショ糖) |
α -グルコース β -フルクトース |
なし |
インベルターゼ スクラーゼ |
砂糖 サトウキビ |
|
ラクトース (乳糖) |
β -ガラクトース グルコース |
あり |
ラクターゼ |
牛乳 |
|
セロビオース |
β -グルコース グルコース |
あり |
セロビアーゼ |
マツ葉 |
(i) マルトース
「マルトース」は、デンプンを酵素「アミラーゼ」で加水分解すると生じます。そして、このマルトースをさらに酵素「マルターゼ」で加水分解すると、グルコースだけが得られます。次の図.10のように、マルトースは、グルコース単位2つが結合した構造です。左側の糖単位のC-1位に結合したヒドロキシ基(-OH)と、右側の糖単位のC-4位に結合したヒドロキシ基(-OH)が脱水縮合すると、マルトースの構造になります。
図.10で示したマルトースの左側の糖単位の立体配置はα型です。また、この図では、右側の糖単位の立体配置もα型になっています。基本的には、「2分子のα-グルコースが脱水縮合すると生成する構造」を持つと考えればよいでしょう。しかし、水溶液中では、右側の糖単位のα型の立体配置は、β型や鎖状型と平衡状態にあるので、マルトースの水溶液は還元性を示します。
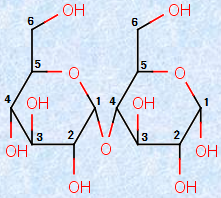
図.10 マルトース分子の構造式
2(C6H10O5)n + nH2O → nC12H22O11
C12H22O11 + H2O → 2C6H12O6
(ii) スクロース
二糖類の中で最も重要なのは、砂糖の主成分である「スクロース」です。世界で毎年10億t以上が生産されています。今でこそ砂糖は安価な甘味料ですが、昔は非常に貴重なものであり、中世のヨーロッパでは、高価な香辛料であったコショウよりさらに高値で取引されていました。日本語では「ショ糖」と呼びますが、昔は「蔗糖」と書きました。これは、イネ科のサトウキビの別名である「甘蔗」から得られる糖という意味を持たせたものです。
スクロースは、すべての光合成植物中に存在し、その植物のエネルギー源として働いています。スクロースは、熱帯ではサトウキビの茎から、温帯ではサトウダイコン(テンサイ)の根から抽出し、その搾り汁の14~20%がスクロースです。サトウキビの原産地については諸説あり、南太平洋あるいはインド南部と考えられています。砂糖が作られたのは2,000年以上も前と推測されており、その栽培はアジア、中東を経て、北アフリカからスペインに広がりました。サトウキビが日本で栽培されるようになったのは、江戸時代からといわれています。一説によると、1726年に八代将軍徳川吉宗が、薩摩藩の支配下にあった琉球からサトウキビの苗を取り寄せ、諸藩に精糖を奨励したといいます。

図.11 サトウキビは砂糖の原料となる農作物である
現在では、サトウキビは広く世界中の熱帯・亜熱帯気候の地域で栽培されており、その栽培量は年間で12億tにも達します。米(7憶t)と小麦(5億t)の生産量の合計と同じくらいといえば、その栽培量の多さが分かるでしょう。食用の農作物としては、最も多く栽培されている植物です(2位のトウモロコシは10億t)。いかに人類が甘味を求めているのかが分かります。
砂糖を製造するには、まずサトウキビの搾り汁から、不純物として含まれている有機酸、タンパク質、ペクチン、繊維などを除きます。そして、これを濃縮すると、砂糖の元になる結晶が析出します。この操作によって得られた結晶と液体の混合物を、「白下(しらした)」といいます。この白下から、「分蜜糖」という結晶を分離した残りが「糖蜜」です。糖蜜を含んだままの砂糖が、いわゆる「黒砂糖」になります。黒砂糖は、成分である糖分の他にカリウム、鉄、カルシウム、亜鉛などのミネラル成分を多く含み、特有の香味を持ちます。そして、分蜜糖をさらに精製して結晶化させたものが、私たちがよく見る「砂糖」です。砂糖はまた、「ザラメ糖」・「グラニュー糖」・「粉砂糖(グラニュー糖を粉砕したもの)」のように、結晶の大きさの違いによってさらに区分されます。「氷砂糖」は、白ザラメ糖やグラニュー糖などを原料とし、溶かした糖液を45~70℃において、2週間以上もかけて大きな結晶としたものです。氷砂糖は、いわば純粋な砂糖の巨大結晶であり、梅酒などの果実酒を作るときによく使われます。
表.5 様々な砂糖の名称と分類
|
名称 |
上白糖 |
グラニュー糖 |
三温糖 |
粉砂糖 |
氷砂糖 |
黒砂糖 |
|
色 |
無色透明 |
無色透明 |
黄褐色 |
無色透明 |
無色透明 |
褐色 |
|
質感 |
粒が小さく しっとり |
粒がやや小さく サラサラ |
粒が小さく しっとり |
最も粒が小さく サラサラ |
大きな結晶 |
大きな塊 (または小さな粒) |
|
精製度 |
★★★★☆ |
★★★★★ |
★★★☆☆ |
★★★★★ |
★★★★★ |
★★☆☆☆ |
|
味 |
クセがない |
すっきり |
コクがある |
すっきり |
上品 |
濃厚で独特なコク |
|
用途 |
料理や製菓 |
コーヒーや紅茶 |
煮物や佃煮 |
菓子 |
果実酒 |
かりんとう |
ところで、梅酒作りになぜ氷砂糖を使うのかというと、これには化学的な理由があります。わざと溶けにくい氷砂糖を使うことによって、梅の果実の周りを取り巻く溶液の濃度を、急激に高めないようにする工夫です。梅の風味が強い梅酒を作るためには、アルコールが梅の果実に浸透して、十分に時間が経ってアルコールに梅の風味が移ったあと、そのアルコールが外に出る来るようにする必要があります。氷砂糖が溶ける前は、梅の果実内部の浸透圧の方が高いため、アルコールが果実の中に浸透してきます。そして、時間が経過して氷砂糖が溶けると、今度は梅の果実外部の浸透圧の方が高くなるため、梅の風味を含んだアルコールが外に出てくるようになります。しかし、ここでグラニュー糖や粉砂糖などの溶けやすいものを使ってしまうと、溶液の浸透圧がすぐに高くなって、梅の果実に十分アルコールが浸透するよりも早く、内部の水分が搾り出されてしまい、梅の風味が出てこないのです。

図.12 氷砂糖を使わないと、おいしい梅酒が作れない
スクロースを希酸、または酵素「インベルターゼ」や酵素「スクラーゼ」で加水分解すると、グルコースとフルクトースの等量混合物になります。2つの酵素の違いは、インベルターゼはフルクトース側から働くのに対して、スクラーゼはグルコース側から働くという点にあります。その他、インベルターゼはスクロース以外にも何種類かのオリゴ糖(ラフィノースやスタキオースなど)を加水分解できるのに対し、スクラーゼはスクロースにしか働かないという違いがあります。また、ヒトの腸液にはスクラーゼが含まれていますが、インベルターゼは分泌されません。
スクロースでは、それぞれが還元性を示す構造を作るα -グルコースのC-1位に結合したヒドロキシ基(-OH)と、β -フルクトースのC-2位に結合したヒドロキシ基(-OH)とが、どちらも結合に使われています。そのため、水溶液中で開環型との間の平衡は存在せず、還元性を示しません。この点が、他の二糖類とは明白に異なっています。
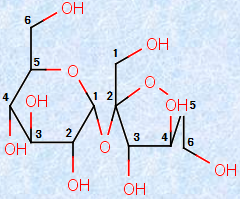
図.13 スクロース分子の構造式
スクロースの「旋光度」は、+66.5°です。ところが、スクロースを加水分解して、グルコースとフルクトースの等量混合物にすると、比旋光度は数値のみならず符号も変わって、-19.9°に変化します。その理由は、グルコースの旋光度が+52.7°であるのに対して、フルクトースの旋光度が-92.4°という負の値を持っているからです。つまり、旋光性は「右旋性」から「左旋性」に転じます。そこで、この混合物を「転化糖(invert sugar)」と呼んでいます。
ハチミツの主成分が、この転化糖であることはよく知られています。それは、ハチが集めてくる天然の花の蜜に含まれるスクロースが、ミツバチの分泌液中のインベルターゼによって加水分解を受けて、転化するために生じるのです。転化糖は、その成分としてグルコースやフルクトースを含んでいるので、還元性を示します。また、フルクトースを含んでいるため、もとのスクロースよりも甘味が強く、甘味剤として用いられます。特に菓子に用いると、吸湿性があるので結晶化が妨げられ、食感を保持することができます。
ハチミツは、人類が古くから利用した甘味料であったと考えられています。その証拠は、今から約9,000年も前の旧石器時代のものと思われるスペインのビコルプ付近の「ラ・アラーニャ洞穴」の岩壁画に、明らかにハチの巣からハチミツを採っていると思われる女性の姿が描かれていることです。サトウキビから砂糖を採るよりはるか昔から、ハチミツは甘味料や薬として用いられ、あるいは発酵させたハチミツは、酒としても役立っていました。

図.14 スペインのラ・アラーニャ洞穴の岩壁に描かれている、ハチミツを採っている女性の絵
ちなみに、一般的に家庭でよく使う砂糖は「上白糖」ですが、上白糖には、スクロースの他に転化糖が2~3%含まれています。一方で、グラニュー糖や氷砂糖は、その成分のほとんどがスクロースです。したがって、上白糖とグラニュー糖を舐め比べると、転化糖を含む上白糖の方が強く甘味を感じるはずです。また、転化糖は水分を保持しているので、上白糖はグラニュー糖と比べるとしっとりとしています。
また、日本独自の砂糖に、香川県や徳島県などの四国東部で伝統的に生産されている「和三盆」というものがあります。和三盆は、サトウキビの樹液から、伝統的な職人技で分離することで作られ、スクロースの他にも、不純物として様々なうま味成分が入っているとされます。どのような成分が含まれているのかは、あまり詳しく分かっていませんが、各種のミネラルや糖類、あるいはアミノ酸などが含まれているのではないかと考えられています。和三盆は、甘さがくどくなく後味も良いため、和菓子の高級材料として使用されています。

図.15 和三盆は、黒砂糖をまろやかにしたような独特の風味を持ち、高級砂糖として扱われている
(iii) セロビオース
「セロビオース」は、セルロースを酵素「セルラーゼ」で加水分解すると生じます。甘味はほとんどなく、自然界では松葉に少量含まれている以外、遊離状態ではほとんど存在していません。セロビオースはマルトースの立体異性体で、酵素「セロビアーゼ」で加水分解すると、グルコースだけが得られます。マルトースと異なる点は、左側のグルコース単位のC-1位が、β配置を持っていることです。それ以外は、すべてマルトースの構造と同じです。
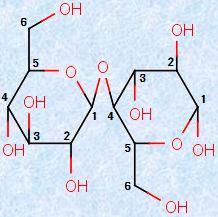
図.16 セロビオース分子の構造式
(iv) トレハロース
「トレハロース」は、自然界の多くの動植物や微生物中に存在する二糖です。中国語で「海藻糖」と書かれるように、海藻類にも含まれています。動物では、エビや昆虫類に特に多く含まれています。還元性を示さない二糖としては、スクロースがよく知られていますが、トレハロースも還元性を示さない二糖です。トレハロースを加水分解すると、2分子のグルコースが得られますが、グルコースの還元基同士が縮合した構造を持つため、トレハロースは還元性を示しません。
トレハロースは、スクロースの0.5倍程度の甘味を持ちます。砂糖の代わりにトレハロースを用いると、甘味が抑えられるので、「上品な甘味」という表現が使われます。スクロースの約2倍の水分を保持できる性質があるので、和菓子を中心に麺類やご飯、パンなどの軟らかさを保ち、デンプンがパサパサになるのを防ぐ目的で広く利用されています。ご飯を炊くときの水に2%程度のトレハロースを加えておくと、冷たくなってもご飯が硬くなりにくくなります。
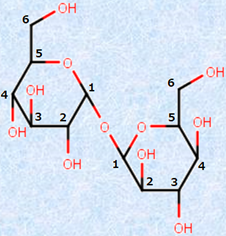
図.17 トレハロース分子の構造式
バッタや蝶、ハチなど多くの昆虫の血糖はトレハロースであり、酵素「トレハラーゼ」でグルコースに加水分解して利用しています。トレハロースは、還元性を示すアルデヒド基(-CHO)を持たないので、タンパク質に対する糖化反応が起こりにくく、グルコースに比べて有害性が低いです。そのため、昆虫で血糖として存在するトレハロース濃度は400~3,000 mg/dLと、ヒトで血糖として存在するグルコース濃度70~110 mg/dLに比べて、はるかに高い値となっています。
「不死身の生き物」などと呼ばれることもある緩歩動物のクマムシは、土の中や落ち葉だまりなどに生息している体長が数mmほどの小さな生物です。クマムシは乾燥に非常に強く、乾燥状態になると、体内のグルコースをトレハロースに変えて乾眠します。この状態になると、120℃以上の高温や-250℃以下の低温にも耐え、ヒトの致死量の1,000倍以上の放射線を浴びても死にません。そして、適温に戻してから水分を与えれば、再び動き回るようになります。このような完全な乾燥状態になっても、死に至ることなく復活できる性質を「クリプトビオシス(cryptobiosis)」といいます。

図.18 クマムシは乾燥状態になると、体内のグルコースをトレハロースに変えて、極限状態に備える
クマムシの他にも、ネムリユスリカの幼虫やミジンコの耐久卵なども、細胞内にトレハロースを蓄えることで、乾燥状態に耐えられるようになっていると考えられています。植物においても、砂漠や山岳地帯に生えているイワヒバは、トレハロースを有することで、乾燥してカラカラになっていても、雨が降ると青々と復活するため、「復活草」とも呼ばれています。また、干しシイタケが水でよく戻るのも、トレハロースを多く含有しているからです。トレハロース水溶液は、水分が失われて高濃度になると、流動性を失ってガラス化しやすい性質を持ち、生体成分の運動性を低下させて、その変性を防止しているものと考えられます。
(4) 多糖類
「多糖類」には、「デンプン」・「グリコーゲン」・「セルロース」などがあり、これらの分子式は、すべて「(C6H10O5)n」で表されます。このうち、デンプンとセルロースは主に植物中に存在する多糖で、グリコーゲンは主に動物中に存在する多糖です。
(i) デンプン
植物は、光合成によりグルコースを合成します。しかし、グルコースは水溶性が高いので、そのままでは雨などで流れてしまって、貯蔵には不向きです。そのため、植物はグルコース同士を結合させ、水溶性の低い「デンプン」の形にすることで、グルコースを貯蔵しています。穀類やイモ類、トウモロコシ、米などの主成分はデンプンであり、これは「植物がグルコースを貯蔵する形態」と考えても構いません。
デンプンの分子量は、数万~数百万にも及びます。デンプン分子は、数百~数万個のα -グルコース分子が、繰り返し縮合した構造をしています。デンプンでは、還元性を示す部分が末端のみであり、分子量に対して還元性を示す部分の比率が小さすぎるので、一般に還元性はないと考えます。デンプン粒は、冷水には溶けにくいのですが、80℃の熱水に浸けておくと、溶性部分と不溶性部分に分けることができます。溶性部分は、分子量が104~105程度と比較的小さく、直鎖状構造を持つ分子でできており、これを「アミロース(amylose)」といいます。アミロースは、α -グルコースの1,4位のヒドロキシ基(-OH)が縮重合した綿状高分子です。
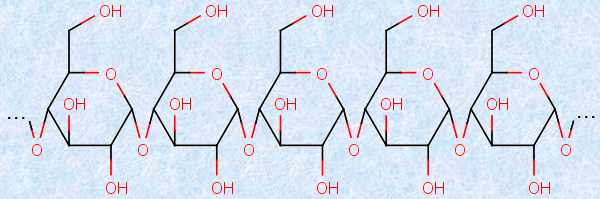
図.19 アミロース分子の構造式
一方で、不溶性部分は、分子量が105~106程度と比較的大きく、分岐の多い構造を持つ分子でできており、これを「アミロペクチン(amylopectin)」といいます。アミロペクチンは、アミロースと同様の1,4-結合の他、1,6-結合でも連結されています。デンプンが水中で完全に溶けず、膨潤してコロイドになるのは、この分岐構造が原因となっています。一般的なうるち米には、アミロースがだいたい20~25%含まれ、残りの75~80%はアミロペクチンです。一方でもち米では、ほぼ100%がアミロペクチンです。
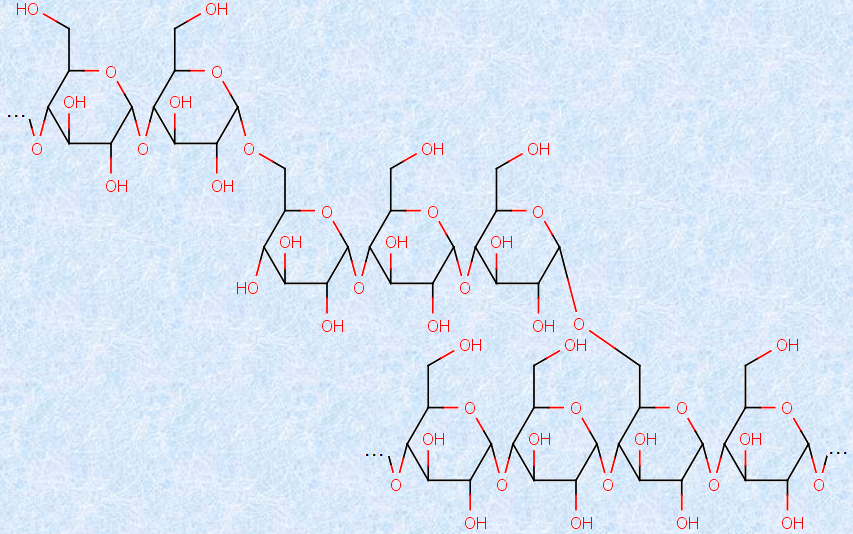
図.20 アミロペクチン分子の構造式
デンプンはヨウ素液と反応すると、青~青紫色になります。この呈色反応を、「ヨウ素デンプン反応(iodine-starch reaction)」といいます。ヨウ素デンプン反応が起こるのは、ヨウ素I2がデンプンのらせん構造の内部に入り込むからです。デンプン中の多くのヒドロキシ基(-OH)は、らせんの外側を向いており、らせんの内側は疎水的です。そのため、無極性分子であるヨウ素I2は、らせんの内側に取り込まれやすくなります。そして、デンプンからヨウ素I2へと電荷の移動が起こって、「電荷移動錯体(charge transfer complex)」を作ると、可視光領域に新しい吸収帯を生じて呈色します。
このときに何色に呈色するのかは、らせん構造の長さによって決まります。らせん構造が長くなるにつれ、可視光の吸収は長波長側にずれ、呈色が薄赤色→赤色→赤紫色→青紫色→青色へと変化していきます。例えば、アミロースでは、らせん構造が長いので濃青色を呈しますが、アミロペクチンでは、枝分かれが多いためにらせん構造が短くなり、赤紫色を呈します。ちなみに、らせん構造が二巻き以下(重合度12以下)になると、呈色しなくなることがあり、一巻き以下(重合度6以下)では呈色しなくなります。この色の変化から、加水分解の進行状況を知ることもできます。

図.21 デンプンからヨウ素I2へ電荷の移動が起こり、ヨウ素デンプン反応が起こる
デンプンを希酸や酵素「アミラーゼ」で加水分解していくと、まずは比較的分子量の小さい「デキストリン(C6H10O5)n’」が生成します。デキストリンは、分類上は多糖類に分類されますが、分子量的にはデンプンとマルトースの中間にあたります。分子量が小さい分、デキストリンはデンプンより水に溶けやすいです。デキストリンは、生体内では酵素アミラーゼによって、さらにマルトースにまで分解され、最終的にはグルコースになります。しかし、一部アミラーゼによって加水分解しにくい成分があり、これを精製して得られる「難消化性デキストリン」は、整腸作用と食後血糖上昇抑制作用があることが報告されています。
デンプン(C6H10O5)n → デキストリン(C6H10O5)n’ → マルトースC12H22O11 → グルコースC6H12O6
また、炭水化物の消化に関わるアミラーゼを合成する遺伝子は、日本人や中国人のように、米のご飯をたくさん食べている民族に特に多いことが分かっています。これには、「遺伝子重複(gene duplication)」と呼ばれる現象が関わっており、炭水化物を多く摂取する食習慣がある人々の間では、アミラーゼ遺伝子の数の増加が見られるのです。遺伝子が重複すると、単一の遺伝子よりも早く経代に伴う変異が蓄積されるため、遺伝子重複は、進化の主要な役目を担っていると考えられています。アミラーゼ遺伝子の多い日本人や中国人は、他の人種と比べて、炭水化物で太りにくい体質になっています。
(ii) グリコーゲン
「グリコーゲン」は、「動物デンプン」とも呼ばれ、動物が体内でグルコースを貯蔵する形態です。消化したグルコースが腸から吸収され、血液によって肝臓や筋肉に運ばれたあと、酵素の働きでグルコースが重合すると、グリコーゲンになります。ヒトの肝臓には約100 g、全身の筋肉には約200 gのグリコーゲンが蓄えられており、これは約半日分の活動に要するエネルギー(約1,200 kcal)に相当します。
体内におけるグリコーゲンの役割は、食物から摂取した過剰量のグルコースを除去することです。グルコースは体に必要な栄養源ですが、そのまま体内に放置すると、タンパク質との糖化反応が起こって有害です。そのため、不要なグルコースは除去する必要があります。また、グリコーゲンを加水分解してグルコースにするのは容易なので、あとになって細胞がエネルギーを必要とするときに、供給源となる働きもすることができます。グリコーゲンがこのような役割を果たすことで、血液中のグルコース濃度は、ほぼ一定の0.1%に保たれています。グリコーゲンの構造や分子量は、アミロペクチンとよく似ていますが、末端から加水分解しやすいように分岐がさらに多くなっており、ヨウ素デンプン反応は赤褐色を呈します。
(iii) セルロース
「セルロース」は、β -グルコースの1,4位のヒドロキシ基(-OH)が縮重合した、分岐のない鎖状高分子です。その分子量は、数百万~数千万にも達します。β -グルコースの分子構造は板状に近く、このβ -グルコース単位が表裏表裏・・・・・・とその向きを交互に逆にして、連結した構造になっています。さらに、隣り合った分子鎖が、ヒドロキシ基(-OH)間で水素結合を形成するため、分子同士が強く結びついた非常に硬い繊維状物質を作ります。そのため、セルロースは、熱湯やその他有機溶媒にも溶けにくく、化学的に安定で、ヨウ素とも呈色反応を起こしません。
植物の乾燥質量の30~50%はセルロースで、植物の細胞壁や、その他植物の骨格となる所に使われています。このため、セルロースはこの地球上において、最も大量に存在する有機化合物であり、世界の植物たちによって、年間2,000億tが作り出されるといわれています。身近なところでは、麻や木綿などの布は、ほぼ純粋なセルロースです。いわゆる食物繊維も、大半はセルロースであるし、医薬の錠剤にもセルロースが利用されます。細菌にもセルロースを生産するものがあり、例えば、ナタ・デ・ココは酢酸菌の作り出したゲル状セルロースです。
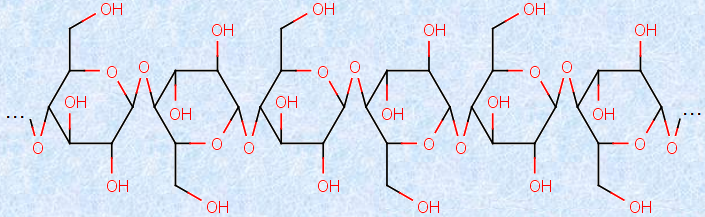
図.22 セルロース分子の構造式
ヒトや動物は、α -グルコースからなるデンプンやグリコーゲンを消化できますが、β -グルコースからなるセルロースは消化できません。このことは、生化学反応の特異性を明瞭に示す良い例です。デンプンとセルロースの唯一の化学的相違点は、グルコース単位のC-1位における立体化学の違いだけです。ヒトの消化器官には、α -グルコシド結合の加水分解を触媒する酵素だけが存在し、β -グルコシド結合の加水分解に必要な酵素を欠いています。ところが、自然界にはβ -グルコシド結合を加水分解できる酵素を持ったバクテリアが、数多く存在します。例えば、シリアリはこのようなバクテリアの一種を腸管内に宿しているため、セルロースを豊富に含む木材を主食として繁殖します。牛や山羊のような反芻動物も、複数の連続した胃の中に消化に必要な微生物を繁殖させているため、草などのセルロース源を消化できる訳です。

図.23 シロアリのセルロース分解能が、バイオマスエタノールの製造に役立つことが期待され、研究が進められている
ちなみに、布団を干したときの「お日様の匂い」は、以前は「ダニの死骸」から発せられる匂いだと思われていましたが、今では誤りであるということが分かっています。カネボウ化粧品の研究によると、この「お日様の匂い」は、布団の綿などの繊維が太陽光によって分解されることにより発生することが明らかになっています。繊維を構成するセルロースの一部が、太陽光に含まれる紫外線によって分解して、脂肪酸やアルデヒドなどの揮発性物質になります。この脂肪酸やアルデヒドの匂いが混ざり合うことで、独特なあの「お日様の匂い」が作り出されるのです。実験では、ダニが存在しない環境下においても、「お日様の匂い」が確認されることから、ダニの死骸が匂いと無関係であることが実証されたといいます。
(iii-1) 酢酸セルロース
セルロースは、数多くの重要な工業製品の原料として利用されています。セルロースのグルコース単位には、ヒドロキシ基(-OH)が3つ残っています。そこで、アルコールと反応する様々な試薬を用いることで、セルロースのヒドロキシ基(-OH)を化学的に変換することができます。例えば、セルロースを無水酢酸(CH3CO)2Oと反応させて、「酢酸セルロース」が製造されています。「アセテート繊維 (アセテートレーヨン)」の材料は、セルロースのヒドロキシ基(-OH)の約97%をアセチル化して、アセトキシ基(-OCOCH3)としたものです。酢酸セルロースは、写真フィルムや液晶ディスプレイにも使われています。
[C6H7O2(OH)3]n + 3n(CH3CO)2O → [C6H7O2(OCOCH3)3]n + 3nCH3COOH
トリアセチルセルロースは、溶媒に溶けにくいのですが、エステル結合の一部を穏やかに加水分解して、ジアセチルセルロース[C6H7O2(OH)(OCOCH3)2]nにすると、アセトンなどの極性溶媒に溶けるようになります。このアセトン溶液を細孔から空気中に噴射して、熱風を用いて乾燥させることで、アセテート繊維が得られます。アセテート繊維は、より合わせて糸にすることで、適度な吸湿性と絹のような美しい光沢を持つようになります。難燃性なので、不特定多数が利用する公共施設のカーテンの材料として使用されます。また、軟らかい素材感が得られることから、衣類の素材としてもしばしば利用されます。
[C6H7O2(OCOCH3)3]n + nH2O → [C6H7O2(OH)(OCOCH3)2]n + nCH3COOH
(iii-2) 硝酸セルロース
セルロースを硝酸HNO3と反応させると、繰り返し単位当たりに3個あるヒドロキシ基(-OH)の全部、または一部がニトロ化された「硝酸セルロース」が得られます。硝酸セルロースは、かつて衣類に用いられたこともありましたが、大変に燃えやすく、着用した服が燃えて、モデルが死亡するという事故が起こったために、現在は衣類に用いられることはありません。硝酸セルロースが発見されたのは1845年のことで、スイスの化学者であるフリードリヒ・シェーンバインは、自宅で硝酸HNO3と硫酸H2SO4の混合液に綿を浸す実験を行っていました。
[C6H7O2(OH)3]n + nxHNO3 → [C6H7O2(OH)3-x(ONO2)x]n + nxH2O
混合液に浸した綿を洗って乾かしても、特に変化が見られませんでした。それどころか、実験前の綿と何一つ変わりはないように見えました。しかし、その綿にマッチで火を着けたシェーンバインは驚きました。綿は一瞬でパッと燃え上がり、めらめらと鮮やかな無煙の炎をあげ、燃えカスも残さず消えてしまったのです。これが、「硝酸セルロース」すなわち「綿火薬」発見の瞬間でした。
これを見たシェーンバインの頭に、1つの妙案が閃きました。当時の戦争では、火薬として昔ながらの割合で硝石、木炭、硫黄を配合した「黒色火薬」が使われていました。黒色火薬には、確かに銃弾を発射させる力はありましたが、発射後には大量の白煙が漂い、兵士は敵の所在も分からないままに、互いに撃ち合っていました。そのため、息が苦しくなった兵士が、仕方がなく陣地を移動せざるを得なくなる場合もありました。そこでシェーンバインは、この「綿火薬」と呼ばれるようになった爆発性の新物質を、黒色火薬の代わりに使えないだろうかと考えました。シェーンバインは、試薬の量を変化させて反応を調整し、やがて望み通りの速さで燃焼する綿火薬を製造できるようになりました。綿火薬は、発射にあたって大量の白煙を上げる黒色火薬に比して、「無煙火薬」と呼ばれています。

図.24 綿火薬に点火すると一瞬で燃え尽きる
セルロースの場合、グルコース1単位当たりのヒドロキシ基(-OH)が、いくつニトロ化されるかによって、硝酸セルロースの性質が変化します。例えば、セルロース中のヒドロキシ基(-OH)が、すべて硝酸HNO3でエステル化されたものを「トリニトロセルロース」といいます。トリニトロセルロースは多数の酸素原子を分子内に持っているので大変燃えやすく、135℃で分解が始まって、180℃で発火する性質があります。
[C6H7O2(OH)3]n + 3xHNO3 → [C6H7O2(ONO2)3]n + 3xH2O
(iii-3) コロジオン
セルロースの繰り返し単位にある2個のヒドロキシ基(-OH)が、硝酸HNO3でエステル化されたものを「ジニトロセルロース」といいます。ジニトロセルロースは、エタノールとC2H5OHジエチルエーテルC2H5OC2H5との混合物に溶けます。この混合物を「コロジオン(collodion)」といいます。この名称は、ギリシア語の「kollodes(にかわ状の)」に由来します。この物質は粘り気のある液体で、切傷や手術創に塗布すると、耐水性の被膜を作るため、世界初の絆創膏(水絆創膏)として利用されました。傷口にこの液体を塗ると、それが透明で水を通さない軟膏に変わるのだから、当時の人々がどれほど驚いたのか、想像に難くありません。コロジオンは現在でも、東京甲子社から販売されている「コロスキン」などに含まれ、水絆創膏として利用されています。
[C6H7O2(OH)3]n + 2xHNO3 → [C6H7O2(OH)(ONO2)2]n + 2xH2O

図.25 「コロスキン」の名前は「菌を殺す」ではなく、成分である「コロジオン」に由来する
(iii-4) セルロイド
ジニトロセルロースに、クスノキの精油から得られる「樟脳」を20%ほど加えたものが、世界で初めて工業生産されたプラスチックである「セルロイド(celluloid)」です。樟脳は、クスノキを水蒸気蒸留することで得られます。クスノキの木片を大釜に入れ、それを高温で蒸して、成分を水蒸気として抽出するのです。セルロイドは、合成法が簡単であることに加え、90℃で軟らかくなるので、成型が容易という特徴を持ちます。
セルロイドの開発のきっかけは、ビリヤードの大流行でした。1860年代後半、アメリカでビリヤードが大流行しました。ビリヤードの球の材料として、唯一適していた素材が象牙だったのですが、ビリヤードの球を十分に作れるほどのゾウはいませんでした。そのため、ビリヤード産業におけるゾウ不足が、深刻な問題となりました。そこで、ニューヨークのフェラン・アンド・コランダ―商会が、「象牙の人造代用品」を考案した人物に、賞金として当時としては破格の1万ドルを与えると発表したのです。

図.26 セルロイドは、ビリヤードの象牙の球の代用品として登場した
この賞金の噂は、ニューヨーク州オルバニー在住の若き発明家ジョン・ウェズリー・ハイエットの耳にも届きました。しかし、象牙のように弾力性と粘りがあり、適度な硬さを持つ素材は中々なく、ハイアットは理想的な代用品を見付けられずにいました。ハイアットは、ある日コロジオンを保管してある戸棚を開けたところ、コロジオンがこぼれて固まっているのを目にしました。このとき、ハイアットの頭にある考えが閃きました――これをビリヤードの球の型に流し込めるのではないだろうか?
結局、コロジオンで球ができることは分かったのですが、その技術をハイアットが完成させるには、7年もの歳月がかかりました。秘訣は、コロジオンを熱と圧力で型に流し込む前の段階で、クスノキの精油から得られる樟脳を混ぜることでした。樟脳は可塑剤の働きをするため、硝酸セルロースの長い分子が、成型の過程で滑り合うようになります。ハイアットは、1868年にこの新素材を「セルロイド」と名付けて発表しました。そして1870年には、セルロイドを特許化して工業生産を開始しました。「セルロイド」という名は、ハイエットの会社が登録した商標であり、これが一般名詞化したものです。自由に成形可能でありながら、硬くて丈夫という性質を持ったセルロイドは、爆発的な売れ行きを示しました。

図.27 ハイエットは、7年もの歳月をかけて、世界初のプラスチックであるセルロイドを発明した
その後、セルロイドは、アメリカ国内だけでなくヨーロッパにも広がり、袖や襟のカラー、筆箱、下敷き、ピアノの鍵盤、ギターのピック、コルセット、おもちゃの人形、ピンポン玉、ブラシ、義歯などに、多用途で使用されるようになります。特に、取り外しのできるセルロイド製のカラーは、人気商品となりました。当時、シャツをチョッキで隠して、同じシャツを何日も着ている人が多かったからです。セルロイド製のカラーなら、汚れても水洗いすれば済みます。これらの商品のいくつかは、それまで象牙で作られていたので、セルロイドの発明は、ゾウの密猟を激減させ、多くのゾウの命を救う結果にもなりました。セルロイドが日本に広まったのは、20世紀になってからです。財閥が参入して各社の優秀な技術者が集められたこと、原料の樟脳が当時支配下にあった台湾の特産品であったこともあり、第一次世界大戦の特需をきっかけに、1937年には世界一の生産量と品質を誇るに至ります。

図.28 セルロイド製のギターのピック
1889年には、アメリカの世界最大の写真用品メーカーであるイーストマン・コダック社が、セルロイドを薄く延ばして、セルロイド製の映画フィルムを開発しました。セルロイドフィルムに1コマ1コマを撮影して、連続で再生することで、映画を作ることができるようになったのです。1895年には、フランスのリュミエール兄弟が、現代に続く映写機と映画のシステムを発明し、世界初の実写映画を製作しました。このときの映写機のレンズは、なんと水を入れたフラスコだったといいます。このセルロイドフィルムは、1950年代頃まで広く使用されました。セルロイドは映画産業を誕生させ、20世紀の文化の重要な担い手にもなったのです。映画の夜明けは「セルロイド時代」と呼ばれ、初の映画スターは「セルロイド名士」と呼ばれました。アニメーション制作に使用される、いわゆる「セル画」は、当時セルロイドのシートを使っていたための名称です。

図.29 セルロイド製の映画フィルム
しかし、セルロイドは熱に弱く、摩擦程度の熱でも発火することがあるという欠点がありました。また、耐候性が悪いため、日光が当たるとセルロースと硝酸HNO3に分解しやすく、発生した硝酸HNO3が近くのものを溶かしてしまったりすることもありました。そのため、石油化学樹脂の隆盛とともに徐々に使用量は減少し、他のプラスチックが使われるようになりました。「セルロイド製のビリヤード球がぶつかり合った瞬間に、その衝撃で爆発が起きて、銃声と勘違いした男たちが、撃ち合いを始めた」という真偽不明の逸話さえ残っています。
その他、映画のフィルムも、映写機や照明の熱で発火しやすいために、しばしば火災の原因となり、多くの人命を奪っています。1897年には、パリの映画館で上映中に大火災が発生し、180人も亡くなりました。当時は、映画を見るのも命がけだったのです。このため、セルロイドは製造・貯蔵に厳しい規制がかけられ、より扱いやすいプラスチックが出現した現在では、見かける機会が少なくなりました。しかし、材料の歴史において、セルロイドの果たした役割は極めて大きかったといえるでしょう。
(iii-5) セルロースナノファイバー
最近では、夢の素材といわれる「セルロースナノファイバー(cellulose nanofibers)」の実用化が進んでいます。2000年代に始まるナノテクノロジーの隆盛において、ナノセルロースは、2004年頃から論文数などが急激に増加してきました。世界的に研究開発が活発化する中で、日本と北欧諸国が先行しています。
セルロースナノファイバーは、幅15 nm程度の大きさまで細くほぐしたセルロース繊維です。パルプのような木材や雑草、野菜、おから、古布などの様々なバイオマスから作られ、これを乾燥させて固めると、鉄の半分程度の重さで、強度が鉄の5倍にもなる素材になるといいます。軽さと強度を生かし、自動車のドアやボンネットの新たな材料として注目されており、セルロースナノファイバーをプラスチックに10%混ぜることで、強度を保ちながら自動車の重さを20%軽量化し、燃費を向上できるといいます。

図.30 セルロースナノファイバーは、植物由来のカーボンニュートラルな新素材として、現在注目を集めている
セルロースナノファイバーの研究により、2015年9月には、森林分野のノーベル賞ともいわれる「マルクス・バーレンベリ賞」を、東京大学の農学者である磯貝明ら3名の日本人研究者がアジアで初めて受賞しました。セルロースナノファイバーは、間伐材などの森林資源や産業廃棄物を含む様々な植物資源の有効活用に繋がり、環境負荷が小さく、持続型資源として現在注目されています。さらに、植物由来であることから生体に親和性があり、人体に取り込まれても害が小さいことから、人工血管や軟骨などの医療用材料としての応用も研究されています。今のところ製造コストが高いのが難点ですが、これが解決されれば、軽量かつ安価、応用範囲も広い材料となることでしょう。
・参考文献
1) 石浦章一「タンパク質はすごい!」技術評論社(2014年発行)
2) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
3) 黒栁正典「人の暮らしを変えた植物の化学戦略 香り・味・色・薬効」築地書館(2020年発行)
4) 斉藤勝裕「最強の「毒物」はどれだ?」技術評論社(2014年発行)
5) 齊藤烈/藤嶋昭/山本隆一/他19名「化学基礎」啓林館(2012年発行)
6) 佐藤健太郎「世界史を変えた新素材」新潮社(2018年発行)
7) ジョー・シュワルツ「シュワルツ博士の化学はこんなに面白い」主婦の友社(2002年発行)
8) 高村一知「天然および合成甘味料について」聖徳栄養短期大学紀要6,34-44,1975-03-20
9) 塚原典子/麻見直美「好きになる栄養学」講談社(2008年発行)
10) 都甲潔/飯山悟「トコトン追究 食品・料理・味覚の科学」講談社(2011年発行)
11) 日本博学倶楽部『[決定版]「科学の謎」未解決ファイル』PHP研究所(2013年発行)
12) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
13) 船山信次「こわくない有機化合物超入門」技術評論社(2014年発行)
14) 前橋健二「甘味の基礎知識」日本醸造協会誌106(12),818-825,2011-12-15
15) 松岡雅忠「私たちの生活と糖類」化学と教育68巻5号(2020年)
16) 山﨑昌廣「人体の限界 人はどこまで耐えられるのか 人の能力はどこまで伸ばせるのか」SBクリエイティブ株式会社(2018年発行)
17) 山崎幹夫「新化学読本-化ける、変わるを学ぶ」白日社(2005年発行)
18) 吉兼正能「日本のセルロイド工業の発祥」化学と教育66巻1号(2018年)