・イオン化傾向
【目次】
(1) イオン化傾向とは何か?
水溶液中における金属の陽イオンへのなりやすさを表したものを、「イオン化傾向(ionization tendency)」いいます。また、そのイオン化傾向の大きさの順に並べた序列を、「電気化学列(electrochemical series)」あるいは「イオン化列(ionization series)」といい、イタリアの物理学者であるアレッサンドロ・ボルタによって初めて決定されました。

図.1 主な金属のイオン化列
イオン化傾向が大きい金属ほど、陽イオンになって酸化されやすいということになるので、一般的にイオン化傾向の大きな金属は、強い還元剤になります。また一方で、イオン化傾向の小さな金属イオンは、電子e- を受け取って還元されやすいということになるので、強い酸化剤になります。なお、水素H2は金属ではありませんが、金属と同様に陽イオンになること、また金属と水素イオンH+ との反応性を考える上で必要なので、イオン化列の中に含めることが多いです。イオン化列は、語呂合わせで、次のように覚えると良いでしょう。
Li(リッチに)>K(貸そう)>Ca(か)>Na(な)>Mg(まあ)>Al(あるよ)>
Zn(あ)>Fe(て)>Ni(に)>Sn(すん)>Pb(な)>H2(ひ)>Cu(ど)>Hg(す)>Ag(ぎる)>Pt(借)>Au(金)
ある金属元素の単体が、水中で電子e- を出して陽イオンになるとき、そのなりやすさの順序がイオン化傾向であるから、金属単体のイオン化傾向は、次に示す化学反応式の反応エンタルピーΔHが小さいほど、イオン化傾向が大きいといえます。これは、反応エンタルピーΔHが小さいほど、生成物である陽イオンが、熱力学的に安定であるからです。
M(固体) + aq → Mn+ (aq) + ne-
さて、この化学反応は、さらに3つの段階に分けることができます。すなわち、上式の反応エンタルピーΔHの値は、次の図.2のように、昇華エンタルピーH1 kJ/molとイオン化エネルギーE2 kJ/mol、水和エンタルピーH3 kJ/molから求められます。

図.2 反応エンタルピーΔHについてのエンタルピー図
これより、一般的にイオン化傾向は、水和エンタルピーH3(H3<0)が小さく、昇華エンタルピーH1 (H1>0)とイオン化エネルギーE2 (E2>0)が小さいほど、大きくなるということが分かります。したがって、イオン化傾向は、イオン化エネルギーだけではなく、昇華エンタルピーや水和エンタルピーにも影響されるのです。このように定義すると、金属元素以外のイオン化傾向も調べることができ、そのイオン化傾向は、次の表.2のようになります。
表.2 その他の化合物・単体のイオン化傾向
|
単体(還元力) |
H2 > S2O32- > H2S >Cu>I->Ag>Br->Cl->Au>SO42->NO3->F- |
ただし、イオン化傾向は、その単体の反応性を単純に反映するものではないということに、注意する必要があります。このことでよく議論されているのが、カルシウムCaとナトリウムNaの順序です。カルシウムCaとナトリウムNaは、イオン化傾向の順序ではCa>Naです。しかし、水H2Oとの反応性は、明らかにNa>Caです。すなわち、ナトリウムNaの方が、カルシウムCaよりも激しく水H2Oと反応するのです。イオン化傾向がこのような順序になる理由は、イオン化傾向が、昇華エンタルピー・イオン化エネルギー・水和エンタルピー の3つの反応エンタルピーから決まるからです。カルシウムCaとナトリウムNaを比べたとき、昇華エンタルピーとイオン化エネルギーこそ、Ca>NaでナトリウムNaが有利ですが、水和エンタルピーは、Ca<<NaでカルシウムCaの方が圧倒的に有利なのです。
表.3 カルシウムCaとナトリウムNaの比較
|
|
カルシウムCa |
ナトリウムNa |
|
昇華エンタルピーH1 |
163 kJ/mol |
100 kJ/mol |
|
イオン化エネルギーE2 |
590 kJ/mol |
496 kJ/mol |
|
水和エンタルピーH3 |
−1,616 kJ/mol |
−403 kJ/mol |
|
ΔH =H1+E2+H3 |
−863 kJ/mol |
193 kJ/mol |
したがって、イオン化傾向は、このように反応性の順序を完璧に反映しているとはいえない部分があり、反応性については、飽くまで定性的な1つの要素として留めるのが望ましいと思います。しかし、高校化学では、イオン化傾向の関係を用いて、反応性を考察する問題が多く出題されるので、代表的なものについては、覚えておく必要があります。
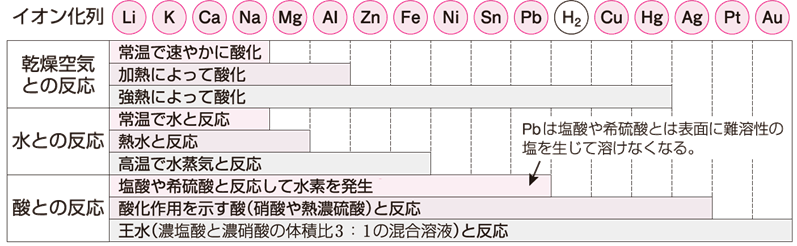
図.3 イオン化傾向と金属の反応性
(2) 金属陽イオンとの反応
金属単体と金属陽イオンの反応が進行するかどうかを判断するとき、イオン化傾向を使うと、反応が進行するかどうかの判断をすることができます。例えば、亜鉛板を硫酸銅(II) CuSO4の水溶液に浸すと、亜鉛板は亜鉛イオンZn2+ となって溶け出し、亜鉛板の表面には、銅Cuが樹枝状の結晶となって析出してきます。一方で、銅板を硫酸亜鉛ZnSO4の水溶液に浸しても、何の変化も起こりません。一般的に、ある金属塩の水溶液に別の金属を浸したとき、イオン化傾向の大きさの違いによって、金属表面に別の金属の樹枝状の結晶が成長することが多いです。これを「金属樹(metal tree)」といい、銅樹の他に銀樹、鉛樹、スズ樹などがあります。
Zn + Cu2+ → Zn2+ + Cu

図.4 硫酸銅(II) CuSO4水溶液中の亜鉛Znの反応
このようになるのは、イオン化傾向の大きさが、Zn>Cuだからです。すなわち、銅(II)イオンCu2+ が存在している状態よりも、亜鉛イオンZn2+ が存在している状態の方が系の中では安定なので、亜鉛Znが電子e- を銅(II)イオンCu2+ に受け渡し、銅Cuの結晶が析出してくるという訳です。なお、この反応は酸化還元反応であり、この反応では、亜鉛Znが還元剤、銅(II)イオンCu2+ が酸化剤として作用しています。イオン化傾向の順序は、このように金属単体と金属陽イオンとが、酸化還元反応を起こすかどうかの判断を与えるのです。一般的に、金属単体MAと金属陽イオンMBn+ が反応するとき、イオン化傾向の大きさがMA>MBならば、次の酸化還元反応が起こるといえます。逆に起こらなければ、イオン化傾向の大きさはMB>MAであると判断できます。
MA + MBn+ → MAn+ + MB

図.5 様々な金属樹
(3) 空気中の酸素との反応
表.4 空気中の酸素O2との反応
|
Li K Ca Na |
Mg Al Zn Fe Ni Sn Pb (H2) Cu |
Hg Ag |
Pt Au |
|
常温で速やかに反応 |
常温では徐々に反応 高温では速やかに反応 |
反応しにくい |
反応しない |
金属は酸化されると、その酸化被膜が金属と酸素O2との接触を断ち、反応は途中で止まります。しかし、酸化被膜がはがれやすいとか、湿気を吸って溶解しやすいとか、反応熱で酸化被膜がすぐに高温になり、酸化被膜の分子運動が激しくなって、酸素O2が浸透しやすくなるなどの要因があると、金属は内部まで酸化されるようになります。イオン化列では、アルカリ金属やアルカリ土類金属が、常温でも速やかに内部まで酸化されます。
4Na + O2 → 2Na2O
2Ca + O2 → 2CaO
銅Cuや鉄Feなどは、通常内部まで酸化されることはなく、高温で加熱すると、速やかに表面が酸化物に変化して、内部を保護するようになります。
2Cu + O2 → 2CuO
4Fe + 3O2 → 2Fe2O3
また、銀Agなどは、空気中で加熱しても酸化されません。むしろ、酸化銀(I) Ag2Oは、加熱により酸素O2を発生して分解します。
2Ag2O → 4Ag + O2
この反応は、エンタルピー変化がΔH>0の吸熱反応です。しかしながら、反応が進むと分子数は増大するので、エントロピー的にはΔS>0となります。よって、次に示す「ギブスの自由エネルギー式(Free energy equation of Gibbs)」より、温度Tが十分に大きければ、TΔSの項が大きくなってΔG<0となり、還元反応が優位に進行することになります(反応速度と化学平衡を参照)。
![]()
銀Agよりもイオン化傾向が大きい金属(Li〜Cu)は、この反応が進行しません。この理由は、エンタルピー変化ΔHがあまりにも大きくて、自由エネルギーがΔG<0となりにくいからです。参考として、次の表.5に、主な金属酸化物の標準生成エンタルピーΔHfを示します。この表.5からは、酸化銀(I) Ag2Oの標準生成エンタルピーΔHfが、他の金属酸化物のそれと比べて、非常に大きいことが分かります(値が小さいほど、大きな発熱反応ということです)。すなわち、銀Agの酸化物である酸化銀(I) Ag2Oは、他の金属酸化物と比べて、熱力学的にはさほど安定化されていないため、高温では容易に分解反応が起こるのだと考えられます。
表.5 主な金属酸化物の標準生成エンタルピーΔHf
|
|
Al2O3 |
Fe2O3 |
PbO2 |
Ag2O |
|
ΔHf |
-1676 kJ/mol |
-827 kJ/mol |
-277 kJ/mol |
-31 kJ/mol |
(4) 水との反応
表.6 水H2Oとの反応
|
Li K Ca Na |
Mg |
Al Zn Fe |
Ni Sn Pb (H2) Cu Hg Ag Pt Au |
|
常温の水と反応 |
沸騰水と反応 |
高温水蒸気と反応 |
水とは反応しにくい |
純水中では、H2O⇄H++OH- の電離平衡が存在するので、常に少量の水素イオンH+ が存在しています。金属の単体を純水に入れると、イオン化傾向が水素H2より大きい金属は、基本的にはこの水素イオンH+ を還元して、水素H2を発生させるはずです。しかし、亜鉛Znを水H2Oと反応させると、亜鉛Znの表面には、不溶性の水酸化亜鉛(II) Zn(OH)2が生じて、内部を保護するため、反応はすぐに止まってしまいます。
Zn + H2O → Zn(OH)2 + H2
したがって、水H2Oとよく反応する物質は、イオン化傾向が水素H2より大きく、かつ金属水酸化物が水によく溶けるものであるということが分かります。イオン化傾向が大きいLi〜Naに代表されるアルカリ金属やアルカリ土類金属は、常温でも水H2Oと反応して、水素H2を発生させます。これらは、金属水酸化物が水に溶けやすいので、強塩基性を示します。
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2

図.6 常温の水と反応するカルシウムCa(左)とナトリウムNa(右)
また、マグネシウムMgは、常温の水H2Oでは反応しにくいのですが、沸騰水とならよく反応します。
Mg + 2H2O → Mg(OH)2 + H2

図.7 沸騰水と反応するマグネシウムMg
イオン化傾向が中程度のアルミニウムAlや亜鉛Zn、鉄Feなどは、高温の水蒸気とならば反応します。反応の結果生成した金属水酸化物は、高温では不安定なので、水H2Oを放出して、酸化物の形となります。この反応は、イオン化列の鉄Feまで起こり、鉄Feでは逆反応も起こるため、平衡状態となります。
2Al + 3H2O → Al2O3 + 3H2
Zn + H2O → ZnO + H2
3Fe + 4H2O ⇄ Fe3O4 + 4H2
ニッケルNiよりイオン化傾向の小さな金属は、水H2Oとは反応しにくく、高温では、逆に酸化物を水素H2で還元することができます。
NiO + H2 → Ni + H2O
CuO + H2 → Cu + H2O
(5) 酸との反応
表.7 酸との反応
|
Li K Ca Na Mg Al Zn Fe Ni Sn Pb |
(H2) Cu Hg Ag |
Pt Au |
|
H+ で酸化され、陽イオンとなる H+ は還元され、H2となる |
希硝酸・濃硝酸・熱濃硫酸と反応 |
王水と反応 |
水素H2よりイオン化傾向が大きい金属は、酸の水素イオンH+ が酸化剤として働き、金属は酸化されて陽イオンとなり、酸に溶けます。このとき、水素イオンH+ は金属に還元され、水素H2となります。
Zn + 2HCl → ZnCl2 + H2
Fe + H2SO4 → FeSO4 + H2

図.8 亜鉛Zn(左)と鉄Fe(右)の反応
ただし、鉛Pbは、水素イオンH+ で酸化されるものの、塩酸HClや硫酸H2SO4にはほとんど溶けません。この理由は、水に難溶な塩である塩化鉛(II) PbCl2や硫酸鉛(II) PbSO4が鉛Pbの金属表面に生じて、反応がそれ以上進行しなくなるからです。
また、イオン化傾向でCu〜Agまでの金属は、イオン化傾向が水素H2よりも小さいため、水溶液中の水素イオンH+ とは反応しません。しかし、水素イオンH+ より酸化力が強い酸とは反応します。このような酸化力の強い酸としては、硝酸HNO3や熱濃硫酸H2SO4があります。このとき発生する気体は水素H2ではなく、濃硝酸HNO3なら二酸化窒素NO2、希硝酸HNO3なら一酸化窒素NO、熱濃硫酸H2SO4なら二酸化硫黄SO2が発生します。
Cu + 2H2SO4(heat.conc) → CuSO4 + SO2 + 2H2O
3Cu + 8HNO3(dil) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3(conc) → Cu(NO3)2 + 2NO2 + 2H2O
2Ag + 2H2SO4(heat.conc) → Ag2SO4 + SO2 + 2H2O
3Ag + 4HNO3(dil) → 3AgNO3 + NO + 2H2O
Ag + 2HNO3(conc) → AgNO3 + NO2 + H2O

図.9 銅Cuと各種酸の反応
イオン化傾向の非常に小さな金属(金Auや白金Pt)は、酸化力の強い熱濃硫酸H2SO4や硝酸HNO3でも酸化されず、「王水(aqua regia)」にしか溶けません。王水は、濃塩酸HClと濃硝酸HNO3を3:1で混合したものであり、非常に強い酸化力を示します。このような強い酸化力を示す理由は、次の反応より、塩化ニトロシルNOClと塩素Cl2が生成するからです。塩化ニトロシルNOClは、酸化力が非常に強く、ほとんどの金属を酸化することができます。
3HCl + HNO3 → NOCl + Cl2 + 2H2O
Au + NOCl + Cl2 + HCl → H[AuCl4] + NO

図.10 王水と金Auの反応
さらに、クロムCrやアルミニウムAl、鉄Fe、コバルトCo、ニッケルNiなどの三価以上の陽イオンを作る金属は、濃硝酸HNO3のような水H2Oの少ない状況下で酸化されると、金属表面に厚さ数nm程度の緻密な構造を持つ酸化皮膜が生じて、金属内部を保護するようになります。このような状態を、「不動態(passivity)」といいます。不動態が生じると、本来反応すべき金属が反応しなくなり、酸や塩基に対して、極めて安定になります。
不動態を利用した商品には、アルマイトやステンレスなどがあります。アルマイトは、アルミニウムAlを人工的に不動態化処理したものです。また、ステンレスは、含有するクロムCrが空気酸化により不動態化したものです。

図.11 アルマイト加工したアルミ鍋
(6) 標準電極電位
金属のイオン化傾向は、25℃で1.013×105 Paの下で、水素H2が水素イオンH+ になる性質の強さと比較して、数値で表すことができます。これを「標準電極電位(standard electrode potential)」といい、電圧の単位Vで示します。主な金属の標準電極電位を次の図.12に示します。電位が低いほど酸化反応が起こりやすくなり、陽イオンになろうとする傾向が強くなります。つまり、電位が低いほどイオン化傾向は大きくなります。

図.12 標準電極電位
標準電極電位は、水素H2の電位を0 Vとして表すと約束されています。水素イオンH+ の濃度が1 mol/Lの塩酸HCl水溶液中に多孔質の白金電極を入れ、その表面に25℃で1.013×105 Paの水素H2を通して、接触させた電極を標準水素電極といいます。標準水素電極とある金属Mを組み合わせてできた電池の起電力が、その金属の標準電極電位となります。例えば、亜鉛Znを水素電極と接続すると、両極間の電位差は0.76 Vとなります。このとき、亜鉛Znと水素H2では、亜鉛Znの方がイオン化傾向が大きいので、亜鉛Znが負極となり、亜鉛Znの標準電極電位が−0.76 Vと求まります。
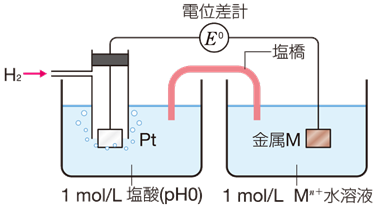
図.13 標準電極電位の求め方
これを応用すると、電池に使われる各金属の標準電極電位から、電池の起電力を求めることができます。例えば、ダニエル電池の起電力Eは、硫酸亜鉛水溶液ZnSO4aqと硫酸銅(II)水溶液CuSO4aqがそれぞれ1 mol/Lのとき、E=0.337−(−0.763)=1.100 Vとなります。電位差を求めるときは、必ず高い方の標準電極電位(正極)から、低い方の標準電極電位(負極)を引く約束なので、電池の起電力は必ず正の値となります。
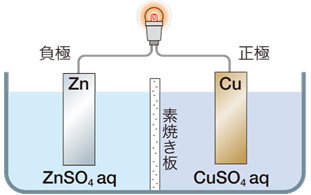
図.14 ダニエル電池の起電力を求める
・参考文献
1) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
2) 卜部吉庸「化学の新研究」三省堂(2013年発行)