�E�d�C���w(�d�C����)
�y�ڎ��z
(1) �d�C�����̌���
�d�����̐��n�t��Z���t��2�̓d�ɂ����A�����Ɉ��l�ȏ�̒����d���������܂��B����ƁA�t���̕�����C�I���A�܂��͓d�Ɏ��g���A����̓d�ɂł͎_������A�����̓d�ɂł͊Ҍ�����锽�����N����܂��B���̂悤�ɊO������d�C�G�l���M�[���������āA�������ɓd���������邱�ƂŁA�����I�ɂ͐i�s���Ȃ��_���Ҍ������������N�����A�����������w�������鑀��̂��Ƃ��A�u�d�C����(electrolysis)�v�Ƃ����܂��B�d�C�����́A�����I�ɂ͐i�s���Ȃ��_���Ҍ��������A�������i�s��������@�ł��B���̂��߁A�d�C�������N�����ɂ́A�t�N�d�͈ȏ�̋N�d�͂����d����p����K�v������܂��B
�d�C�����ł́A�O������^����ꂽ�d�C�G�l���M�[���A�_���Ҍ������ɂ���ĉ��w�G�l���M�[�ɕϊ�����܂��B���̂��߁A�d�C�����ɂ�鐶�����̉��w�G�l���M�[�́A�����������K�������Ȃ�܂��B�܂�A�d�C�����́A�M���w�I�ɂ͋z�M�����ł��B�܂��A�O���d���̐��ɂƂȂ������d�ɂ��u�z��(anode)�v�Ƃ����A���ɂƂȂ������d�ɂ��u�A��(cathode)�v�Ƃ����܂��B
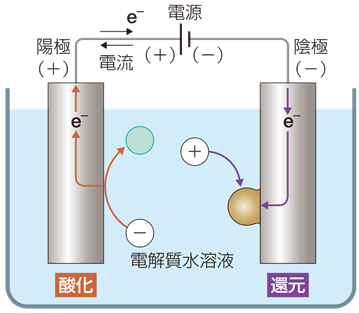
�}.1 �d���Ɠd�C�����̊W
�d�C�����ɂ����ẮA�A�ɂɂ͓d�qe- �����܂�A�z�ɂɂ͓d�qe- ���s�����邱�Ƃɂ��A�A�ɂ̓}�C�i�X�̓d�C��тсA�z�ɂ̓v���X�̓d�C��тт邱�ƂɂȂ�܂��B���������āA�����̓d�ɂ�d�����t�ɓ����ƁA�A�ɂɂ͗z�C�I�����W�܂�A�z�ɂɂ͉A�C�I�����W�܂��Ă��܂��B�����āA����ɉA�ɂł͗z�C�I���ɓd�qe- ���n�����Ƃ����������A�z�ɂł͉A�C�I������d�qe- ����낤�Ƃ����������N����A�d�����t�ɒ����d��������邱�ƂɂȂ�܂��B�܂�A�d�C�������N�����Ă���Ƃ��A�z�ɂł͎_�������A�A�ɂł͊Ҍ��������N���邱�ƂɂȂ�̂ł��B�����_���Ҍ������ł��A�d�r�̏ꍇ�́A���ɂŎ_�������A���ɂŊҌ��������N����̂ŁA���ӂ��K�v�ɂȂ�܂��B
(2) �A�ɂ̔���
�@�O���d�����d�qe- �����ꍞ�މA�ɂł́A�ł��Ҍ�����₷������(�_����)���A�d�q������Ĕ������܂��B�܂�A�A�ɂł͊Ҍ��������N����܂��B�d�������n�t�̏ꍇ�A���n�t���ɑ��݂���C�I���̎�ނɂ���āA���fH2����������ꍇ�ƁA�����P�̂��͏o����ꍇ������܂��B
�\.1 �A�ɂł̔���
|
Li+�E�E�EAl3+ |
Zn2+�E�E�EPb2+ |
H+ |
Cu2+�E�E�EAg+ |
|
�E���n�t���ł́A��ʂɐ͏o���Ȃ� �E�Z�����̓d���ɂ��͏o���� |
�A�ɔ̎�ނɂ���ẮA���n�t������ł��͏o���邱�Ƃ����� |
�E�_�����n�t�ł� 2H+ �{ 2e- �� H2 |
Ag��Cu�̏��Ő͏o���� �@ Ag+ �{ e- �� Ag �A Cu2+ �{ 2e- �� Cu |
|
�E�����`������n�t�ł� 2H2O �{ 2e- �� H2 �{ 2OH- |
��ʓI�ɂ́A�C�I�����X���̏����������C�I���قǁA�_���͂������̂ŁA�Ҍ�����ĒP�̂ɂȂ�₷���ł��B���������āA�����̃C�I�������݂��Ă��鐅�n�t�ɑ��A�d����0���珙�X�ɏグ�Ȃ���d�C�������Ă����ƁA�܂���Ag���A���ɓ�Cu���A���̎��ɐ��fH2���͏o���Ă����܂��B
Ag+ �{ e- �� Ag
Cu2+ �{ 2e- �� Cu
2H+ �{ 2e- �� H2
�Ƃ��낪�A���f�C�I��H+ �ɂ��ẮA��H2O�����݂������A���Ɏ����悤�ȓd�����t�ŁA�K�������͐��f�C�I��H+ �������ɑ��݂��Ă��܂��A���̂��߁A���fH2���C�I�����X���̑傫�������ɂ��ẮA���f�C�I��H+ ���D��I�ɊҌ�����Ă������߂ɁA�͏o���ɂ����̂ł��B
H2O�@ ⇄�@H+�@�{�@OH-
�������A���fH2�̔����ɂ́A�d�ɂ̎�ނɂ���āu���f�ߓd��(hydrogen overvoltage)�v���K�v�ƂȂ�܂��B���̂��߁A�ꍇ�ɂ���ẮA���fH2���C�I�����X���̑傫���������͏o���邱�Ƃ����肦�܂��B�j�b�P��Ni�∟��Zn�̃��b�L���\�Ȃ̂́A���̂��߂ł��B�Ⴆ�A����Hg�́A���f�ߓd����1.0�`1.3 V�Ɣ��ɑ傫�����߁A����Hg��d�ɂɎg���ƁA��d���ł͐��fH2���������ɂ����Ȃ�A�C�I�����X���̑傫���������͏o���₷���Ȃ�܂��B
|
|
Pt |
Au |
Ni |
Fe |
Cu |
Zn |
Hg |
|
���f�ߓd�� |
0.005 V |
0.02 V |
0.21 V |
0.3 V |
0.4�`0.6 V |
0.6�`0.7 V |
1.0�`1.3 V |
�������A�C�I�����X���̔��ɑ傫������(Li�`Al)�̗z�C�I���ɂ��ẮA�Ҍ�������̂ŁA�ʏ킱���̋����P�̂͐��n�t���Ő͏o���܂���B�����̋����̒P�̂�͏o���������Ƃ��ɂ́A�ő̂̉���Z�����āA�t�̏�Ԃɂ������̂ړd�C��������K�v������܂��B���̂悤�ɂ��邱�ƂŁA���f�C�I��H+ �␅H2O���Ҍ�����邱�ƂȂ��A�����̗z�C�I���������Ҍ����邱�Ƃ��ł���̂ł��B���̕��@���A�u�Z�����d��(molten salt electrolysis)�v�Ƃ����܂��B
(3) �z�ɂ̔���
�@�O���d���֓d�qe- ������o���z�ɂł́A�ł��_������₷������(�Ҍ���)���A�d�q�������Ĕ������܂��B�܂�A�z�ɂł͎_���������N����܂��B���̂Ƃ��A�z�Ɏ��g���_�������ꍇ�ƁA�d���t���̕������_�������ꍇ������܂��B
�\.3 �z�ɂł̔���
|
�z�ɂɎg���Ă��镨�� |
�N���锽�� |
|
�C�I�����X����Ag�ȏ�̋��� |
�ɔ��g���_������A�n������ M �� Mn+ �{ ne- |
|
Pt��C�̂悤�Ȏ_������ɂ������� |
�d���t���̉A�C�I�����_������� �@ 2Cl- �� Cl2 �{ 2e- �A 4OH- �� O2 �{ 2H2O �{ 4e-�i����j �@ 2H2O �� O2 �{ 4H+ �{ 4e-�i�����`�_���j |
�C�I�����X������Ag�ȏ�̋�����d�ɂɗp�����ꍇ�A�z�Ɏ��炪�_������A�n���Ă��܂��܂��B�������A�d�ɂƂ��ċ�Au�┒��Pt�A�Y�fC�̂悤�ɁA�_������ɂ���������p�����ꍇ�A�d���t���̉A�C�I�����A����Ɏ_������邱�ƂɂȂ�܂��B�܂��A�z�ɂɉ�Pb��p�����ꍇ�́A�_������Ď_����(IV) PbO2�ƂȂ�܂��B����́A���~�d�r�̏[�d���̔����Ɠ����ł�(�d�C���w(�d�C����)���Q��)�B
Pb�@�{�@2H2O�@���@PbO2�@�{�@4H+�@�{�@4e-
�������A���_�C�I��SO42- ��Ɏ_�C�I��NO3- �́A�ɂ߂Ď_������ɂ����̂ŁA�����͂�قǂ̍����łȂ�����A�z�ɂł͎_������܂���B�܂�A�ʏ�A���_�C�I��SO42- ��Ɏ_�C�I��NO3- �͔������܂���B���_�C�I��SO42- ��Ɏ_�C�I��NO3- �����n�t���ɑ��݂���ꍇ�A��H2O������Ɏ_������邱�ƂɂȂ�܂��B
2H2O�@���@O2�@�{�@4H+�@�{�@4e-
�܂��A�n���Q�������C�I���ł́A�Ҍ��͂̑傫���́AI-��Br-��Cl- �̏��Ȃ̂ŁA�͏o�̂��₷�����AI-��Br-��Cl- �̏��ɂȂ�܂��B����ŁA���_�����C�I��OH- ���_������锽���ɂ��ẮA�n���Q�������C�I���̎_�����������N����₷���ł��B
2Cl- �� Cl2 �{ 2e-
4OH- �� O2 �{ 2H2O �{ 4e-
�������A���_�����C�I��OH- �́A�����`�_�������ł͎_������ɂ����Ȃ��ɁA�d�ɂɂ���ẮA�u�_�f�ߓd��(oxygen overvoltage)�v�̖�肪���邽�߁A�_�fO2���������锽���͋N����ɂ����Ȃ邱�Ƃ�����܂��B���������āA�d�C�����ɂ�����z�ɂł́A�_�f�ߓd���̑傫������Pt�Ȃǂ��g���Ă���ꍇ�A������AI-��Br-��Cl-��OH- �̏��Ɏ_�������ƍl���Ė�肠��܂���B
�\.4 ��ȋ����́u�_�f�ߓd���v
|
|
Ni |
Fe |
Cu |
Ag |
Pt |
|
�_�f�ߓd�� |
0.12 V |
0.24 V |
0.25 V |
0.40 V |
0.44 V |
(4) �d�C�����̗�
(i) ���_��(II)���n�t�̓d�C����
�@���_��(II)CuSO4���n�t�𔒋��d�ɂœd�C��������ƁA�A�ɂł́A���̎�(I)�̂悤�ɓ�(II)�C�I��Cu2+ ���Ҍ�����A�d�ɂɓ�Cu���͏o���܂��B�܂��A�z�ɂł́A���̎�(II)�̂悤�Ɏ_������ɂ������_�C�I��SO42- �ɑ����Đ�H2O���_������A�_�fO2���������锽�����N����܂��B�d�C�����Ŏ_�fO2����������悤�ȏꍇ�A�Y�f�d�ɂ͓�_���Y�fCO2���ǂɕω����ď��X�ɐN�����̂ŁA�����d�ɂ�p����悤�ɂ��܂��B

�}.2 ���_��(II)CuSO4���n�t�̓d�C����
�A��(Pt)�FCu2+�@�{�@2e-�@���@Cu�E�E�E(I)
�z��(Pt)�F2H2O�@���@O2�@�{�@4H+�@�{�@4e-�E�E�E(II)
���̂Ƃ��A�A�ɕt�߂̗n�t�ł́A��(II)�C�I��Cu2+ �̔Z�x���������邾���ŁApH�͂قƂ�Ǖω����܂���B�������A�z�ɕt�߂̗n�t�ł́A���f�C�I��H+ �������邽�߂ɁApH���������Ȃ�܂��B�܂��A�A�ɂŎ��d�qe- �Ɨz�ɂŕ��o�����d�qe- �̗ʂ͓����Ȃ̂ŁA���_��(II) CuSO4���n�t�̓d�C����S�̂ł́A��(I)�~2�{��(II)���A���ӂ���4e- �����������A���̃C�I���������ŕ\����܂��B
2Cu2+�@�{�@2H2O�@���@2Cu�@�{�@O2�@�{�@4H+
(ii) ���̓d�C����
�@�������̓C�I���Z�x���Ⴂ�̂ŁA�����d���������Ȃ��ƁA�d��������܂���B���̂��߁A��H2O�̓d�C�����ɂ́A�������_���i�g���E��NaOH���n�t��A�_H2SO4��p���܂��B�Ⴆ�A���_���i�g���E��NaOH���n�t��d�C��������ƁA�i�g���E���C�I��Na+ �͊Ҍ�����ɂ������߁A�A�ɂł́A����ɐ�H2O���Ҍ�����܂��B�܂��A�z�ɂł́A���_�����C�I��OH- ���_������āA�_�fO2���������锽�����N����܂��B�e�ɂ̔����́A���̒ʂ�ł��B

�}.3 ���_��(II)CuSO4���n�t�̓d�C����
�A��(Pt)�F2H2O�@�{�@2e-�@���@H2�@�{�@2OH-�E�E�E(III)
�z��(Pt)�F4OH-�@���@O2�@�{�@2H2O�@�{�@4e-�E�E�E(IV)
���̂Ƃ��A�A�ɕt�߂̗n�t�ł́A���_�����C�I��OH- �������邽�߂ɁApH���傫���Ȃ�܂��B����ŁA�z�ɕt�߂̗n�t�ł́A���_�����C�I��OH- �̔Z�x���������邽�߂ɁApH���������Ȃ�܂��B�܂��A�A�ɂŎ��d�qe- �Ɨz�ɂŕ��o�����d�qe- �̗ʂ͓����Ȃ̂ŁA�S�̂̔�����1�̉��w�������ŕ\���ƁA��(III)�~2�{��(IV)���A��H2O�̓d�C�������N���������Ƃ�������܂��B
2H2O�@���@2H2�@�{�@O2
(iii) �Z�����d��
�@�����i�g���E��NaCl����ڂɓ���ċ��M����ƁA��800���ŗZ�����ĉt�̏�ԂɂȂ�܂��B������u�Z����(molten salt)�v�Ƃ����A���̏�Ԃł̓C�I�������R�ɓ�������̂ŁA���d���������܂��B�����Y�f�_��d�ɂɂ��ēd�C��������ƁA�A�ɂł́A�i�g���E���C�I��Na+ ���Ҍ�����ăi�g���E��Na�̒P�̂������A�z�ɂł́A�������C�I��Cl- ���_������ċC�̂̉��fCl2���������܂��B���̂悤�ɓd�C�����ʼn��fCl2����������ꍇ�A�����d�ɂ̓e�g���N�����h����(II)�_�C�I��[PtCl4]2- �Ȃǂɕω����ď��X�ɐN�����̂ŁA�Y�f�d�ɂ�p����悤�ɂ��܂��B
�A��(C)�FNa+�@�{�@e-�@���@Na�E�E�E(V)
�z��(C)�F2Cl-�@���@Cl2�@�{�@2e-�E�E�E(VI)
���̂Ƃ��A�A�ɂŎ��d�qe- �Ɨz�ɂŕ��o�����d�qe- �̗ʂ͓����Ȃ̂ŁA�S�̂̔�����1�̉��w�������ŕ\���ƁA��(V)�~2�{��(VI)���A�����i�g���E��NaCl�̓d�C�������N���������Ƃ��킩��܂��B
2NaCl�@���@2Na�@�{�@Cl2
���n�t�̓d�C�����ł́A�C�I�����X���̑傫������(Li�`Al)��͏o�����邱�Ƃ͂ł��܂���B�������A�n�����d���ł́A�C�I�����X���̑傫��������͏o�����āA�P�̂邱�Ƃ��ł��܂��B���̕��@�́A�i�g���E��Na��`�E��Li�A�J���V�E��Ca�A�}�O�l�V�E��Mg�A�A���~�j�E��Al�Ȃǂ̍H�ƓI���@�ɗp�����܂��B
(5) �d�C�����̗ʓI�W
�@�����d�ɂƊ_��p���āA��H2O�̓d�C�������s���܂��B����ƉA�ɂł́A���f�C�I��H+ ���Ҍ�����Đ��fH2���������A�z�ɂł́A��H2O���_������Ď_�fO2���������܂��B���̂Ƃ��̊e�ɂ̔������́A���ꂼ�ꎟ�̂悤�ɕ\����܂��B
�A��(Pt)�F2H+�@�{�@2e-�@���@H2�E�E�E(VII)
�z��(Pt)�F2H2O�@���@O2�@�{�@4H+�@�{�@4e-�E�E�E(VIII)
���̂Ƃ��A�����d�q�̐�(������)�́A���ɂœ������Ȃ�܂��B�Ⴆ�A���n�t�ɓd�q��4 mol�����ƁA�z�ɂł͐�H2O��2 mol�_������A�_�fO2��1 mol�������܂��B����ŁA�A�ɂł͐��f�C�I��H+ ��4 mol�Ҍ�����A���fH2��2 mol�������܂��B���̂悤�ɁA�d�C�����ɂ���ĕω����镨���̗ʂ́A�ړ������d�q�̕����ʂɔ�Ⴗ��̂ł��B�܂��A�d�q1�����d�C��Q�́A-1.602�~10-19 C�ň��ł��B�܂�A�d�C�����ł́A�ω����镨���̕����ʂ́A�ʂ����d�C��Q�ɔ�Ⴕ�܂��B������u�t�@���f�[�̓d�C�����̖@��(Faraday's laws of electrolysis)�v�Ƃ����A1833�N�ɃC�M���X�̉��w�҂ł���}�C�P����t�@���f�[���������܂����B
�_������Œm����X���@���e�E�A���j�E�X���A�u�d�ׂ�тт��d�q�������͌��q�̏W�c���C�I���ł���v�Ƃ��������𗧂Ă��̂́A�t�@���f�[�̓d�C�����̖@������50�N�����Ƃ�1884�N�̂��Ƃł��B�t�@���f�[�̔������A�����ǂ�قlj���I�Ȃ��̂ł����������f���܂��B�t�@���f�[�́A�����h���̕n�����ƒ�ɐ��܂�A���w�Z�𒆑ނ���13������ƌv���x���邽�߂ɓ����n�߂����߁A���x�Ȑ��w�Ȃǂ͂قƂ�ǒm��Ȃ������Ƃ����܂��B�����́A���R�Ȋw���j���[�g���͊w�̃��f���ŋL�q����悤�Ȑ��������w�̌X�������������̂ł����A�C�^���A�̕����w�҂ł���A���b�T���h���E�{���^��1800�N�Ƀ{���^�d�r���������ƁA�d�C�������ۂ�d���̎��C��p���ۂȂǂ̏�����������A�����I��@�����ڂ����悤�ɂȂ�܂����B���w������Ă��Ȃ������t�@���f�[�����R�Ȋw�����̓��ɓ��ꂽ�̂́A�������������̎���w�i�����������Ƃɂ��܂��B�t�@���f�[�́A�����ɂ���ėl�X�Ȏ��ۂ𖾂炩�ɂ������߁A�t�@���f�[���u�Ȋw�j��ō��̎�����`�ҁv�ƌĂԐl�������ł��B�_�����A�z�ɁA�A�ɁA�C�I���Ȃǂ̗p��́A���ׂăt�@���f�[����ʉ����������̂ł��B

�}.4 �C�M���X�̉��w�҃}�C�P���E�t�@���f�[�́A�d���C�w����ѓd�C���w�̕���ł̍v���Œm����
�t�@���f�[�̖@���́A������Ɣ������̌W���䂪�������Ƃ��������̓��e�ł��B���ꂪ�@���Ƃ��Ďc���Ă��闝�R�́A�d�q�̑��݂����炩�łȂ������Ƃ��ɁA�t�@���f�[�������I�ɂ��̖@�������o��������ł��B�d�q1 mol�����d�C�ʂ́A�d�q1�����d�C�� -1.602�~10-19 C�ƃA�{�K�h���萔6.022�~1023�@/mol�̐ςŕ\����̂ŁA
![]()
���̐�Βl9.65�~104 C/mol���u�t�@���f�[�萔(Faraday constant)�v�Ƃ����A�L��F�ŕ\���܂��B�܂��A�d�C�����ɂ����āA��������dt������ɗ����d�C��dQ�̂��Ƃ��A�d��I�Ƃ����܂��B�܂�A�d�C��Q�́A����t�̊��ŕ\�����Ƃ��ł��A�d��I�́A�d�C��Q������t�Ŕ����������̂ł��B
![]()
������A�d��I������t�Őϕ�����ƁA���̂悤�� ![]() �Ƃ����W�������܂��B
�Ƃ����W�������܂��B
![]()
![]()
![]()
�܂�A�d�C�����ɂ�����i�kA�l�̓d����t�ks�l�����ƁAit�kC�l�̓d�C�ʂ���H�ɗ����̂ł��B���Ȃ݂ɁA1 C�͂ǂ̂��炢�̓d�C�ʂȂ̂��Ƃ����ƁA�傫���̖ڈ��Ƃ��āA1��̗����̓d�ׂ��A��1 C�Ƃ����Ă��܂��B����ɁA�d�C��Q���t�@���f�[�萔F�Ŋ���A�d�C�����̔����Ɋ֗^���Ă���d�qe- �̕����ʂ����߂��܂��B
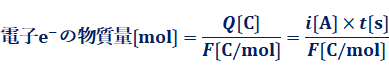
�E�Q�l����
1) ꎓ���/������/�R�{����/��19���u���w�v�[�ъ�(2012�N���s)
2) �ΐ쐳���u�V���n�̉��w(��)�v�x�䕶��(2005�N���s)
3) �n�Ӑ��u�d�C���w�̂����݁v���w�Ƌ���65��12��(2017�N)