�E�y�j�V�����̉Ȋw
�y�ڎ��z
(1) �j��ő�̃Z�����f�B�s�e�B
�@�u�A�I�J�r�v�̐��Y���関�m�̕����ɁA�u�h�E���ۂ�x�����ہA�ҋۂȂǂɑ���u�E�ۍ�p�v�����邱�Ƃ������̂́A�C�M���X�̍ۊw�҂ł���A���N�T���_�[�E�t���~���O�ł����B���̕����́A�S���̋��R�ɔ������ꂽ���̂ł����B�u�Z�����f�B�s�e�B�v�Ƃ������t�́A�ӂƂ������R����|���ɁA�\�z�O�̂��̂�����Ƃ����Ӗ��Ŏg���܂����A�t���~���O�̔����́A�u�j��ő�̃Z�����f�B�s�e�B�v�Ƃ����Ă��ߌ��ł͂Ȃ����̂ł����B

�}.1 �t���~���O�̑唭���́A�u�Z�����f�B�s�e�B�v�̍ł����Ƃ��Č��p����Ă���
1928�N9���A�����h���ɂ���Z���g�E���A���[�Y�a�@�ɋΖ����Ă����t���~���O�́A�u�h�E���ۂ̕ψي����������Ă��܂����B�Ƃ��낪�A�t���~���O�́A�u�h�E���ۂ�|�{���悤�Ƃ��Ă����V���[�������̂܂܂ɂ��āA�o�[�g���E�~���ɂ���ʑ��ɒ����Ԃ̉Ƒ����s�ɏo�Ă��܂��܂��B�t���~���O�́A���Ƃ��Ǝ�������|��������A���������肹���ɋx�ɂɏo�����邱�Ƃ������A�������̓J�r��G�ۂ��ɐB���₷�����ł������Ƃ����܂��B�����ċ��R�ɂ��A���̃V���[���̒��ɃA�I�J�r�̖E�q����э��݁A���w�������N�����܂��B����́A�������w�ł́u�R���^�~�l�[�V�����v�Ƃ�������̂ŁA�P��̔�������|�{���Ă����̂ɁA�����ɑ��̔������������荞��ł��܂����ۂł��B���ʂ̌����҂Ȃ�A�R���^�~�l�[�V�������N����ƁA���������s�����ƌ��Ȃ��āA�V���[���̒��g���̂ĂĂ��܂��Ƃ���ł��B�t���~���O�����l�ɁA�V���[����Еt���悤�ƁA���̏������n�߂܂��B
�������A�t���~���O�͂��̍�Ƃɓ��钼�O�A���锭�������܂��B�V���[�����̃A�I�J�r�̑傫�ȃR���j�[�̎��͂ł́A�u�h�E���ۂ̃R���j�[�������ɂȂ��Ă��āA�n�ۂ��N�����Ă����̂ł��B�u�V���[�����ɐ������A�I�J�r���A�u�h�E���ۂ��E�����炩�̕����ݏo���Ă���̂�������Ȃ��v�Ɛ��������t���~���O�́A���̖��m�̍R�ە������u�y�j�V�����v�Ɩ������܂����B���ꂪ�A�₪�Đ��S���̐l�����~�������ɂȂ�Ƃ́A���̂Ƃ��̓t���~���O���g���v�������Ȃ������ł��傤�B1929�N�ɃC�M���X�̎����a���w�G��(Experimental Pathology Vol.3, p.226)�ɔ��\���ꂽ�y�j�V�����́A�u�h�E���ۂ����łȂ��A��\�I�ȕa���̂ł���x�����ۂ�ҋۂȂǂɂ������������܂����B
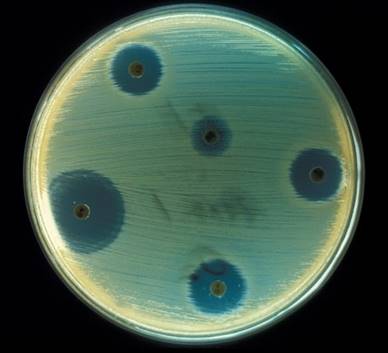
�}.2 �u�R�������v�̎��͂ł́A���F�u�h�E���ۂ̔ɐB���}�������
�������A�t���~���O�́A���̕����������ɕ����ł��܂���ł����B�����ŁA���̕����̊ܗʂ𑪒肷�邽�߂ɁA�J�r�̔|�{�h�t����߂��Ă����A�ۂ̔����j�~���邱�Ƃ��ł���Œ�Z�x�����߂邱�Ƃɂ��܂����B���Ȃ݂ɁA�t���~���O���s�������̕��@�́A���ł��R�������̍R�ۗ͂���������̂ɗp�����Ă��܂��B���̌��ʁA�t���~���O�̔|�{�h�t�́A200�{�A300�{�Ɗ�߂��Ă����Ă��A���������Ƀu�h�E���ۂ̔���j�~���~�߂��A800�{�ɂ܂Ŋ�߂��Ă��A�܂�����j�~�͂�ۂقNj������Ƃ�������܂����B���ʓI�ɁA���̃J�r�̐��Y����y�j�V�����́A�����E�ۂɂ悭�p�����Ă������Ŗ�́u�t�F�m�[���v���A���{�������۔���j�~�͂������Ƃ��F�߂��܂����B
�����ėp����Ă����t�F�m�[���́A��p�̍ۂ̏��Ŗ�Ƃ��Ďg�p����Ă��܂������A��p���⏝���̎E�ۂ͂ł��Ă��A�̓��ɓ��荞�ۂ�ގ����邱�Ƃ͂ł��܂���ł����B�t�F�m�[���ɂ͕��H��������A��������߂A�ۂ�����ɁA�l�̂̍זE���_���[�W���邩��ł��B����ŁA�y�j�V�����p���Ă��A�̓��̍זE�ɑ��Ċ�{�I�ɊQ���Ȃ����Ƃ��A���������ɂ���Ė��炩�ɂȂ��Ă��܂����B�t���~���O�́A�y�j�V�����̔����ɂ��A�̓��ɑ��H�����a���ۂƂ̐킢�ɏ�������\�������o���܂����B
�}.3 �����͏��ł̂��߁A��p���Ƀt�F�m�[�������A�����͔��߂��t�F�m�[���t�Ő��
�@�t���~���O�́A���̃J�r���u�y�j�V���E�����v�ɑ����邱�Ƃ�F�߂āA���̕������u�y�j�V�����v�Ɩ��������̂ł����A��ɁA���̃J�r�̓y�j�V���E�����ނ̌��Ђł���A�����J�_���Ȃ̃`���[���Y�E�g���ɂ���āA�u�y�j�V���E���E�m�^�c��(Penicillium notatum)�v�ł���Ɠ��肳��܂����B���̃J�r�́A�e��̃A�I�J�r�̒��ł���������ނł���A���������Δ������y�j�V�������Y�\�͂������Ă��܂����B���̒���ȃJ�r���A�t���~���O�̃V���[���̒��ɔ�э���ł����̂́A�F��Ƃ��������悤������܂���ł����B
�������A���̃J�r�ɂ���Đ��Y�����y�j�V�����̗ʂ͂ق�̂킸���ł���A25���ȏ�ɂȂ�ƁA�y�j�V�����Y���Ȃ��Ƃ�����肪����܂����B�������A�y�j�V���������ɕs����ȉ������ł��������߁A�����Ɏ��o�����Ƃ��A�����ԕۑ����邱�Ƃ���������̂ł��B����̂ɁA����ȏ�Ɍ�����i�߂邱�Ƃ͂Ȃ��Ȃ�����A�����Ƃ��ẮA�J�r�̐��Y���镨���̉��w�����ɂ����Đ��E��ł����������h����w�̃n�����h�E���C�X�g���b�N�ł����A���ɂ̓y�j�V�����������ɕ������錤����f�O���Ă��܂����قǂł��B�t���~���O���A�Ȍ�y�j�V���������s���邱�Ƃ͂Ȃ��A�y�j�V�����̔����́A���ꂩ��10�N�߂����̊ԁA�����҂�������Y�ꋎ���܂����B
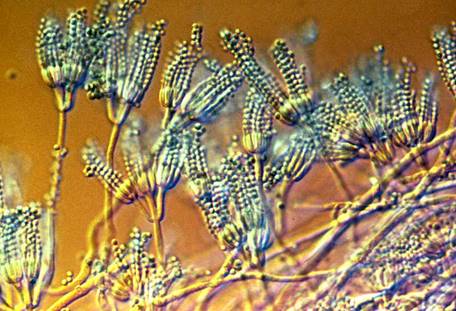
�}.4 �A�I�J�r�ɂ́A�u�y�j�V���X�v�ƌĂ��M�̂悤�Ȍ`�̍\��������A���ꂪ�w���u�y�j�V���E���v�̗R���ɂȂ��Ă���
�@�������A����E��풼�O��1938�N�ɂȂ��āA�I�b�N�X�t�H�[�h��w�̐����w�҂ł���n���[�h�E�t���[���[�́A�ӂƂ����@��Ƀt���~���O�̘_���ɖڂ��~�߂܂����B�t���[���[�́A�������̐��Y����V�R�́u�R�ې������v�̌��������Ă��܂������A���܂��ܓǂt���~���O�̃y�j�V�����̔����Ɋւ���_���ɋ����𖣂���A�����̐����w�҂ł���G�����X�g�E�`�F�[����Ǝ��g��ŁA�y�j�V�����̌����ɏ��o�����Ƃɂ����̂ł��B
�@�J�r�̔|�{�́A�ʏ�̓K���X���̃t���X�R�ōs���̂ł����A�t���[���[�����́A���퐻�̃t���X�R�Ŕ|�{������@���l�Ă��܂����B�����āA160 km�����ꂽ�H��ɗ���ō���Ă��炢�A174�̓��퐻�̔|�{�t���X�R�����܂����B�|�{���J�n�ł����̂́A1940�N�̃N���X�}�X�C�u�������Ƃ����܂��B�t���[���[�����́A�G�ۂɉ�������Ȃ��悤�ɒ��ӂ��Ȃ���A������y�j�V���E���E�m�^�c���̔|�{���J��Ԃ��A�|�{�h�t����y�j�V�����𒊏o�������܂����B�t���[���[�����́A�L�@�n�}�Ǝ_�܂��̓A���J�����n�t�ɂ�钊�o��������X�ɉ��ǂ��A�s����ȃy�j�V�����Ȃ킸�ɔZ�k����Z�p���m�����Ă����܂����B�\�����s����ȃy�j�V�����́A�I舂ȕ��@���h�t�����������肷��ƁA�����ɉ��Ă��܂��܂����B���̐����͍�����ɂ߁A�t���[���[�����͐��J�����������āA����Ƃق�̂킸���Ȋ��F�̕����������ł����B
�������A���̊��F�̕����́A50���{�Ɋ�߂��Ă��A�u�h�E���ۂ̔����j�~����Ƃ��������ׂ��З͂����āA�t���[���[����������܂����B�t���[���[�����́A������قڏ����ȃy�j�V�������Ǝv���Ă��܂������A���Ƃŕ��������Ƃ���ɂ��ƁA���̂Ƃ��̃y�j�V�����̏��x�́A�Ȃ��0.1%�ȉ��ł������Ƃ����܂��B�������A���̃y�j�V�����́A�u�h�E���ۂɊ������Đ��サ���}�E�X�������ɗ������点�A�������}�E�X�ɂ͉��̉e�����^���Ȃ����Ƃ�������܂����B�܂��A�t���[���[�������A���̎����Ƀ}�E�X���g�����͙̂F��ł����B�l�Ԃ̐����@�\�Ɖ��w�g���̑啔���́A���̚M���ނƋ��ʂ��Ă��܂����A�ɑ��锽���́A�l�ԂƓ����ƂňقȂ�ꍇ������܂��B�Ⴆ�A�A�X�s�����́A�l�R�ɂƂ��Ēv���I�ȓŕ��ɂȂ�܂����A�y�j�V�������܂��A�������b�g�ɑ��Ă͓ŕ��Ƃ��č�p����̂ł��B�������̂Ƃ��A�t���[���[�������������b�g�������Ɏg���Ă�����A���E���̍R���������A���Y���C���ɏ�邱�Ƃ͂Ȃ�������������܂���B

�}.5 �������b�g�ɂƂ��āA�y�j�V�����͖ғłɂȂ�
�@�V���Ƀt���[���[�̕����ł��鉻�w�҂̃m�[�}���E�q�[�g���[�������������`�[���́A�y�j�V�����̑��Y�ɗ�݁A1941�N�ɂ́A�s���ǂɔY�ފ��҂ւ̒��˂��ł���܂łɂ��������܂����B���̊��҂̓o���̞��Ŏw�����t���A�ۂɊ������ĉ��^���S�g�ɋy�сA�m���̏d���ł����B�\�\����́A����Ζ`���I�Ȏ��Âł����B�y�j�V�������ۊ����ǂɗL���Ȃ̂�������܂���ł������A�y�j�V�������ŏ���200 mg���˂��A3���Ԃ�����100 mg�����˂��Ă����܂����B����ƁA���̊��҂̏Ǐ�́A����Ԃɉ��P�̒����������A5����ɂ͔M��������A�H�~���N���Ď��������Ă��܂����B���̌��ʂ��A����܂Ŏ�����܂˂��Ď���҂����Ȃ������ۊ����NJ��҂̎��ẤA���ł͂Ȃ��Ǝv����悤�ɂȂ�܂����B�������A���ł�1939�N�Ƀ��[���b�p�ɖu����������E��킪�A�܂��ɂ����Ȃ�ƂȂ��Ă���A�h�C�c��R�̔����ɔ����ꂽ�C�M���X�{�y�ł́A����ȏ�̃y�j�V���������E���Y�́A�قƂ�Ǖs�\�ɂȂ��Ă��܂����B
�@�v���]�����t���[���[�́A�A�����J�ɓn�邱�Ƃɂ��܂����B��������L�ׂ��̂́A�A�����J�ő�̎��P���ƒc�̂ł��郍�b�N�t�F���[���c�ƁA�A�����J�̔������w�҂ł���A���h�����[�E���C���[�ł����B�����āA1941�N10���ɃA�����J�ł̃y�j�V�������Y�Ɋւ������ψ���J�Â���A��1942�N3���ɂ́A������1��2,300���P�ʂ̃y�j�V����������邱�ƂɂȂ����̂ł����B����������͑���E���̐^���������A�y�j�V�����̓o��́A���Ōv��m��Ȃ������̃A�����J���̖����~�����͂��ł��B1944�N6���ɂ́A�u�j��ő�̍��v�Ƃ�����ꂽ�m���}���f�B�[�㗤��킪�s���A�y�j�V�����́A���̐^�����⊶�Ȃ��������܂����B�^��Ă���폝�҂́A�y�j�V�����̂������ŁA�قƂ�ǃK�X���s��s���ǂȂǂ̍ۊ����ǂ��N�������ƂȂ��A�������܂����B���ꂪ�A�L���ȃy�j�V������������̂���܂��ł��B

�}.6 �m���}���f�B�[�㗤���ł́A200���l�߂��������h�[�o�[�C����n��A�R�^���^�������̃m���}���f�B�[�C�݂ɏ㗤����
�@�y�j�V�����̌��т��̂��āA1945�N�Ƀm�[�x�������w�E��w�܂��^�����Ă��܂����A��܂����̂̓t���~���O�A�t���[���[�A�`�F�[����3���ŁA�y�j�V�����̗Տ������ɑ傫�ȍv���������q�[�g���[�͎�܂��Ă��܂���B�m�[�x���܂ɂ́A�e����3���܂łƂ������������邽�߂ł��B�Ō�Ƀy�j�V�����v���W�F�N�g�ɎQ�����Ă������C���[���A�����J�n���̖�j���āA�q�[�g���[�������҂���O���Ă��܂������Ƃ������������܂���B�C�M���X�l�ł���t���~���O���������āA�C�M���X�̃I�b�N�X�t�H�[�h��w�̃t���[���[�ƃq�[�g���[���J�������y�j�V�����ł����A�ŏI�i�K���A�����J�ɂ��������߂ɁA�y�j�V�����̓������͂قƂ�ǃC�M���X�ɂ͓����Ă��炸�A����ǂ��납�A�C�M���X���A�����J�ɓ��������x�����Ă���n���ł���Ƃ����̂́A���Ƃ�����Șb�ł��B
(2) ���{�ɂ�����y�j�V����
�y�j�V�����́A�A�I�J�r�����͂̍ۂ���A�����̐g����邽�߂ɍ���Ă���ƍl�����܂��B�y�j�V�����傷�邱�ƂŁA���̍ۂƂ̐���������L���ɐi�߂邱�Ƃ��ł���̂ł��B�������̐��E�ł́A���̂悤�ȁu��������������̋ۂ̔ɐB��}���āA���̔������݂̂�������v�Ƃ����h�R��p������I�ɋN�����Ă��܂��B���̌��ۂ�������ꂽ�̂͌Â��A1876�N�̃A�C�������h�̕����w�҃W�����E�e�B���_���A���N�̃t�����X�̍ۊw�҃��C�E�p�X�c�[���ɂ���ĕ���Ă��܂��B���̌��ۂ̐��̂��𖾂����̂́A1907�N�A���{�̔������w�҂ł���֓������ł����B���{���E�ݖ��E���X�E�Ē��Ȃǂ������̂Ɏg����u���ہv���A���j�ۂ⑽���̈����u�h�E���ۂ̐����j�~���镨���Y���邱�Ƃ𗧏����̂ł��B���̕����̍\���́A1911�N�ɔ_�|���w�҂̖��c�厡�Y�����肵�A������u���_�v�Ɩ��t���܂����B�������A���̂悤�ȉ���������Âɉ��p���悤�Ƃ������z�́A1928�N�̃t���~���O�̃y�j�V����������҂��Ȃ���Ȃ�܂���B
�}.7 �u���_�v�́A���ۂ��O���R�[�X�y�����邱�Ƃɂ���Đ������A�ア�R�ۍ�p������
���{�ł́A1944�N1��27���̒����V���ɁA�G�W�v�g���������ۂɔx���ɂ��������C�M���X�̃`���[�`�����A�y�j�V�����ɂ���Ė��E���������Ƃ����j���[�X���f�ڂ���܂����B���̃j���[�X���h���ƂȂ��āA���N2��1���ɂ́A���{�ɂ����R�R��w�Z���Ƀy�j�V�������������邽�߂̈ψ���������܂����B�܂��A�u�y�j�V�����v�Ƃ������̂ɂ��Ă��A���{�œ���ꂽ���̂��A�K�������t���~���O�̔��������y�j�V�����Ƃ͌���Ȃ��̂ŁA��ɃA�I�J�r�́u�v�ɂ��Ȃ�ŁA�u�ɑf(�ւ���)�v�Ƃ����a���ɉ��߂��Ă��܂��B�Ȃ��A���͂��̃j���[�X�͌��ŁA�`���[�`���̔x�������Â����̂́A���ۂɂ̓y�j�V�����ł͂Ȃ��A�u�T���t�@�܁v�ł��������Ƃ��A���͔������Ă��܂��B

�}.8 �u�ɑf�v�́A�s���ǂ�x���Ȃǂɂ悭���������߁A���Y�����͖�܂̐F����u���F�̖��p�v�ƌĂꂽ���Ƃ�������
�y�j�V�����Ɋւ�����́A���̂Ƃ���A���̑O�N��1943�N�̏H���ɁA�h�C�c����A�������{�̐����͂ɂ���Ă����炳��A���łɕ����Ȃ���A���R�R��w�Z�̌R�㏭���ł�������_���F�̎�ɓn���Ă��܂����B��_�́A������w��w���݊w���ɗ��R�̈ˑ��w���ɂȂ�A�R��C����́A���B�Ȃǂ̋Ζ����o�āA1942�N�ɗ��R�R��w�Z�̋����ƂȂ����l���ł��B��_�́A�������Ö�Ƃ��čL���p�����Ă����u�T���t�@�܁v�������Ȃ��a�C�ɂ��y�j�V�����������ƒm��A����������ً}�ۑ�Ƃ���ׂ����Ƌ�\���Ă��܂����B�������A�R�̓y�j�V�����̗D�揇�ʂ͒Ⴂ�ƌ��Ȃ��A�Ȃ��Ȃ����グ�Ă��炦���ɂ����̂ł��B�Ƃ�����A�`���[�`���̃j���[�X�����|���ƂȂ��āA���{�̃y�j�V���������́A��_����C�҂Ƃ��āA�����̊�b��w�E���E�Տ��E���w�E�_�|���w�E��w�E�A���Ȃǂ̊e����̌��Ђ��W�߂ăX�^�[�g���܂����B
�����ċ����ׂ����ƂɁA���{�̌����`�[���́A���̔N��10���ɂ́A�������y�j�V�����炵���������A�I�J�r�̔|�{�t����̎悷�邱�Ƃ��ł��A11���ɂ́A�X�i���Ƃ̎O���H��▜�L����̉���H��ȂǂŁA�y�j�V�����̐��Y���J�n���ꂽ�Ƃ����܂��B11���̒����V���ɂ́A�u�Z���ԂɌ������� ���E��ɑf �킪�R�w��w�ɊM�́v�Ƃ�����ŁA��X�I�Ɍ������ʂ�Ă��܂��B���̊Ԃɔ�₳�ꂽ���Ԃ́A����1�N�ɂ������Ȃ������̂ł��B���Y���ꂽ�y�j�V�����́A���x�͒Ⴉ�������̂́A�s�v�c�Ƃ悭�����܂����B���x���Ⴂ���߁A�̊O�֔r�o����ɂ����Ȃ�A�悭�������̂ł͂Ȃ����Ƃ����Ă��܂��B�������A�����s���ɂ��ʎY���ɂ͎��s���A���̕��m�������~���ɂ͎���܂���ł����B�������̂Ƃ��Ƀy�j�V�����̗ʎY���������Ă�����A���̗��j�́A��������̂ɂȂ��Ă����̂ł��傤���B
1945�N8���A�L���E����̌��������̂��ƁA���{�͏I����}���܂����B���N9���ɂ́AGHQ(�A���R���i�ߕ�)���痤�R�a�@�ւƁA�픚�Ҏ��×p�̃A�����J���̃y�j�V�������͂����܂����B�K���X�r�ɓ������y�j�V�����́A���x�������Ĕ������������ł��B1946�N�ɓ��{�y�j�V�����w�p���c��ݗ������ƁAGHQ�̓y�j�V���������̌��Ђł���e�L�T�X��w�̃W���N�\���E�t�H�X�^�[����{�ɏ��ق��܂����B�t�H�X�^�[�́A���{�e�n�Ńy�j�V�������Y��̔錍�����J�u�����A���{�e�n�̍H���ϋɓI�ɉ���Ďw�����܂����B�t�H�X�^�[�̐s�͂������āA1949�N�ɂ́A���{�̐����Њe�Ђ��㎿�̌����y�j�V�����Y�ł���悤�ɂȂ�A�����\�ɂȂ�܂����B���̌��ʁA���{�ł͍R�������̊J������ѐ��Y�����������債�A�������獂��҂܂ł̂��ׂĂ̔N��w�ŁA�����ǂɂ�鎀�S�����������������܂����B
�}.9 ���{���̃y�j�V�����͊��F���������A�A�����J���̃y�j�V�����͏��x�������Ĕ��F������
���Ȃ݂ɁA������Ƃ���̖���uJin-�m-�v�́A��l���ň�t�̓���m���A�����Ƀ^�C���X���b�v���A���̒m�����������āA�����̐l�X���~���Ƃ�����_�Ȑݒ�̍�i�ł���A�e���r�h���}��������āA��q�b�g���܂����B���̍�i�ł́A����m�����琻�������y�j�V�����ŁA�]�˂̒������~���V�[�����A�O���̑傫�ȎR��ƂȂ��Ă��܂��B���y�E���o�E�h�߂Ȃǂ̑���Ɋ��ꂽ�ݖ������E�l�����̋��͂āA�A�I�J�r����y�j�V����������V�[���́A���Ƀ��A���e�B�̂�����̂ɂȂ��Ă����Ǝv���܂��B
�������A�œN�v���u���w����25���v�ɂ��A�u�J���̊}�X(ጎ�)��ׂ͓���ƍN���J�r�̏`�ŁA��������������Ƃ��n�܂�v�Ƃ���܂��B����ƍN�́A�u���q�E���v��̍���v�̍Œ��A�������物�F�u�h�E���ۂ̂悤�ȋۂ�����A�w���ɑ傫�Ȏ�ꕨ���ł��Ă��܂��܂����B���ɓ��Ɉ������Ă����e�Ԃ������˂āA�Ɛb��1�l���}�X��ׂɌ������A�u��ꕨ�Ɍ����v�Ƃ����y�c�q�������A��܂����B�A�I�J�r�̐��������̓y�c�q��w���ɓh������Ƃ���A���т��������^�������o�āA��ꕨ�͎��������Ƃ����܂��B����́A�u�A�I�J�r�Ɋ܂܂�Ă����y�j�V�����̂������ł������v�Ƃ������̂ł��B����͏��X�����ł����A���ꂪ�{���̘b�Ȃ�A���{�l�̓y�j�V������������300�N�ȏ���O�ɁA�R�������𗘗p���Ă������ƂɂȂ�܂��B�Ƃ͂����A�y�뒆�ɂ͎G�ۂ������̂ŁA�ނ�݂ɓy�������ɓh��t����A�d���ۊ����ǂɂȂ�\��������܂��B�ƍN�̐^���͂��Ȃ����������ł��傤�B

�}.10 �y�j�V�����́A����ƍN�̓������������̂��낤��
(3) �y�j�V�����̉��w
�@�Ȃ��y�j�V�����͓����ɂ͊Q���Ȃ��A�ۂ������E���̂ł��傤���H�y�j�V�����̕��q�\���́A1945�N�ɃC�M���X�̐����w�҃h���V�[�E�z�W�L�����X��������͂ɂ���Ė��炩�ɂ���A����܂łɒm���Ă����V�R�L�@�������Ƃ͑S���قȂ�A�u�� -���N�^���v�Ƃ����\�������V�K�Ȃ��̂ł����B����́A�Y�f���q3�ƒ��f���q1����Ȃ�l�p����\���̕����ł��B�� -���N�^���́A�ɂ߂Ē������\���ł���A�V�R�ɂ���ȉ����������݂���Ƃ́A����܂őz�������Ă��܂���ł����B�� -���N�^���̊́A�Y�f-�Y�f���������l�p�ɂ˂��Ȃ��Ă���̂ŁA�c�݃G�l���M�[���傫���A������������������A�����Ɋ��J���Ă��܂��܂��B��������ς���A�u���w�I�ɔ������������v�Ƃ������ƂɂȂ�܂��B
�@�ۂ́A���S�ȖԖڏ�̕��q�łł����u�זE�ǁv�Ƃ������v�ȊZ��g�ɂ܂Ƃ����ƂŁA���̑̂��O�E�������Ă��܂��B�y�j�V�����́A���̍זE�ǂ̎�v�����ł���u�y�v�`�h�O���J���v����������y�f�Ɏ����ƁA�� -���N�^���������J���Č������Ă��܂��A�y�f�@�\�����킹�܂��B�܂�A�y�j�V�����́A�ۂ̍זE�ǂ̐�������j�Q���邱�ƂŁA�R�ۍ�p�������̂ł��B�ۂ́A���S�ȍזE�ǂ������ł��Ȃ��Ȃ�ƁA�זE����ɔ����Ă��̍זE�ǂ͂ǂ�ǂ�Ɣ����Ȃ�A���B���}������܂��B�܂��A�ۍזE���̐Z�����́A�����̑̉t������ʂɍ������߁A�זE�ǂ������Ȃ�ƁA�����̐Z�����ɑς���ꂸ�A�j�Ď���ł��܂��܂��B�l�Ԃ⓮���̍זE�́A�ۂƈ���čזE�ǂ������Ȃ����߁A��{�I�Ƀy�j�V�����͐l�̂ɂ͉e��������܂���B���ꂪ�A�y�j�V�����̍R�ۍ�p�̃��J�j�Y���ł���A�� -���N�^���̔������̍����́A�R�ۍ�p�ƕs���Ȃ��̂ł��B�Ȃ��A�זE�ǂ������Ȃ��ۂł���u�N���~�W�A�v��u�}�C�R�v���Y�}�v�ɑ��ẮA�y�j�V�����͍R�ۍ�p�������܂���B�܂��A�זE�Ƃ����`�Ԃ����Ȃ��u�E�C���X�v�ɂ��Ă��A���l�ɗL���ł͂���܂���B
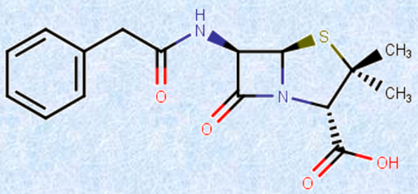
�}.11 ��\�I�ȁu�y�j�V����G�v�̍\����(�����t�߂̎l�p�`���� -���N�^����)
���A�y�j�V�����ɂ��Ă̌������i�ނƁA���������Ɂu�y�j�V�����v�Ɩ��t����ꂽ�����͍������ł����āA���ۂɂ�F�EG�EX�EK�̂悤�ɋL����t����ꂽ����ނ��̃y�j�V���������݂��邱�Ƃ�������܂����B����ɁA�����̉��w�\���ɂ́A�u6-�A�~�m�y�j�V�����_�v�ƌĂ���{�I�ȕ��������ʂ��đ��݂��邱�Ƃ�������܂����B�Ⴆ�A�C�M���X�Ō������ꂽ�u�y�j�V���E���E�m�^�c���v����ɐ��Y�����u�y�j�V����K�v�́A6-�A�~�m�y�j�V�����_�̃A�~�m��(-NH2)�ɃJ�v�����_CH3-(CH2)6-COOH���A�~�h�����������̂ł���A�A�����J�Ŏ�Ƃ��āu�y�j�V���E���E�N���\�Q�k���v�ɂ���Đ��Y���ꂽ�u�y�j�V����G�v�́A�t�F�j���|�_C6H5CH2COOH���A�~�h�����������̂ł��B���ł��y�j�V����G�́A���̃y�j�V���������R�ۊ�����|�{�t����̎��ʁA�������萫�ɗD��Ă��܂����B�u���E���̍R�������v�Ƃ��āA�ŏ��Ɏ��p�����ꂽ�̂́A���̃y�j�V����G�ł��B
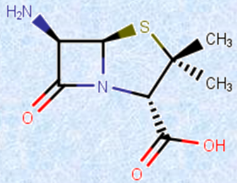
�}.12 �u6-�A�~�m�y�j�V�����_�v�́A�y�j�V�����̖�p�̒��j�I�ȕ����ł���
�܂��A�y�j�V����G�̍\���Ɋ܂܂��t�F�j���|�_�́A�g�E�����R�V����R�[���X�^�[�`������ۂɁA���Y���Ƃ��ē�����u�R�[���X�e�B�[�v�t�v�ɔ��ʊ܂܂�Ă��܂��B����ɂ́A�J�r�̐���ɕK�v�ȃr�^�~���A�~�l�����A�A�~�m�_�Ȃǂ��L�x�Ɋ܂܂�܂��B���̃R�[���X�e�B�[�v�t��|�n�ɉ�����ƁA�y�j�V�����̎��ʂ��A12�{�ɂ����シ��Ƃ���������܂����B����Ȃ�A�J�r��|�{����^���N�Ƀt�F�j���|�_��Y��������ǂ��Ȃ�̂��Ǝ��������Ƃ���A�J�r�́u�y�j�V����G�v���悭���悤�ɂȂ�܂����B�����āA�����Ƀt�F�j���|�_�̑���Ƀt�F�m�L�V�|�_C6H5OCH2COOH�������Ă��ƁA�t�F�j���|�_�ɑ����ăt�F�m�L�V�|�_�̎�荞�܂ꂽ�u�y�j�V����V�v�����Y����܂����B���̃y�j�V����V�́A�s�����K��G�ƈ���āA�_���������ł�����Ȑ����������Ă���̂ŁA�������Ă��݂ʼn�Ȃ��y�j�V�����Ƃ��Ă��Ă͂₳��܂����B���̂悤�ɂ��āA�|�{�t�ɗl�X�Ȏ_�������āA�l�H�I�Ƀy�j�V���������o�����݂͍L����������A�l�X�ȓ����������������́u�������y�j�V�����v������܂����B
�@�������A����ȃy�j�V�����ɂ����_�͂���A����1�Ɂu�y�j�V�����E�V���b�N�v������܂��B1956�N�A���{�Ŏ��̎��Ò��Ƀy�j�V�����𓊗^���ꂽ������w�@�w�����̔������Y���A�u�A�����M�[�����v���N�����Ď��S�����̂ł��B���̂��Ƃ��_�@�ɁA�y�j�V�������^�Ƃ̊֘A������������܂����B���̌��ʁA�y�j�V�������^�ɂ�鎀�S�҂��A���ł�100�����Ă������Ƃ����炩�ɂȂ�A�傫�ȎЉ���ƂȂ�܂����B�y�j�V�����́A�A�����Q���Ƃ��Ă̈�ʂ������A�A�����M�[�������N�����₷���̂ł��B���悻0.01�`0.001%���x�̊m���ŁA�d�ĂȃA�����M�[�Ǐ�ł���u�A�i�t�B���L�V�[�E�V���b�N�v�������N�������Ƃ��������Ă��܂��B
(4) �R�������̌���
�@�u�R�������v�ɂ́A�ۂ����ł�����u�E�ۍ�p�v��A���B��}����u�Ëۍ�p�v�����邽�߁A�u�R�ۖ�v�Ƃ��ėp�����܂��B�R�������̓o��ɂ���āA�l�ނ́A�ۊ����ǂւ̋��͂ȑR��i���̂ł��B���Ắu���̕a�v�Ƃ����Ă������X�̕a�C���A�R�������̓o���́A�₷�₷�Ǝ���悤�ɂȂ�܂����B�����������O�ɂ����āA���{�l�̕��ώ�����40�Α�Ő��ڂ��Ă��܂��B�����A���c�����S���͍����������A20�`30��̎Ⴓ�ŖS���Ȃ邱�Ƃ��A���قǒ��������Ƃł͂���܂���ł����B�������A1950�N�ɂ́A���{�l�̕��ώ�����60�ΑO��ƂȂ�A���݂ł́A80���Ă��܂��B����́A�A�����̐�̌R�̎w���ɂ���āA�}���ɉ��P���ꂽ�q������h�{��ԂȂǂ̗v�����l�����܂����A�y�j�V�������n�߂Ƃ���R�������̕��y���A�傫�Ȗ������ʂ����Ă���ɈႢ����܂���B����ɂ��A�R�������̓o��ɂ��A���{�l�̎�����10�N�����т��Ƃ������Ă��܂��B�R�������́A���₻����̕a�@�֍s���A���S�~�ŏ������Ă����A��������ӂꂽ��ƂȂ�܂����B
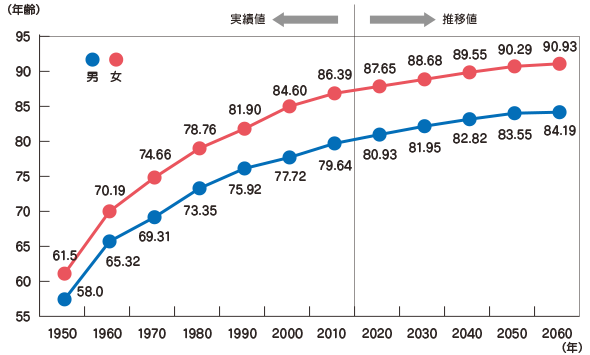
�}.13 ���{�l�̕��ώ����̐���(�����J���Ȃ���э����Љ�ۏ�l����茤�����ɂ�鐄�v����)
�@�ȑO�́A�u�R�������v�Ƃ����ƁA�a���ۂɑ����p��L���鉻�w�����݂̂��w���Ă��܂����B�������A���݂ł́A�R�������̂����������������́A�R�ۍ�p�����Ɏ~�܂炸�A�R�K���܂Ƃ��ē������̂�A�Ɖu�̓�����}��������̂ȂǁA�l�X�ȍ�p������������������Ă��܂��B�Ⴆ�A�R�K����p��L����R�������̒��ɂ́u�u���I�}�C�V���v��u�}�C�g�}�C�V��C�v�A�Ɖu�}����p��L������̂ɂ́u�^�N�������X(FK506)�v������A�����͂���������{�Ŕ������ꂽ���̂ł��B���������債���R�������ɉ��w�I���H�����������̂�A���l�̍\�������w�I�ɍ����������̂́A�����ɂ́u�����R�ۖ�v�Ƃ����܂��B�������A��ʓI�ɂ͂��������ׂāA�u�R�������v�ƌĂ�Ă��܂��B
�@�Ȃ��A���{�Ŕ������ꂽ�R������(�R����)�Ƃ��ẮA��w�҂̑呺�q���A�É����ɓ��s��ނ̃S���t��ō̎悵���y�ɐ���ł������ˋۂ��甭�������u�A�x�����N�`���v������܂��B���̍R�����������w�ϊ������u�C�x�����N�`���v�́A�呺�ƃA�����J�̐����Ѓ����N�E�A���h�E�J���p�j�[�Ƃ̋��������ŊJ������܂����B�C�x�����N�`���́A�ۂ�^�ۂɑ��Ă͍R�ۊ����������܂��A����ނ̐ߑ������ނɑ�����ʂ͋���ŁA����5���C���݂��Ă���E�V�ɑ��āA��������0.2 mg��1�^���������ŁA�����S�ł���قǂ̈З͂�����܂��B�C�x�����N�`���́A���̐_�o�זE�����`���l���ɓ��荞�݁A�_�o�`�B��j�Q���邱�ƂŁA����Ⴢ����Ď��Ɏ��点�܂��B�C�x�����N�`���́A�A�t���J�����Ŗ������Ă���u�o���N���t�g���v��u�I���R�Z���J(�������)�v�Ƃ������A�u�t�B�����A�v�ƌĂ����̒��Ԃ��N�������y�a�̏Ǐ���P�ɁA�ɂ߂ėD�ꂽ���ʂ������܂����B
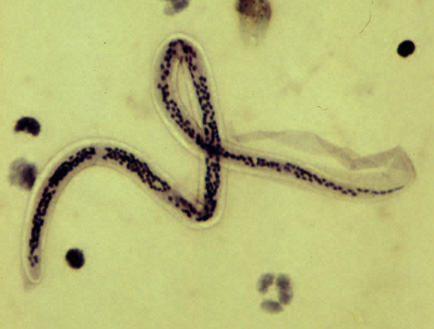
�}.14 �u�t�B�����A�v�͍ג�������̊��ŁA���u���̂悤�ȋz����������Ċ�������
�o���N���t�g���́A����Ɓu�۔�ǁv�Ȃǂ������N�����܂��B�۔�ǂ̊��҂́A�̖̂������̔畆��牺�g�D�̌����g�D�����������B���čd�����A�]�E�̔畆��̗l����悷�邽�߁A���̖����t���Ă��܂��B�L���Ȃ��̂ł́A�����̈ېV�̎u�m�ł��鐼���������۔�ǂɊ������A�A�X���l�̓���ɖc��オ���Ă����Ƃ����L�^���c����Ă��܂��B�����́A���̂��߂ɔӔN�͔n�ɏ�邱�Ƃ��ł����A�����ς��U�𗘗p���Ă����悤�ł��B�܂��A�I���R�Z���J�����Ĉ����N�����u�I���R�Z���J�ǁv�́A�u�͐쎸����(���o�[�u���C���h�l�X)�v�Ƃ��̂���A��̋߂��ɐ��ރu���Ɏh����邱�ƂŊ������܂��B�̓��ɓ��荞�I���R�Z���J���ڂɓ��荞�ނƁA���_�o�ɏ�Q��^���āA�ň��̏ꍇ�����Ɏ���܂��B���͂����킹�邱�Ƃ����邱�ƂȂ���A��̋߂��̓y�n���k��n�Ƃ��ė��p�s�\�ɂȂ邱�Ƃɂ��q����܂��̂ŁA���ɉe���̑傫���a�C�ł��B
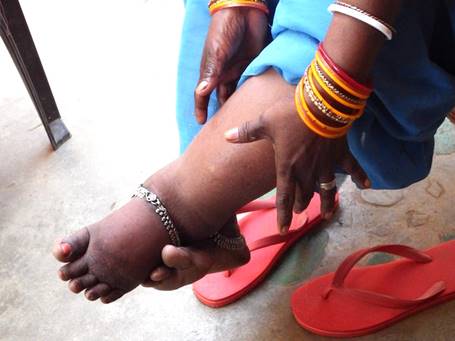
�}.15 �u�۔�ǁv�́A�q�g���h��Ƃ���t�B�����A�ނ����邱�Ƃɂ������N�������
�C�x�����N�`���́A1988�N�����WHO(���E�ی��@��)��ʂ��āA�A�t���J�̓��Y�����Ƀ����N�Ђ��疳���Ŕz�z����Ă���A���݂܂łɐ����2���l�ȏ���̐l�X��a���̊댯������~���܂����B���̃y�[�X�ōs���A�t�B�����A�������N�������y�a��2020�N�܂łɖo�łł���ƌ����Ă��܂��B�C�x�����N�`���́A�܂��Ɂu�A�t���J���~������v�Ƃ�����ł��傤�B���̑��ɂ��A�呺�͔������̐��Y����L�p�ȓV�R�L�@�������̒T��������45�N�ȏ�s���A����܂łɗނ̂Ȃ�480�����V���ȉ��w���������Ă��܂��B�����ɂ��A�ۊ����ǂȂǂ̗\�h�E�o�ŁA�n��A�������ۂ̉𖾂ɑ傫�ȍv�������Ă��܂����B�����̌��т���A2001�N�ɂ́u���{�w�m�@�̉���v�A2012�N�ɂ́u�������J�ҁv�ɑI�肳��A2015�N�ɂ́u�m�[�x�������w�E��w�܁v����܂��Ă��܂��B

�}.16 ��w�҂̑呺�q�́A2015�N�ɓ��{�l��3�l�ڂƂȂ�u�m�[�x�������w�E��w�܁v����܂���
���Ȃ݂ɁA�呺�����N�s���Ă��������́A�V�R�̐A���������������������o���Ƃ����A�ɂ߂ČÓT�I�Ȏ�@�ł��B���q�����w�̍Ő�[���s�����q�W�I���Ö�̊J���̂悤�ȁA�w��I�ȈӖ��ł̔h�肳�͂Ȃ��A�����Ă��܂��u�D�L�������v�ł��B�呺���m�[�x�������w�E��w�܂���܂������ƁA2001�N�Ƀm�[�x�����w�܂���܂������w�҂̖�Ǘǎ��́A�u�呺���m�̐l�i�ւ̎�܂ł�����A�m�[�x�����a�܂ł��ǂ������̂ł͂Ȃ����v�Ƃ����Ӗ��̃R�����g�����Ă��܂��B����́A2015�N�̃m�[�x�������w�E��w�܂̖{����˂����ꌾ�ł͂Ȃ����Ǝv���܂��B�ߔN�̃m�[�x���܂́A�n���̉���������ւ̍v�����d�������X�������邩��ł��B�Ⴆ�A2014�N�̃m�[�x�������w�܂́A�FLED���J�����������E�E�V��_�E�����C���3���ɑ����܂������A���̎�ܗ��R�ɂ́A�n�������̐ߖ�A�z�d�Ԃ𗘗p�ł��Ȃ��n��̐����̎������߂邱�Ƃւ̊��҂Ȃǂ����荞�܂�Ă��܂��B�n���̉���������̉��P�Ɍ��ѕt������A�m�[�x���܂Ƃ����ō��̉h�_�ɂӂ��킵���ƕ]�����ꂽ�̂ł��B
�\.1 ��ȁu�R�������v�Ɓu�����R�ۖ�v
|
|
���� |
��Ȉ�ʖ� |
|
�E�ۍ�p�̂��� �R������ |
�y�j�V�����n |
�t�F�l�`�V�����J���E�� �A���s�V���� |
|
�Z�t�F���n |
�Z�t�@���L�V�� ���_�Z�t�H�`�A�� �Z�t�`�]�L�V���i�g���E�� |
|
|
���m�o�N�^���n |
�A�Y�g���I�i�� |
|
|
�J���o�y�l���n |
�����y�l�� |
|
|
�O���R�y�v�`�h�n |
���_�|���~�L�V��B |
|
|
�Ëۍ�p�̂��� �R������ |
�e�g���T�C�N�����n |
���_�~�m�T�C�N���� |
|
�}�N�����C�h�n |
�N�����X���}�C�V�� |
|
|
�����R�ۖ� |
�L�m�����n |
�s�y�~�h�_�O���a�� |
|
�j���[�L�m�����v |
�V�v���t���L�T�V�� ���{�t���L�T�V�� |
(5) �ۂƂ̏I���Ȃ��킢
�@�R�������̔����́A�l�ނ��ۊ����ǂƂ̐킢�������������Ɏv���܂����B�R�������̓o��ɂ��A���S���N�ɓn���Đl�ނ��ꂵ�߂Ă�����a�\�\���j�A�y�X�g�A�`�t�X�A�ԗ��A�R�����Ȃǂ̍ۊ����ǂ̑������A���̂킸�����\�N�̂����ɋ쒀����Ă������̂ł��B�������A����͐V���Ȑ킢�̖��J���ł�����܂����B�ۂɑ��ē����R���������g��������ƁA�ۂ͊Ԃ��Ȃ��A���̖�ɑ����R�͂����悤�ɂȂ�܂��B���̂悤�ȍR�������������Ȃ��ۂ��A�u��ܑϐ��ہv�Ƃ����܂��B
�@�Ⴆ�A1940�N��̏��߂ɂ́A�������y�j�V�����̌����Ȃ��ۂ��o�ꂵ�Ă��܂����B�y�j�V�����ϐ��ۂ̏ꍇ�́A�u�� -���N�^�}�[�[�v�Ƃ����y�f������悤�ɂȂ��Ă��܂��B�y�j�V�����̊����̌��́A�u�� -���N�^���v�Ƃ����l�������ɂ���܂��B�������A�� -���N�^�}�[�[�́A������ -���N�^���̎l���\����j�A���������Ă��܂��̂ł��B���̑��̍R�������ɑ��Ă��A�ۂ͂�������Ė�����������A�������g�̍\����ς����肵�āA�R�������ɑR���Ă��邱�Ƃ��������Ă��܂��B
�@����ɁA��ܑϐ��ۂ̏o�����J�j�Y���ɂ��Ă��A�����ׂ����Ƃ�������܂����B�Ⴆ�A����ۂ���`�q�̓ˑR�ψقɂ��A���܂��ܖ�ܑϐ����l�������Ƃ��܂��B�ۂ́A���̂悤�Ȋ��ɓK�����`�����l������ƁA���̈�`�q���p�b�P�[�W�ɂ��āA���̍ۂɔz��܂��B���̃p�b�P�[�W���ꂽ��`�q�̂��Ƃ��A�u�v���X�~�h�v�Ƃ����܂��B1�C�ł���ܑϐ���`�q���l�������ψَ킪�����ƁA�u��ܑϐ��v���X�~�h�v�𑼂̍ۂɕ����ĉ��̂ŁA��ܑϐ����l�������ۂ��������܂��B���Ƃ��V�����R���������J�������Ƃ��Ă��A�g���n�߂Đ��J�����琔�N������ƁA�����͕K�����ꂪ�����Ȃ��ϐ��ۂ�����܂��B�����āA���̂悤�ȑϐ��ۂɑ��ẮA�]���̍R�������͌��͂������Ȃ��̂ŁA�V���ȍR�������̊J�������߂��܂��B�܂��ɁA��܂̊J���ƍۂ̐i���Ƃ̏I���Ȃ��킢�ł��B
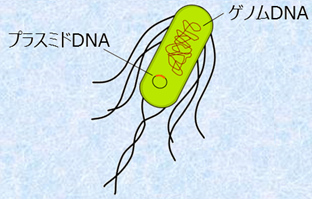
�}.17 �u�v���X�~�hDNA�v�́A�ۂ̍זE�����ɑ��݂��A�u�Q�m��DNA�v�Ƃ͓Ɨ����Ď����I�ɕ������s��
�@�܂��A��ܑϐ��́A������ނ̍ۓ��m�����łȂ��A���̎�ނ̍ۂɂ��L���邱�Ƃ��������Ă��܂��B�Ⴆ�A��ܑϐ������������F�u�h�E���ۂƕ��ʂ̐ԗ��ۂ������Ă����ƁA�₪�Ė�ܑϐ��v���X�~�h���ԗ��ۂւƎn����A�ԗ��ۂ͈ꋓ�ɖ�ܑϐ����l�����܂��B�o�C�I�Y�Ƃ͂��Ȃ蔭�W���Ă��āA��ܑϐ��v���X�~�h�́A�������o����Ύ�ɓ���邱�Ƃ��ł���Ƃ����܂��B���ۂɔ���������A�ǂ�ȍR�������������Ȃ����j�ۂ��R�����ۂ������Ă��܂��̂ł��B�C�M���X�Ȃǂł́A�ϐ��ۖ��́u�e�����Y�����݂̍��Ƃɑ��鋺�Ёv�Ƃ���A�u�����Ă��܂��B���ՂȍR�������̎g�p�́A�ϐ��ۂ��琬����������o�������Ȃ̂ł��B���łɉ��F�u�h�E���ۂł�98%�A�x�����ۂł�37%�Ƀy�j�V�����������Ȃ��Ƃ����܂��B
���ɓ��{�̈�Ì���́A�R���������g���߂��Ă���Ƃ����A��莋����Ă��܂��B���{�́A���N�ی��ɂ���Ĉ�Ô�̎��ȕ��S�z�����Ȃ��Ȃ邽�߁A�y�x�ȏǏ�ɂ��A�R���������������邱�Ƃ������̂ł��B�Ⴆ�A���ׂ������ƁA���Ҏ��g����t�ɑ��āA�R�������̏��������߂邱�Ƃ������Ό����܂��B�������A���ۂɂ́A�R�������́u�ۊ����ǁv�ɂ͗L���ł����A�u�E�C���X�����ǁv�ɂ͑S�����ʂ�����܂���B���ׂ̌�����90%�̓E�C���X�̊����ł���Ƃ����Ă���A�唼�́u���C�m�E�C���X�v��u�R���i�E�C���X�v�ƌĂ��^�C�v�ł��B���ׂŖƉu�͂��������Ƃ���ɁA�a�����ۂɁu�����v���A�C�ǎx����x���Ȃǂǂ����ۂɂ͌��ʂ�������̂́A���̗\�h���ʂ͂قƂ�ǂȂ��Ƃ����Ă��܂��B�R������������ł��A�C�x�߂ɂ����Ȃ�Ȃ��̂ł��B
�\.2 ���nj�Q�̌����ƂȂ�E�C���X
|
�a���� |
���ׂɐ�߂銄�� |
|
���C�m�E�C���X |
30�`50% |
|
�R���i�E�C���X |
10�`15% |
|
�p���C���t���G���U�E�C���X |
10�`15%
|
|
RS�E�C���X |
|
|
�C���t���G���U�E�C���X |
|
|
�A�f�m�E�C���X |
|
|
���̑��̃E�C���X |
5% |
|
�������E�C���X |
30�`35% |
|
��-�n�����A������ |
5�`10% |
�u�E�C���X�����v�ɑ���̖̂Ɖu�@�\���A14�`22���ɂ����Ċ����ɂȂ�̂ɑ��A�u�ۊ����v�ɑ���̖̂Ɖu�@�\�́A5�`12���ɂ����Ċ����ɂȂ�Ƃ���������܂��B���̕ɏ]���A�ߌ�ɔ��M���N�������ꍇ�́A�E�C���X���̕��ׂł���\���������Ƃ������ƂɂȂ�܂��B�������A��t���g���A�����̍ۊ����̋^��������ꍇ��A�x���̋��ꂪ����ꍇ�ɂ́A�ۊ����̌���������O�ɁA�R���������������Ă��܂����Ƃ�����悤�ł��B����ɂ́A���ݎg�p����Ă���R�������̔�������3����1�́A���ۂɂ͕s�K�v�Ȃ��̂ł���Ƃ������Ă��܂��B�����̌y�x�ȕ��ׂɍR���������o�V�o�V�Ə��������҂́A�u�o�C�I�n�U�[�h�v���N�����������Ă���Ƃ����v���܂���B
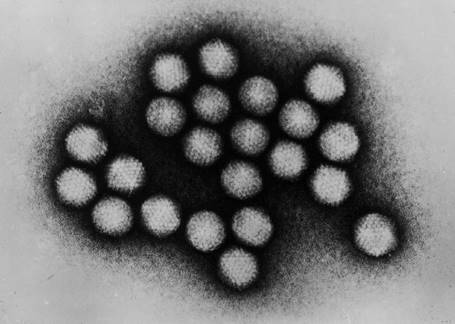
�}.18�@�u�A�f�m�E�C���X�v�́A���ׂ̌����ƂȂ��v�a���E�C���X��1��
���ՂȍR�������̎g�p�ɂ��A���łɊ댯�ȑϐ��ۂ��o�����Ă��܂��B�Ⴆ�A�uMRSA(���`�V�����ϐ����F�u�h�E����)�v�Ƃ����ϐ��ۂ́A�u���`�V�����v�Ƃ������ʂȍR�������ɂ��ϐ������������F�u�h�E���ۂł��B���`�V�����́A�� -���N�^�}�[�[�ɂ���ĕ�������ɂ����A�ϐ��ۂɋ����R�������Ƃ��ēo�ꂵ�܂����B�������A���ꂳ����MRSA�ɂ͌����Ȃ��̂ł��BMRSA���̂́A���N�Ȑl�̔畆�⒰���ɂ����Ă��A���̊Q���y�ڂ��܂��A����ɂ̓y�j�V�������܂ޑ����̍R���������S�������܂���BMRSA�́A�R�����������p������a�@�Ȃǂő����������A�Ɖu�͂̒ቺ�������@���̊��҂Ɂu�@�������v���邱�Ƃ����ɂȂ��Ă��܂��B��x��������ƁA�قƂ�ǂ̍R�������������Ȃ����߁A���Â͋ɂ߂č���ɂȂ�܂��B�K�Ȏ��Â����Ȃ��ƁA�u�x���v��u�������v�A�u�s���ǁv�Ȃǂ������N�����A�Ǐd���ƁA���Ɏ���댯��������܂��B
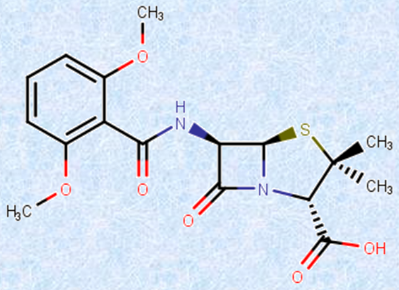
�}.19 �u���`�V�����v�́A�y�j�V�����ɑϐ������ۂɑR���邽�߂�1960�N�ɍ��ꂽ�R������
���̂悤�Ȗ�ܑϐ������������F�u�h�E���ۂɑ��ẮA�u�o���R�}�C�V���v�Ȃǂ̏����̍R�������݂̂��E�ۗ͂����܂��B�o���R�}�C�V���́A1956�N�̓o��ȗ��A30�N�ȏ�����炭�ϐ��ۂ��o�������A�u�ŋ��̍R�������v�Ƃ��Ă̒n�ʂ���葱���Ă��܂����B�o���R�}�C�V���́A�זE�ǂ̍ޗ����q�ɑ��ė��̓I�Ɍ������A�זE�ǂ̌`����W���A�܂��^���p�N���̍����ɕK�v�ȕ��q�̐��Y���W�Q���܂��B���̂��߁A�]���́u�ϐ��ۂ��������Ȃ���v�ƍl�����Ă��܂����B
�������A���́u�ŋ��̕ǁv���A���ɕ����Ƃ�������Ă��܂����B1987�N�A���̃o���R�}�C�V���ɂ��ϐ������ۂ̏o�������ꂽ�̂ł��B�u�ŋ��̍R�������v�Ǝv���Ă����o���R�}�C�V���s�ނ̃j���[�X�́A���E�̈�w�E�ɑ傫�ȏՌ���^���܂����B���̖�ܑϐ��ۂ́A�l�Ԃ̒��̒��ɏ�݂��钰���ۂŁA�uVRE(�o���R�}�C�V���ϐ�������)�v�Ƃ����܂��BVRE�ł́A�זE�ǂ̍ޗ����q�̍\�����킸���ɕω����Ă���A�o���R�}�C�V�����������ɂ�����ԂɂȂ��Ă��܂��BVRE�o���̌����́A���[���b�p�{�Y�Ǝ҂��A�H���ɂ��钹�⓮���Ƀo���R�}�C�V���Ɏ����R������(���{�ł͎g�p����Ă��܂���)���A���ߐ��ɗ^�������Ă������Ƃɂ���ƍl�����Ă��܂��BVRE���̂́A���܂�L�Q���̍����a���ۂł͂Ȃ��A�ʏ�͊������Ă��قƂ�ǔ��ǂ��܂���B�������A�����a�C�Ȃǂ̂��߂ɖƉu�͂��ቺ���Ă���ƁA�������Ǐ�������܂��B
�A�����J���a�Ǘ��Z���^�[(CDC)�ɂ��ƁA�A�����J�ł͒����ۂ̂����A�o���R�}�C�V���ɑϐ�������(VRE)�̊����́A1989�N�ɂ�0.3%�ł������A1993�N�ɂ�8%�A1996�N�ɂ�10%�ɏ㏸�����Ƃ������Ƃł��BVRE�����ǂǂ������҂̒v�����́A70%����ƕ���Ă���A�@�����������������ꍇ�́A�ɂ߂Đ[���Ȏ��Ԃ�������ƍl�����Ă��܂��B�����2002�N�ɂ́A��ܑϐ��v���X�~�h��VRE���物�F�u�h�E���ۂւƓ`���A�uVRSA(�o���R�}�C�V���ϐ����F�u�h�E����)�v���o�ꂵ�܂����B������A����ɕa�����̋����ۂ��A�o���R�}�C�V���ւ̑ϐ����l�����邱�Ƃ��A�\���ɂ��蓾�邱�Ƃł��B
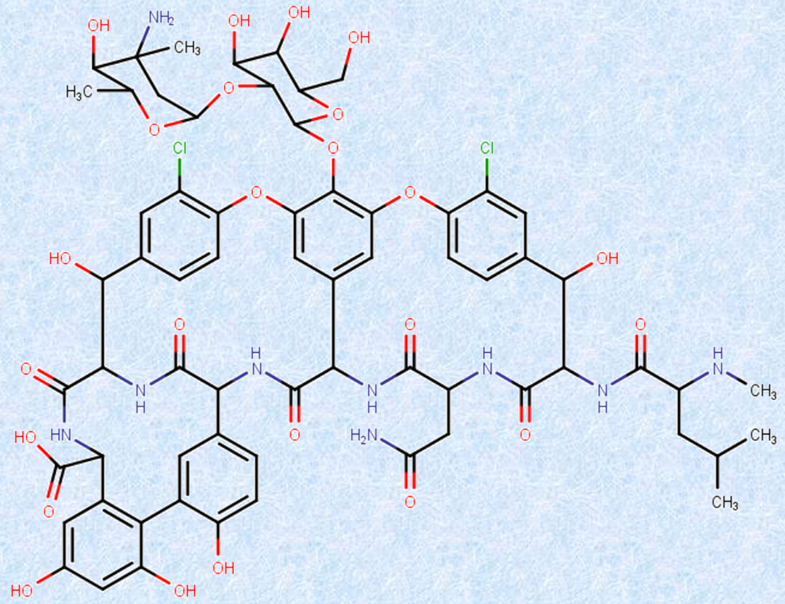
�}.20 �u�o���R�}�C�V���v�́A�قƂ�ǂ̍R�������ɑ��đϐ����l������MRSA�ɑ��������Ƃ���Ă���
���݂́A���͂⎡���悤�̂Ȃ��ۊ����ǂ��o�����Ă��A�S�����������Ȃ��ɂ���܂��B�ŋ߂ł́A�R�������ɑϐ��������j�ۂ������Ă���A���łɏI���������̂悤�Ɏv���Ă������j�������A�Ăъg�債�Ă��܂��B�ǂ̂悤�ȍR��������p�����Ƃ��Ă��A�����͕K�����̍R�������������Ȃ��ϐ��ۂ�����܂��B�������ɂł��邱�Ƃ́A�R���������L���Ɏg������Ԃ������ł��������邱�Ɓ\�\���Ȃ킿�A�s�v�ȍR�������̎g�p���~�߂āA�ϐ��ۂ̏o����x�点�邱�Ƃ�������܂���B
�@�R�����������̑��l�҂ł������ۊw�҂̔~�V�_�v�́A���āu�Ȋw�͑ϐ��ۂƋ������Ă��邪�A�Ȋw�̕����ϐ��ۂ��啪���i��ł���v�Əq�ׂ����Ƃ�����܂��B�~�V�́A���������w���������J�݂��āA�K���ɗL���ȍR���������A���E�ŏ��߂ĊJ���������Ƃł��m���Ă��܂��B�������A�����͔~�V�̌��t�Ƃ͑��e�ꂸ�A�ۂ��ˑR�ψق���җ�ȃX�s�[�h�ɁA�Ȋw�͈��|�������܂��B�R�������̏o���ɂ���āA�l�ނ͍ۊ����ǂƂ̐킢�ɏ����������Ɏv���܂����B�������A�ۂƂ̐킢�͂��ꂩ����܂������A�c�O�Ȃ���A����͏I���̌����Ȃ��킢�ł���悤�ł��B
�E�Q�l����
1) �}��`�M�u�g�߂ȃN�X���̌��������݁v�Z�p�]�_��(2010�N���s)
2) ��{�M���u�ʔ����قǂ悭�킩�� ���w�v���{���|��(2003�N���s)
3) ���������Y�u���i�ƃm�[�x���� ���Ö�͎�܂ł���̂��H�v�p��V��(2016�N���s)
4) ���������Y�u���w�����͂Ȃ�������̂��v�Z�p�]�_��(2008�N���s)
5) ���������Y�u���E�j�����v�u�k��(2015�N���s)
6) �������j�u�ʔ����Ė���Ȃ��Ȃ鉻�w�vPHP������(2012�N���s)
7) ��ׁؕu�łƖ�y���ׂĂ̓ł́u��v�ɂȂ�!?�z�v�V���o�Ŏ�(2015�N���s)
8) �[��ǗS�u�Ȃ��A���Ȃ��̖�͌����Ȃ��̂��H�v������(2014�N���s)
9) �D�R�M���u���킭�Ȃ��L�@������������v�Z�p�]�_��(2014�N���s)
10) �D�R�M���u�ł̉Ȋw-�łƐl�Ԃ̂������-�v�i�c����(2013�N���s)
11) ���T�C�G���X�I�t�B�X�ҁu��͑̂ɉ������邩�v�Z�p�]�_��(2006�N���s)
12) �R�芲�v�u�ʔ����قǂ悭�킩�� �łƖ�v���{����(2004�N���s)
13) �R�芲�v�u�V���w�ǖ{-������A�ς����w�ԁv������(2005�N���s)