・酸と塩基(中和反応)
【目次】
(ii) (Na2CO3 + NaHCO3) + HClの場合
(iii) (NaOH + Na2CO3) + HClの場合
(1) 中和反応
化学には、ものを混ぜ合わせる作業がつきものです。事実、そうして化学は始まりました。私たちの遠い祖先は、デンプンと酵母菌を混ぜ合わせ、アルコールを作りました。樹脂と木灰を混ぜ合わせ、セッケンを作りました。硫黄と木炭、硝石を混ぜ合わせ、黒色火薬を作りました。こうした有益な日用品に刺激されたのでしょう。他にも便利なものを作り出せないものかと、人々はせっせと物質を混ぜ続けました。しかし、大抵は満足のいくような結果は出ませんでした。あるエジプト人は、ブタの眼球、アンチモン、サビ、ハチミツを混ぜたものを、目の見えない患者の耳に注ぎ入れ、視力を回復させようとしました。もちろん、効果は全くありませんでした。「医学の父」といわれる古代ギリシアのヒポクラテスも、アヘン、セイヨウワサビ、ハトの糞を混ぜたものを禿げ頭に塗り、毛髪を育成しようとしましたが、やはり効果はありませんでした。

図.1 古代ギリシアのヒポクラテスは、後の西洋医学に大きな影響を影響を与えたことから、「医学の父」と呼ばれている
さて、人類は古くから、柑橘類の果汁などのように、酸っぱい味のする物質があることを知っていました。この物質は、その味もさることながら、金属を腐食したり、ミルクを凝固したりするといった、特別の性質があるために関心が持たれ、「酸(acid)」と呼ばれてきました。この言葉は、ラテン語の「acere(酸っぱい)」という語に由来しています。一方で、酸と反応して、その働きを弱める物質も昔から知られており、それは「塩基(base)」と呼ばれました。「中和反応(neutralization)」とは、酸と塩基の化学反応のことです。酸から生じる水素イオンH+ と、塩基から生じる水酸化物イオンOH- とが、互いに酸と塩基の性質を打ち消し合いながら反応していき、熱力学的に安定な水H2Oを生成します。
H+ + OH- → H2O
ただし、中和反応において注意しなければならないことは、これは「酸とは水溶液中で水素イオンH+ を生じる物質であり、塩基とは水溶液中で水酸化物イオンOH− を生じる物質である」というアレニウスの定義における酸塩基でしか成立しないということです。この理由は、「酸とは水素イオンH+ を他に与える物質であり、塩基とは水素イオンH+ を他から受け取る物質である」というブレンステッドの定義における酸塩基の定義では、酸と塩基は連続的な概念であると考えられていて、アレニウスの定義における酸同士が酸塩基反応を起こす場合があるからです。例えば、ブレンステッドの定義によれば、硫酸H2SO4と硝酸HNO3が酸塩基反応をします。
H2SO4(酸) + HNO3(塩基) ⇄ HSO4- (共役塩基) + H2NO3+ (共役酸)
この反応が起こるのは、硫酸H2SO4が硝酸HNO3よりも強い酸だからです。しかし、この反応を中和反応と呼ぶのは、少し違和感があります。したがって、中和反応とは、水H2Oよりも酸性度が強い物質と水H2Oよりも塩基性度が強い物質の反応であると定義することにします。
また、硫酸H2SO4と硝酸HNO3をそれぞれ1 molだけ完全に中和するのに必要な水酸化ナトリウムNaOHは、それぞれ1 molおよび2 molになります。このように1 molの硫酸H2SO4を中和するのに2 molの水酸化ナトリウムNaOHが必要になる理由は、硫酸H2SO4が2価の酸だからです。
HNO3 + NaOH → NaCl + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
それでは、弱酸である酢酸CH3COOHを完全に中和するのに必要な水酸化ナトリウムNaOHは、一体何molになるのでしょうか?水溶液中では、酢酸CH3COOHのような弱酸はわずかな水素イオンH+ しか電離していないので、少しの強塩基で中和できるなどと単純に考えてしまいがちです。しかし、それはもちろん事実とは異なります。中和反応は、酸塩基の出す過剰な水素イオンH+ と水酸化物イオンOH- が、熱力学的に安定な水H2Oになっていく点に反応の本質があります。したがって、たとえ弱酸や弱塩基であっても、アレニウスの定義における酸塩基は、すべて水H2Oよりは水素イオンH+ や水酸化物イオンOH- を出す力の強い物質であるのだから、これらの一方が少しでも残っていれば、完全中和したことにはならないのです。つまり、完全中和するためには、酸や塩基の強弱とは無関係に、とにかく出しうる水素イオンH+ や水酸化物イオンOH- が完全になくなるように、酸と塩基を加得ていく必要があります。よって、1 molの酢酸CH3COOHを完全中和するのに必要な水酸化ナトリウムNaOHは、酢酸CH3COOHの量と同じ1 molになります。
CH3COOH + NaOH → CH3COONa + H2O
まとめると、中和反応においては、酸や塩基の強さに関わらず、次のような関係が成り立ちます。
酸が出せるH+ のmol = 塩基が出せるOH- のmol
また、酸HAの価数をa、濃度をCA mol/L、体積をVA mLとし、塩基Bの価数をb、濃度をCB mol/L、体積をVB mLとすると、酸塩基の中和反応においては、次のような一般式が導き出せます。
![]()
(2) 塩の加水分解反応
酸由来の陰イオンと塩基由来の陽イオンからできた化合物を「塩(salt)」といいます。塩は、その組成により何種類かに分類されます。酸塩基が完全中和して酸のHも塩基のOHも残っていない塩を「正塩(normal salt)」、酸のHが残っている塩を「酸性塩(acid salt)」、塩基のOHが残っている塩を「塩基性塩(basic salt)」といいます。なお、この分類は形式的なものであり、塩の水溶液の液性とは無関係であることに注意が必要です。また、複数の塩からなる「複塩(double salt)」や、錯イオンを含む「錯塩(complex salt)」などもあります。
表.1 主な塩の分類
|
塩の分類 |
例 |
|
正塩 |
Na2CO3、K2SO4、Na3PO4、NaCl、CuSO4、CH3COONaなど |
|
酸性塩 |
NaHCO3、KHSO4、Na2HPO4、NaH2PO4など |
|
塩基性塩 |
MgCl(OH)、CuCl(OH)、FeO(OH)など |
|
複塩 |
AlK(SO4)2・12H2O、CaCl(ClO)・H2Oなど |
|
錯塩 |
K4[Fe(CN)6]、[CoCl(NH3)5]Cl2など |
アレニウスの定義における酸と塩基は、完全中和すると塩の水溶液となります。しかし、「弱酸+強塩基」や「強酸+弱塩基」による正塩の場合、弱酸由来の陰イオンは水素イオンH+ をもらう能力が大きいため、また弱塩基由来の陽イオンは水素イオンH+ を放出する能力がある程度大きいため、ほんの少しではあるものの、中和反応が戻ることになります。
CH3COONa + H2O ⇄ CH3COOH + NaOH
NH4Cl + H2O ⇄ NH3 + H2O + HCl
したがって、このような場合、中和は完了していないのではないかと思うかもしれません。しかし、もしそう考えると、中和は永遠に完了しないこととなります。なぜならば、上記の反応は平衡反応であり、どんな条件においても、ある程度は中和反応が押し返されるからです。つまり、「弱酸+強塩基」や「強酸+弱塩基」による中和反応の場合、中和の当量点の液性は完全な中性ではなく、弱酸性あるいは弱塩基性となるのです。上記の反応では、塩が水H2Oと反応することによって、水素イオンH+ または水酸化物イオンOH- を生じるため、この反応を「塩の加水分解(hydrolysis of salt)」といいます。これより、正塩の水溶液の液性は、それを形成するもとの酸塩基の強弱より、次の表.2のように推測することができます。
表.2 塩の水溶液の液性
|
加える酸 |
加える塩基 |
水溶液の液性 |
|
強酸 |
強塩基 |
中性 |
|
弱酸 |
強塩基 |
弱塩基性 |
|
強酸 |
弱塩基 |
弱酸性 |
|
弱酸 |
弱塩基 |
簡単には判断不能 |
(i)「強酸+強塩基」の正塩の場合
塩酸HClと水酸化ナトリウムNaOHの中和反応で生じる塩化ナトリウムNaClは、水に溶けると次のように電離します。
NaCl → Na+ + Cl-
このときに生じるナトリウムイオンNa+ と塩化物イオンCl- は、水溶液中ではともに安定であり、何の変化もしないので、水溶液の液性は中性のままです。
(ii)「弱酸+強塩基」の正塩の場合
酢酸CH3COOHと水酸化ナトリウムNaOHの中和反応で生じる酢酸ナトリウムCH3COONaは、水に溶けると次のように電離します。
CH3COONa → CH3COO- + Na+
このとき生じる酢酸イオンCH3COO- は、塩基性が水H2Oより強いです。そのため、一部の酢酸イオンCH3COO- が水H2Oと反応(加水分解)して、水酸化物イオンOH- を生じ、水溶液の液性は弱塩基性となります。なお、この反応の平衡定数は、Kh=5.4×10-10と見積もられています。つまり、2×109個だけ酢酸イオンCH3COO- があったら、そのうちの1個ぐらいが加水分解されているということです。
CH3COO- + H2O ⇄ CH3COOH + OH-
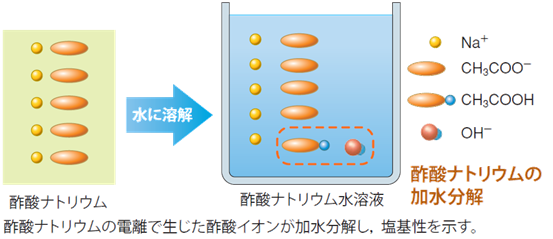
図.2 酢酸ナトリウムCH3COONaの加水分解
(iii)「強酸+弱塩基」の正塩の場合
塩酸HClとアンモニアNH3の中和反応で生じる塩化アンモニウムNH4Clは、水に溶けると次のように電離します。
NH4Cl → NH4+ + Cl-
このとき生じるアンモニウムイオンNH4+ は、酸性が水H2Oより強いです。そのため、一部のアンモニウムイオンNH4+ が水H2Oと反応(加水分解)して、オキソニウムイオンH3O+ を生じ、水溶液の液性は弱酸性となります。なお、この反応の平衡定数は、Kh=5.5×10-10と見積もられています。つまり、2×109個だけアンモニウムイオンNH4+ があったら、そのうちの1個ぐらいが加水分解されているということです。
NH4+ + H2O ⇄ NH3 + H3O+
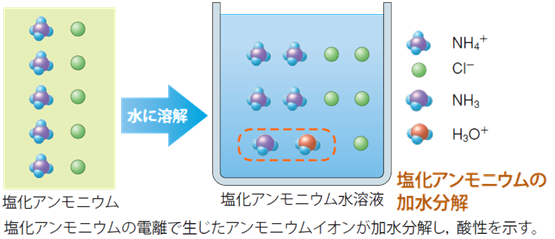
図.3 塩化アンモニウムNH4Clの加水分解
(iv) 酸性塩の場合
硫酸水素ナトリウムNaHSO4や炭酸水素ナトリウムNaHCO3、リン酸水素ナトリウムNa2HPO4、リン酸二水素ナトリウムNaH2PO4などの酸性塩の液性については、簡単には判断できません。残っているHを水素イオンH+ として電離する反応と、水H2Oと反応してもとの酸へ戻る反応の2つが起こりうるためです。このような場合は、2つの反応の電離の起こりやすさ、すなわち電離定数の大小から、酸性塩基性を判断します。例えば、炭酸水素ナトリウムNaHCO3の水溶液の場合、次の2の反応が起こります。
HCO3- + H2O ⇄ H3O+ + CO32- ・・・ Ka=10-10.3
HCO3- + H2O ⇄ H2CO3 + OH- ・・・ Kb=10-7.7
これより、炭酸水素ナトリウムNaHCO3の水溶液の場合はKa<Kbなので、水酸化物イオンOH- を電離する反応の方が起こりやすく、炭酸水素ナトリウムNaHCO3の水溶液は、塩基性であると判断することができます。このようにして酸性塩の液性を調べると、次の表.3のようになります。酸性塩の液性は単純に判断できないので、これはある程度覚えるしかありません。硫酸水素ナトリウムNaHSO4と炭酸水素ナトリウムNaHCO3の液性ぐらいは、覚えておきましょう。
表.3 酸性塩の水溶液の液性
|
|
NaHSO4 |
NaHCO3 |
Na2HPO4 |
NaH2PO4 |
|
Ka |
10-2 |
10-10.3 |
10-12.4 |
10-7.2 |
|
Kb |
10-24 |
10-7.7 |
10-6.8 |
10-11.9 |
|
液性 |
酸性 |
塩基性 |
塩基性 |
酸性 |
(3) 水のイオン積とpH
普通の水は、二酸化炭素CO2やわずかな電解質を含み、電流をいくらか流します。それでは、純粋な水は電流を流さないのでしょうか?ドイツの物理学者であるフリードリッヒ・コールラウシュは、特別な蒸留装置で不純物を除去した純粋な水H2Oを作り、精密に電気伝導性を測定しました。すると、純水でもわずかに電流が流れることが確かめられたのです(純水の場合では、25℃で水分子は5.6億個に1個の割合で電離しています)。このことから、水溶液中あるいは純粋中において、水分子の一部は電離して、次のような平衡状態になっており、あらゆる水溶液中において、次のような関係が成立していることが分かりました。
H2O ⇄ H+ + OH-
![]()
なお、平衡定数Kの式において、[H2O]は溶媒なので式には書きません。この平衡定数Kは、一般に「水のイオン積(ionic product of water)」と呼ばれ、Kwで表すことにします。
![]()
25℃では、水のイオン積はKw = 1.0×10-14 (mol/L)2の一定値となります。また、水素イオンH+ と水酸化物イオンOH- から水H2Oが生成する反応は発熱反応(ΔH<0)なので、温度を上げると平衡は吸熱方向(ΔH>0)に移動します。それ故に、この平衡では[H+]と[OH-]が増加し、Kwの値も大きくなります。つまり、Kwの値は温度に依存し、温度が高くなると、Kwの値は増大するのです。例えば、40℃ではKw = 3.0×10-14 (mol/L)2ぐらい、60℃ではKw = 1.0×10-13 (mol/L)2ぐらいになります。
H+ aq + OH- aq ⇄ H2O ΔH =−56.5 kJ
また、水溶液中の酸塩基の強さは、[H+]や[OH-]によって定量的に表すことができます。しかし、水のイオン積はKw=1.0×10-14 と非常に小さい値になるため、[H+]や[OH-]もたいてい10-x で表されるような非常に小さい値になり、このままでは少々扱いにくいです。そこで、1909年にデンマークの生化学者であるセレン・セーレンセンは、[H+]や[OH-]の負の対数を指標にしようと提案しました。この値をpH(水素イオン指数)もしくはpOH(水酸化物イオン指数)といいます。pHやpOHの「p」は、英語「power」を表しています。「power」を意味する単語は、フランス語「puissance」もドイツ語「potenz」もpで始まるため、1909年頃の科学大国であるドイツやフランスも、すぐにpHやpOHの発想を受け入れました。
水素イオン指数:pH=−log10[H+]
水酸化物イオン指数:pOH=−log10[OH-]
なお、水のイオン積はKw=[H+][OH-]=1.0×10-14 であるので、負の対数をとると、pH+pOH=14の関係になり、どちらか一方さえ分かれば、他方は簡単に求めることができます。したがって、特に何の断りもないときは、pOHではなくpHを使うことが多いです。なお、中性の溶液では、[H+]=[OH-]の関係が成立しているので、次のような関係が成り立ちます。
![]()
![]()
![]()
よって、25℃の中性溶液ではpH=7となります。また、酸性溶液では[H+]>[OH-]の関係が成り立っているので、pH<7が酸性であるということも分かります。同様にして、塩基性溶液では[H+]<[OH-]の関係が成り立っているので、pH>7が塩基性になります。ただし、水のイオン積Kwの値は高温では増大するので、60℃(Kw = 1.0×10-13)では中性の水のpHは6.5となります。この数字が7より小さいからといって、酸性だと勘違いしてはいけません。飽くまで中性とは、[H+]=[OH-]のことであって、pH=7.0のことではないからです。
表.4 液性とpHの関係(25℃)
|
液性 |
定義 |
25℃において |
|
酸性 |
[H+]>[OH-] |
pH<7 |
|
中性 |
[H+]=[OH-] |
pH=7 |
|
塩基性 |
[H+]<[OH-] |
pH>7 |
ちなみに、pHの読み方は、昔はドイツ語読みの「ペーハー」でしたが、1958年にはJIS(日本産業規格)で英語読みの「ピーエイチ」または「ピーエッチ」と読むように決まり、1970年にはNHKも「ピーエイチ」に決めたのですが、その後も一般には「ペーハー」と読まれることが多かったようです。2000年代になると、中学校理科の教科書に「pH計」が出てくるようになり、当初は読み方が付いていませんでしたが、2012年発行の教科書から全社「ピーエイチ」と読み方が付くようになり、今では「ペーハー」と読む人はほとんどいなくなりました。
(4) 中和滴定実験
酸HAの価数をa、濃度をCA mol/L、体積をVA mLとし、塩基Bの価数をb、濃度をCB mol/L、体積をVB mLとすると、酸塩基の中和反応においては、次のような関係が成り立ちます。
![]()
ここで、aとbは物質に固有の値なので、定数として扱うことができます。そこで、例えば、CAが未知の場合、残るCB, VA, VBが分かれば、CAを上式より求めることができます。「中和滴定実験(neutralization titration)」とは、中和反応を利用して、VAとVBを実験的に求め、未知の酸または塩基の水溶液の濃度を求めようという実験のことです。しかし、中和滴定実験では、VAとVBの値しか直接的に知ることができないため、どちらかの溶液の濃度は、既知でなければなりません。そこで、濃度既知の水溶液は、一般的に試薬製造業者が製造供給している、極めて濃度の正確な「標準溶液(standard solution)」を使うことが多いです。
酸の標準溶液には、質量や成分が安定しているシュウ酸二水和物(COOH)2・2H2Oの結晶を溶かして作った水溶液を用いることが多いです。なお、硫酸H2SO4には吸湿性(空気中の水分を吸収する性質)があり、塩化水素HClには揮発性(蒸発しやすい性質)があるため、硫酸H2SO4や塩酸HClは濃度が変化しやすいです。そのため、これらを標準溶液にすることはできません。また、水酸化ナトリウムNaOHの固体は空気中の水分や二酸化炭素CO2を吸収するため、その質量を正確に測定することが難しいです。そのため、使用直前にシュウ酸(COOH)2の標準溶液で中和滴定して濃度を決定した水酸化ナトリウムNaOH水溶液を用います。
中和滴定では、まず濃度を定めたい未知の酸または塩基の水溶液を、ホールピペットでコニカルビーカーに取ります。ホールピペットを用いるのは、標線部の管径が細くなっていて誤差が少なく、極めて精度が高いからです。このときに、精度の低い駒込ピペットやメスシリンダーを使ってはいけません。そして、濃度既知の塩基または酸の標準溶液を、ビュレットからゆっくりと滴下していき、中和点に達するまでに要した標準溶液の体積を求めるのです。なお、水溶液の濃度を正確に調整するときは、メスフラスコを使用します。メスフラスコは精度が高く、正確に溶液を希釈したいときなどに、よく用いられる実験器具です。
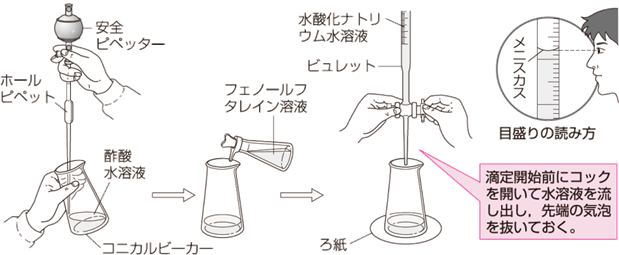
図.4 中和滴定の操作
しかしながら、いつ反応が完了したのかは、反応溶液をただ見つめていても分かりません。そこで、いつ反応が完了したのかを、どのようにして知るのかが問題となります。例として、0.1 mol/Lの塩酸HCl 10 mLを、0.1 mol/Lの水酸化ナトリウムNaOH水溶液で滴定するときを考えてみます。縦軸に混合溶液のpH、横軸にNaOH水溶液の滴下量〔mL〕を取り、それをグラフに表すと、次の図.5のようになります。
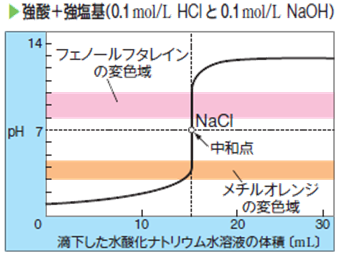
図.5 強酸-強塩基の滴定曲線
どちらも0.1 mol/Lの酸・塩基なので、中和の当量点は、水酸化ナトリウムNaOH水溶液を10 mL加えたときになります。それよりも注目すべきは、溶液のpHが、中和点で急激に変化しているということです。これを「pHジャンプ(pH jump)」といいます。このように中和点付近で急激にpHが変化する理由は、溶液の[H+]を計算してみると分かります。
|
(i)NaOHaq=0 mLのとき [H+]=0.1 mol/L ∴pH=1.0 (ii)NaOHaq=5 mLのとき [H+]=(0.1×10/1000−0.1×5/1000)÷15/1000=0.033 mol/L ∴pH=1.5 (iii)NaOHaq=9.9 mLのとき [H+]=(0.1×10/1000−0.1×9.9/1000)÷19.9/1000=0.00050 mol/L ∴pH=3.3 (iv)NaOHaq=10 mLのとき [H+]=[OH-]=10-7 mol/L ∴pH=7.0 |
このように中和点付近では、ごくわずかな[H+]の変化でも、急激に溶液のpHが変化します。これは、pHが[H+]の負の対数であることに起因しています。したがって、中和滴定において中和点を知るためには、pHメーターを使って、滴定とともに溶液のpHを測定して滴定曲線を書き、その曲線上で急激にpHが変化する点を読み取れば良いということになります。

図.6 pHメーター(税込みで約100,000円)
しかしながら、pHメーターは高価な実験器具であり、また取り扱いも丁寧でなくてはならないので、高校の化学実験レベルで使われることはほとんどありません。したがって、たいていの場合は、この急激なpH変化とともに変色するような物質を少量加えておいて、変色したときをもって、中和完了点とすることが多いです。このときに加えておく物質は、反応の完了点を指示してくれる試薬なので、一般的に「指示薬(indicator)」と呼ばれます。指示薬の多くは、ベンゼン環を含む複雑な構造を持つ有機化合物であり、特定のpHで分子構造が変化することで、色が変化します。各滴定において、何を指示薬として使うことができるかは、酸塩基の強弱と指示薬の変色域とで決まります。
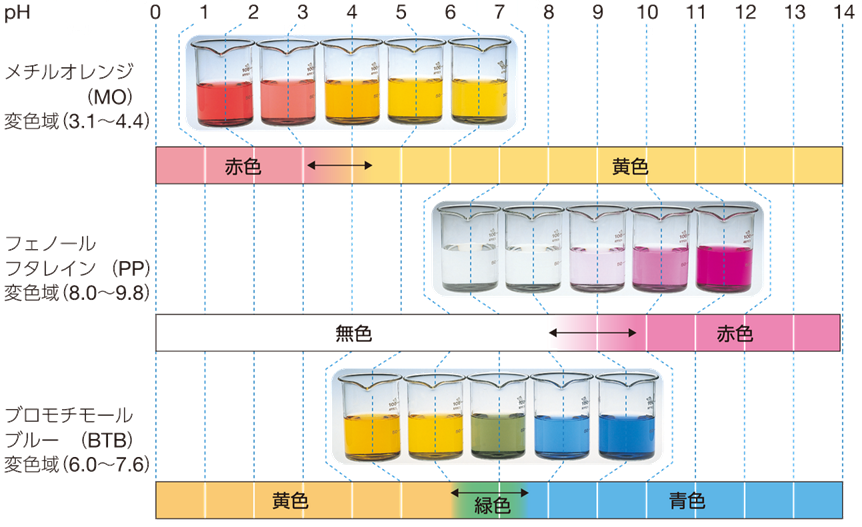
図.7 主な指示薬とその変色域
例えば、HCl+NaOHのような「強酸+強塩基」の滴定では、完全中和点はpH=7になりますが、中和点付近のpHの変化幅が極めて大きいので、変色域がpH=3〜11の中に入っている物質なら、すべて指示薬として使うことができます。しかし、CH3COOH+NaOHのような「弱酸+強塩基」の滴定では、完全中和点がpH≒9であると同時に、この点付近でのpHの変化幅が小さくなっているので、この付近に変色域を持つ物質しか、指示薬として使うことができないのです。次の図.8に、様々な強さの酸塩基の滴定曲線を示します。
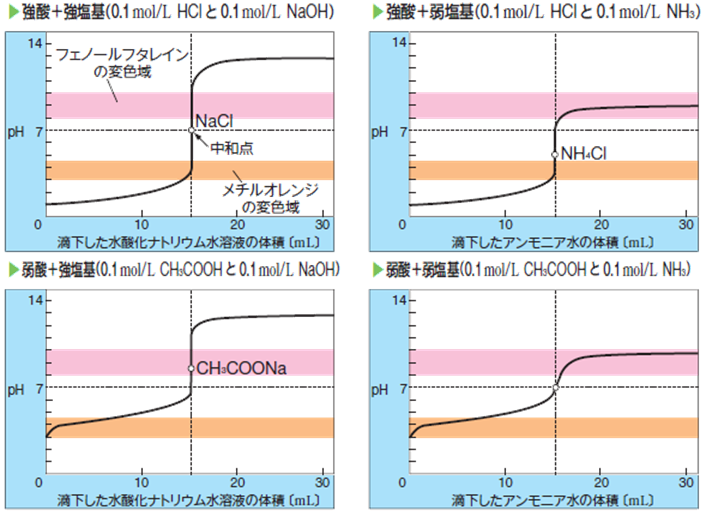
図.8 様々な強さの酸塩基の滴定曲線
これより、完全中和点のpHおよび中和点付近でのpHの変化幅を考慮すると、指示薬としての可否は、ほぼ次の表.5のようになります。「強酸+強塩基」の滴定では、フェノールフタレインでもメチルオレンジでも、どちらの指示薬でも使うことができます。しかし、それ以外の酸塩基滴定では、使えない指示薬が出てくるので、注意が必要になります。また「弱酸+弱塩基」の滴定では、いずれの指示薬でも、完全中和点を特定することができないので、どちらの指示薬も使うことができません。
表.5 指示薬の使用の可否
|
酸 |
塩基 |
フェノールフタレイン |
メチルオレンジ |
|
強酸 |
強塩基 |
〇 |
〇 |
|
弱酸 |
強塩基 |
〇 |
× |
|
強酸 |
弱塩基 |
× |
〇 |
|
弱酸 |
弱塩基 |
× |
× |
中和滴定に用いるガラス器具の使い方についても、注意が必要です。ビュレットやホールピペットは、滴定する溶液の体積を測定する器具なので、内部が純水で濡れていると、濃度が変わってしまい、誤った実験結果が出てしまいます。ただし、測定する溶液で濡れていることには構わないので、自然乾燥させる時間がないときは、中に入れる溶液で数回共洗いすれば、使用することができます。一方で、メスフラスコやビーカーは、この逆になります。すなわち、滴定される溶液は、その「物質量mol」が変わらなければ何の問題もないのだから、純水が入って溶液の濃度が変わっていても、問題がないということです。つまり、メスフラスコやビーカーを自然乾燥させる時間がないときは、純水で洗えば、そのまま使用することができます。
(5) 複雑な中和滴定
酸と塩基が1種類ずつ反応する中和滴定ならば、反応は簡単に解析することができます。しかし、滴定で起こる反応が複数ある場合は、その中和滴定の解析は少々複雑になります。次の(i)〜(iii)に、よく問題にされる複雑な中和滴定を示します。
(i) (NH4Cl + HCl) + NaOHの場合
この場合、反応は次の2段階で進むことになります。
HCl + NaOH → NaCl + H2O ・・・(I)
NH4Cl + NaOH → NaCl + NH3 + H2O ・・・(II)
中和滴定では、式(I)の反応が終わってから、式(II)の反応が進むことになります。塩化アンモニウムNH4Cl水溶液は弱酸性なので、式(II)の反応は、pH=5〜6付近から始まります。そこで、水溶液中の塩酸HClの物質量をx mol、塩化アンモニウムNH4Clの物質量をy molとすると、次の関係が成り立ちます。
式(I)で滴下したNaOHのmol = x mol (メチルオレンジが赤から黄)
式(II)で滴下したNaOHのmol = y mol (フェノールフタレインが無から赤)
(ii) (Na2CO3 + NaHCO3) + HClの場合
この場合、反応は次の2段階で進むことになります。
Na2CO3 + HCl → NaHCO3 + NaCl ・・・(III)
NaHCO3 + HCl → NaCl + CO2 + H2O ・・・(IV)
中和滴定では、式(III)の反応が完全に終わってから、式(IV)の反応が進むことになります。炭酸ナトリウムNa2CO3は、式(III)の反応で完全中和されずに、炭酸水素ナトリウムNaHCO3となります。このとき生じる炭酸水素ナトリウムNaHCO3は、より強い塩基である炭酸ナトリウムNa2CO3が反応し尽くすまで反応することはなく、増加し続けます。つまり、式(IV)では、反応する炭酸水素ナトリウムNaHCO3の物質量が、炭酸ナトリウムNa2CO3の物質量分だけ増加することになります。式(III)の反応が終わって炭酸ナトリウムNa2CO3がなくなると、炭酸水素ナトリウムNaHCO3だけになります。このときのpHは8.3ぐらいで、これはフェノールフタレインの変色域の外れです。すなわち、フェノールフタレインの赤色が消えたときが第一当量点となります。そこで、炭酸ナトリウムNa2CO3の物質量をx mol、炭酸水素ナトリウムNaHCO3の物質量をy molとすると、次の関係が成り立ちます。
式(III)で滴下したHClのmol = x mol (フェノールフタレインが赤から無)
式(IV)で滴下したHClのmol = y mol + x mol (メチルオレンジが黄から赤)
(iii) (NaOH + Na2CO3) + HClの場合
この場合、反応は次の3段階で進むことになります。
NaOH + HCl → NaCl + H2O ・・・(V)
Na2CO3 + HCl → NaHCO3 + NaCl ・・・(VI)
NaHCO3 + HCl → NaCl + CO2 + H2O ・・・(VII)
この中和滴定においては、式(V)→式(VI)→式(VII)の順に反応が起こります。しかし、式(VI)の反応はpH=12ぐらいから始まるため、式(V)の反応が90%ぐらい進行してから、同時に式(VI)の反応も少し起こり始めるのです。つまり、この反応では、式(V)と式(VI)の反応を個別に定量することは困難であり、式(V)と式(VI)の反応を完全に終えてから、式(VII)の反応を定量することになります。そこで、水酸化ナトリウムNaOHの物質量をx mol、炭酸ナトリウムNa2CO3の物質量をy molとすると、次の関係が成り立ちます。
式(V)と式(VI)で滴下したHClのmol = x mol + y mol (フェノールフタレインが赤から無)
式(VII)で滴下したHClのmol = y mol (メチルオレンジが黄から赤)
・参考文献
1) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
2) 卜部吉庸「化学の新研究」三省堂(2013年発行)
3) ジョー・シュワルツ「シュワルツ博士の化学はこんなに面白い」主婦の友社(2002年発行)
4) 渡辺正 訳「教養の化学―暮らしのサイエンス―」東京化学同人(2019年発行)