・イオン化エネルギーと電子親和力
【目次】
(i) 同一周期では、イオン化エネルギーは原子番号と共に大きくなり、18族で極大を示す
(ii) 同族では、イオン化エネルギーは原子番号が大きくなるほど、小さくなる
(i) 同一周期では、電子親和力は原子番号と共に大きくなり、17族で極大を示す
(ii) 同族では、電子親和力は原子番号が大きくなるほど、小さくなる(ただし例外がある)
(1) 電子配置
古代から中世においては、物質の根源をなす不可欠な究極的要素は「元素(element)」でした。しかし、当時はその元素がどのような姿をしているのかということは、ほとんど分かっていませんでした。現在では、すべての物質は「原子(atom)」からできていることが分かっています。現代化学では、原子が「物質を構成する具体的要素」を指すのに対し、元素は「性質を包括する抽象的概念」になっています。原子は、中心にある正電荷を帯びた「原子核(atomic nucleus)」と、その周囲にある負電荷を帯びた何個かの「電子(electron)」から構成されています。原子核の周囲を運動する電子は、「電子殻(electron shell)」と呼ばれる限られた空間に存在しており、原子核に近いほうからK殻、L殻、M殻、N殻・・・・・・と呼ばれています。次の図.1の左側は、1913年にデンマークの理論物理学者であるニールス・ボーアが示した、電子が原子核の周りを軌道運動しているとするボーアモデルです。
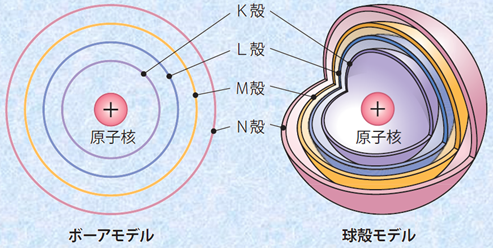
図.1 原子のボーアモデルと求殻モデル
電子殻は、それぞれで最大収容電子数が決まっており、内側からn番目の電子殻に収容できる最大電子数は、2n2 個と表すことができます。ここで、nは「主量子数(principal quantum number)」と呼ばれる値であり、電子のだいたいのエネルギー準位(原子核からのおおよその距離)を決める値です。これより、n=1のK殻には2個の電子、n=2のL殻には8個の電子、n=3のM殻には18個の電子、n=4のN殻には32個の電子が収容されることが分かります。さらに、電子殻は1つ以上の「電子軌道(electron orbital)」より構成され、電子が2個収容されるs軌道、電子が6個収容されるp軌道、電子が10個収容されるd軌道、電子が14個収容されるf軌道があります。ちなみに、sは「sharp(鋭い)」、pは「principal(主な)」、dは「diffuse(ぼやけた)」、fは「fundamental(基本的な)」の頭文字を取ったものです。もともとは原子が出すスペクトル線の特徴を表す記号で、もはや意味を失っているものの、現在でも慣用的に使われています。f軌道の先にはg軌道やh軌道も考えられますが、g軌道やh軌道を持つ安定な原子は確認されていません。
また、p軌道はさらにm=0, ±1に対応する3つの軌道から構成され、d軌道はm=0, ±1, ±2に対応する5つの軌道から、f軌道はm=0, ±1, ±2, ±3に対応する7つの軌道から構成されます。ここで、mは「磁気量子数(magnetic quantum number)」と呼ばれる値であり、軌道の広がる向きを決める値です。つまり、それぞれの軌道には電子が2個ずつ収容されるので、1つの軌道からなるs軌道には1×2=2個、3つの軌道からなるp軌道には3×2=6個、5つの軌道からなるd軌道には5×2=10個、7つの軌道からなるf軌道には7×2=14個の電子が、最大で収容されることになるのです。次の表.1に、主な電子殻と電子軌道の関係を示します。
表.1 主な電子殻と電子軌道の関係
|
主量子数 |
電子殻 |
軌道名 |
磁気量子数 |
収容できる電子数 |
最大収容電子数 |
|
n=1 |
K殻 |
1s |
m=0 |
2 |
2 |
|
n=2 |
L殻 |
2s |
m=0 |
2 |
8 |
|
2p |
m=0, ±1 |
6 |
|||
|
n=3 |
M殻 |
3s |
m=0 |
2 |
18 |
|
3p |
m=0, ±1 |
6 |
|||
|
3d |
m=0, ±1, ±2 |
10 |
|||
|
n=4 |
N殻 |
4s |
m=0 |
2 |
32 |
|
4p |
m=0, ±1 |
6 |
|||
|
4d |
m=0, ±1, ±2 |
10 |
|||
|
4f |
m=0, ±1, ±2, ±3 |
14 |
一般的に電子は、主量子数nの小さい電子殻から収容されることになっており、最も内側にあるK殻から、順番に電子が収容されていきます。したがって、どの電子殻までどのように電子が収容されていくのかは、元素の種類によって異なり、それぞれの原子の最も外側の電子殻の電子を「最外殻電子(peripheral electron)」といいます。最外殻電子は、一般的にその原子の化学結合や物性に深く関係しており、「価電子(valence electron)」とも呼ばれています。なお、貴ガス原子に関しては、最外殻電子が不活性なので、例外的に価電子は0とされています。次の表.2に、主な元素の「電子配置(electron configuration)」を示します。
表.2 HからKrまでの電子配置
|
原子 番号 |
元素 記号 |
K殻 |
L殻 |
M殻 |
N殻 |
||||||
|
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
||
|
1 |
H |
1 |
|
|
|
|
|
|
|
|
|
|
2 |
He |
2 |
|
|
|
|
|
|
|
|
|
|
3 |
Li |
2 |
1 |
|
|
|
|
|
|
|
|
|
4 |
Be |
2 |
2 |
|
|
|
|
|
|
|
|
|
5 |
B |
2 |
2 |
1 |
|
|
|
|
|
|
|
|
6 |
C |
2 |
2 |
2 |
|
|
|
|
|
|
|
|
7 |
N |
2 |
2 |
3 |
|
|
|
|
|
|
|
|
8 |
O |
2 |
2 |
4 |
|
|
|
|
|
|
|
|
9 |
F |
2 |
2 |
5 |
|
|
|
|
|
|
|
|
10 |
Ne |
2 |
2 |
6 |
|
|
|
|
|
|
|
|
11 |
Na |
2 |
2 |
6 |
1 |
|
|
|
|
|
|
|
12 |
Mg |
2 |
2 |
6 |
2 |
|
|
|
|
|
|
|
13 |
Al |
2 |
2 |
6 |
2 |
1 |
|
|
|
|
|
|
14 |
Si |
2 |
2 |
6 |
2 |
2 |
|
|
|
|
|
|
15 |
P |
2 |
2 |
6 |
2 |
3 |
|
|
|
|
|
|
16 |
S |
2 |
2 |
6 |
2 |
4 |
|
|
|
|
|
|
17 |
Cl |
2 |
2 |
6 |
2 |
5 |
|
|
|
|
|
|
18 |
Ar |
2 |
2 |
6 |
2 |
6 |
|
|
|
|
|
|
19 |
K |
2 |
2 |
6 |
2 |
6 |
|
1 |
|
|
|
|
20 |
Ca |
2 |
2 |
6 |
2 |
6 |
|
2 |
|
|
|
|
21 |
Sc |
2 |
2 |
6 |
2 |
6 |
1 |
2 |
|
|
|
|
22 |
Ti |
2 |
2 |
6 |
2 |
6 |
2 |
2 |
|
|
|
|
23 |
V |
2 |
2 |
6 |
2 |
6 |
3 |
2 |
|
|
|
|
24 |
Cr |
2 |
2 |
6 |
2 |
6 |
5 |
1 |
|
|
|
|
25 |
Mn |
2 |
2 |
6 |
2 |
6 |
5 |
2 |
|
|
|
|
26 |
Fe |
2 |
2 |
6 |
2 |
6 |
6 |
2 |
|
|
|
|
27 |
Co |
2 |
2 |
6 |
2 |
6 |
7 |
2 |
|
|
|
|
28 |
Ni |
2 |
2 |
6 |
2 |
6 |
8 |
2 |
|
|
|
|
29 |
Cu |
2 |
2 |
6 |
2 |
6 |
10 |
1 |
|
|
|
|
30 |
Zn |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
|
|
|
|
31 |
Ga |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
1 |
|
|
|
32 |
Ge |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
2 |
|
|
|
33 |
As |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
3 |
|
|
|
34 |
Se |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
4 |
|
|
|
35 |
Br |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
5 |
|
|
|
36 |
Kr |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
|
|
高校化学では、「電子は内側の電子殻からK殻、L殻、M殻・・・・・・の順に配置する」と習います。しかし、表.2からも分かるように、厳密にはそれは事実と異なります。電子がK殻から順に配置されていき、M殻の3p軌道が埋められたあと、次の電子はM殻の3d軌道には入らず、N殻の4s軌道に入るのです。これは、それぞれの電子軌道のエネルギー準位を考えることで解決することができます。多電子系において、各電子軌道のエネルギー準位は、おおよそ次の図.2のような順番となります。
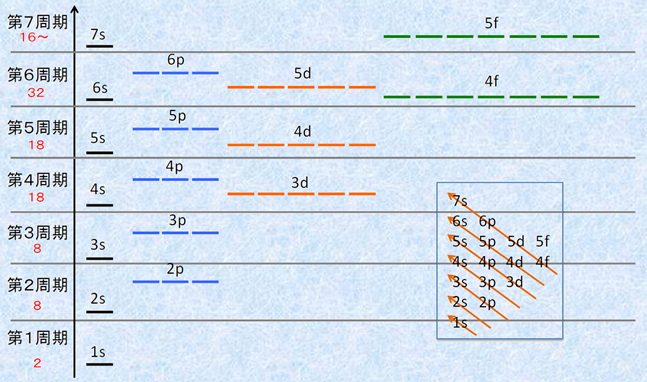
図.2 各電子軌道のエネルギー準位の関係
電子は、エネルギー準位の低い軌道から順に配置されていきます。図.2を見ると、3d軌道よりも4s軌道の方のエネルギー準位が低いため、3p軌道が電子で埋められたあとは、次の電子は3d軌道よりも優先的に4s軌道に配置されていくのです。K殻、L殻、M殻・・・・・・と電子殻が内側から外側に位置するようになるにつれて、エネルギー準位が高くなる事実に反し、このようにある電子軌道でエネルギー準位の逆転現象が起こる理由は、電子軌道の形に答えがあります。
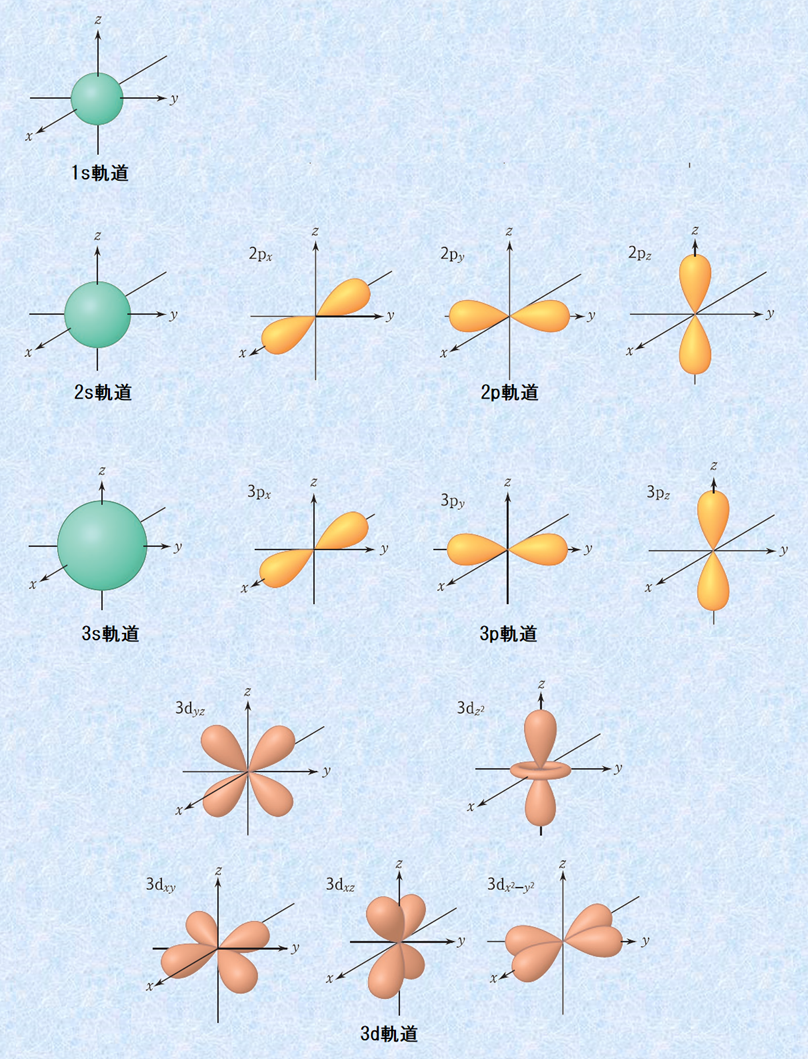
図.3 電子軌道の形
s軌道は、原子核を中心として球状に分布した軌道であり、1s<2s<3s・・・・・・と電子殻が大きくなるにつれて、s軌道も大きくなっていきます。また、p軌道は、三次元方向に伸びた亜鈴形の軌道であり、s軌道と同じように2p<3p<4p・・・・・・と電子殻と共に大きくなっていきます。d軌道やf軌道は、主に金属元素で重要になってくる軌道であり、非常に複雑な形をしています。このような電子軌道の形が、どのようにしてエネルギーに関わってくるのでしょうか?結論を述べる前に、電子と原子核の間に作用する力について触れておく必要があります。自由に動き回れる電子が、電子殻や電子軌道といった限られた空間に束縛されているのは、電子と原子核の間に「クーロン力(coulomb force)」と呼ばれる力が作用しているからです。クーロン力とは、荷電粒子間に働く静電気的な力のことです。
![]()
ここで、q1とq2は荷電粒子の電荷量、rは粒子間の距離、kは比例定数です。Fはq1×q2>0ならば斥力であり、q1×q2<0ならば引力を表します。電子は負の電荷を持ち、原子核は正の電荷を持つことから、原子核と電子の間では、引力が作用していることになります。これが、自由に運動する電子が原子核の周りに束縛されている理由です。また、クーロン力は距離の2乗に反比例することから、原子核の近くにある電子ほど、強いクーロン力を受けていることになります。強い引力を受けている電子は、他の荷電粒子の相互作用の影響を受けにくいので、原子核の近くにある電子ほどエネルギー的に安定化します。よって、原子核に最も接近しているK殻の電子が最も安定であり、エネルギー準位も低くなるのです。
また、図.3の電子軌道の形を見ると、s軌道<p軌道<d軌道<f軌道と収容電子数が多くなるにつれて、電子軌道の形が外側に広がるようになり、電子は原子核から離れていくことが分かります。原子核からどのくらいの距離に電子が多く存在しているのかを表したものを、「動径分布関数(radial distribution function)」といいます。次の図.4は、M殻の電子軌道の動径分布関数です。図では分かりにくいのですが、各軌道の原子核からの平均距離は全部同じです。s軌道やp軌道は原子核付近に電子が少し存在していますが、d軌道やf軌道は原子核付近には電子が存在していません。したがって、原子核付近の電子の存在確率は、s軌道>p軌道>d軌道>f軌道となり、各電子軌道のエネルギー準位も、s軌道<p軌道<d軌道<f軌道となるのです。一般的にK殻<L殻<M殻・・・・・・とエネルギー準位が高くなるのは、間違いではありません。しかし、それは電子殻レベルで見た場合であり、電子軌道レベルまで見た場合は、電子殻のエネルギーの壁を超えて、4s<3dといったエネルギー準位の逆転現象が生じるのです。
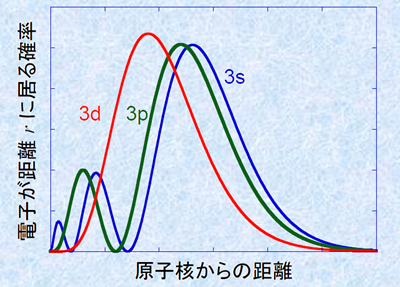
図.4 M殻の電子軌道の動径分布関数
また、周期表の第4周期に見られるように、電子殻のエネルギー準位の壁を超えて、3d軌道よりも4s軌道に優先的に電子が配置された場合、面白い現象が見られます。一般的に電子は、最外殻に配置されていくのですが、4s軌道に先に電子が埋められた場合、電子は内殻である3d軌道に配置されていくことになるのです。次の表.3のSc〜Cuのように、内殻に優先的に電子が配置されていく元素を「遷移元素(transition elements)」といいます。遷移元素は、d軌道やf軌道に電子が配置されていく元素であり、そのすべてが金属元素です。遷移元素の最外殻電子数は、族番号によらず1または2であるため、同一周期の元素同士で似たような性質を示します。これに対して、s軌道やp軌道に電子が配置されていく元素を「典型元素(typical elements)」といいます。典型元素は、最外殻に電子が配置されていき、族番号が1つ増えるにつれ価電子が1つずつ増えていくため、族ごとに特有の性質を示します。
表.3 Sc〜Cuまでの電子配置
|
原子 番号 |
元素 記号 |
K殻 |
L殻 |
M殻 |
N殻 |
||||||
|
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
||
|
21 |
Sc |
2 |
2 |
6 |
2 |
6 |
1 |
2 |
|
|
|
|
22 |
Ti |
2 |
2 |
6 |
2 |
6 |
2 |
2 |
|
|
|
|
23 |
V |
2 |
2 |
6 |
2 |
6 |
3 |
2 |
|
|
|
|
24 |
Cr |
2 |
2 |
6 |
2 |
6 |
5 |
1 |
|
|
|
|
25 |
Mn |
2 |
2 |
6 |
2 |
6 |
5 |
2 |
|
|
|
|
26 |
Fe |
2 |
2 |
6 |
2 |
6 |
6 |
2 |
|
|
|
|
27 |
Co |
2 |
2 |
6 |
2 |
6 |
7 |
2 |
|
|
|
|
28 |
Ni |
2 |
2 |
6 |
2 |
6 |
8 |
2 |
|
|
|
|
29 |
Cu |
2 |
2 |
6 |
2 |
6 |
10 |
1 |
|
|
|
ここで、表.3の遷移元素に注目したとき、V(1s2, 2s2, 2p6, 3s2, 3p6, 3d3, 4s2)とCr(1s2, 2s2, 2p6, 3s2, 3p6, 3d5, 4s1)の間、Ni(1s2, 2s2, 2p6, 3s2, 3p6, 3d8, 4s2)とCu(1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s1)の間で、原子番号が1つ増えるときに奇妙な現象が起こっていますね。3d軌道に電子が1個追加されたとき、3d軌道の電子数が5個と10個になるように、わざわざ4s軌道から電子が移動してきています。この理由は、d軌道の最大収容電子数が10個であり、d軌道の収容電子数が10個と5個になったとき、特別に元素の安定性が増すためです。3d軌道の電子が10個で満たされたとき、その元素は「閉殻(closed shell)」したといいます。閉殻というのは、その最外殻に最大数の電子が入っている状態のことです。また、3d軌道の電子が5個で満たされたときの構造は、閉殻に対して「半閉殻(half closed shell)」といいます。d軌道が半閉殻構造を取っているとき、5つの軌道に電子が1個ずつ収容されることになります。なぜそれぞれの軌道に電子が1個ずつ収容されるのかというと、もし1つの狭い軌道に電子が2個収容されるなら、電子同士のクーロン力による斥力が働いて反発し合い、エネルギー的に不安定になるからです。そのため、電子は軌道に収容されるとき、許される限りできるだけ多くの軌道に分布しようとします。閉殻構造と半閉殻構造は、電子間の反発が上手く避けられたバランスの良い電子配置であり、これらの電子配置を持つ原子は、特別な安定性を示すのです。

図.5 d軌道の半閉殻と閉殻
(2) イオン化エネルギー
気体状態の原子から電子を1個取り去って、1価の陽イオンにするのに必要な最小のエネルギーを、「イオン化エネルギー(ionization energy)」といいます。原子核に束縛されている電子を無理やり取り去るのにエネルギーを使うので、イオン化エネルギーは熱化学的には吸熱反応になります。例として、次にナトリウムNaのイオン化エネルギーを表すエンタルピー変化を付した化学反応式を示します。
Na(気) → Na+(気) + e- ΔH=496 kJ
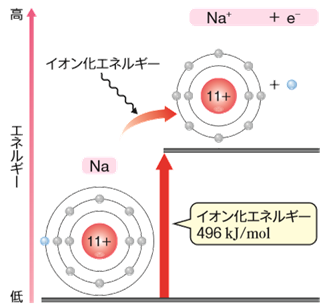
図.6 ナトリウムNaのイオン化エネルギー
つまり、イオン化エネルギーが小さいほど電子を放出しやすいということになるので、イオン化エネルギーが小さいほど陽イオンになりやすく、イオン化エネルギーが大きいほど陽イオンになりにくいということになります。そのため、イオン化エネルギーは、最外殻電子の安定性を示す指標となります。イオン化エネルギーが大きいほど、最外殻電子はエネルギー的に安定であるということです。次の図.7に、主な原子のイオン化エネルギーと原子番号の関係を示します。
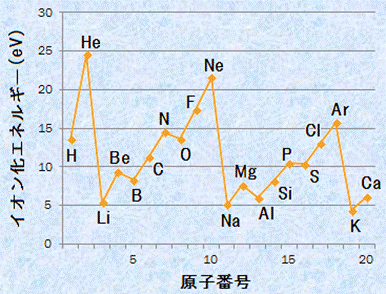
図.7 主な原子のイオン化エネルギーと原子番号の関係(1 eV=1.602×10-19 J)
原子のイオン化エネルギーは、ある程度周期的な変化を見せます。周期表の同じ族では、原子番号が大きいほどイオン化エネルギーは小さくなります。また、周期表の同じ周期では、18族元素でイオン化エネルギーが極大を示し、1族元素でイオン化エネルギーが極小を示します。このイオン化エネルギーの周期的な変化は、電子配置を考えることで理解することができます。
(i) 同一周期では、イオン化エネルギーは原子番号と共に大きくなり、18族で極大を示す
原子番号3のLiから原子番号10のNeまで、イオン化エネルギーは、原子番号と共に大きくなる傾向があります。この理由は、同一周期では、原子番号の増加と共に原子核の陽子数が増え、最外殻電子を原子核に引き付けるクーロン力が強くなるからです。このように最外殻電子が感じる原子核の陽電荷のことを、「有効核電荷(effective nuclear charge)」といいます。第2周期のLiからNeまで、電子はL殻に順番に配置されていきます。原子核からの距離は、L殻ではK殻の約4倍もあるので、L殻から見ると、K殻は原子核とほぼ等しい位置にあると見なせます。つまり、このときL殻より内側にあるK殻の電子は、原子核の陽電荷を打ち消す役割をしていると考えることができるのです。このように最外殻電子と原子核との間に働くクーロン力が、内殻電子の存在によって弱くなる現象を「遮蔽効果(shielding effect)」といいます。有効核電荷を正確に計算するのは難しいですが、大体の値を次のように見積もることができます。
有効核電荷 = 原子核中の陽子数 − 内殻電子の数
第2周期のLiからNeまで、K殻にある2個の電子が、それぞれの原子核の陽電荷を2だけ打ち消していると考えると、Liの有効核電荷は+3−2=+1、Beの有効核電荷は+4−2=+2、Bの有効核電荷は+5−2=+3・・・・・・というように、有効核電荷は最外殻電子数と等しくなります。このように同一周期では、原子番号と共に有効核電荷が増大していきます。その結果、最外殻電子が受けるクーロン力も、有効核電荷と共に増大していくことになるのです。
表.4 第2周期の原子の有効核電荷
|
族 |
1族 |
2族 |
13族 |
14族 |
15族 |
16族 |
17族 |
18族 |
|
元素記号 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
陽子数 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
内殻電子数 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
|
最外殻電子 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
有効核電荷 |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
+8 |
同一周期において、原子番号の増大と共に、クーロン力が大きくなるのは事実です。しかし、図.7を見てみると、B(1s2, 2s2, 2p1)、O(1s2, 2s2, 2p4)、Al(1s2, 2s2, 2p6, 3s2, 3p1)、S(1s2, 2s2, 2p6, 3s2, 3p4)などで、原子番号が大きくなっているのにイオン化エネルギーが小さくなるという現象が生じています。これを見て、すぐに理由が分かった人は、電子配置をよく理解できていますね。B(1s2, 2s2, 2p1)やAl(1s2, 2s2, 2p6, 3s2, 3p1)では、最外殻電子のうちの1個がp軌道に入ることになります。p軌道はs軌道に比べて不安定であり、エネルギー準位が高くて電子の束縛が弱いのです。よって、BやAlでは、最外殻のp軌道の電子を放出しやすいことになり、わずかにイオン化エネルギーが小さくなるのです。また、O(1s2, 2s2, 2p4)やS(1s2, 2s2, 2p6, 3s2, 3p4)では、最外殻のp軌道に電子が4個収容されています。p軌道は3つの軌道を持っているので、4個の電子を規則に従って順番に収容していくと、1つの軌道にだけ電子が2個入ることになります。この状態は、電子のクーロン力による反発が大きくなって不安定となるので、電子を放出しやすくなるという訳です。
(ii) 同族では、イオン化エネルギーは原子番号が大きくなるほど、小さくなる
図.7の同族元素の関係を見たとき、イオン化エネルギーは原子番号が大きくなるほど、小さくなることが分かります。例えば、18族のHe, Ne, Arを比べたとき、イオン化エネルギーはHe>Ne>Arとなり、原子番号の大きいものほど小さくなります。この理由は、原子番号の増加と共に電子殻が大きくなり、最外殻電子を原子核に引き付けるクーロン力が弱くなるからです。クーロン力は距離の2乗に反比例するので、同族で電子殻を比べたとき、原子番号と共にK殻<L殻<M殻・・・・・・と電子殻が大きくなり、クーロン力は弱くなります。それ故に、イオン化エネルギーは原子番号が大きくなるほど、小さくなるのです。
(3) 電子親和力
気体状態の原子が電子を1個受け取って、1価の陰イオンになるときに放出するエネルギーを、「電子親和力(electron affinity)」といいます。電子を受け取ったときに外部にエネルギーを放出するので、電子親和力は熱化学的には発熱反応になります。例として、次に塩素Clの電子親和力を表すエンタルピー変化を付した化学反応式を示します。
Cl(気) + e- → Cl- (気) ΔH=−349 kJ
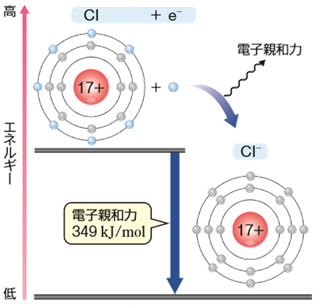
図.8 塩素Clの電子親和力
つまり、電子親和力が大きいほど陰イオンになったとき安定化するので、電子親和力が大きいほど電子を受け取って陰イオンになりやすく、電子親和力が小さいほど陰イオンになりにくいということになります。しかしながら、電気的に中性状態の原子に電子を与えて、果たして原子が安定になるのかという疑問も当然生じるはずです。電気的に中性である原子と電子の間には、本来何ら引力も斥力も働かないはずなのですから。ただし、電子が原子に近付いて最外殻付近まで来ると、原子は単純な球状の中性粒子とは見なせなくなります。ここまで近付くと、電子は最外殻電子から受ける斥力と有効核電荷から受ける引力とが絡んだ、合力を受けると考えられるからです。つまり、中性状態の原子でも、電子を引き付ける能力がわずかに存在する場合があるのです。したがって、電子親和力が大きい原子とは、電子を受け取って陰イオンになることによって、中性原子よりも安定化する原子のことです。言い換えれば、電子を受け取ることによって、閉殻構造か半閉殻構造を獲得できる原子になります。次の図.9に、主な原子の電子親和力と原子番号の関係を示します。
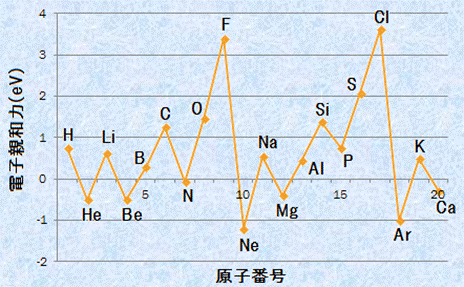
図.9 主な原子の電子親和力と原子番号の関係(1 eV=1.602×10-19 J)
陰イオンになって安定化できるエネルギーが小さい分、電子親和力はイオン化エネルギーに比べて小さくなります。図.7や図.9を見ると、イオン化エネルギーが5〜25 eVであるのに対して、電子親和力は- 1〜4 eVぐらいです。また、電子親和力はイオン化エネルギーとある程度似たような周期的変化を見せますが、異なる部分もあります。それは、電子親和力は17族元素で極大を示し、イオン化エネルギーは18族元素で極大を示すことです。この違いもまた、電子配置とクーロン力を考えることで理解することができます。
(i) 同一周期では、電子親和力は原子番号と共に大きくなり、17族で極大を示す
同一周期では、一般的に原子番号と共に原子核の有効核電荷が増大するので、18族元素では最も強く最外殻電子が束縛されることになります。しかし、電子親和力とは、電子を受け取ったときに放出するエネルギーのことなので、18族元素が電子を受け取るには、外側の電子殻を使う必要があります。例えば、Heが電子を受け取るとするなら、K殻はすでに満員なので、次の電子は外側のL殻に収容されます。しかし、内側のK殻が原子核の陽電荷を打ち消しているとすると、この状態ではHeの有効核電荷は+2−2=0で、Heには新しく収容される電子を引き付ける能力はないことになります。つまり、18族元素では受け取る電子に引力が働かないので、電子親和力は、電子を受け取ることによって閉殻構造を獲得できる17族元素が極大になるのです。
同一周期では、一般的に原子番号の増大と共に電子親和力は大きくなるということができるでしょう。しかし、図.9を見てみると、18族元素を除いたBe(1s2, 2s2)、N(1s2, 2s2, 2p3)、Mg(1s2, 2s2, 2p6, 3s2)、P(1s2, 2s2, 2p6, 3s2, 3p3)などで、原子番号が大きくなっているのに電子親和力が小さくなるという現象が生じています。この理由もまた、電子配置を考慮することで理解することができます。Be(1s2, 2s2)とMg(1s2, 2s2, 2p6, 3s2)では、それぞれ2sと3s軌道が電子で満たされており、この状態で電子を受け取ると、受け取った電子はp軌道に入ることになります。p軌道は、s軌道に比べてエネルギー準位が高く不安定なので、BeとMgでは、電子親和力が小さくなるのです。また、N(1s2, 2s2, 2p3)やP(1s2, 2s2, 2p6, 3s2, 3p3)では、最外殻のp軌道が半閉殻構造で安定しており、電子を受け取ると安定な半閉殻構造を壊すことになります。したがって、NやPでは、電子を受け取ることが不利に働くので、電子親和力は小さくなります。
(ii) 同族では、電子親和力は原子番号が大きくなるほど、小さくなる(ただし例外がある)
同族では、一般的に原子番号が大きくなるほど電子殻が大きくなり、電子を束縛するクーロン力が弱くなるので、電子親和力は小さくなる傾向にあります。しかし、これは周期表全体を見たときの傾向であり、第2周期と第3周期を比べたとき、電子親和力は第2周期<第3周期となって、電子親和力の大きさが逆転しています。この理由は、イオンの大きさを考えることで理解することができます。
表.5 17族元素のイオン半径と電子親和力
|
元素記号 |
F |
Cl |
Br |
I |
|
イオン半径 |
1.19×10-10 m |
1.67×10-10 m |
1.82×10-10 m |
2.06×10-10 m |
|
電子親和力 |
3.40 eV |
3.62 eV |
3.37 eV |
3.06 eV |
同族元素では、原子番号が大きくなるほど外側の電子殻に電子が配置されるようになるので、イオンの大きさは大きくなります。例えば、第2周期と第3周期の17族元素の陰イオンの大きさを比べると、F- (0.119 nm)<Cl- (0.67 nm)のようになります。したがって、フッ化物イオンF- の場合、塩化物イオンCl- よりもかなり小さな領域に電子が集中することになるので、クーロン力による電子の反発が生じて、エネルギー的に不安定になると考えられます。これが、電子親和力が第2周期<第3周期となる理由です。この傾向は他の元素にも見られ、第2周期と第3周期では、一般的に第3周期の元素の方が電子親和力が大きくなります。
(4) 電気陰性度
「電気陰性度(electronegativity)」とは、原子が結合状態で結合に関与している共有電子対を、自身の方向へどのくらいの強さで引き付けているのかを数値化したものです。電気陰性度の小さな原子ほど電気的に陽性で、また電気陰性度の大きな原子ほど電気的に陰性です。電気陰性度は、電子親和力と名前も定義も似ていますが、全くの別物なので注意が必要です。電気陰性度は自身の方向へ共有電子対を引き付ける強さを相対的に数値化したものであり、何の単位も存在しないのに対して、電子親和力は電子を受け取ったときに放出するエネルギーのことで、「kJ/mol」というエネルギーの単位が存在するのです。
電気陰性度の値としては、一般的にアメリカの化学者であるライナス・ポーリングが、原子間の結合エネルギーの大きさに基づいて算出した次の図.10で示したような値を用います。ポーリングは、フッ素Fの電気陰性度を4.0として、各原子の電気陰性度を決定しました。貴ガスは共有結合を作らないので、一般的に電気陰性度は定められていません。
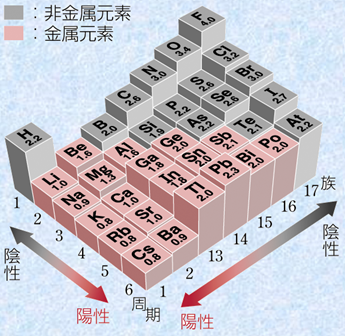
図.10 ポーリングの電気陰性度
電気陰性度は、すべての元素の中でフッ素Fが最大であり、周期表の右上に行くほど大きくなる傾向にあります。しかし、18族元素のHe, Ne, Arなどは、化学結合を作りにくいので、一般的に定義されていません。周期表の中では、水素Hが特徴的な電気陰性度を持っており、その値は2.20と1族元素の中では異様に大きいです。高校レベルの化学では、水素のイオンは水素イオンH+ の陽イオンしかでてきませんが、大学レベルの化学では、水素化物イオンH- のように水素の陰イオンがでてきます。このように水素は中間的な電気陰性度を持つので、陽イオンにも陰イオンにもなることができるのです。
ところで、アメリカの化学者であるロバート・マリケンは、原子のイオン化エネルギーと電子親和力の平均値を電気陰性度と定義しました。マリケンは、着目した原子のイオン化エネルギーが大きいほど自身の電子を引き付ける力が強く、また電子親和力が大きいほど相手の電子を引き付ける力が強いと考えたのです。この式によって導かれたマリケンの電気陰性度は、ポーリングの求めた値と強い相関関係にあります。しかし、このマリケンの方法では、すべての原子の電気陰性度を正確に求められないという欠点があり、一般的にマリケンの電気陰性度は用いられていません。けれどもこの式は、電気陰性度がイオン化エネルギーや電子親和力と強い関係にあることを示した点で評価されています。
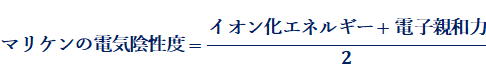
(5) 核力
自由に動き回れる電子が、電子殻や電子軌道といった限られた空間に存在できるのは、クーロン力のおかげでした。原子は荷電粒子の集まりなので、原子はクーロン力がなければ、安定して存在できません。しかし、ここで1つの疑問が生じます。クーロン力が原子を安定化させている力なのだとしたら、どうして原子核といった非常に狭い領域に、陽子のような陽電荷を持った粒子同士が集合して存在できるのでしょうか?普通に考えれば、陽子同士のクーロン力による斥力が働いて、原子核はバラバラになって崩壊してしまうはずです。原子核が安定して存在できる理由は、原子核の中で「核力(nuclear force)」という非常に強い引力が作用しているからです。
核力について説明する前に、そもそもクーロン力や重力のように、距離の離れた粒子間で働く力の原理が何なのかを整理しておきましょう。粒子間に働く力は、2個の粒子が別の粒子をキャッチボールすることにより発生します。例えば、クーロン力の場合は、電荷を持つ2個の粒子が「光子(photon)」をキャッチボールすることにより発生します。重力の場合は、2個の粒子が「重力子(graviton)」をキャッチボールすることにより発生します。このように粒子間で力を媒介する粒子のことを、「ゲージ粒子(gauge boson)」といいます。なお、重力子は理論だけで、まだ発見はされていません。しかし、2016年には、レーザー干渉計重力波観測所(LIGO)が、太陽質量の36倍と29倍のブラックホール同士が合体したときに放出される重力波を世界で初めて検出することに成功しています。重力子は重力波を媒介する素粒子なので、重力子の発見も期待されています。
そして、原子核を強い引力により安定化させている核力も、ゲージ粒子を交換することによって働いていると考えられているのです。核力を媒介するゲージ粒子は「パイ中間子(pion)」と呼ばれ、この理論は「中間子理論(meson theory)」と呼ばれています。核力は、陽子と中性子が原子核内でパイ中間子を光速に近い速さでキャッチボールすることで働いているのです。陽子がパイ中間子を放出し、中性子がこれを受け取ると、陽子は中性子になり、中性子は陽子へと変化します。このようにパイ中間子によって陽子の正電荷が絶えず運び続けられ、その結果として、陽子と中性子の間には強い核力が働くことになるのです。
表.6 相互作用とゲージ粒子の種類
|
相互作用 |
クーロン力 |
重力 |
核力 |
|
ゲージ粒子 |
光子 |
重力子 |
パイ中間子 |
|
相対強度 |
1 |
10-36 |
106 |
パイ中間子の存在を予言したのは、日本の物理学者である湯川秀樹です。湯川がパイ中間子を予言した1935年は戦時中であり、日本人の科学者は海外から評価されにくい状況にありました。しかし、12年後の1947年にイギリスの物理学者であるセシル・パウエルが、宇宙線の中からパイ中間子を発見し、これによって湯川の中間子理論の正しさが証明されました。これにより、湯川は日本人として初めてのノーベル章を1949年に受賞しました。ちなみに、核力の発見には、面白いエピソードがあります。当時、湯川は当時不眠症に悩まされていました。眠れない夜、湯川は天井の木の板の年輪模様を眺めていて、この中間子理論がひらめいたといいます。年輪の真ん中にグリグリとした模様が2つあって、それをひょうたん型の年輪が取り囲んでいるのが原子核に見えたのだと、後に湯川は語っています。中間子理論自体は、数式で表されるものですが、年輪の模様というイメージから生まれたというのは、実に興味深いことです。

図.11 パイ中間子を予言した湯川秀樹は、1949年にノーベル物理学を受賞した
2025年には、日本物理学会が「1949年に湯川秀樹が日本人で初めてノーベル賞を受賞することが決まった日」である11月3日を「物理の日」と制定しました。日本で発見された原子番号113番の元素「ニホニウム」にもちなんでいます。一般の人にも物理学に親しみを持ってもらうのが狙いということです。その他、学問にちなんだ日は、日本化学会などが定める「化学の日(1 mol当たりの粒子数であるアボガドロ数6.20×1023にちなんで10月23日)」や、日本数学検定協会が定める「数学の日(円周率にちなんで3月14日)」などがあります。
・参考文献
1) 卜部吉庸「化学の新研究」三省堂(2013年発行)
2) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
3) H.ハート/L.E.クレーン/D.J.ハート 共著「ハート基礎有機化学」培風館(1986年発行)
4) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)