・無機化学(錯イオン生成反応)
【目次】
(ii) 配位子が水酸化物イオンOH- のヒドロキシド錯イオン
(iii) 配位子がシアン化物イオンCN- のシアニド錯イオン
(iv) 配位子がチオ硫酸イオンS2O32- のチオスルファト錯イオン
(1) 錯イオン
(i) 錯イオンとは何か?
気体状態の原子から電子を取り去り、陽イオンにするためには、イオン化エネルギーという大きなエネルギーが必要でした。それにもかかわらず、金属元素の原子は、物質中では、たいてい陽イオンの形で存在しています。このようなことが可能なのは、電子を放出して不安定な陽イオンになっても、陽イオンの周囲には多くの電子や陰イオンがあるので、それらと強く引き合うことで、全体としてはエネルギー的に安定になるからです。
例えば、塩化銅(II) CuCl2が水に溶解したときのことを考えましょう。銅(II)イオンCu2+ と塩化物イオンCl- が別れると、銅(II)イオンCu2+ は、極めて不安定な状態となります。しかし、周囲には水分子しかいないのだから、銅(II)イオンCu2+ は、水分子の持つ電子を引き付けようとします。電子の所有権は、当然酸素原子にありますが、銅(II)イオンCu2+ は、この酸素原子の持つ電子を奪い取ろうとするのです。ところが、電気陰性度の大きさはO>Cuなので、銅Cuが酸素原子の持つ電子を奪い取ることはできません。だとすれば、銅(II)イオンCu2+ は、結合に使われていない酸素原子の有する非共有電子対を貸してもらう以外には、生きる道がなくなります。このようにして、銅(II)イオンCu2+ が酸素原子の非共有電対を引き付けた形の結合が、銅(II)イオンCu2+ と水H2Oの酸素原子との間に生じます。このように、電子対を一方の原子から他方の原子に一方的に供給して生じる結合は、「配位結合(coordinate bond)」と呼ばれます。そこで、このときの水分子のような作用をする物質を「配位子(ligand)」と呼びます。
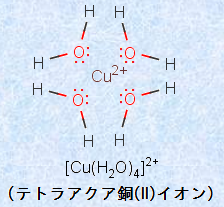
図.1 銅(II)イオンCu2+ と水H2Oの錯イオン
さて、提供された2個の電子e- の中で、実際はその1/4ぐらいの電荷しか、陽イオンに貸し与えられていません。そこで、陽イオンは1個の配位子だけでは満足できないので、さらにいくつか配位子を集めます。集められた配位子は、反発をできるだけ避けようとするから、規則正しく配列します。このようにしてできたのが「錯イオン(complex ion)」です。溶液中の金属イオンは、基本的にはこのような錯イオンの形で存在し、これを行動単位としています。
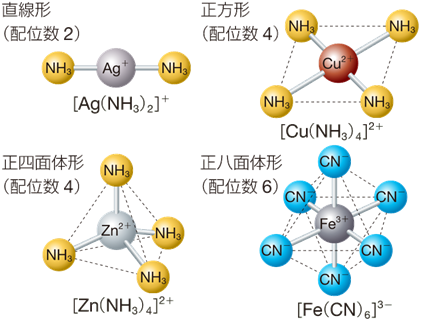
図.2 様々な錯イオンの形
ところで、電気陰性度の小さい金属(1族や2族など)のイオンの周囲にも、常に配位子が存在します。例えば、ナトリウムイオンNa+ の周囲には、だいたい4分子の水H2Oが常に存在しています。しかし、トリウムイオンNa+ は、本来電子を引き付ける力が弱いため、水H2Oとは安定な結合を作らず、水H2Oは激しく入れ替わっています。したがって、これらのイオンでは「水和」は起こっていても、「錯イオンを形成」しているとはいわないのが普通なのです。錯イオンを作りやすいのは、主に電気陰性度が中程度の遷移金属の陽イオンであるのは、このような理由からです。
(ii) HSAB原理
錯体の安定性は、各種の配位原子の順序によって、大きく2つのグループに分けられることが経験的に示されています。例えば、アルミニウムイオンAl3+ やカルシウムイオンCa2+、鉄(III)イオンFe3+、コバルト(III)イオンCo3+ などの比較的軽い陽イオンは、次のような順序で、陰イオンと安定な配位結合を形成します。
F- > Cl- > Br- > I-
O2- > S2- > Se2- > Te2-
N3- > P3- > As3- > Sb3-
一方で、銅(I)イオンCu+ や銀(I)イオンAg+、カドミウム(II)イオンCd2+ などの比較的重い陽イオンは、上記とほぼ反対の傾向を示し、次のような順序で、陰イオンと安定な配位結合を形成します。
F- < Cl- < Br- < I-
O2- < S2- < Se2- < Te2-
N3- < P3- < As3- < Sb3-
その後、1963年にアメリカの化学者であるラルフ・ピアソンは、これをもとにして「硬い酸(hard acid)」や「硬い塩基(hard base)」、「軟らかい酸(soft acid)」や「軟らかい塩基(soft base)」というように、様々な酸塩基を分類しました。この概念を「HSAB原理(hard and soft acids and bases law)」といいます。ピアソンによれば、HSAB原理を使うことによって、上記の経験則が整理できるというのです。
|
・ルイス酸のうち、半径が大きくて電荷の小さなイオンは、「軟らかい酸」 ・ルイス酸のうち、半径が小さくて電荷の大きなイオンは、「硬い酸」 ・ルイス塩基のうち、電気陰性度が小さくて分極率の大きなイオンは、「軟らかい塩基」 ・ルイス塩基のうち、電気陰性度が大きくて分極率の小さなイオンは、「硬い塩基」 |
次の表.1に、代表的な酸塩基のHSAB原理の適用例を示します。一般的には、硬い塩基は硬い酸と反応しやすく、軟らかい塩基は軟らかい酸と反応しやすいです。硬い塩基と硬い酸の反応は、イオン結合を主としてクーロン力による寄与が大きく、軟らかい塩基と軟らかい酸の反応は、共有結合を主として軌道間相互作用による寄与が大きいです。HSAB原理は、錯体化学における錯体の安定性や反応性の理解だけでなく、金属触媒の反応機構や化学分析の原理などの理解に広く用いられています。
表.1 代表的な酸塩基のHSAB原理の適用例
|
硬い酸 |
H+、Li+、Na+、K+、Be2+、Mg2+、Ca2+、Al3+、Cr3+、Co3+、Fe3+、AlCl3など |
|
中間的な酸 |
Fe2+、Co2+、Ni2+、Cu2+、Zn2+、Pb2+、Sn2+、R3C+、SO2など |
|
軟らかい酸 |
Cu+、Ag+、Hg+、Pt2+、Au3+、金属原子、I2、Br2、C6H5NO2など |
|
硬い塩基 |
OH-、F-、CH3COO-、SO42-、Cl-、CO32-、NO3-、ROH、RO-、NH3、H2Oなど |
|
中間的な塩基 |
Br-、N2、C6H5NH2など |
|
軟らかい塩基 |
I-、SCN-、S2O32-、CN-、RCN、H-、R- 、R3P、CO、C2H4、C6H6など |
例えば、軟らかい塩基であるヨウ化物イオンI- は、硬い酸であるリチウムイオンLi+ よりも、軟らかい酸である銀イオンAg+ に対して高い親和性を持ちます。それ故に、ヨウ化銀AgIは結合が安定で、水に溶けにくいのです。また別の例としては、ニッケルイオンNiやパラジウムPdなどの遷移金属原子に対する配位子として、ホスフィンR3Pが頻繁に使用されています。これも、軟らかい酸である金属原子と、軟らかい塩基であるホスフィンR3Pとの親和性の高さを利用した例です。
硬い酸と塩基、および軟らかい酸と塩基の考え方は、反応速度の理解にも応用できます。例えば、硬い塩基である水酸化物イオンOH- は、軟らかい酸である臭素Br2よりも硬い酸である水素イオンH+ と速く反応します。一方、アルケンは一般に軟らかい塩基なので、硬い酸である水素イオンH+ よりも軟らかい酸である臭素Br2と速く反応します。
HO- + H+ → H2O
CH2=CH2 + Br2 → CH2Br-CH2Br
さらに1983年には、ピアソンはアメリカの化学者であるロバート・パールと共に、HSAB則の理論を拡張して、「化学硬度(chemical hardness)」を導入しました。化学硬度ηは、イオン化エネルギーをI、電子親和力をAとすると、次のように表すことができます。
![]()
(2) 錯イオン生成反応
水溶液中に存在する水和された金属イオンは、金属イオンが水H2Oを配位子として、「アクア錯イオン(aqua complex ion)」の形となっています。したがって、金属イオンM2+ の水溶液中での配位子Lとの反応は、配位子がH2OからLに交換する反応です。配位子Lの濃度を上げていくと、次に示す平衡が右へずれて、配位していたH2Oが、後から加えられたLに置き換えられていきます。
[M(H2O)n]2+ + nL ⇄ [MLn]2+ + nH2O
このように、水溶液中で錯イオンを形成する反応は平衡反応で表せるので、一般的に大量の配位子Lを加えると、平衡が大きく右にずれて、ほとんどすべてのH2OがLで置き換わった錯イオンが生成します。なお、水溶液中では、水H2Oが配位しているのが当然であるから、アクア錯イオンなどを表記するときは、水H2Oを省略して反応式を書くことも多いです。次に、水H2O以外が配位している代表的な錯イオンを示します。
(i) 配位子がアンモニアNH3のアンミン錯イオン
水溶液中のアンモニアNH3の濃度が高くなると、銀(I)イオンAg+ やコバルト(III)イオンCo3+、ニッケル(II)イオンNi2+、銅(II)イオンCu2+、亜鉛(II)イオンZn2+ などが、NH3分子と錯イオンを形成します。この覚え方は、「銀(Ag)子(Co)に(Ni)どう(Cu)も会えん(Zn)」です。アンモニアNH3が配位子の錯イオンは、「アンミン錯イオン(ammine complex ion)」と呼ばれます。
[Ag(NH3)2]+ ジアンミン銀(I)イオン (構造:直線型、色:無色)
[Co(NH3)6]3+ ヘキサアンミンコバルト(III)イオン (構造:正八面体型、色:橙色)
[Ni(NH3)6]2+ ヘキサアンミンニッケル(II)イオン (構造:正八面体型、色:青紫色)
[Cu(NH3)4]2+ テトラアンミン銅(II)イオン (構造:正方形型、色:濃青色)
[Zn(NH3)4]2+ テトラアンミン亜鉛(II)イオン (構造:正四面体型、色:無色)
(ii) 配位子が水酸化物イオンOH- のヒドロキシド錯イオン
水酸化ナトリウムNaOH水溶液などを加えて、水溶液中の水酸化物イオンOH- の濃度を高くすると、アルミニウムイオンAl3+ や亜鉛(II)イオンZn2+、スズ(IV)イオンSn4+、鉛(II)イオンPb2+ などが、水酸化物イオンOH- と錯イオンを形成します。これらの金属は、酸にも塩基にも反応するので、一般的に「両性金属イオン(amphoteric metal ion)」と呼ばれます。この覚え方は、「あ(Al)あ(Zn)すん(Sn)なり(Pb)と両性に溶ける」です。水酸化物イオンOH- が配位子の錯イオンは、「ヒドロキシド錯イオン(hydroxide complex ion)」と呼ばれます。また、錯イオン自身が陰イオンの場合は、語尾を「〜酸イオン」にする約束になっています。
[Al(OH)4]− テトラヒドロキシドアルミン酸イオン (構造:正方形型、色:無色)
[Zn(OH)4]2− テトラヒドロキシド亜鉛(II)酸イオン (構造:正四面体型、色:無色)
[Sn(OH)6]2− ヘキサヒドロキシドスズ(IV)酸イオン (構造:正八面体型、色:無色)
[Pb(OH)4]− テトラヒドロキシド鉛(II)酸イオン (構造:正四面体型、色:無色)
なお、アンモニアNH3は弱塩基なので、その水溶液で高濃度(およそ0.1 mol/L以上)の水酸化物イオンOH- を実現させることはできません。よって、アンモニアNH3の濃厚水溶液における水酸化物イオンOH- 濃度では、両性金属イオンのヒドロキシド錯イオンを形成することはできないと考えて下さい。
(iii) 配位子がシアン化物イオンCN- のシアニド錯イオン
シアン化カリウムKCN水溶液などを加えて、水溶液中のシアン化物イオンCN- の濃度を高くすると、銀(I)イオンAg+ や亜鉛(II)イオンZn2+、鉄(III)イオンFe3+、鉄(II)イオンFe2+ など多くの金属イオンが、シアン化物イオンCN- と錯イオンを形成します。シアン化物イオンCN- が配位子の錯イオンは、「シアニド錯イオン(cyanide complex ion)」と呼ばれます。
[Ag(CN)2]− ジシアニド銀(I)酸イオン (構造:直線型、色:無色)
[Zn(CN)4]2− テトラシアニド亜鉛(II)酸イオン (構造:正四面体型、色:無色)
[Fe(CN)6]3− ヘキサシアニド鉄(III)酸イオン (構造:正八面体型、色:黄褐色)
[Fe(CN)6]4− ヘキサシアニド鉄(II)酸イオン (構造:正八面体型、色:淡黄色)
(iv) 配位子がチオ硫酸イオンS2O32- のチオスルファト錯イオン
チオ硫酸ナトリウムNa2S2O3水溶液などを加えて、水溶液中のチオ硫酸イオンS2O32- の濃度を高くすると、銀(I)イオンAg+ が、チオ硫酸イオンS2O32- と錯イオンを形成します。チオ硫酸イオンS2O32- が配位子の錯イオンは、「チオスルファト錯イオン(thiosulfate complex ion)」と呼ばれます。
なお、「チオスルファト」ように配位子自身が2音節以上の長い名称を持っている場合は、配位子名を( )でくくり、数詞「ジ、トリ、テトラ・・・」の代わりに別の倍数詞「ビス、トリス、テトラキス・・・」を付けて命名するという規則があります。そもそも「チオスルファト」とは、「SO42-」の酸素原子1個を硫黄原子1個で置換した「S2O32-」を表しています。これを仮に「ジチオスルファト」というと、「SO42-」の酸素原子2個を硫黄原子2個で置換した「S3O22-」を表すことになって混乱するので、「S2O32-」が2個あるということを正確に表すために、「チオスルファト」を( )でくくり、前に「ビス」を付けて命名するようにしているのです。
[Ag(S2O3)2]3− ビス(チオスルファト)銀(I)酸イオン (構造:直線型、色:無色)
(3) 錯イオン生成反応を利用した沈殿物の溶解反応
沈殿というのは、難溶性の塩が沈んでいる状態と考えます。しかし、どんな難溶性の塩でも、必ず一部はイオン解離して溶けています。例えば、水酸化銅(II) Cu(OH)2の沈殿が生じている水溶液では、次の溶解平衡が成立しています。
Cu(OH)2 ⇄ Cu2+ + 2OH-
しかし、水溶液中である限り、銅(II)イオンCu2+ はそのままの形では存在しておらず、実際には[Cu(H2O)4]2+ というアクア錯イオンの形になっています。したがって、この反応は、正確には次のように書き表せます。
Cu(OH)2 + 4H2O ⇄ [Cu(H2O)4]2+ + 2OH- ・・・(I)
そして、この水溶液に大量のアンモニアNH3を加えると、水H2OとアンモニアNH3の配位子交換反応が起こります。
[Cu(H2O)4]2+ + 4NH3 ⇄ [Cu(NH3)4]2+ + 4H2O ・・・(II)
そうすると、テトラアクア銅(II)イオン[Cu(H2O)4]2+ の濃度が減少するので、式(I)の平衡は右へ移動し、結局のところ、水酸化銅(II) Cu(OH)2の溶解が進むことになります。全体としてのイオン反応式は、式(I)+式(II)より、次のように表せます。
Cu(OH)2 + 4NH3 ⇄ [Cu(NH3)4]2+ + 2OH-
そこで、金属イオンを含む水溶液に、アンモニアNH3水や水酸化ナトリウムNaOH水溶液を少しずつ加えていくと、次の表.2のように変化します。アンモニア水を加えていった場合でも、アンモニアNH3は弱塩基なので、生じた水酸化物イオンOH- によって、最初は金属水酸化物が沈殿します。そして、さらにアンモニアNH3を加えていくと、最終的にはアンミン錯イオンを形成する金属は、すべて溶解してしまいます。
表.2 金属イオンを含む水溶液にアンモニアNH3水や水酸化ナトリウムNaOH水溶液を加えたときの変化
|
|
アンモニア水 |
水酸化ナトリウム水溶液 |
||
|
少量 |
過剰 |
少量 |
過剰 |
|
|
Ag+ (無色) |
Ag2O↓(暗褐) |
[Ag(NH3)2]+ (無色) |
Ag2O↓(暗褐) |
Ag2O↓(暗褐) |
|
Zn2+ (無色) |
Zn(OH)2↓(白) |
[Zn(NH3)4]2+ (無色) |
Zn(OH)2↓(白) |
[Zn(OH)4]2- (無色) |
|
Al3+ (無色) |
Al(OH)3↓(白) |
Al(OH)3↓(白) |
Al(OH)3↓(白) |
[Al(OH)4]- (無色) |
|
Fe2O3・nH2O↓(赤褐) |
Fe2O3・nH2O↓(赤褐) |
Fe2O3・nH2O↓(赤褐) |
Fe2O3・nH2O↓(赤褐) |
|
|
Cu2+ (青) |
Cu(OH)2↓(青白) |
[Cu(NH3)4]2+ (濃青) |
Cu(OH)2↓(青白) |
Cu(OH)2↓(青白) |
ただし、ハロゲン化銀を溶解させるときには、注意が必要です。ハロゲン化銀の中でも、ヨウ化銀AgIは、共有結合性が特に強いために溶解度が極めて小さく、水1 Lに対して、10-8 mol程度しか溶解しません(Ksp=1×10-16)。そこへアンモニア水を加えても、0.1 mol/Lのアンモニア水1 Lに対し、10-5 mol程度までしか溶解度が上がらないので、事実上、ヨウ化銀AgIはアンモニア水には溶解しないと考えて下さい。ただし、ヨウ化銀AgIは、アンモニアNH3よりも強力な配位子であるシアン化物イオンCN- やチオ硫酸イオンS2O32- を含む水溶液には、錯イオンを形成して溶解します。
表.3 ハロゲン化銀の溶解反応
|
|
+ NH3aq アンモニア |
+ Na2S2O3aq チオ硫酸ナトリウム |
+ KCNaq シアン化カリウム |
|
AgCl↓(白) |
[Ag(NH3)2]+ (無色) |
[Ag(S2O3)2]3− (無色) |
[Ag(CN)2]− (無色) |
|
AgBr↓(淡黄) |
[Ag(NH3)2]+ (無色) |
[Ag(S2O3)2]3− (無色) |
[Ag(CN)2]− (無色) |
|
AgI↓(黄) |
AgI↓(黄) |
[Ag(S2O3)2]3− (無色) |
[Ag(CN)2]− (無色) |
また、シアニド錯イオンであるヘキサシアニド鉄(II)酸カリウムK4[Fe(CN)6]や、ヘキサシアニド鉄(III)酸カリウムK3[Fe(CN)6]の水溶液は、鉄(II)イオンFe2+ や鉄(III)イオンFe3+ の検出に使われます。鉄(II)イオンFe2+ を含む水溶液に、ヘキサシアニド鉄(III)酸カリウムK3[Fe(CN)6]水溶液を加えると、濃青色沈殿を生じます。また、鉄(III)イオンFe3+ を含む水溶液に、ヘキサシアニド鉄(II)酸カリウムK4[Fe(CN)6]水溶液を加えても、同様の濃青色沈殿を生じます。これは、それぞれの水溶液中にKFeIIFeIII(CN)6の構造を持つ、同一の濃青色沈殿が生じたためです。
鉄(III)イオンFe3+ の検出には、チオシアン酸カリウムKSCN水溶液もよく用いられます。チオシアン化物イオンSCN- は、鉄(III)イオンFe3+ と[Fe(SCN)(H2O)5]2+ の構造を持つ錯イオンを形成し、血赤色の溶液となります。
表.4 鉄(II)イオンFe2+ と鉄(III)イオンFe3+ の検出
|
|
+ K4[Fe(CN)6]aq ヘキサシアノ鉄(II)酸カリウム |
+ K3[Fe(CN)6]aq ヘキサシアノ鉄(III)酸カリウム |
+ KSCNaq チオシアン酸カリウム |
|
Fe2+ (淡緑) |
― |
KFeIIFeIII(CN)6↓(濃青) |
変化なし |
|
Fe3+ (黄褐) |
KFeIIFeIII(CN)6↓(濃青) |
― |
[Fe(SCN)(H2O)5]2+ (血赤) |
・参考文献
1) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
2) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)
3) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)
4) 卜部吉庸「化学の新研究」三省堂(2013年発行)