・第13族元素(ホウ素族元素)
【目次】
(iii) 硫酸アルミニウムカリウム十二水和物AlK(SO4)2・12H2O
(1) 第13族元素
周期表において、第13族に属するホウ素B・アルミニウムAl・ガリウムGa・インジウムIn・タリウムTlなどの元素を、総称して「ホウ素族元素」といいます。ホウ素族元素の原子は、最外殻電子配置がns2npである元素(n=2,3,4・・・)です。最外殻にある3個の価電子を失って、貴ガスと同じ電子配置を作って安定化するため、+3のイオン価を持つ陽イオンが広く知られています。
ただし、ホウ素族元素のうち、ホウ素Bのみが安定な陽イオンを形成せず、もっぱら共有結合化合物を形成します。この理由は、主にホウ素Bの原子半径およびイオン半径が、他の同族元素と比べて非常に小さいことに起因します。ホウ素Bの最外殻電子は、強く原子核に引き付けられており、ホウ素Bの関与する化学結合では、化学結合は共有結合性をかなり帯びることになるのです。他のアルミニウムAlやガリウムGa、インジウムIn、タリウムTlなどは、金属としての性質を示し、岩石中に広く分布することから、これらの4元素は「土類金属」と呼ばれます。
表.1 第13族元素の主な性質
|
化学式 |
融点 (℃) |
密度 (g/cm3) |
共有結合半径 (nm) |
第一イオン化エネルギー (kJ/mol) |
|
B |
2,349 |
2.08 |
0.082 |
800.6 |
|
Al |
933 |
2.70 |
0.118 |
577.5 |
|
Ga |
303 |
5.91 |
0.126 |
578.8 |
|
In |
430 |
7.31 |
0.144 |
558.3 |
|
Tl |
577 |
11.85 |
0.148 |
589.4 |
(2) ホウ素
(i) ホウ素B
元素としての「ホウ素(boron)」は、金属元素と非金属元素の中間的な性質を示すことから、「半金属元素」と総称される元素の一種として位置付けられます。ホウ素Bは、安定した共有結合を形成するという点では、同じ第13族元素であるアルミニウムAlやガリウムGaなどの金属元素よりも、むしろ炭素Cやケイ素Siと類似した性質を示します。
ホウ素Bの単体は、常温常圧で金属光沢を持った黒色の非金属固体です。ホウ素B同士の結合は共有結合性が強いため、自由電子として導電性に寄与できる電子が少なく、導電性はあまり大きくありません。しかし、半導体としての性質を持ち、銀Agや銅Cuなどと比べると10〜12倍も電流が流れにくいのですが、金属とは逆に温度が上がると電気伝導性が高くなります。

図.1 ホウ素の単体は化学的に不活性であり、耐酸性が強く、フッ化水素酸HFにも侵されない
(ii) 三ハロゲン化ホウ素BX3
ホウ素Bの化合物は、ホウ素原子が通常+3の酸化状態を取ります。これらには、酸化物や硫化物、窒化物およびハロゲン化物などが含まれます。ハロゲン化物には、三フッ化ホウ素BF3や三塩化ホウ素BCl3などの三ハロゲン化ホウ素BX3があり、いずれもハロゲンが正三角形の頂点を占め、その中心にsp2混成したホウ素原子が存在します。これらの化合物は、ホウ素原子上に6個の電子しか持たないため、オクテット則を満たしていません。そのため、反応ではルイス酸として働き、ルイス塩基のような電子供与体と即座に反応します。例えば、三フッ化ホウ素BF3は、フッ化物イオンF− と反応して、テトラフルオロホウ酸イオンBF4− になります。

図.2 三フッ化ホウ素BF3では、ホウ素Bはsp2混成軌道を作っている
(iii) 窒化ホウ素BN
ホウ素Bと窒素Nを化合させると、周期表で両者の間に位置する炭素Cに似た結晶ができます。窒化ホウ素BNは、ダイヤモンドやカーボンナノチューブを含む炭素Cの同素体に似た構造を取ります。ダイヤモンド様の構造をした窒化ホウ素BNは、「立方体晶窒化ホウ素(c-BN)」と呼ばれます。立方体晶窒化ホウ素において、ホウ素原子と窒素原子は、ダイヤモンドの正四面体構造における炭素原子の位置に交互に存在しています。なぜこのような構造を取れるのでしょうか?
それぞれの原子が共有結合を4本作るとき、ホウ素原子は電子対が1対足らず、逆に窒素原子は電子対が1対余ります。このため、ホウ素原子と窒素原子の間には配位結合が形成され、この結合は形成方法が異なるだけで、性質は共有結合と同等です。その結果として、ホウ素原子も窒素原子も共有結合を4本ずつ持つことになり、ダイヤモンド様の構造を取ることができるのです。立方体晶窒化ホウ素の結晶は、ダイヤモンドに近い硬度を持ち、ダイヤモンドよりずっと安価で、優れた耐熱性があります。特に鉄Feと反応しにくい特性があるので、これを活かして鉄系金属材料の切削加工に用いられます。最近では、表面を親水性に加工すると高い生体適合性を示すことが報告され、人工骨などに使える可能性があるとして研究されています。

図.3 立方体晶窒化ホウ素は、硬化鋼を切削する工作機械の刃に使われる
(3) アルミニウム
(i) アルミニウムAl
「アルミニウム(alminium)」は、ミョウバン(英語でAlum)から分離された元素なので、その名が付きました。地殻中に酸素Oとケイ素Siに次いで多く存在する元素で、金属元素では最も多く存在しています。アルミニウム原子は、価電子を3個持ち、3価の陽イオンになりやすいです。元素としてのアルミニウムAlは、「両性」として作用することが大きな特徴です。例えば、アルミニウムAlは塩酸HClに溶け、濃厚な水酸化ナトリウムNaOH水溶液にも溶けます。
2Al + 6HCl → 2AlCl3(無色) + 3H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4](無色) + 3H2
化合物も両性の性質を示し、酸にも塩基にも反応します。例えば、白色ゲル状の水酸化アルミニウムAl(OH)3が沈殿しているpH=6付近の水溶液に、酸を加えると沈殿は溶解し、塩基を加えても沈殿は溶解します。このような水酸化物は「両性水酸化物」と呼ばれ、そのイオンは「両性イオン」と呼ばれます。
Al(OH)3 + 3H+ → Al3+(無色) + 3H2O
Al(OH)3 + OH− → [Al(OH)4]− (無色)
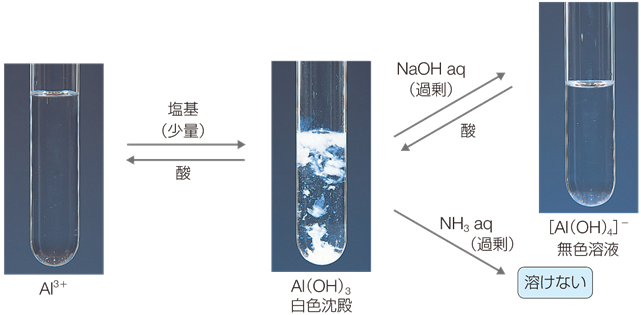
図.4 アルミニウムイオンAl3+ の反応
アルミニウムAlは、冷水や熱水とは反応しません。しかし、高温水蒸気とは反応して酸化アルミニウムAl2O3になり、水素H2を発生します。水H2Oと反応するので水酸化アルミニウムAl(OH)3が生成物となりそうですが、高温では水酸化アルミニウムAl(OH)3は不安定なので、直ちに脱水して酸化アルミニウムAl2O3の形となります。酸化アルミニウムAl2O3は、「アルミナ(alumina)」とも呼ばれます。
2Al + 3H2O → Al2O3(白) + 3H2
アルミニウムAlの単体は、銀白色の金属であり、常温常圧で優れた熱伝導性と電気伝導性を持ちます。軽量で加工性も良く、機械的特性や化学的耐久性などに優れているため、容器や建材、家庭用品、自動車や航空機の部品など、幅広く利用されています。しかし、アルミニウムAlは酸素原子Oとの親和性が強いため、人類が金属単体として取り出せるようになったのは、1825年以降のことです。1825年、デンマークの物理学者ハンス・クリスティアン・エルステッドは、塩化アルミニウムAlCl3と金属カリウムKを混ぜて加熱することで、単体のアルミニウムAlを得ることに成功しました。アルミニウムAlを鉱石から分離するための、多少なりとも工業的な手法が発見されたのは、1850年代になってからです。それまでは、アルミニウム化合物を入手の難しいアルカリ金属の単体(NaやKなど)とともに加熱して製造していました。
3K + AlCl3 → 3KCl + Al
そのため、アルミニウムAlの価格は途方もなく高価なものとなり、その価値は同重量の銀Agの12倍にもなりました。今となっては信じ難いことですが、当時は「金銀と並び称される新しい貴金属」との呼び声が高く、その地位に見合った方法で加工され、見せびらかされていました。1885年のパリ万国博覧会では、アルミニウムAlの延べ棒は、「粘土から得られた銀」と銘打たれ、宝石を散りばめた王冠と並べて展示されていました。アルミニウムAlは万博の目玉の1つとなり、連日黒山の人だかりであったといいます。
フランス皇帝ナポレオン三世は、軽い素材であるアルミニウムAlが軍事に役立つのではないかと考え、パリ郊外にアルミニウムAlを製造する工場を建設しました。そして、ここで製造されたアルミニウムAlで、ナポレオン三世は自分の衣服のボタン、扇、皇太子のための玩具などを製造させました。ナポレオン三世が開いた晩餐会では、最高位の賓客をアルミニウムAlの食器で饗応し、それに次ぐ身分の者には、金Auや銀Agの食器でもてなしたといいます。食器のあまりの軽さに戸惑い驚く客を見て、得意満面の笑みを浮かべる皇帝の姿が目に見えるようです。ただし、アルミニウム製の軍備は、ナポレオン三世の在世中には実現せず、1870年に敵国プロイセンの捕虜となって、帝位を降りています。

図.5 ナポレオン三世は、アルミニウムAlの持つ可能性に魅了され、アルミニウム製品を愛好していたという
意外に思うかもしれませんが、アルミニウムAlは、熱力学的には鉄Feよりも酸化されやすい金属です。酸化アルミニウムAl2O3の酸化被膜が透明なので、錆びていないように見えるだけで、実はすでに錆びています。しかし、アルミニウムAlの酸化被膜は緻密で頑丈なため、一度酸化されると内部が保護されるようになり、内部は鉄Feよりもずっと侵されにくくなります。一方で、鉄Feの場合は、赤褐色の酸化被膜が表面に生じて、それがボロボロと剥がれ落ちるため、内部の鉄Feがまたすぐに酸化されます。
アルミニウムAlに濃硝酸HNO3を反応させると、表面に酸化アルミニウムAl2O3の緻密な酸化被膜を生じて、反応の進行を停止させます。このような保護膜が形成された状態を、「不動態(passivity)」といいます。アルミニウムAlを陽極として、電気分解により人工的に不動態にしたものは、「アルマイト(alumite)」と呼ばれます。アルマイトは、1929年に理化学研究所の植木栄らが発明しました。アルマイトを利用した家庭用製品には、弁当箱や鍋、やかん、灰皿などがあります。アルマイトは、建材や電車、航空機の内装品などにも幅広く利用されています。

図.6 不動態であるアルマイトは非常に硬質であり、酸や塩基に対しても耐久性がある
アルミニウムAlの表面に水銀Hgが付着すると、興味深い現象が起こります。表面のわずかな傷から内部に浸透した水銀Hgは、アルミニウムAlとアマルガムを作ります。このアマルガムは液体であり、表面に酸化被膜は生成できません。アマルガム表面のアルミニウムAlは、空気中の水H2Oと急速に反応して水酸化アルミニウムAl(OH)3になります。 これは極めて嵩が大きな結晶で、キノコのように盛り上がります。この化学反応は、アルミニウム工場では深刻な問題でした。天井の水銀灯の取替え作業時に、1つでも落として割ってしまうと、倉庫一杯分を廃棄しなければならないからです。したがって、取替え時は倉庫を空にして、シートを敷いて行っていたといいます。

図.7 アルミニウムアマルガムの酸化反応
その他、アルミニウムAlの有名な合金としては、「ジュラルミン」があります。ジュラルミンは、アルミニウムAlに少量の銅CuやマグネシウムMgを混ぜた合金のことです。ドイツの化学者であるアルフレート・ヴィルムは、陸軍省の依頼で軽量な合金の開発を命じられ、1906年にジュラルミンを開発しました。軽量(密度2.8 g/cm3)ながら高い強度を示すことから、航空機や鉄道車両の材料などに用いられます。ただし、ジュラルミンは金属疲労に弱く、腐食もしやすいという欠点も持つため、航空機などでは、十分な点検体制を取ることが求められています。鉄道車両でも、新幹線をはじめとして特急型電車や通勤型電車などで、アルミ車体の採用例も多いです。このようにアルミニウムAlの用途は非常に幅広いですが、大抵はこのようなアルミニウム合金としての利用であり、1円玉のようなほぼ100%アルミニウムAlのものは、むしろ稀な存在といえます。

図.8 航空機の材料には、ジュラルミンが使用される
金属のアルミニウムAlは、酸素原子Oとの親和性が非常に大きいです。アルミニウムAlの粉末を強熱すると、多量の熱や強い光を伴って燃焼し、酸化アルミニウムAl2O3の白色粉末になります。
4Al + 3O2 → 2Al2O3(白)
そこで、鉄FeやクロムCr、マンガンMn、コバルトCoなどの酸化物に、アルミニウムAlの粉末を混合して、マグネシウムリボンなどを用いて熱源を供給します。すると、アルミニウムAlは金属酸化物を還元する一方、自らは酸化アルミニウムAl2O3に酸化されます。そして、アルミニウムAlに還元されて生成した金属は、発生する熱により融解して、冷却後には塊状で取り出すことができます。このようにして金属塊を得る方法を、「テルミット法(thermite process)」といいます。特別な設備なしで3,000℃の高温が得られるので、鉄管や鉄道レールの溶接などに用いられます。
2Al + Fe2O3 → 2Fe + Al2O3 ΔH =−853 kJ

図.9 テルミット反応の様子
(i-1) アルミニウムの工業的製法(ホール・エルー法)
工業的には、アルミニウムAlの単体は、天然に存在する「ボーキサイト」から得られます。ボーキサイトの名称は、この鉱石が最初に発見された南フランスのプロヴァンス地方にある小さな村「レ・ボー=ド=プロヴァンス」に由来します。なお、この村のボーキサイトは、20世紀末には完全に枯渇しており、現在のフランスは、ボーキサイトの大半を西アフリカからの輸入に頼っています。地球上で採取可能なボーキサイトは、推定で約280億tもあり、比較的豊富に存在する鉱石です。ただし、ボーキサイトが産生する地域は、過去に熱帯雨林であった地域か、現在熱帯雨林である地域に限られます。その生成には、日射と多量の降雨が必要だからです。

図.10 ボーキサイトは日射と降水量の多い地域で産出され、アルミニウムAlの原料となる
ボーキサイトには、約40〜70%の酸化アルミニウムAl2O3が含まれています。しかし、酸化鉄(III) Fe2O3や二酸化ケイ素SiO2などの不純物も含まれているので、まずはボーキサイトからアルミニウム成分と不純物を分けなければなりません。ボーキサイトから酸化アルミニウムAl2O3を取り出す方法を発明したのは、オーストリアの化学者であるK.J.バイヤーです(1888年)。このバイヤー法は、「アルミニウムAlが強塩基である水酸化ナトリウムNaOH水溶液に溶ける」という両性元素の性質を利用します。まず、ボーキサイトを粉砕したあと、濃い水酸化ナトリウムNaOH水溶液に溶かします。一方で、鉄成分やケイ酸成分は、水酸化ナトリウムNaOH水溶液には不溶なので、沈殿として除かれます。
Al2O3 + 3H2O + 2NaOH → 2Na[Al(OH)4](無色)
そして、この水溶液に二酸化炭素CO2を加え、pHを小さくしていくと、再びアルミニウム成分が、水酸化アルミニウムAl(OH)3として沈殿してきます。
[Al(OH)4]− → OH− + Al(OH)3↓(白)
この水酸化アルミニウムAl(OH)3の沈殿を焼成すると、脱水して水H2Oが抜けて、純粋な酸化アルミニウムAl2O3となります。そして、この酸化アルミニウムAl2O3を溶融塩電解することで、純粋なアルミニウムAlが得られるのです。
2Al(OH)3 → Al2O3(白) + H2O
ところが、この酸化アルミニウムAl2O3の融点は約2,000℃と高温であり、この温度に耐える材料は少ないし、消費エネルギーとコストも膨大なものになります。そこで、約1,000℃の融点を持つ氷晶石Na3AlF6をまず融解し、液化した氷晶石Na3AlF6を溶媒にします。そして、液体の氷晶石Na3AlF6に酸化アルミニウムAl2O3を少しずつ混合して溶かし、凝固点降下により約950℃で融解するようにしていきます。最後に、この液体を炭素電極で電気分解することで、陰極で金属アルミニウムAlを得ることができます。生成したアルミニウムAlは、溶融状態において氷晶石Na3AlF6と酸化アルミニウムAl2O3の混合物よりも密度が高いことを利用して、電解層の下部より回収されます。
一方で、陽極では、酸化物イオンO2− が炭素棒と反応して、一酸化炭素COや二酸化炭素CO2が発生します。800℃以上の高温では、一酸化炭素COの方が生成しやすくなります。陽極の炭素棒は、次第に消耗するので、絶えず補給する必要があります。
(陰極) Al3+ + 3e− → Al
(陽極) O2− + C → CO + 2e− または 2O2− + C → CO2 + 4e−
この精製方法は、アメリカの化学者チャールズ・マーティン・ホールとフランスの化学者ポール・エルーが、1886年にそれぞれ独自に開発した方法であり、一般的に「ホール・エルー法(Hall-Heroult process)」と呼ばれます。当時、アメリカとフランスの間には船便以外の通信手段がなかったので、彼らの発明は独立のものとして見なされ、特許権は両者に均等に与えられました。ホール・エルー法が開発されるまで、アルミニウムAlは金Auよりも高価な貴重な金属でした。しかし、ホール・エル−法によってアルミニウムAlの製造コストは大きく下がり、1 kg当たり10,000ドルだったものが40セントにまで下がりました。今や私たちは膨大な量のアルミニウムAlを生産することができ、世界の年間合計生産量は3,000万tにのぼります。アルミニウム製品を愛好していたナポレオン三世は、自分の臣民の子孫がサンドイッチを包んだり、残り物を包んで保存したりするのに、安い使い捨てのアルミホイルを使っていると聞いたら、さぞかし驚くことでしょう。

図.11 ホール・エルー法により、アルミニウムAlの単体を得る
ちなみに、氷晶石Na3AlF6は、1799年にグリーンランドのイヒドゥートで初めて発見された鉱物です。最初は「融けない氷」と考えられ、外観が氷にそっくりであったことから、この名前が付けられました。世界的にも、氷晶石Na3AlF6がまとまって産出するのはグリーンランドだけであり、グリーンランドは氷晶石Na3AlF6の輸出により、莫大な富を得ました。しかし、現在ではより安価な合成品が用いられるようになり、1987年にイヒドゥートの鉱山は閉山して、町はゴーストタウンと化しています。

図.12 氷晶石Na3AlF6は、発見当初は「融けない氷」と考えられ、外観が氷にそっくりであったことから、この名前が付けられた
ホール・エルー法の問題点は、融解および電気分解で、大量の電気エネルギーを消費することです。この原因は、アルミニウムイオンAl3+ のイオン価が比較的大きく、原子量が小さいことによります。このため、同じ質量の金属を電気分解で得る場合でも、アルミニウムAlは特に大量の電気エネルギーを必要とします。また、イオン化傾向が大きいことで、分解電圧も高くなってしまうという問題点もあります。
そのため、アルミニウムAlは、「電気の缶詰」と呼ばれることもあります。350 mLのアルミ缶1個分のアルミニウムAlを得るためには、20 Wの白熱電球を15時間も点灯するだけの電気が必要になります。それ故、アルミニウムAlのリサイクルは重要であり、リサイクルによって必要なエネルギーは、ホール・エルー法の約3%になるという計算があります。電気料金の高い日本では、ボーキサイトからのアルミニウムAl生産は、オイルショック後の1980年代中頃に止めてしまい、電気料金の安い国から地金として輸入するようになっています。
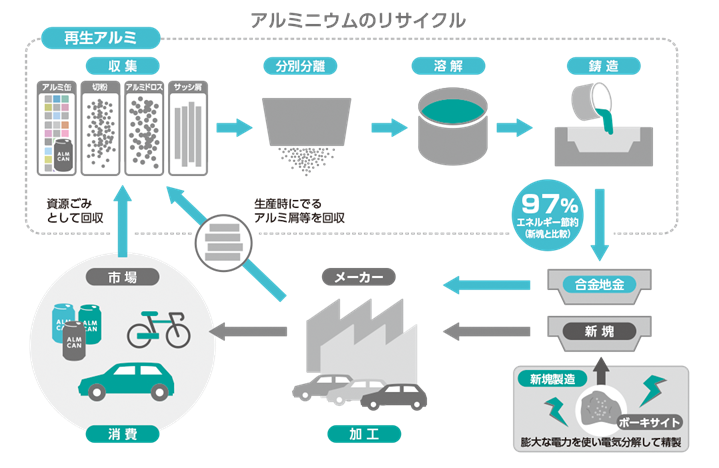
図.13 アルミニウムをリサイクルすることで、約97%のエネルギーが節約できる
実は、この方法の発見者であるホールとエルーには、奇妙な境遇があります。彼らは、共同研究でこの製法を発見した訳ではありません。互いに遠く離れた国に生まれ、面識もなかったのですが、いずれも1863年に生まれ、1886年に23歳の若さで、ほぼ同じアルミニウムAlの精錬法を見出しているのです、しかも、ともに1914年に50歳で亡くなっているというのだから驚きです。このように、科学の世界においては、同じような発見が、全く違う場所で、ほぼ同時になされるという偶然がよく起こります。アルミニウムAlに関する知識の蓄積、発電所の整備と普及による豊富な電力供給といった条件が揃ったことが、その背景にあるのでしょう。

図.14 アメリカの化学者チャールズ・マーティン・ホール(左)とフランスの化学者ポール・エルー(右)
(ii) 酸化アルミニウムAl2O3
酸化アルミニウムAl2O3の結晶は、高い融点とかなりの硬さを持っています。具体的には、酸化アルミニウムAl2O3の融点は2050℃で、純粋な結晶のモース硬度は9と、ダイヤモンド(モース硬度10)に次ぐ硬さを持っています。また、高温でも電気を通しにくい一方で、熱はよく伝えます。人工的に合成された酸化アルミニウムAl2O3の結晶は、その高い硬度を生かして、研磨剤や刃物、人工骨などとして用いられます。両性酸化物なので、粉末状態では酸にも塩基にも反応します。しかし、純粋な結晶になっている酸化アルミニウムAl2O3は、アルマイトと同様に酸にも塩基にも反応しにくいです。
Al2O3 + 6HCl → 2AlCl3(無色) + 3H2O
Al2O3 + 3H2O + 2NaOH → 2Na[Al(OH)4] (無色)
宝石の中でも「ルビー」と「サファイア」は、どちらも酸化アルミニウムAl2O3を主成分とする「コランダム(corundum)」という鉱物の結晶です。不純物として微量の酸化クロム(III) Cr2O3を含むと赤色のルビーに、赤色以外の結晶はサファイアとして扱われます。サファイアには、酸化鉄(III) Fe2O3や酸化チタンTiO2などが不純物として含まれる場合が多いです。純粋な酸化アルミニウムAl2O3の結晶は無色ですが、微量の金属元素を含むと着色します。一般にルビーの方がサファイアよりも高価であり、クロムCrの含量が1%ほどのルビーが最も価値が高く、クロムCrの含量が低くなっていくにつれ、赤色が薄くなって価値が下がります。クロムCrが0.1%しか混ざっていない薄赤色のものは「ピンクサファイア」と呼ばれ、価格はルビーの1/10以下になります。

図.15 ルビー(左)とサファイア(右)は、酸化アルミニウムAl2O3を主成分とする宝石である
(iii) 硫酸アルミニウムカリウム十二水和物AlK(SO4)2・12H2O
硫酸アルミニウムカリウム十二水和物AlK(SO4)2・12H2Oは、一般的に「ミョウバン(明礬)」と呼ばれます。硫酸アルミニウムAl2(SO4)3と硫酸カリウムK2SO4の混合水溶液をゆっくり冷やすと、ミョウバンの無色透明の正八面体結晶が析出します。ミョウバンを水に溶かすと、アルミニウムイオンAl3+ とカリウムイオンK+、硫酸イオンSO42− の各イオンに電離します。また、ミョウバンの水溶液は、アルミニウムイオンAl3+ が水H2Oと反応してヒドロキシアルミニウムイオン[Al(OH)]2+ となり、水溶液中で水素イオンH+ を生じるために、pH3〜4程度の弱酸性を示します。
AlK(SO4)2・12H2O → Al3+ + K+ + 2SO42− + 12H2O
Al3+ + H2O ⇄ [Al(OH)]2+ + H+
ミョウバンAlK(SO4)2・12H2Oのように複数の塩が結合した化合物で、水に溶けると個々の成分イオンに電離するものを「複塩(double salt)」といいます。また、ミョウバンAlK(SO4)2・12H2Oを加熱すると、結晶水を失って無水物AlK(SO4)2になり、これを「焼きミョウバン」といいます。薬局やスーパーなどで販売されているミョウバンは、普通は焼きミョウバンの方です。ミョウバンAlK(SO4)2・12H2Oは、温度変化により溶解度が大きく変わる性質があり、溶解度曲線や単結晶生成の化学実験によく使用されます。

図.16 ミョウバンの正八面体結晶
ミョウバンAlK(SO4)2・12H2Oは、鉱物や温泉の沈殿物から得られます。媒染剤や沈殿剤などの用途があり、古代ローマ時代から使われてきました。例えば、綿や毛織物をタマネギの皮と一緒に煮込んだところで何も起こりませんが、そこに少量のミョウバンAlK(SO4)2・12H2Oを加えると、織物は鮮やかな黄色に染まるようになります。アルミニウムイオンAl3+ が、布地の酸素原子と染料の酸素原子を橋渡しし、互いに結び付けるのです。媒染剤の発見は偶然の産物で、染料が入った液体にヒカゲノカズラ科のシダを加えれば、織物が綺麗に染色されることに誰かが気付いたのでしょう。ヒカゲノカズラ科のシダには、良質の天然ミョウバンAlK(SO4)2・12H2Oが含まれていることが分かっています。

図.17 ヒカゲノカズラは、山野に自生する細長いブラシのような多年草である
なお、アルミニウムAlは、アジサイの花の色にも影響を与えます。アジサイは花色が七変化するといわれ、「七変化」の別名があります。「七変化」を辞書で引くと、「アジサイの別名」という記載があるほど、アジサイの花色は変わりやすいのです。アジサイに含まるアントシアニンは、アルミニウムイオンAl3+ があると錯体を形成して青色を呈し、アルミニウムイオンAl3+ がないときは赤色を呈します。アルミニウムAlは、酸性土壌ではよく溶け、アルカリ土壌ではあまり溶けません。つまり、酸性の土壌では青色になり、中性〜弱塩基性の土壌では赤色になるのです。栽培しているアジサイを青色にしたい場合は、土壌に酸性の肥料とミョウバンAlK(SO4)2・12H2Oを与えます。花1 g当たりに含まれるアルミニウムAlの量がおよそ40 µg以上になると、アジサイが青色になるという研究結果があります。ちなみに、白色系のアジサイは色素を持たない品種なので、土壌のpHにはあまり影響されません。

図.18 青色のアジサイは、酸性の土壌で咲きやすい
一方で、酸性雨による森林荒廃や湖沼での魚類の死滅は、酸性により土壌から溶け出したアルミニウムAlによるとの報告もあります。アルミニウムAlが過剰に体内に取り込まれると、鉄Feの代謝経路に乗って骨や筋肉に取り込まれて沈着し、骨の脆弱化や筋肉の萎縮硬化をもたらします。和歌山県古座川周辺でALS筋萎縮性側索硬化症になった患者のレポートでは、アルミニウムイオンAl3+ が患者の脳や脊髄に通常の2〜20倍も蓄積していることが確かめられたといいます。現在この地域では、上水道が完備されたので、その後は完全に解決しています。なお、海水には平均で約0.005ppmのアルミニウムイオンAl3+ が含まれており、大西洋海水には太平洋海水の50倍ものアルミニウムAlが溶けています。
・参考文献
1) 大東孝司「プラグマティック化学」河合出版(2017年発行)
2) 大宮理「ケミストリー世界史 その時、化学が時代を変えた!」PHP研究所 (2022年発行)
3) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
4) 桜井弘「元素118の新知識 引いて重宝、読んでおもしろい」講談社(2017年発行)
5) 佐藤健太郎「世界史を変えた新素材」新潮社(2018年発行)
6) 左巻健男「面白くて眠れなくなる元素」PHP研究所 (2016年発行)
7) ジョー・シュワルツ「シュワルツ博士の化学はこんなに面白い」主婦の友社(2002年発行)
8) セオドア・グレイ「世界で一番美しい元素図巻」創元社(2011年発行)
9) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)
10) -「元素をめぐる美と驚き アステカの黄金からゴッホの絵具まで〔下〕」早川書房(2017年発行)
11) 山口幸夫「理科がおもしろくなる12話」岩波書店(2001年発行)
12) 吉村忠与志「知るほどハマル!化学の不思議」技術評論社(2007年発行)