�E�����̓��f��
�y�ڎ��z
(1) ��������
[�����P�F�Ε������̍쐬]
�@ ��������0.2
g�������ǂɎ��A���Y�f���2 mL��������B
�A �����ǂ���̂Ђ�ɒ@������悤�ɂ��Ă悭�U�荬���A�����ԕ��u����B
�B �㐟�݉t����s�y�b�g��1 mL�قǎ��A�T�d�ɃV���[���Ɉڂ��B�V���[���𖧕��Ȃ��悤�ɂ��ĊW���������炵�Ă��Ԃ��A�h���t�g���œ��Y�f������������������(����������������قnj����͑傫���������₷��)�B
�C ���Y�f����������ƁA�Ε������̌�����������B
[�����Q�F�P�Η����̍쐬]
�@ �����������ǂɗ�������2.0 g�����B
�A �l�܂�ɂ����������낤�Ƃɋl�߁A�낤�Ƒ�ɃZ�b�g����B
�B ���������݂Ŏ����ǂ������A�����ǂ�U��Ȃ���A��̕�����ψ�Ɏ�ʼn��M����B���̂Ƃ��A���������M���߂��ė������Ԋ��F�ɂȂ�Ȃ��悤�ɒ��ӂ���B
�C �������������ׂėZ���āA���F�œ����ȗ������̂���t�̂ƂȂ����Ƃ���ŁA�낤�Ƃ̒��ɑf���������𗬂����ށB
�D �������₦�āA�\�ʂɔ��������ł����Ƃ���ŁA�f�������������o���g����B���̂Ƃ��A�������g����^�C�~���O���x���Ȃ�ƁA�ł܂��Ă��܂������̊ώ@���ł��Ȃ��Ȃ�̂Œ��ӂ���B
�E ���̂܂ܕ��₵�A�\���ɗ₦��ƁA�P�Η����̌�����������B
�� ��߂ł͂Ȃ��̂ŁA�낤�Ƃ̉��Ƀr�[�J�[��u���K�v�͂Ȃ��B
[�����R�F�S�����̍쐬]
�@ 200 mL�r�[�J�[�ɐ����قǓ����B
�A �����Q�Ŏg�p���������ǂɗ�������4.0 g�����B
�B ���������݂Ŏ����ǂ������A�U��Ȃ��狭�ʼn��M����B���M�𑱂��Ă����ƁA���F�ŗ������̂����Ԃ���A�Ԋ��F�ŔS���̂����Ԃɕς�邪�A����ɉ��M�𑱂���ƁA�Ăъ��F�ŗ������̂����ԂɂȂ�B
�C ���������������Ƃ���ŁA�@�̃r�[�J�[�̒��ɑf���������𗬂����ށB
�D �������S�����𐅂�����o���B
�� �����͉��M����Ɣ����邱�Ƃ����邪�A�����ǂ̌���G��G�Ђŕ����A���ł���B
(2) ���_
����S�̒P�̂ɂ́A�u���������v�E�u�P�Η����v�E�u�S�����v�Ȃǂ̓��f�̂�����܂��B�����ł́A���F���̎Ε��������M�͊w�I�ɍł�����ŁA�V�R�ɎY�o����闰��S�͂��ׂĎΕ������ł��B�Ε���������120���ɉ��M���ėZ�����������ƁA��C���ŕ��₷��ƁA���F�j��̒P�Η����������܂��B����ɁA250���ɉ��M�����t�̗�����␅�ɒ����ŋ}�₷��ƁA�e���̂���S�����������܂��B
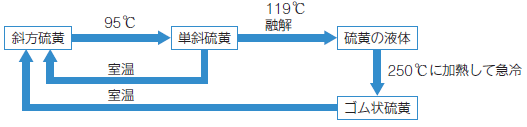
�}.1 ����S�̓��f�̂̊W
�������A�P�Η������S�������A�����Œ����ԕ��u���Ă����ƁA���悻������ɂ͈���ȎΕ������ɕω����܂��B���̐}.2�̂悤�ɁA�Ε������ƒP�Η����́A������̊qS8����Ȃ�A���ɂ͗n���܂���B�������A���Y�fCS2�ɂ͂悭�n���A�x���[������уg���G���ɂ����ʗn���܂��B�S�����́A�����̗������q�����X�Ɍ��������������qSx(x�̒l�͐��\���ɋy�Ԃ��Ƃ�����)����Ȃ�A���Y�fCS2�ɂ͗n���ɂ����ł��B
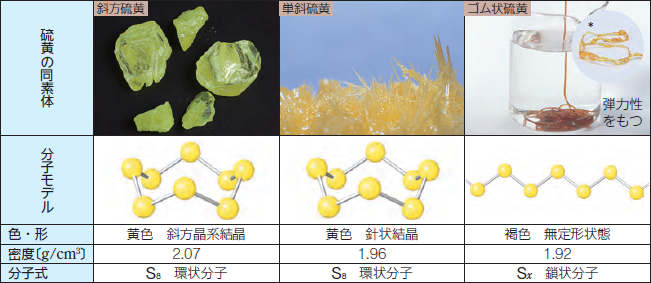
�}.2 ����S�̓��f�́i�������ɂ���āA���F�`���F�ɂȂ�j
���Ȃ݂ɁA�S�����̐F�́A���ȏ��ł����炭�u���F�v�ł���Ƃ���Ă��܂������A2009�N�ɎR�`���߉��H�Ɛ��w�Z��17�̏��N���A�����ɂ���Ă��ꂪ���ł��邱�Ƃ��w�E���A���ȏ���������������Ƃ����ꌏ������܂����B���x99%�̎Ε����������ƂɃS����������Ă݂��Ƃ���A���ȏ��ʂ芌�F�̂��̂������܂����B�������A���x99.5%�̎Ε��������瓯�l�ɃS����������Ă݂��Ƃ���A���ȏ��Ƃ͈قȂ�u���F�v�̂��̂�����ꂽ�Ƃ����̂ł��B
����܂ł́A��w�����ł��u���F�v�������Ƃ���Ă���A������O�̂悤�ɐM�����Ă��܂����B�������Ȃ���A�Ȋw�Ɂu��v�͂Ȃ��A�Ȋw�I�ł���Ƃ������Ƃ́A���Ȃ킿���؉\��������Ƃ������Ƃł��B������O�̂悤�ɐM�����Ă��邱�Ƃ̒��ɂ��A���ɋC�t���Ă��Ȃ������ŁA�{���͊Ԉ���Ă��邱�Ƃ����邩������܂���B���̈ꌏ�́A���N�̉Ȋw�I�ȓ��@�͂��ĂA�����Ȕ����ł������Ƃ����܂��B

�}.3 ���F�̃S����(��)�ƕs�����̂��߂Ɋ��F�ɂȂ����S����(�E)