�E�|�_�i�g���E���̍Č���
�y�ڎ��z
(1) ��������
�@ �|�_�i�g���E���O���a��CH3COONa�3H2O��10 g�ʂ���A�����ǂ̒��ɓ����B
�A ���X�V�����_�[�Ő�4.0 mL��ʂ���A�@�̎����ǂ̒��ɓ����
�B 500 mL�r�[�J�[�ɐ������A��80���̉��x�Ŏ����ǂ����߁A���������S�ɗn�����B
�C �n�����|�_�i�g���E�����n�t���V���[���ɂ��ׂė������݁A�����܂ŕ��₷��B
�D �n�t����߂���A�V���[���̐^�ɐ|�_�i�g���E���̌���(����)�����ʗ��Ƃ��B
�E �D�̃V���[���̒��G���āA���x�̕ω����m���߂�B
(2) ���_
�@�ő̗̂n��x�́A��ʂɉ��x�������قǑ傫���Ȃ�̂ŁA�����ő��ʂ̗n�����܂ޗn�t���p���Ă����A�O�a�n�t�ɂȂ鉷�x�ŁA�n������Ȃ��Ȃ����n���̌��������n�܂�͂��ł��B�������A�n���̎�ނ��p�̕��@�ɂ���ẮA�n��x�ł͖O�a�ɒB���Ă���͂��Ȃ̂ɁA�������͏o���Ă��Ȃ��Ƃ�������܂��B����́A�n�𐬕����猋���̊j�ƂȂ鑊��������̂ɁA���̃G�l���M�[��v���邩��ł��B���̂悤�ɁA�n��x�ȏ�̗n�����n���Ă����Ԃ��u�ߖO�a(supersaturation)�v�Ƃ����A���̂悤�ȗn�t���u�ߖO�a�n�t(supersaturation solution)�v�Ƃ����܂��B
���̎����ŗp������|�_�i�g���E���O���a��CH3COONa�3H2O�́A58���ŒE�����Ė������ɂȂ�܂��B���̂Ƃ����o�����������ɁA�����̐|�_�i�g���E��CH3COONa�����ׂėn���ł���̂ŁA58����|�_�i�g���E��CH3COONa�̗Z�_�Ƃ��Ă��܂��B�|�_�i�g���E��CH3COONa�͈��肵���ߖO�a��Ԃ��ێ��ł��镨���ŁA�O�a��ԂɒB���Ă���A���x���啝�ɒቺ���āu�ߗ�p���(supercooling)�v�ɂȂ��Ă��A�����̐͏o���N����ɂ����̂ł��B�������A�ߖO�a�n�t�Ɂu�U���v����������A�|�_�i�g���E���́u�����j�v�𓊓�����Ȃǂ̎h����^����ƁA��C�Ɍ����̐͏o���n�܂�܂��B
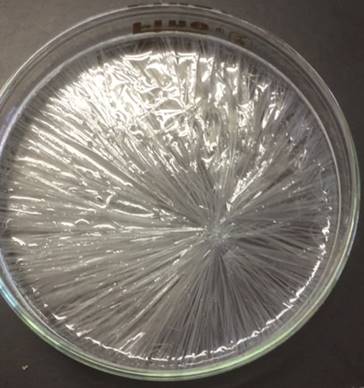
�}.1 �ߖO�a�n�t�ɏ��ʂ́u�����j�v�𓊓�����ƁA���I�Ȍ��������n�܂�
�@���̂悤�Ȍ��I�Ȍ����͏o�ɂ́A��ʂ̔M�̕��o�������܂��B�Z�t�͋}���Ɉ���Ȍ����ɖ߂�A�Ìœ_��58���܂ʼn��x���㏸���܂��B���̌��ۂ����p���āA2008�N������A�u�G�R�J�C���v�Ƃ����ė��p�\�ȃJ�C�����̔������悤�ɂȂ�܂����B�G�R�J�C���́A�|�_�i�g���E���������ɗn�����A�������Ǝ����܂ŗ�p���āA�u�ߖO�a��ԁv�ɂ������̂𗘗p���܂��B�\���͋ɂ߂ăV���v���ŁA�r�j�[���̓����ɂ́A�|�_�i�g���E���̉ߖO�a�n�t�Ɣ��������Ђ������Ă��邾���ł��B�����̋����Ђ�܂�Ȃ���Ȃǂ��āu�����I�h���v��^����ƁA�|�_�i�g���E���̌���������C�Ɏn�܂��āA���M����̂ł��B�G�R�J�C���́A�g���I��������̂��Ȃǂʼn��M���ĉt�̂ɖ߂��A�Ăт������Ǝ����܂ŗ�p���邱�ƂŁA���x�ł��Ďg�p���邱�Ƃ��ł��܂��B�������A�ő�̌��_�͔��M�̎������Ԃł���A���̃J�C����30�����x���������܂���B

�}.2 �u�G�R�J�C���v��30���قǒg����邱�Ƃ��ł���
�E�Q�l����
1) �������ȑ�w�T�C�G���X���H�[�u�y���މ��w�����v���q���X(2003�N���s)