�E��ԕω�
�y�ڎ��z
(i) �J���n�ł́A�t�̂�������������Ă��A���̕����͏��C���ȉ��̒l������肦�Ȃ�
(ii) �J���n�ł́A���C���ƊO�����������Ȃ�ƁA�������N����
(1) �����̏��
�������\�����闱�q�́A�₦���u�M�^��(thermal motion)�v�����Ă���̂ŁA�����Ă����ƌ݂��ɂ��̏�ԂɂȂ��Ă����܂��B�Ⴆ�A���ɐԃC���N����H���Ƃ��ƁA�����ɐԃC���N�����X�ɍL�����Ă����܂��B���̂悤�ɁA�����̍\�����q�����R�ɎU����Ă������ۂ��u�g�U(diffusion)�v�Ƃ����܂��B�g�U�́A�������疳�����Ɍ������ω��ł���A���̂��Ƃ��u���G��(randomness)�v�����傷������ɐi�ނƂ����܂��B

�}.1 �L�fBr2�̊g�U
����ŁA���q�Ԃɂ̓t�@���f�����[���X�͂Ȃǂ̕��q�ԗ͂������Ă��āA�݂��ɏW�����悤�Ƃ���X��������܂��B�������A���q�̔M�^���͉��x�������Ȃ�قǑ傫���Ȃ�܂����A���q�Ԃɓ������͉͂��x�������Ȃ��Ă��قƂ�Ǖω����܂���B�����ŁA��ʓI�ɉ��x���グ�Ă����ƁA���q�̔M�^���͌������Ȃ�̂ŁA���q���m���݂��ɏW�����悤�Ƃ���͂����̏�ԂɂȂ낤�Ƃ���͂̕��������Ȃ�A���q�̏W����Ԃ��ς���Ă��܂��B���Ȃ킿�A�u��ԕω�(physical change)�v�Ƃ����̂́A�~�N���I�ɂ́u���q�̏W����Ԃ̕ω��v�Ȃ̂ł��B
��ʓI�ɉ��x�∳�͂�ω������Ă����ƁA�����́u�ő�(solid)�v�E�u�t��(liquid)�v�E�u�C��(gas)�v�̎O�ԊԂŏ�ԕω������܂��B�Ⴆ�A�ő̂̕X�����M����Ɖt�̂̐��ɂȂ�A����ɉ��M����ƋC�̂̐����C�ɂȂ�܂��B�ő́E�t�́E�C�̂Ƃ������̂́A���j�I�ɂ́A�����I�Ȑ����ɂ���ʂ���Ă��܂����B���Ȃ킿�A�ő͈̂��̑̐ςƌ`�������A�t�͈̂��̑̐ςƎ��R�Ȍ`�������A�C�͎̂��R�ȑ̐ςƌ`�����Ƃ������ނł��B�������A����̉��w�ł́A�����̏�Ԃ͗��q�Ԃ̑��ݍ�p�ŋ�ʂ���܂��B���Ȃ킿�A�ő̂ł͗��q�Ԃ̑��ݔz�u����܂��Ă���A�t�̂ł͋ߐڗ��q�͐ڐG���Ă��邪���ݔz�u�͒�܂��Ă��炸�A�C�̂ł͗��q���m������Ă���̂ŗ��q�Ԃ̑��ݍ�p�͔M�^���ɂقƂ�lje����^���܂���B
�\.1 �����̎O��
|
�ő�(solid) |
�t��(liquid) |
�C��(gas) |
|
���̑̐ςƌ`�����B���x���������ė��q�̉^���G�l���M�[���������Ȃ�A���q�Ԃɓ������͂ŗ��q���K�����������ɕ���� |
���̑̐ςƎ��R�Ȍ`�����B���x���オ���ė��q�̉^���G�l���M�[���傫���Ȃ�A���q�Ԃɓ������͂�U����Ă�����x�^���ł���悤�ɂȂ������ |
���R�ȑ̐ςƌ`�����B���q�̔M�^���ɔ�ׂė��q�Ԃ̈��͂��قƂ�ǖ����ł���悤�ɂȂ�A���q�����R�ɉ^���ł���悤�ɂȂ������ |
�C�̂́A�ő̂�t�̂�藱�q�Ԃ̋������傫���A���q�͔M�^���ɂ��A��Ԃ���������������Ă��܂��B���������āA�C�̂͑̐ς�`����肹���A�ő̂�t�̂ɔ�ׂāA���x�����ɏ������ł��B����ʼnt�̂́A���q���M�^���ɂ�肻�̈ʒu�����R�ɕς��邱�Ƃ��ł���̂ŁA�������������Ď��R�Ȍ`�������܂��B�������A���q�Ԃ̋����͋߂��A���̊Ԃɓ������q�ԗ͂������̂ŁA���͂��ς���Ă��قڈ��̑̐ς������܂��B�t�̖̂��x�◱�q�Ԃ̋����́A�ő̂Ƃقړ����x�ł���A���q�ԋ����ł��p�[�Z���g�̈Ⴂ��������܂���B�ő̂́A���q�̔M�^���������q�Ԃɓ������q�ԗ͂̉e���̕��������̂ŁA���q�͈��̈ʒu�ɌŒ肳��A���̈ʒu�𒆐S�ɐU�����Ă��܂��B���̂��߁A�ő͈̂��̌`�������A���͂��ς���Ă����̑̐ς������܂��B�ő̂ł́A�����툳�̋C�̂Ɣ�ׁA���q�ԋ�����1/10���x�A�̐ς�1/1,000���x�ɂȂ��Ă��܂��B
�\.2 �����̎O�ԊԂ̗��q�ԋ����Ƒ̐ς̕ω��i�ő̂�1�Ƃ���j
|
|
�ő� |
�t�� |
�C�� |
|
���q�Ԃ̋��� |
1 |
1.05 |
10 |
|
�̐� |
1 |
1.15 |
1,000 |
�ő̂ɂ́A�H��NaCl�̂悤�ɗ��q���K���I�ɔz�Ă���u����(crystal)�v�ƁA�K���X�̂悤�ɗ��q�z�u���s�K���ȁu�A�����t�@�X(amorphous)�v������܂��B�����ɂ͖��m�ȗZ�_��Ìœ_������܂����A�A�����t�@�X�ɂ͖��m�ȗZ�_��Ìœ_���Ȃ��A��ԕω����A���I�ɋN����܂��B�K���X�����ŔM����Ə��X�ɓ���n�߂邽�߁A�K�x�ɓ�炩���Ȃ����Ƃ��Ɉ�����������Ȃ����肵�āA�K���X�H�����邱�Ƃ��ł��܂��B�Ȃ��A�K���X�́u�S�x�����ɍ����Ȃ����t�́v�ł���ƈȑO�͍l�����Ă��܂������A���݂ł͌ő̂ł���ƍl�����Ă��܂��B

�}.2 �K���X�H�̗l�q
�@�����̏�ԕω��ɂ����āA�ő̂���t�̂ւ̕ω����u�Z��(melting)�v�Ƃ����A���̋t���u�Ì�(solidification)�v�Ƃ����܂��B�܂��A�t�̂���C�̂ւ̕ω����u����(evaporation)�v�Ƃ����A���̋t���u�Ì�(condensation)�v�Ƃ����܂��B����ɁA�ő̂���C�̂ւ̕ω����u����(sublimation)�v�Ƃ����A���̋t���u�É�(sublimation from gas)�v�Ƃ����܂��B��ʓI�ɗ��q�Ԃɓ������q�ԗ͂����������قǁA�Z����������N����ɂ����A�Z�_�╦�_�͍����Ȃ�X��������܂��B���������āA��ʓI�ɃC�I����������������́A���q���������Z�_�╦�_�������Ȃ�܂��B
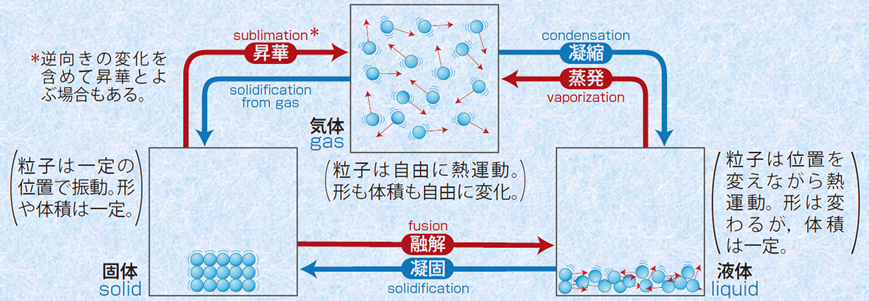
�}.3 �����̏�ԕω�
���Ɋւ��ẮA��ʓI�Ɍő̂���C�̂ւ̕ω����w�����Ƃ������ł��B������ł́A�ő̂���C�̂ւ̕ω����u���v�A�C�̂���ő̂ւ̕ω����u�Év�ƌĂ�ŋ�ʂ����Ă��܂����A���{���p��ɂ́A���҂���ʂ���p��͂���܂���B�܂��A���́A���E�fI2��i�t�^����C10H8�A��_���Y�fCO2�Ȃǂ̖��ɐ����q����Ȃ镨���ɂ悭�������ԕω��ł��B

�}.4 ���E�fI2�͏��ؐ�������A���F�̔Z���̏��C�ɂȂ�
�Z��������́A�������\�����闱�q���������M�^�����A���̉^���G�l���M�[�������\�����A���q�Ԃ̕��q�ԗ͂����邱�ƂŋN����܂��B���̐}.5�́A��C�����Ōő̂Ɉ��ʂ̔M�������������Ƃ��́A���M���ԂƉ��x�̊W���O���t�ɂ������̂ł��B���M������ƁA�����̉��x�͏オ���Ă����܂����A��ԕω��̍ۂɂ́A���̔M���Z��M������M�Ȃǂ́u���M(latent heat)�v�Ɏg���邱�ƂɂȂ�̂ŁA������M�������Ă����x�����ɂȂ�̂ł�(�O���t�ŌX����0�ɂȂ��Ă���Ƃ���)�B���̂��Ƃ́A�Z��������ɔ������M���A�z�M�����ł��邱�Ƃ��ؖ����Ă��܂��B
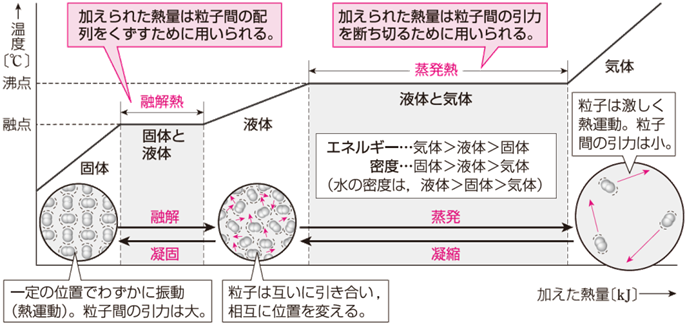
�}.5 �ő̂̉��M�Ɖ��x�ω�
(2) �ԕ��t
�������e�풆�ɁA�K���ȗʂ̉t�̂����ĕ��u���Ă����ƁA�t�̂̈ꕔ�͏������ċC�̂ɂȂ�܂��B�C�̂̒��ɂ́A�Ïk���ĉt�̂ɖ߂�̂��o�Ă���̂ŁA�t�̂��\���ɑ��݂��Ă���A������͏������x�ƋÏk���x���荇���A��������̕ω����Ȃ��Ȃ�܂��B���̏�Ԃ��u�C�t���t(vapor-liquid equilibrium)�v�Ƃ����A���̂Ƃ��̋C�̂̈��͂��u�O�a���C��(saturation vapor pressure)�v�܂��́u���C��(vapor pressure)�v�ƌĂт܂��B���҂�ʂ̈Ӗ��Ŏg�������Ă���l���悭���܂����A�O�a���C���Ə��C���́A�{�������Ӗ��Ŏg����p��ł��B
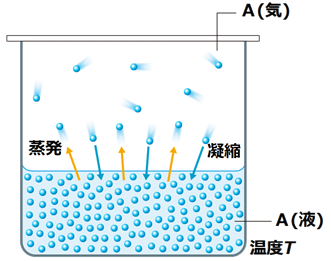
�}.6 ���C���͏��������C�̂��������͂ł���
�@�����ŁAA(�t)⇄A(�C)�̋C�t���t�����݂���Ƃ��A���̔����̕��t�萔��K�Ƃ���ƁA�u���ʍ�p�̖@��(law of mass action)�v���A�������������܂��B
A(�t)⇄A(�C)
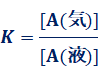
[A(�t)]��[A(�C)]�́A�e���ł�A��������n���e���̑̐�V�Ŋ������l�A���Ȃ킿�e���ł�A�̃����Z�x�ł��B�t�̂ɂ��ẮA���鉷�x�ł̑̐ς����Ȃ̂ŁA���x���܂����l�ɂȂ�܂��B���������āA[A(�t)]�̒l�́AA�̎��ʂ�w�t g�AA�̕��q�ʂ�M�A���x��d g/L�Ƃ���ƁA���̂悤�ɂȂ�܂��B
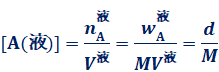
�܂�A���xT�����܂�A[A(�t)]�͈��l�����̂ł��B����ɁA���鉷�x�ł́AK�͈��͂ɂ�炸���l�����̂ŁA[A(�C)]���܂����l�������Ȃ����Ƃ�������܂��B�����āA����[A(�C)]�́A���z�C�̂̏�ԕ�����PV��nRT���g���āA���̂悤�ɕ\���܂��B
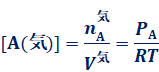
���xT �͌��܂��Ă���̂ŁAPA���܂����l�������Ȃ��悤�ɂȂ�܂��B�C�̂́A�ő̂�t�̂ɔ�ׂĈ��k�����R�ł���A���̔Z�x��傫���ω������邱�Ƃ��ł��܂��B�������A�C�t���t�����藧���Ă���ꍇ�A�C���̔Z�x[A(�C)]�͂��鉷�x�ň��ɂȂ邩��A���̏��C��PA���܂����ɂȂ�̂ł��B���������āA���鉷�x�ł́A���͂�̐ςɂ�炸�A���̏��C���͈��ɂȂ邱�Ƃ�������܂��B�e��̂悤�Ȗ��n�̒��ŁA���镨���̋C�̂Ɖt�̂Ƃ��������Ă���Ƃ��A��莞�Ԃ��߂���Ƃ₪�ċC�t���t�ƂȂ�̂ŁA���̋C�̂̈���(����)�́A���C���ɓ������ƍl���Ė�肠��܂���B�܂�A�t�̂����݂��閧�n�ł́A���̕����̋C�̂̈��͂́A�K�����C���ƂȂ�̂ł��B
|
�@ ���鉷�x�ɂ����āA���C���͈��͂�̐ςɂ�炸�A���l����� �A ���n�ʼnt�̂����݂���Ƃ��A���̕����̋C�̂̈��͂͏��C���ɓ����� |
�t�����́A���ׂĕ��t��Ԃ�ڎw���ĕω����Ă����܂��B���镨���̋C�̂Ɖt�̂����n�ŋ������Ă���Ƃ��A���̕����̋C�̂̈��͂͏��C���ɓ������Ȃ�܂��B�܂��A���C���͂��鉷�x�ɂ����Ă͈��ɂȂ�̂�����A���̕����̋C�̂̈��͂����C�����傫���Ȃ邱�Ƃ͂��肦�܂���B�����ŁA���̂悤�ɂ��āA���n�ɂ��镨���̏�Ԃʂ��܂��B
|
�@ ���n�̉t�̂����ׂď������āA�C�̂ɂȂ��Ă���Ɖ��肷�� �A �������ׂĂ��C�̂ł���Ɖ��肵���Ƃ��̈���Pif���A���z�C�̂̏�ԕ�����PV��nRT�Ȃǂŋ��߂� �B ���ɂ悤�ɂ��ď�Ԃʂ��� �@(i) Pif�����C���̂Ƃ� �@�@�܂��C�t���t�ɒB���Ă��Ȃ��̂ŁA���ׂĂ��������ċC�̂ɂȂ��Ă���B���̂Ƃ��̋C�̂̈��͂�Pif�Ɠ����� �@(ii) Pif�����C���̂Ƃ� �@�@�C�t���t�ɂȂ�܂ŋC�̂̋Ïk���N����̂ŁA�t�̂ƋC�̂��������Ă���B���̂Ƃ��̋C�̂̈��͂͏��C���Ɠ����� |
���̂悤�ɍl���邱�ƂŁA���n�ɂ��镨���̏�Ԃʂ��邱�Ƃ��ł��܂��B���n�ł́A�����ʂƑ̐ς����Ȃ̂ŁA���z�C�̂̏�ԕ�����PV��nRT���g���āA���͂��o�����Ƃ��ł��܂��B�������A���O�Ȃǂ̊J���n�ł́A�C�̗��q���g�U���Ă����̂ŁA��ԕ��������g�����Ƃ��ł��܂���B���������āA�J���n�ɂ����ẮA���̂悤�ɍl���܂��B
(i) �J���n�ł́A�t�̂�������������Ă��A���̕����͏��C���ȉ��̒l������肦�Ȃ�
�R�b�v�̒��ɐ������āA�ӂ��������ɕ��u�����Ƃ��܂��B���Ԃ��o�ĂA�R�b�v�̒��̐��͂��ׂď������āA�C�̂ƂȂ��Ă��܂��܂��B�������ׂď������Ă��܂����R�́A���������C�̕��q����C���Ɋg�U���Ă������߁A�����琅���������Ă��C�t���t�ɒB���Ȃ�����ł��B�����ŁA�t�̂̕\�ʂł́A�����Ċ���ʋC�t���t��ڎw���āA�������ǂ�ǂ�i�݂܂��B���O�Ȃǂ̊J���n�ɔG�ꂽ���������Ċ��������Ƃ��ł���̂́A��C���̐����C�̈��͂����C���ɒB���Ă��Ȃ�����Ȃ̂ł��B�����Ȃǂ̖��n�ɋ߂����Ő����������Ƃ��́A���O�ɔ�ׂĐ��͊����ɂ����Ȃ�܂��B
���Ȃ݂ɁA��C���̐����C�̈��͂����C���Ɠ������Ƃ��́A��C���̎��x��100%�̂Ƃ��ł��B���̂Ƃ��́A�C�t���t���������Ă���̂ŁA�G�ꂽ���͌����Ċ����܂���B�܂��A�������������C�̎������͂́A���̉��x�̏��C�����͑傫���Ȃ�Ȃ��̂ŁA�n�\�߂��̋�C���㏸���ĉ��x��������ƁA�����C���t�̂̐��ɋÏk���Ă��܂��B����_�́A���̂悤�ɂ��Đ����Ă���̂ł��B

�}.7 �����C���܂ގ�������C����₳���ƁA���x100%�ɒB�����Ƃ���Ő����C���Ïk���A�_���ł���
(ii) �J���n�ł́A���C���ƊO�����������Ȃ�ƁA�������N����
�u����(boiling)�v�Ƃ͉����Ɩ₤�ƁA�u�����͉t�̂��C�̂ɂȂ錻�ۂł���v�Ɠ�����l���悭���܂��B�������A����͈Ⴂ�܂��B�����Ƃ́A�t�̓���������������N���錻�ۂ̂��Ƃł��B�t�̂��������鉷�x���u���_(boiling point)�v�Ƃ����܂����A�t�͕̂��_���Ⴂ���x�ł��A�C�t���t��ڎw���ď������܂��B���������A���_�ł����t�̂��������Ȃ��̂�������A�퉷�Ő����������ƂȂǂ��肦�Ȃ��̂ł��B
�܂��A���C���́A�����̎�ނƉ��x�ɂ���Ă̂��܂�܂��B���x�Ə��C���̊W���������O���t�́A�u���C���Ȑ�(vapor pressure curve)�v�ƌĂ�܂��B���̃O���t���番����悤�ɁA���C���͉��x�̏㏸�ƂƂ��ɑ傫���Ȃ�܂��B�܂�A���x���オ��ƁA�C�t���t�ɂ����ċC�̂̊����������A�������₷���Ȃ�̂ł��B��ʓI�ɕ��q�ԗ͂̑傫�������قǁA���q���m���������������ď������ɂ����Ȃ�̂ŁA���C���͏������Ȃ�܂��B���q�ʂ̊��ɐ�H2O�̏��C�����������̂́A��H2O�͕��q�Ԃ�4�{�̐��f���������āA�݂��ɋ������������Ă��邩��ł��B
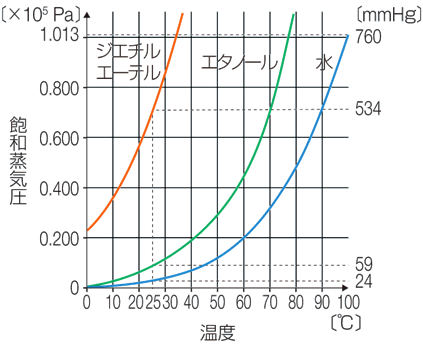
�}.8 ���C���Ȑ�
�Ƃ���ŁA�����͂ǂ������d�g�݂ŋN����̂ł��傤���H���M�𑱂���ƁA���q�̔M�^�����������Ȃ��āA�t�̓����ʼn^���G�l���M�[�̑傫�����q������Ă��܂��B���̕��q���A����̕��q�������̂��āA�t�̓����ɏ����ȋ�Ԃ����܂��B���̋�Ԃɂ́A��������͏��C�����A�O������͑�C�����������Ă��܂��B�������C��������C���̕����傫����A��������Ԃ͒����������Ԃ���A�����ɏ��ł��Ă��܂��܂��B�������A�t�̂̉��x���グ�Ă����ƁA���C���͑傫���Ȃ�A�₪�ĊO���Ɠ������Ȃ�܂��B�����āA���̏��C������C�����傫����A�t�̂��C�̂ɂȂ�W�����Ȃ��Ȃ�A�t�̓����̋�ԂɌ������ď������i�݁A�M��������������A�C�A���������邱�ƂɂȂ�܂��B�K�X�o�[�i�[�ȂǂŒ��ڔM����Ă����ʕt�߂ł́A�ߔM��ԂɂȂ��ĉ^���G�l���M�[�̑傫�ȕ��q���������₷���A�����ȋ�Ԃ�����₷���Ȃ�܂��B�������āA�t�̓����Ő�������ԂɌ������������N����A���������C�A�����͂ŕ����オ���āA�����Ƃ������ۂ�������悤�ɂȂ�̂ł��B
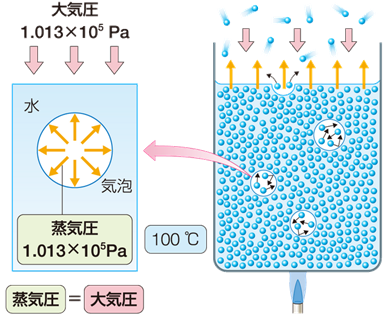
�}.9 �t�̒��ɐ������C�A
����̒��Ő������M�����ꍇ�́A��_���Y�fCO2��_�fO2�Ȃǂ̂��Ƃ��Ɨn�����Ă�����C�������A���M�ɂ���ĉߖO�a���(���x���オ��Ɛ��ɗn����C�̗̂ʂ����Ȃ��Ȃ�)�ɂȂ�A�n������Ȃ��Ȃ�����C�����������Ŕ����C�A�����܂��B���̔����C�A���j�ƂȂ�A�����C�A���������邱�Ƃɂ���āA�������N����̂ł��B�������A�����悤�ɐ������M�����ꍇ�ł��A��x�ϕ�����Ȃǂ��ėn���C�̂������������ĉ��M����ꍇ��A�d�q�����W��p����Ȃǂ��ĒZ���Ԃʼn��x���グ��ꍇ�ɂ́A�t�̓����ɔ����C�A�����������A���_�ɂȂ��Ă��������N����Ȃ��Ȃ��āA�ߔM��ԂƂȂ邱�Ƃ�����܂��B���̏�Ԃ͑�ϊ댯�ł���A�����I�ȏՌ���ٕ����t�̂ɉ�������₢�Ȃ�A�����I�ȕ������N�����̂ł��B���̌��ۂ��u�˕�(explosive boil)�v�Ƃ����܂��B�˕����N����ƁA�����M�����ʂɒD���ĉ��x��������A���炭�͐Â��ȏ�Ԃ������܂����A���M�𑱂��Ă����ƁA�Ăѓ˕����N����Ƃ����悤�ȏ�Ԃ��J��Ԃ��悤�ɂȂ�܂��B�˕��́A�����̉t������ɔ�юU�点��댯��������̂ŁA���ӂ��Ȃ���Ȃ�Ȃ����ۂł��B

�}.10 �t�̂̎�������M�����ꍇ�ɂ́A�˕����N����₷���Ȃ�
�w�������Ȃǂł́A�˕���h�����߂ɁA�t�̂𝘝a������A��������ꂽ�肵�܂��B�����́A�����ׂ̍����������u���E��(porous)�v���ł��B�t�̂ɕ�����������ƁA�����ɕ����߂�ꂽ�C�A�������̊j�ƂȂ��āA�˕���h���܂��B�������茳�ɂȂ��ꍇ�́A�ׂ����ӂ����A�ؔ��ł��A��p���邱�Ƃ��ł��܂��B�g�p�ς݂̕����ɂ́A��C�ł͂Ȃ��t�̂��܂܂�Ă���̂ŁA���̂܂܂ł͂قƂ�ǖ��ɗ����܂���B�������A�g�p���������ł��悭���������邱�ƂŁA�Ăюg�p���邱�Ƃ��ł���悤�ɂȂ�܂��B

�}.11 �������t�̂ɉ����邱�ƂŁA�˕���h�����Ƃ��ł���
��ʓI�ɂ́A�O����1�C����760 mmHg��1.013�~105 Pa�ɂ����Ƃ��ɕ������鉷�x���A���̕����́u���_(boiling point)�v�Ƃ����܂��B�������A�O�����ς��ƁA�������鉷�x���ω����邱�Ƃɒ��ӂ��܂��傤�B�Ⴆ�A�W��3,776 m�̕x�m�R�R���ł́A��C����630 hPa�ƂȂ��āA��H2O�͖�87���ŕ������܂��B�x�m�R�R���ŃJ�b�v���[������H�ׂ�l�����܂����A���̉��x�ł̓f���v���̌Љ����i�܂��A�J�b�v���[���������������H�ׂ��܂���B�܂��A�W��8,848 m�̃G�x���X�g�R���ł́A��C����300 hPa�ƂȂ�A��H2O�͖�70���ŕ�������悤�ɂȂ�܂��B

�}.12 �x�m�R�R���ł́A��H2O�͖�87���ŕ�������
����ŁA��ʓI�Ȉ��͓�́A��C��t�̂������Ȃ��悤�ɓ����𖧕n�ɂ��邱�ƂŁA��̒��̋C����2.4�C�����x�܂ŏグ�Ă��܂��B���̋C���ł́A��H2O�̕��_�͖�125���ɂȂ�܂��B�������x�́A���x��10���オ�邲�Ƃ�2�`4�{�ɂ��Ȃ�܂��B���̍����⍂���ɂ��A��ؗނȂ�זE�ǂ������j��A���ނȂ�^���p�N����@�ۂ�������������邽�߁A�Z���ԂŒ������邱�Ƃ��\�ƂȂ�܂��B����ɁA���M���͒ʏ�̓�Ŏς�����A���̐H�ނ̓������Â��ŏ��Ȃ��̂ŁA�傫�ȐH�ނɂ悭��ʂ��Ă��A�ϕ��ꂪ�N����ɂ����Ƃ������_������܂��B

�}.13 ���͓��p���邱�ƂŁA�H�ނ�ʏ��荂�����x�ƈ��͂̉��ŁA��r�I�Z���ԂŒ������邱�Ƃ��ł���
(3) ��Ԑ}
(i) ��Ԑ}�̌���
�@���鈳�͂Ɖ��x�̂��ƂŁA���̕����̏�Ԃ��������}���u��Ԑ}(phase diagram)�v�Ƃ����܂��B���̐}.14�̂悤�ɁA��Ԑ}�͏c���Ɉ��́A�����ɉ��x������Ď����܂��B���͂Ɖ��x�����^�����Ă���A��Ԑ}�����āA���̕����̏�Ԃ����Ȃ̂���ڂŕ�����̂ł��B
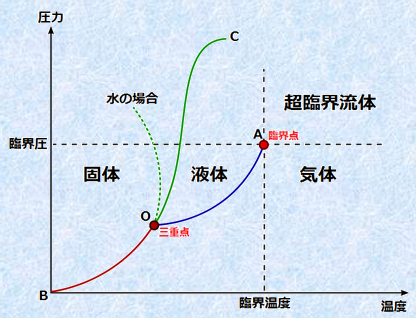
�}.14 ��Ԑ}
��Ԑ}�ɂ����āA�C���ƌő��̋��E�ł���Ȑ�OB���u���؈��Ȑ�(sublimation curve)�v�A�C���Ɖt���̋��E�ł���Ȑ�OA���u���C���Ȑ�(vapor pressure curve)�v�A�t���ƌő��̋��E�ł���Ȑ�OC���u�Z���Ȑ�(melting curve)�v�Ƃ����܂��B���̋Ȑ���̏����ł́A2�̏�Ԃ̊Ԃŕ��t�����藧���Ă���A�Ȑ����2�̏�Ԃ����肵�ċ����ł��鉷�x�ƈ��͂������Ă��܂��B���C���Ȑ��̍����������̏I�_�́u�ՊE�_(critical point)�v�ƌĂ�A����ȏ�̉��x�ƈ��͂ɂ����ẮA�u���ՊE����(supercritical fluid)�v�Ƃ�����ԂɂȂ�܂��B
���ՊE���̂́A�����I�ɂ͋C�̂̐U�镑����������̂́A�������x�̂��߂ɉt�̂̐����������������̏�Ԃł��B�Ⴆ�A���ՊE���̂̓�_���Y�fCO2�́A�f�J�t�F�R�[�q�[�����̍ۂɁA�J�t�F�C���𒊏o���ď������߂ɗp�����Ă��܂��B�܂��A���ՊE���̂̐�H2O�́A�A�Z�g���̂悤�ȗL�@�n�}�Ƃ��ĐU�镑���A���@���������قƂ�Ǘn�������A���^��CH4�̂����ȗL�@���������悭�n�����悤�ɂȂ�܂��B�܂��A�ɂ߂č����_���͂����̂ŁA����Pt���Au�܂Ŏ_�����Ă��܂��܂��B���̎_���͂𗘗p���āA���ՊE���̂̐�H2O���APCB(�|�������r�t�F�j��)��_�C�I�L�V���ނȂǂ̓�𐫗L�@���̏����ɗ��p���悤�Ƃ�������������܂��B

�}.15 ���ՊE���̂���_���Y�fCO2
����ɁA��Ԑ}�ɂ����āA3�̋Ȑ��������_�́u�O�d�_(triple point)�v�ƌĂ�܂��B�O�d�_�ł́A�ő��E�t���E�C���̎O�����������A�ȒP�Ɍ����u�X�����������Ă���v�悤�ȏ�Ԃł��B���̕����ŗL�̂����_�̉��x�ƈ��͂ł������݂ł��܂���B��H2O�̏ꍇ�ł́A�O�d�_��273.16 K�Ŗ�610 Pa�̏�Ԃł��B���݂ł́A��H2O�̎O�d�_��SI�P�ʌn�ɂ����āA���x�̒�`�ɗp�����Ă��܂��B���̒�`�ɂ��A���̎O�d�_�͌�����611.657�}0.010 Pa��0.01���Ƃ���Ă��܂��B

�}.16 ��H2O�̎O�d�_�ł́A�X�������Ԃŕ������N����
�܂��A��H2O�̏�Ԑ}�ł́A�ő̂Ɖt�̂̋����������ʼnt���t�̗Z���Ȑ����A��⍶�オ��ɂȂ��Ă��܂��B����́A��H2O�Ȃ�ł͂̐����ł���A�ő̂̕X���t�̂̐��̕����A���x���傫�����ƂɗR�����Ă��܂��B��H2O�̂悤�ɁA�ő̂��t�̂̏�Ԃ̕��̖��x���傫���������u�ُ�t��(abnormal liquid)�v�Ƃ����܂��B�ُ�t�̂́A��H2O�̑��ɂ̓P�C�fSi��Q���}�j�E��Ge�A�K���E��Ga�A�r�X�}�XBi�Ȃǂ��m���Ă��܂��B�ُ�t�̂ł́A�����ň��͂��グ�Ă����ƁA�ő̂���t�̂ɏ�ԕω����܂��B
(ii) �A�C�X�X�P�[�g�̉Ȋw
���̂悤�ɁA�X�͈��͂��グ��Ɖt�̂ɂȂ��ėn���܂��B���̂��߁A�A�C�X�X�P�[�g��X�L�[�Ȃǂ̕X������鋣�Z���ł���̂́A�u�X���n�Ȃǂ̈��͂ŗZ�����A�X��ɔ����������ł��邱�ƂŖ��C�͂��������Ȃ�A�X�̏�������悤�ɂȂ邩��v�Ƃ�����������܂��B���͂ɂ���ĕX�̗Z�_���ǂꂾ���ቺ����̂��́A�������w�I�Ɍv�Z�\�ł��B�Ⴆ�A�̏d240 kg�̗͎m������30 cm�A��1 mm�̃X�P�[�g�̐n�ɂ܂������ɗ����Ă���Ƃ���ƁA��800 kg/cm2�̈��͂��X�ɂ�����܂����A����ɂ��Z�_�~���͖�0.60���ɉ߂����A�Z�_�t�߂̌���ꂽ�����ł��������ł��܂���B���ہA�t�B�M���A�X�P�[�g�ł͕X�̉��x�͂���炩�߂�-3���i�X�ɐn�������|���Ĕ�ԕK�v�����邽��)�A�X�s�[�h�X�P�[�g�ł͂��d�߂�-5��(�X�Ƃ̖��C�����Ȃ����邽��)�ƂȂ��Ă��邽�߁A���͂ɂ���Z�_�~�����N�����Ă��A�X���Z�����邱�Ƃ͂���܂���B

�}.17 �̏d240 kg�̗͎m���X�P�[�g�C�𗚂����Ƃ��Ă��A�X�̗Z�_��0.60������������Ȃ�
�@�ߔN�A�X�̕\�ʍ\���ɂ��Ă̌������i��ł���A�X�̊���₷���́A�\�ʂ̗Z���ɂ�萶����u�^���t�̑w�v���A�����܂̖������ʂ������߂ƍl�����Ă��܂��B�X�̉��x�̏㏸�ƂƂ��ɁA�\�ʍŊO�w�̐����q�̔M�^���͌������Ȃ�A�w�I�ɍr�ꂽ�\�ʂ����܂��B�\�ʂɐ��������\�`���Snm�̉t�̑w�́A���n�ł��錋���\���̉e���𑽏���̂ŁA���S�ȉt�̂Ƃ͈قȂ�Ƃ����Ӗ��Łu�^���t�̑w�v�ƌĂ�܂��B���ۂɁA�^���t�̑w�̑��݂Ŗ��C�W�����ቺ���邱�Ƃ�A�X�̕\�ʂ̏��������I�ɏC�����ꂽ���Ƃ������I�Ɏ�����Ă��܂��B
�E�Q�l����
1) �ΐ쐳���u�V���n�̉��w(��)�v�x�䕶��(2005�N���s)
2) �m���g�f����w�̐V������O�ȓ�(2013�N���s)
3) ꎓ���/������/�R�{����/��19���u���w�v�[�ъ�(2012�N���s)
4) �����뒉�w�u�n����v�Ɓu�Z����v�x���w�Ƌ���69��3��(2021�N)