�E���a�H��Ń����_�i�H�i�Y�����j���̃����_�Z�x�����߂�
�y�ڎ��z
(1) ��������
�@ 50 mL�r�[�J�[��10�{��߂��������_�i�H�i�Y�����j��15 mL�قlj�����B
�A �������z�[���s�y�b�g��p���āA�@�̃����_10 mL�𐳊m�Ɏ��A100 mL���X�t���X�R�ɓ����B�s�y�b�g�̐�[�̎c�H�́A�ʂ̕�������̂Ђ�ʼn��߂Ă��ׂďo����B
�B ���X�t���X�R�̕W���̎�O�܂ŏ����������A�W�����Ă悭��������B���̌�A��s�y�b�g�ŏ������������T�d�ɉ����A���j�X�J�X�̉��ʂ�W���ɍ��킹��B
�C �r�����b�g�̊��������Ă��邱�Ƃ��m�F���A50 mL�r�[�J�[�Ɏ����0.100 mol/L���_���i�g���E�����n�t���r�����b�g�ɓ����B���_���i�g���E�����n�t�̉t�ʂ́A�r�����b�g�̖ڐ����0�`5 mL�͈̔͂ɂȂ�悤�ɂ��A�t�ʂ�0 mL�����㑤�ɂ��Ȃ����ƁB
�D �r�����b�g�̉��ɐ��_���i�g���E�����n�t�̓�����50 mL�r�[�J�[��u���A�������J���āA�r�����b�g�ɓ��������_���i�g���E�����n�t�����ʂ����o���B���̑���ɂ��A�r�����b�g�̐�[�ɂ��܂��Ă����C�A��ǂ��o�����Ƃ��ł��A�r�����b�g�̐�[�܂ŗn�t�����������B
�E �r�����b�g�𑤖ʂ��猩�āA���̂Ƃ��̐��_���i�g���E���̉t��V1���L�^���Ă����B
�F �ʂ̊������z�[���s�y�b�g��p���āA�B�Œ������������_�𐳊m��10 mL���A�R�j�J���r�[�J�[�ɓ����B�����ɁA�t�F�m�[���t�^���C���n�t��1�H���������B
�G �r�����b�g�̉����F�̃R�j�J���r�[�J�[��u���A�������������J���āA���_���i�g���E�����n�t��20 mL�قǓH������B���̂Ƃ��̃r�����b�g���̐��_���i�g���E���̉t��V2���L�^���Ă����B
�H �����������ԂŁA�Ăуr�����b�g�ɐ��_���i�g���E��������B�t�ʂ��ڐ����0�`5 mL�͈̔͂ɂȂ�悤�ɂ��A���̂Ƃ��̐��_���i�g���E���̉t��V3���L�^���Ă����B
�I �������������J���āA�r�����b�g���琅�_���i�g���E�����n�t��1�H�����Ƃ��B�R�j�J���r�[�J�[��U�荬���Ȃ���H�����A�r�[�J�[���̐��n�t�̐F���ԕς��āA���̐F�������Ȃ��Ȃ�܂œH�����Ă����B���̂Ƃ��̃r�����b�g���̐��_���i�g���E���̉t��V4���L�^���Ă����B
�J �ȍ~�A�C�`�I�̑�����J��Ԃ��B�R�j�J���r�[�J�[���Ăюg�p����ۂ́A�܂��͐������ŐA�����Ōy������������Ɏg�p���邱�ƁB
(2) ���_
��ʂɒ��a�����ł́A�u�_���琶������H+�̕����ʁ�����琶������OH�|�̕����ʁv���������܂��B�Ⴆ�A����Z�x�̊_10 mL���ߕs���Ȃ����a���邽�߂ɁA0.20
mol/L�̐��_���i�g���E�����n�t��8.6 mL�H�������Ƃ��܂��B���̊_�̔Z�x ![]() �́A���̂悤�ɋ��߂邱�Ƃ��ł��܂��B
�́A���̂悤�ɋ��߂邱�Ƃ��ł��܂��B

![]()
![]()
���̂悤�ɂ���ƁA�Z�x���m�̐��n�t�̔Z�x�����߂邱�Ƃ��ł��܂��B����̎����ł́A�Z�x���m�̎_�ɂ̓����_H3PO4���A�Z�x���m�̉���ɂ͐��_���i�g���E��NaOH���g�p���܂����B���_���i�g���E��NaOH�́A��C���̓�_���Y�fCO2�Ɣ������ĔZ�x���ω����邽�߁A�����̒��O�ɒ���������悤�ɂ��܂��B�����_H3PO4�Ɛ��_���i�g���E��NaOH�́A���̂悤�ɒ��a�������܂��B
H3PO4�@�{�@3NaOH�@���@Na3PO4�@�{�@3H2O
�@�����_H3PO4�͎O���̎_�Ȃ̂ŁA���_���i�g���E��NaOH�ƒ��a����ƁA��L�̒��������i�s�������ł��B���̔����́A���̎O�i�K�̒��a�����ɕ����邱�Ƃ��ł��܂��B
H3PO4�@�{�@NaOH�@���@NaH2PO4�@�{�@H2O �E�E�E(I)
NaH2PO4�@�{�@NaOH�@���@Na2HPO4�@�{�@H2O �E�E�E(II)
Na2HPO4�@�{�@NaOH�@���@Na3PO4�@�{�@H2O �E�E�E(III)
�@(I)���̔����̏I�����������̂���ꒆ�a�_�ŁA�����_H3PO4���ꉿ�̎_�Ƃ��Ē��a���ꂽ���Ƃ������܂��B���̂Ƃ��̗n�t��pH�́A�����������_�f�i�g���E��NaH2PO4�̉��������ɂ���4.5�������̂ŁA�w����Ƃ��ă��`���I�����W�i�ϐF��3.1�`4.4�j��p����A��ꒆ�a�_�̏I�_��m�邱�Ƃ��ł��܂��B
����ɐ��_���i�g���E��NaOH���n�t�������Ă����A(II)���̔����̏I�����������̂���a�_�ł��B��a�_�ł́A�����_H3PO4�͓̎_�Ƃ��Ē��a����邱�ƂɂȂ�܂��B���̂Ƃ��̗n�t��pH�́A�����������_���f�i�g���E��Na2HPO4�̉��������ɂ���9.5�������̂ŁA�w����Ƃ��ăt�F�m�[���t�^���C���i�ϐF��8.2�`9.8�j��p����Βm�邱�Ƃ��ł��܂��B
�@�������A(III)���̏I����������O���a�_�́A���Ȃ苭������̗̈�i�����_�i�g���E��Na3PO4�̉��������ɂ��pH�͖�12.7�j�ɂ���A���������_���i�g���E��NaOH���n�t�Ƃق�pH���������̂ŁApH�W�����v�͋N���炸�A�w������g���Ēm�邱�Ƃ͂ł��܂���B
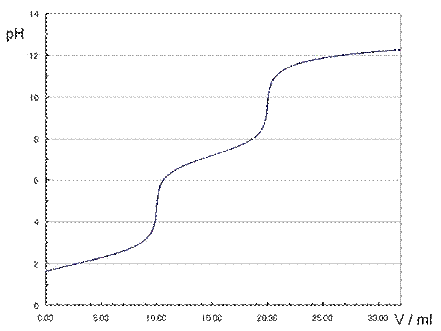
�}.1 0.100
mol/L�̃����_H3PO4�i10
mL�j��0.100 mol/L�̐��_���i�g���E��NaOH�œH�肵���Ƃ��̓H��Ȑ�
����̎����ł́A�w����Ƃ��ăt�F�m�[���t�^���C���n�t��p�����̂ŁA�����_H3PO4�͓̎_�Ƃ��ĐU�镑���A���̂悤�Ȕ������N�����ďI�_�ɒB���܂��B���_���i�g���E�����n�t��0.100 mol/L�ɒ����������̂�p���āA���a�H��ɂ��A�s�̂̃����_�i�H�i�Y�����j�Ɋ܂܂�郊���_H3PO4�̔Z�x�����߂܂����B
H3PO4�@�{�@2NaOH�@���@Na2HPO4�@�{�@2H2O
(3) ����
�@�������ʂ́A���̕\.1�̂悤�ɂȂ�܂����B�r�����b�g�̖ڐ���́A�����_��2��(�ŏ��ڐ����1/10)�܂œǂނ悤�ɂ��܂��B
�\.1 ���a�_�܂łɗv����0.100 mol/L���_���i�g���E�����n�t�̓H���
|
|
1��� |
2��� |
3��� |
|
�H��O�̉t�� V1 mL |
1.41
mL |
2.63
mL |
1.73
mL |
|
�H���̉t�� V2 mL |
24.18
mL |
24.48
mL |
24.22
mL |
|
�H����@ V2�|V1 mL |
22.77
mL |
21.85
mL |
22.49
mL |
|
�H��O�̉t�� V3 mL |
3.21
mL |
0.90
mL |
2.45
mL |
|
�H���̉t�� V4 mL |
10.45
mL |
8.35
mL |
9.61
mL |
|
�H����A V4�|V3 mL |
7.24
mL |
7.45
mL |
7.16
mL |
|
�H��ʂ̍��v �H����@�{�A |
30.01
mL |
29.30
mL |
29.65
mL |
|
�H��ʂ̕��ϒl
|
29.65
mL |
||
�@�H��ʂ̕��ϒl![]() ��p���āA�����_�i�H�i�Y�����j���Ɋ܂܂�郊���_H3PO4�̎���%�Z�x�����߂܂��B�������A���߂������_�i�H�i�Y�����j10 mL�𒆘a����̂ɁA0.100
mol/L���_���i�g���E�����n�t��29.65 mL�K�v�������̂ŁA���߂������_H3PO4�̔Z�x�́A���̂悤�ɋ��߂邱�Ƃ��ł��܂��B
��p���āA�����_�i�H�i�Y�����j���Ɋ܂܂�郊���_H3PO4�̎���%�Z�x�����߂܂��B�������A���߂������_�i�H�i�Y�����j10 mL�𒆘a����̂ɁA0.100
mol/L���_���i�g���E�����n�t��29.65 mL�K�v�������̂ŁA���߂������_H3PO4�̔Z�x�́A���̂悤�ɋ��߂邱�Ƃ��ł��܂��B
![]()
![]()
�@���̃����_H3PO4�́A���X�t���X�R��p����100�{�Ɋ�߂������̂ł��B������A���Ƃ̎s�̂̃����_�i�H�i�Y�����j1.0 L���Ɋ܂܂�郊���_H3PO4 (M��98)�̎��ʂ����߂�ƁA���̂悤�ɂȂ�܂��B
![]()
�@�s�̂̃����_�i�H�i�Y�����j�̖��x��1.70 g/cm3�Ƃ��āA�����_�i�H�i�Y�����j���̃����_H3PO4�̎���%�Z�x�����߂�ƁA���̂悤�ɂȂ�܂��B
![]()
����āA�s�̂̃����_�i�H�i�Y�����j���̃����_H3PO4�̎���%�Z�x�́A���悻85%�Ƌ��߂��܂��B
�E�Q�l����
1) �m���g�f�u���w�̐V�����v�O�ȓ�(2013�N���s)