پE—‘z‹C‘ج‚جڈَ‘ش•û’ِژ®‚ً—p‚¢‚½•ھژq—ت‚ج‘ھ’è
پy–عژںپz
‡@ ٹغ’êƒtƒ‰ƒXƒR‚جŒû‚ةƒAƒ‹ƒ~”“‚ًژو‚è•t‚¯پA—ضƒSƒ€‚إ”›‚è•t‚¯‚éپB‚±‚ج‚ئ‚«پAڈِ‹C‚ج’ت‚蓹‚ئ‚µ‚ؤپAڈ¬‚³‚بŒٹ‚ًƒVƒƒپ[ƒvƒyƒ“ƒVƒ‹‚ب‚ا‚ًژg‚ء‚ؤ‹َ‚¯‚ؤ‚¨‚پB
‡A ƒAƒ‹ƒ~”“‚ًژو‚è•t‚¯‚½ƒtƒ‰ƒXƒR‘S‘ج‚جژ؟—ت ![]() پkgپl‚ًپA“dژq“V”‰‚إ0.01 g‚ج’l‚ـ‚إگ³ٹm‚ة—ت‚éپBƒtƒ‰ƒXƒR‚ح“]‚ھ‚è‚â‚·‚¢‚ج‚إپAƒoƒbƒg‚ب‚ا‚ج‘ن‚ة’u‚¢‚ؤ—ت‚é‚ئ‚و‚¢پB
پkgپl‚ًپA“dژq“V”‰‚إ0.01 g‚ج’l‚ـ‚إگ³ٹm‚ة—ت‚éپBƒtƒ‰ƒXƒR‚ح“]‚ھ‚è‚â‚·‚¢‚ج‚إپAƒoƒbƒg‚ب‚ا‚ج‘ن‚ة’u‚¢‚ؤ—ت‚é‚ئ‚و‚¢پB
‡B ƒAƒ‹ƒ~”“‚ًٹO‚µپAژl‰–‰»’Y‘fCCl4‚ً‹îچƒsƒyƒbƒg‚إ–ٌ3 mL—ت‚èژو‚èپAƒtƒ‰ƒXƒR‚ج’†‚ة“ü‚ê‚éپBژl‰–‰»’Y‘fCCl4‚ً“ü‚ꂽ‚çپAچؤ‚رƒAƒ‹ƒ~”“‚ًژو‚è•t‚¯‚éپB
‡C ژxژٹآ‚ئƒNƒ‰ƒ“ƒv‚ًژو‚è•t‚¯‚½ƒXƒ^ƒ“ƒh‚ً—pˆس‚µپAژxژٹآ‚جڈم‚ة‹à–ش‚ًچع‚¹‚éپB
‡D 1 Lƒrپ[ƒJپ[‚ةگ…‚ً”¼•ھ‚ظ‚ا“ü‚êپA‹à–ش‚جڈم‚ةچع‚¹پAƒtƒ‰ƒXƒR‚ًگ…’†‚ةگZ‚·پBƒtƒ‰ƒXƒR‚ج’ê‚ھƒrپ[ƒJپ[‚ج’ê‚©‚ç1 cm‚‚ç‚¢‚ة‚ب‚é‚و‚¤‚ةپAƒNƒ‰ƒ“ƒv‚ًڈم‰؛‚³‚¹‚ؤچ‚‚³‚ً’²گ®‚·‚éپB
‡E ƒrپ[ƒJپ[‚جگ…‚ج—ت‚ھ9•ھ–ع‚‚ç‚¢‚ة‚ب‚é‚و‚¤‚ةپAگ…‚ً‰ء‚¦‚ؤ—ت‚ً’²گ®‚·‚éپB‚±‚ج‚ئ‚«پAƒrپ[ƒJپ[‚جگ…‚ة•¦“«گخ‚ًگ”Œآ“ü‚ê‚ؤ‚¨‚پB
‡F ƒtƒ‰ƒXƒR‚ًƒNƒ‰ƒ“ƒv‚إ‚µ‚ء‚©‚è‚ئŒإ’肵پAƒKƒXƒoپ[ƒiپ[‚ة“_‰خ‚µ‚ؤپAƒrپ[ƒJپ[‚جگ…‚ً‹‰خ‚إ‰ء”M‚·‚éپB
‡G ƒrپ[ƒJپ[‚جگ…‚ھ•¦“_‚ة‹ك•t‚¢‚ؤ‚«‚½‚çپAƒKƒXƒoپ[ƒiپ[‚ج‰خ‚ًژم‚ك‚ؤپAƒtƒ‰ƒXƒR“à‚جژl‰–‰»’Y‘fCCl4‚ج—ت‚ً‚و‚ٹm”F‚·‚éپBژl‰–‰»’Y‘fCCl4‚حڈِ”‚µ‚ؤپA‚¾‚ٌ‚¾‚ٌڈ‚ب‚‚ب‚ء‚ؤ‚¢‚‚ج‚إپA‰t‘ج‚ھ‚ب‚‚ب‚ء‚½‚ئ‚«‚ة‰ء”M‚ً‚â‚ك‚éپB‰خ‚ًژ~‚ك‚ؤ‚©‚ç3•ھ‚ظ‚ا‚»‚ج‚ـ‚ـ•ْ’u‚µپA‚±‚ج‚ئ‚«‚جƒrپ[ƒJپ[‚جگ…‰·tپkپژپl‚ً‘ھ’è‚·‚éپB
‡H ژG‹ذ‚ب‚ا‚إژè‚ً•غŒى‚µ‚ب‚ھ‚çپAƒtƒ‰ƒXƒR‚ً’چˆسگ[‚ژو‚èڈo‚·پB1 Lƒrپ[ƒJپ[‚ة—âگ…‚ً–‚½‚µپAƒtƒ‰ƒXƒR‚ًگZ‚µ‚ؤ‹}—â‚·‚éپBƒtƒ‰ƒXƒR‚ھژ؛‰·’ِ“x‚ـ‚إ—₦‚½‚çپAژG‹ذ‚إگ…‚ً‚و‚گ@‚«ژو‚éپB
‡I ƒAƒ‹ƒ~”“‚ئ—ضƒSƒ€‚ً•t‚¯‚½‚ـ‚ـپAƒtƒ‰ƒXƒR‘S‘ج‚جژ؟—ت![]() پkgپl‚ً“dژq“V”‰‚إ‘ھ’è‚·‚éپB‘ھ’èŒم‚ةƒAƒ‹ƒ~”“‚ئ—ضƒSƒ€‚ً‚ح‚¸‚µ‚ؤپAژl‰–‰»’Y‘fCCl4‚ً‰ٌژû‚·‚éپB
پkgپl‚ً“dژq“V”‰‚إ‘ھ’è‚·‚éپB‘ھ’èŒم‚ةƒAƒ‹ƒ~”“‚ئ—ضƒSƒ€‚ً‚ح‚¸‚µ‚ؤپAژl‰–‰»’Y‘fCCl4‚ً‰ٌژû‚·‚éپB
‡J ƒtƒ‰ƒXƒR‚ةگ…‚ًˆê”t‚ة–‚½‚µپA‚»‚جگ…‚ًگTڈd‚ةƒپƒXƒVƒٹƒ“ƒ_پ[‚ةˆع‚µ‚ؤپAƒtƒ‰ƒXƒR“à‚إ‹C‘ج‚جگè‚ك‚ؤ‚¢‚½—eگدvپkmLپl‚ً‘ھ’è‚·‚éپB
‡K ƒAƒlƒچƒCƒh‹Cˆ³Œv‚ًژg‚ء‚ؤپA‘ه‹Cˆ³pپkhPaپl‚ً‘ھ’è‚·‚éپB

گ}.1 ‰ء”M‚ةژٹش‚ھ‚©‚©‚é‚ج‚إپA‰·گ…‚ً—p‚¢‚é‚ئپAژٹش‚ج’Zڈk‚ة‚ب‚éپB•¦“«گخ‚حپA“r’†‚إ‰ء”M‚ً’†ژ~‚·‚é‚ئپAŒّ—ح‚ًژ¸‚¤‚ج‚إ’چˆس‚·‚é
(2) —ک_
ژl‰–‰»’Y‘fCCl4(b.p.76.7پژ)‚ج‚و‚¤‚ة‹C‰»‚µ‚â‚·‚¢‰t‘جژژ—؟‚ًپA“K“–—ت‚¾‚¯ٹغ’êƒtƒ‰ƒXƒR‚ة“ü‚êپA•¦“«گ…’†‚ة•غژ‚µ‚ـ‚·پB‚·‚é‚ئپAژl‰–‰»’Y‘fCCl4‚ح’¼‚؟‚ةڈِ”‚µ‚ـ‚·‚ھپAژl‰–‰»’Y‘fCCl4(Mپپ153.82)‚جڈِ‹C‚ج–§“x‚حپA‹َ‹C(Mپپ28.97)‚و‚è‚à‘ه‚«‚¢‚ج‚إپA‚ح‚¶‚ك‚ةƒtƒ‰ƒXƒR“à‚ً–‚½‚µ‚ؤ‚¢‚½‹َ‹C‚حپAڈ™پX‚ة‰؛‚©‚ç‰ں‚µڈم‚°‚ç‚êپA‚â‚ھ‚ؤƒtƒ‰ƒXƒR“à‚©‚ç‚حپA‚ظ‚عٹ®‘S‚ة’ا‚¢ڈo‚³‚ê‚ـ‚·پB‚»‚µ‚ؤچإŒم‚ة‚حپA—]•ھ‚ة“ü‚ꂽ‰t‘جژژ—؟‚جڈِ‹C‚à’ا‚¢ڈo‚³‚êپA‚؟‚ه‚¤‚اژl‰–‰»’Y‘fCCl4‚ج‰t‘ج‚ھ‚ب‚‚ب‚ء‚½ژ“_‚إپAƒtƒ‰ƒXƒR“à‚ًپuژl‰–‰»’Y‘fCCl4‚جڈِ‹C‚¾‚¯پv‚ھ–‚½‚·‚±‚ئ‚ة‚ب‚è‚ـ‚·پB‚»‚µ‚ؤپA‚±‚ج‚ئ‚«‚جڈِ‹C‚جژ؟—تwپAˆ³—حPپA‘جگدVپAگâ‘خ‰·“xT‚ج’l‚ً‹پ‚كپA—‘z‹C‘ج‚جڈَ‘ش•û’ِژ®PVپپnRT‚ة‘م“ü‚·‚ê‚خپAژl‰–‰»’Y‘fCCl4‚ج•ھژq—تM‚ھ•ھ‚©‚é‚ج‚إ‚·پB‚ب‚¨پA—‘z‹C‘ج‚جڈَ‘ش•û’ِژ®PVپپnRT‚حپA•ھژq—تM‚ً—p‚¢‚é‚ئپAژں‚ج‚و‚¤‚ة•دŒ`‚إ‚«‚ـ‚·پB
![]()
![]()
![]()
—‘z‹C‘ج‚جڈَ‘ش•û’ِژ®PVپپnRT‚حپA‹C‘ج‚ة‚µ‚©“K—p‚إ‚«‚ب‚¢•û’ِژ®‚ب‚ج‚إپA‚±‚ج•û’ِژ®‚ة‘م“ü‚·‚é’l‚حپAژl‰–‰»’Y‘fCCl4‚جپuڈِ‹Cپv‚ھپAƒtƒ‰ƒXƒR“à‚ً–‚½‚µ‚ؤ‚¢‚é‚ئ‚«‚ج’l‚إ‚ب‚¯‚ê‚خ‚ب‚è‚ـ‚¹‚ٌپB‚µ‚©‚µپA‚±‚ج‚ئ‚«‚جژ؟—تwپAˆ³—حPپA‘جگدVپAگâ‘خ‰·“xT‚ج’l‚ًپA’¼گعژہŒ±‚إŒv‘ھ‚·‚é‚ج‚حپA”ٌڈي‚ةچ¢“ï‚إ‚·پB‚»‚±‚إپA‚±‚ج‚ئ‚«‚جˆ³—حP‚حپAƒtƒ‰ƒXƒR‚ج“àٹO‚إپAˆê‰ˆ³•½چt‚ھگ¬‚è—§‚ء‚ؤ‚¢‚é‚ئ‚µ‚ؤپAP پپ p (‘ه‹Cˆ³)‚ئ‚µ‚ـ‚·پB‚ـ‚½پAƒtƒ‰ƒXƒR“à‚ة‰·“xŒv‚ھ“ü‚ء‚ؤ‚¢‚é–َ‚إ‚ح‚ب‚¢‚ج‚إپAƒtƒ‰ƒXƒR“à‚ج‰·“xT‚ح•ھ‚©‚è‚ـ‚¹‚ٌپB‚µ‚©‚µپA‚±‚±‚إ‚àƒtƒ‰ƒXƒR‚ج“àٹO‚إپA‰·“x•½چt‚ھگ¬‚è—§‚ء‚ؤ‚¢‚é‚ئ‚µ‚ؤپAT پپ t (گ…‰·)‚ئ‚·‚邱‚ئ‚ة‚µ‚ـ‚·پB‚ـ‚½پA‚±‚ج‚ئ‚«‚ج‘جگدV‚à•ھ‚©‚è‚ـ‚¹‚ٌپB‚µ‚©‚µپA‚±‚±‚إ‚à‰·“x‚ة‚و‚éƒtƒ‰ƒXƒR‚ج—eگد•د‰»‚ح–³ژ‹‚إ‚«‚é‚ئ‚µ‚ؤپAV پپ v (ƒtƒ‰ƒXƒR“à‚جگ…‚ج‘جگد)‚ئ‚·‚邱‚ئ‚ة‚µ‚ـ‚µ‚ه‚¤پB
‚»‚ê‚إ‚حپAژl‰–‰»’Y‘fCCl4‚جپuڈِ‹Cپv‚جژ؟—تw‚حپA‚¢‚‚ç‚ة‚ب‚é‚إ‚µ‚ه‚¤‚©پBژہ‚حپAƒtƒ‰ƒXƒR“à‚ً–‚½‚µ‚½پuڈِ‹Cپv‚جژ؟—ت‚ً‹پ‚ك‚é•û–@‚حپAڈ‚µ–ï‰î‚ب‚ج‚إ‚·پBچإڈ‰‚ة—ت‚ء‚½‹َ‚جƒtƒ‰ƒXƒR‚جژ؟—ت![]() ‚حپAƒtƒ‰ƒXƒR“à‚ة‚ ‚éپu‹َ‹Cپv‚ًٹـ‚ك‚½ژ؟—ت‚إ‚·پB‚µ‚½‚ھ‚ء‚ؤپAƒtƒ‰ƒXƒR“à‚ھٹ®‘S‚ةژl‰–‰»’Y‘fCCl4‚جپuڈِ‹Cپv‚إ–‚½‚³‚ꂽڈَ‘ش(‹َ‹C‚ھٹ®‘S‚ة’ا‚¢ڈo‚³‚ê‚ؤ‚¢‚é)‚جژ؟—ت
‚حپAƒtƒ‰ƒXƒR“à‚ة‚ ‚éپu‹َ‹Cپv‚ًٹـ‚ك‚½ژ؟—ت‚إ‚·پB‚µ‚½‚ھ‚ء‚ؤپAƒtƒ‰ƒXƒR“à‚ھٹ®‘S‚ةژl‰–‰»’Y‘fCCl4‚جپuڈِ‹Cپv‚إ–‚½‚³‚ꂽڈَ‘ش(‹َ‹C‚ھٹ®‘S‚ة’ا‚¢ڈo‚³‚ê‚ؤ‚¢‚é)‚جژ؟—ت![]() ‚ئ‚جچ·‚ًŒvژZ‚µ‚ؤ‚àپAژl‰–‰»’Y‘fCCl4‚جپuڈِ‹Cپv‚جژ؟—تw‚ً‹پ‚ك‚邱‚ئ‚ح‚إ‚«‚ـ‚¹‚ٌپB—eٹي‚ً–‚½‚µ‚ؤ‚¢‚½پu‹َ‹Cپv‚جژ؟—ت•ھ‚¾‚¯پA’l‚ھڈ¬‚³‚‚ب‚ء‚ؤ‚µ‚ـ‚¤‚ج‚إ‚·پB
‚ئ‚جچ·‚ًŒvژZ‚µ‚ؤ‚àپAژl‰–‰»’Y‘fCCl4‚جپuڈِ‹Cپv‚جژ؟—تw‚ً‹پ‚ك‚邱‚ئ‚ح‚إ‚«‚ـ‚¹‚ٌپB—eٹي‚ً–‚½‚µ‚ؤ‚¢‚½پu‹َ‹Cپv‚جژ؟—ت•ھ‚¾‚¯پA’l‚ھڈ¬‚³‚‚ب‚ء‚ؤ‚µ‚ـ‚¤‚ج‚إ‚·پB

‚µ‚½‚ھ‚ء‚ؤپAƒtƒ‰ƒXƒR“à‚ً–‚½‚µ‚½ژl‰–‰»’Y‘fCCl4‚جپuڈِ‹Cپv‚جگ³ٹm‚بژ؟—تw‚ً—ت‚邽‚ك‚ة‚حپA—â‹p‚µ‚ؤپuڈِ‹Cپv‚ًٹ®‘S‚ة‹أڈk‚³‚¹پAƒtƒ‰ƒXƒR‚ج’†‚ة‹َ‹C‚ً–ك‚µ‚ؤ‚â‚é•K—v‚ھ‚ ‚è‚ـ‚·پB‹ï‘ج“I‚ة‚حپAƒtƒ‰ƒXƒR‚ًگ…—پ‚©‚çژو‚èڈo‚µپAژ؛‰·‚ـ‚إ—â‹p‚µ‚ؤپuڈِ‹Cپv‚ً‹أڈk‚³‚¹‚½‚ ‚ئپAƒtƒ‰ƒXƒR‚جٹO‘¤‚جگ…‚ً‚و‚گ@‚¢‚ؤ‚©‚ç—ت‚ء‚½ژ؟—ت![]() ‚ئپAچإڈ‰‚جƒtƒ‰ƒXƒR‚جژ؟—ت
‚ئپAچإڈ‰‚جƒtƒ‰ƒXƒR‚جژ؟—ت![]() ‚ئ‚جچ·‚ھپAƒtƒ‰ƒXƒR“à‚ً–‚½‚µ‚½ژl‰–‰»’Y‘fCCl4‚جپuڈِ‹Cپv‚جژ؟—تw‚ة‚ظ‚ع“™‚µ‚‚ب‚è‚ـ‚·پB
‚ئ‚جچ·‚ھپAƒtƒ‰ƒXƒR“à‚ً–‚½‚µ‚½ژl‰–‰»’Y‘fCCl4‚جپuڈِ‹Cپv‚جژ؟—تw‚ة‚ظ‚ع“™‚µ‚‚ب‚è‚ـ‚·پB

‚؟‚ب‚ف‚ةپA‚±‚ج•û–@‚إ•ھژq—ت‚ھ‹پ‚ك‚ç‚ê‚é‚ج‚حپA‰t‘ج‚ج•¦“_‚ھگ…—پ‚ج‰·“x‚و‚è‚à’ل‚پAڈِ‹C‚ج–§“x‚ھ‹َ‹C‚و‚è‚à‘ه‚«‚¢•¨ژ؟‚ج‚ف‚إ‚·پB‚±‚ê‚حپA—‘z‹C‘ج‚جڈَ‘ش•û’ِژ®‚ً—p‚¢‚邽‚ك‚ةپAگ…—پ‚ج‰·“x‚إ‹C‰»‚³‚¹‚é•K—v‚ھ‚ ‚邱‚ئپA‹C‰»‚µ‚½‚ئ‚«‚ة—eٹي“à‚ج‹َ‹C‚ً’ا‚¢ڈo‚·•K—v‚ھ‚ ‚邱‚ئ‚©‚çپAگà–¾‚·‚邱‚ئ‚ھ‚إ‚«‚ـ‚·پB
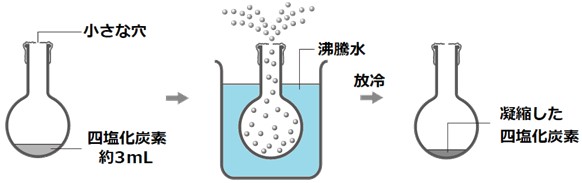
گ}.2 ژہŒ±‚جŒ´—
(3) Œ‹‰ت
پ@ژہŒ±‚جŒ‹‰ت‚و‚èپA![]() پA
پA![]() پAp پپ1027.1 hPaپAv پپ444.6 mLپAt پپ87.9پژ‚ئ‚ب‚è‚ـ‚µ‚½پB‹C‘ج’èگ”Rپپ8.31پ~103 L¥Pa/(mol¥K)‚ً—p‚¢‚ؤپAژl‰–‰»’Y‘fCCl4‚ج•ھژq—تM‚ًŒvژZ‚·‚é‚ئپAژں‚ج‚و‚¤‚ة‚ب‚è‚ـ‚·پB
پAp پپ1027.1 hPaپAv پپ444.6 mLپAt پپ87.9پژ‚ئ‚ب‚è‚ـ‚µ‚½پB‹C‘ج’èگ”Rپپ8.31پ~103 L¥Pa/(mol¥K)‚ً—p‚¢‚ؤپAژl‰–‰»’Y‘fCCl4‚ج•ھژq—تM‚ًŒvژZ‚·‚é‚ئپAژں‚ج‚و‚¤‚ة‚ب‚è‚ـ‚·پB
![]()
![]()
—ک_’l‚حMپپ153.82‚إ‚ ‚èپAژہŒ±’l‚حپA—ک_’l‚و‚è‚àڈ‚µڈ¬‚³‚¢’l‚ة‚ب‚ء‚ؤ‚µ‚ـ‚¢‚ـ‚µ‚½پB‚±‚ج——R‚ئ‚µ‚ؤ‚حپA—â‹p‚µ‚ؤژl‰–‰»’Y‘fCCl4‚ً‹أڈk‚³‚¹‚½‚ ‚ئ‚جژ؟—ت![]() ‚ً—ت‚é‚ئ‚«‚ةپAژl‰–‰»’Y‘fCCl4‚جڈِ‹Cˆ³‚ًچl‚¦‚ؤ‚¢‚ب‚¢‚±‚ئ‚ھ‚ ‚°‚ç‚ê‚ـ‚·پBژl‰–‰»’Y‘fCCl4‚جڈِ‹Cˆ³‚حپA25پژ‚إ1.93پ~104 Pa‚إ‚·پB—â‹p‚µ‚ؤڈِ‹C‚ًٹ®‘S‚ة‹أڈk‚³‚¹‚½ڈَ‘ش‚حپAٹ®‘S‚ب–§•آŒn‚إ‚ح‚ ‚è‚ـ‚¹‚ٌ‚ھپA‚ظ‚ئ‚ٌ‚ا–§•آ‚³‚ꂽڈَ‘ش‚ئ‚ف‚ب‚¹‚é‚©‚çپAژl‰–‰»’Y‘fCCl4‚ح‹C‰t•½چt‚جڈَ‘ش‚إ‚ ‚èپA‚±‚ج‚ئ‚«‚جژl‰–‰»’Y‘fCCl4‚ج•ھˆ³‚ج’l‚حپA25پژ‚ة‚¨‚¯‚éژl‰–‰»’Y‘fCCl4‚جڈِ‹Cˆ³‚ج’l1.93پ~104 Pa‚ة“™‚µ‚¢‚ئ‚ف‚ب‚·‚±‚ئ‚ھ‚إ‚«‚é‚ج‚إ‚·پB
‚ً—ت‚é‚ئ‚«‚ةپAژl‰–‰»’Y‘fCCl4‚جڈِ‹Cˆ³‚ًچl‚¦‚ؤ‚¢‚ب‚¢‚±‚ئ‚ھ‚ ‚°‚ç‚ê‚ـ‚·پBژl‰–‰»’Y‘fCCl4‚جڈِ‹Cˆ³‚حپA25پژ‚إ1.93پ~104 Pa‚إ‚·پB—â‹p‚µ‚ؤڈِ‹C‚ًٹ®‘S‚ة‹أڈk‚³‚¹‚½ڈَ‘ش‚حپAٹ®‘S‚ب–§•آŒn‚إ‚ح‚ ‚è‚ـ‚¹‚ٌ‚ھپA‚ظ‚ئ‚ٌ‚ا–§•آ‚³‚ꂽڈَ‘ش‚ئ‚ف‚ب‚¹‚é‚©‚çپAژl‰–‰»’Y‘fCCl4‚ح‹C‰t•½چt‚جڈَ‘ش‚إ‚ ‚èپA‚±‚ج‚ئ‚«‚جژl‰–‰»’Y‘fCCl4‚ج•ھˆ³‚ج’l‚حپA25پژ‚ة‚¨‚¯‚éژl‰–‰»’Y‘fCCl4‚جڈِ‹Cˆ³‚ج’l1.93پ~104 Pa‚ة“™‚µ‚¢‚ئ‚ف‚ب‚·‚±‚ئ‚ھ‚إ‚«‚é‚ج‚إ‚·پB
‚µ‚½‚ھ‚ء‚ؤپAژہچغ‚ة‚حپAژl‰–‰»’Y‘fCCl4‚جڈِ‹C‚ً—â‹p‚µ‚ؤ‹أڈk‚µ‚½‚ئ‚«پA‹َ‹C‚ح1.0271پ~105 —1.93پ~104پپ8.34پ~104 Pa•ھ‚µ‚©ƒtƒ‰ƒXƒR“à‚ة“ü‚ء‚ؤ‚±‚ب‚¢‚ج‚إ‚·پBچإڈ‰‚ج‹َ‚جƒtƒ‰ƒXƒR‚ة‚حپA1.0271پ~105 Pa‚ج‹َ‹C‚ھ“ü‚ء‚ؤ‚¢‚ـ‚µ‚½پB‚آ‚ـ‚èپAژl‰–‰»’Y‘fCCl4‚جڈِ‹Cˆ³1.93پ~104 Pa‚ة‘ٹ“–‚·‚é•ھ‚ج‹َ‹C‚ھƒtƒ‰ƒXƒR“à‚©‚ç”rڈœ‚³‚êپA”rڈœ‚³‚ꂽ‹َ‹C•ھ‚¾‚¯ژl‰–‰»’Y‘fCCl4‚جژ؟—تw‚حŒy‚‚ب‚é‚ج‚إپAگ³ٹm‚ة‚حپA‚»‚ج1.93پ~104 Pa•ھ‚ج‹َ‹C‚جژ؟—ت‚ً![]() ‚ة‰ء‚¦‚é•K—v‚ھ‚ ‚é‚ج‚إ‚·پB
‚ة‰ء‚¦‚é•K—v‚ھ‚ ‚é‚ج‚إ‚·پB

‚ئ‚±‚ë‚إپA‹َ‹C‚ج–§“x‚ً1.00 g/L‚ئ‚·‚é‚ئپA1.0271پ~105 Pa‚ب‚ç‘جگد444.6 mL‚ج‹َ‹C‚جژ؟—ت‚حپA1.00پ~0.4446پپ0.4446 g‚ئ‚ب‚è‚ـ‚·پB‚و‚ء‚ؤپA”rڈœ•ھ‚ج‹َ‹C‚جژ؟—تپA‚·‚ب‚ي‚؟1.93پ~104 Pa‚ج‹َ‹C‚جژ؟—ت‚حپAژں‚ج‚و‚¤‚ة‚ب‚è‚ـ‚·پB
![]()
‚±‚ج’l‚ً‚à‚ئ‚ة‚µ‚ؤپAژl‰–‰»’Y‘fCCl4‚ج•ھژq—تM‚ًگ³ٹm‚ةŒvژZ‚·‚é‚ئپAژں‚ج‚و‚¤‚ةپA—ک_’l‚ئ”ٌڈي‚ة‹ك‚¢’l‚ة‚ب‚è‚ـ‚·پB
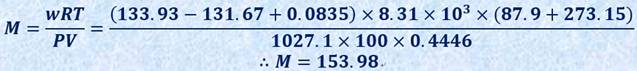
پEژQچl•¶Œ£
1) –m•”‹g—f¢‰»ٹw‚جگVŒ¤‹†£ژOڈب“°(2013”N”چs)
2) گخگىگ³–¾¢گV—Œn‚ج‰»ٹw–â‘è100‘I£ڈx‘ن•¶Œة(2012”N”چs)