�E�����l�َq������Ă݂悤�I
�y�ڎ��z
(1) ��������
�@
�O���j���[��15 g�ƕЌI��12 g���W�b�v���b�N�ɓ����B
�A
�N�G���_0.5 g�Ə��ʂ̐H�p�F�f�������A�悭����ō�����B
�B
����7�H�A�������ʏ`��3�H�����A����ɂ悭����ō�����B
�C
�������Ȃ��Ȃ��Ă�����A�d����0.5 g�����A�悭����ō�����B
�D ��������ƌł܂邮�炢�ɂȂ�����A�H�i�p���b�v�t�B�����Ɏ��o���čD���Ȍ`�ɐ��`����B�����Ă��ł܂�Ȃ��ꍇ�́A����1�H������B
�E �����قǎ��R���������Ċ����B

�}.1 ����̃����l�َq
(2) ���_
�@�����l�َq�́A�V�����i�܂��̓u�h�E���j�A�ЌI���A�N�G���_�������ɂ����ʉَq�ł��B�̂͐��������o�����߂ɁA�d�������������̂����������悤�ł����A���ݎs�̂���Ă��郉���l�َq�ɂ́A�܂܂�Ă��Ȃ����̂������ł��B�d���́A�_�Ɣ�������Ɠ�_���Y�fCO2����o���Ĕ��A���鐫�������邽�߁A�d���������邱�ƂŐ������������܂��B���w�����Ƃ��ẮA�d���̐����͒Y�_���f�i�g���E��NaHCO3�Ȃ̂ŁA�����l�َq�����̒��ŗn�����Ƃ��ɃN�G���_H3(C6H5O7)�Ɣ������āA��_���Y�fCO2�������܂��B
H3(C6H5O7)�@�{�@2NaHCO3�@���@Na2H(C6H5O7)�@�{�@2H2O�@�{�@2CO2
�@���̔������N���闝�R�́A�N�G���_H3(C6H5O7)���Y�_H2CO3�����_���x�������A��_�V���������N���邩��ł��B�������A��_�Ƃ��ėV������Y�_H2CO3�͕s����Ȃ̂ŁA���̒��ł����ɐ�H2O�Ɠ�_���Y�fCO2�ɕ������܂��B�Ȃ��A�N�G���_H3(C6H5O7)�͎O���̎_�ŁA�_�𗣒萔pKa�͑��d����3.12�A���d����4.76�A��O�d����6.39�ł��B����ɑ��A�Y�_H2CO3�͓̎_�ŁA�_�𗣒萔pKa�͑��d����6.35�A���d����10.33�ł��B����̂ɁA�N�G���_H3(C6H5O7)�̑��d���܂ł́A�Y�_H2CO3�����_���x�������̂Ŕ������N����܂����A��O�d���ł͎�_�V���������N����܂���B
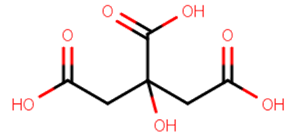
�}.2 �N�G���_�̍\����