・第18族元素(貴ガス)
【目次】
(1) 第18族元素
周期表において、第18族に属するヘリウムHe・ネオンNe・アルゴンAr・クリプトンKr・キセノンXn・ラドンRnなどの元素を、総称して「貴ガス(noble gas)」といいます。これらは、すべて常温常圧で多原子分子を作らずに、1原子が単独で存在する無色無臭の気体です。これらの元素の大きな特徴は、最外殻の軌道が完全に電子で満たされていることであり、このため原子はイオン化しにくく、他の原子や分子と結合して、化合物を作ることはほとんどありません。これが、「不活性ガス(inert gas)」とも呼ばれる所以です。
アルゴンArは、大気中に窒素N2と酸素O2に次いで多く含まれる気体で、大気中の存在比は0.934%(約1%)です。また、ヘリウムHe、ネオンNe、クリプトンKr、キセノンXeは、大気中にごく少量含まれています。大気中に含まれている量は、次の表.1の通りです。ちなみに、ヘリウムHeは、大気中における存在比は0.000524%とごく少量ですが、宇宙では水素Hに次いで多く存在する元素です。
表.1 貴ガスの性質
|
元素 |
電子配置(殻) |
融点 〔℃〕 |
沸点 〔℃〕 |
空気中の存在比 〔vol%〕 |
用途など |
|||||
|
K |
L |
M |
N |
O |
P |
|||||
|
ヘリウムHe |
2 |
|
|
|
|
|
-272* |
-269 |
0.000524 |
気球、低温実験 |
|
ネオンNe |
2 |
8 |
|
|
|
|
-249 |
-246 |
0.00182 |
ネオンランプ |
|
アルゴンAr |
2 |
8 |
8 |
|
|
|
-189 |
-186 |
0.934 |
蛍光灯封入ガス |
|
クリプトンKr |
2 |
8 |
18 |
8 |
|
|
-157 |
-152 |
0.000114 |
ガスレーザー |
|
キセノンXe |
2 |
8 |
18 |
18 |
8 |
|
-112 |
-107 |
0.0000087 |
キセノンランプ |
|
ラドンRn |
2 |
8 |
18 |
32 |
18 |
8 |
-71 |
-62 |
− |
医療用放射線源 |
* ヘリウムHeは26,345 hPaにおける融点。常圧ではいくら冷却しても固体にならない。
しかし、今日では、貴ガスの化合物もいくつか知られています。数少ない貴ガスの化合物の一例は、キセノンXnとフッ素Fとの化合物に見ることができます。二フッ化キセノンXnF2・四フッ化キセノンXnF4・六フッ化キセノンXnF6などが合成されており、キセノンXnの酸化数は、+2・+4・+6と変化します。ここに示したキセノンXnのフッ化物は、すべて常温常圧で結晶状態であり、これらの化合物は、いずれも強力なフッ素化剤となります。キセノンXnが、貴ガスの中でも化合物を作りやすい理由は、イオン化エネルギーが比較的小さいからです。クリプトンKrの化合物としては、二フッ化クリプトンKrF2のみが知られています。

図.1 四フッ化キセノンXnF4の結晶は、空気中の水分と反応するので、乾燥状態で保存する
レーザーは、貴ガスの有効的な応用の1つです。実用化されている代表的なレーザーに、「ヘリウム-ネオンレーザー」というものがあります。ヘリウム-ネオンレーザーは、気体レーザーとしては、最初に開発されたものです。真空ガラス管内に、ヘリウムHeとネオンNeの混合気体を封入し、レーザー細管を通して、電圧をかけて放電をします。すると、安定な軌道を回っていた電子が、さらに外側の軌道に押し出されます。しかし、これは不安定な励起状態なので、すぐに元の安定な基底状態に戻ろうとします。このときに放出されるエネルギーを利用することで、レーザーとして発光させることができるのです。赤色のレーザー光が一般的ですが、緑色や黄色のレーザー光もあります。

図.2 多色のヘリウム-ネオンレーザー
レストランの店頭や看板で煌々と輝く「ネオンサイン」も、基本的にはレーザーと同じ発光原理です。ネオンNeは大気中に0.0018%含まれ、大気中にはアルゴンArの次に割合が多い貴ガス元素です。低圧力のネオンNeを封入した放電管に65〜90 Vの電圧をかけると、放電によって赤橙色に輝きます。同様な発色現象は、他の貴ガス元素でも見られ、ヘリウムHeは黄色、アルゴンArは赤〜青色、クリプトンKrは黄緑色、キセノンXeは青〜緑色の発色を示します。
1907年、フランスの化学者であるジョルジュ・クロードは、液体空気からアルゴンArやネオンNeを大量に得る方法に成功し、その3年後の1910年には、ネオンサインを初めて公開しました。明るい赤橙色の光は、家庭用の照明としては、あまり実用的ではありませんでした。しかし、魅力的な色合いで人目を引くので、広告には最適でした。ネオンの光は、晴れた日でも鮮明に輝き、都会の煤煙を貫通でき、遠く離れたところでも標示が見えました。世界で初めてのネオンNeによる広告サインが登場したのは、パリのモンマルトル通りにある小さな理髪店で、1912年のことでした。

図.3 ネオンサインで彩られた歓楽街の代名詞として、「ネオン街」という言葉が使われることもある
(2) ヘリウム
「ヘリウム(helium)」は、太陽光のスペクトル中に初めて見つかり、地球上には存在しない元素と思われていた時代がありました。「Helios」とは、「太陽神」という意味です。その後、大気中にわずかに存在することが確かめられ、さらに地中からも大量に見つかりました。今日、私たちが使うヘリウムHeは、地下から湧きだす天然ガスから抽出されています。ヘリウムHeは、空気中にも含まれているのですが、その割合はわずか0.0005%です。あまりにも薄すぎるため、空気中から取り出すことは簡単にはできません。しかし、天然ガス中には、ヘリウムHeが1%前後も含まれています。アメリカやカタールなどでは、天然ガスからメタンCH4などを抽出したあとの気体から、工業的にヘリウムHeを得ています。
ヘリウムHeは、他のすべての安定元素と違って、地球ができたときから存在していた訳ではありません。長い年月の間に、地中に存在するラジウムRaなどが原子核崩壊することによって、少しずつ生成したものです。不安定なラジウムRaは、「α線(α粒子)」を放出する原子核崩壊により、ラドンRnへと変化します。そして、物理学者が「α線」と命名したものは、実は「ヘリウム4の原子核」でした。それ故に、この地球上に存在するヘリウム原子は、ほんの数千万年か数億年前には、大きな放射性原子の原子核を構成する陽子や中性子の一部だったのです。
![]()
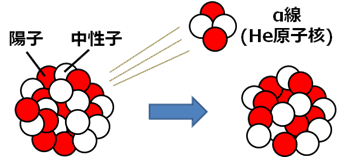
図.4 「α線」の正体は、実は「ヘリウム4の原子核」だった
貴ガス元素の中でも、ヘリウムHeは他の元素と一線を画く特異な性質を有しています。自然界に存在するヘリウムHeのほとんどは、質量数が4の原子核を持ちます。これを、「ヘリウム4」と呼びます。ヘリウム4は、1気圧の下では、絶対零度下においても固体になりません。固体のヘリウム4は、25気圧以上の圧力下で、初めて得られます。ヘリウム4の1気圧下での沸点は、4.21 Kです。
歴史的に見ると、ヘリウムHeは、あらゆる気体の中で、最も遅く液体が得られた物質です。オランダの物理学者であるカメルリング・オネスは、特別な冷却機を用いて、1908年にヘリウムHeの液化に初めて成功しました。当時、金属を冷却していくと、電気抵抗が小さくなっていくことは分かっていました。1911年にオネスは、水銀Hgや鉛Pbなどの純金属を冷却し、超低温での電気的性質の分析を行うことにしました。オネスは、絶対零度では電気抵抗が0になると思っていましたが、水銀Hgを冷却していくと、約4.2 Kで電気抵抗が不連続に0に変わりました。

図.5 オネスは、液体ヘリウムを使って超伝導を発見し、低温物理学の先駆者として知られる
当初、オネスは、試料の電極がショートしたのだと思いました。しかし、すぐに現実に電気抵抗が0になったのだと気付きました。これが、「超伝導(superconductivity)」の発見の瞬間でした。超伝導とは、物質の電気抵抗がゼロとなる状態で、通常の金属伝導とは、質的に異なる現象です。オネスは、「水銀は新たな状態へと遷移した。この状態の特異的な電気的特性から、これを超伝導状態(superconductivity state)とでも呼ぼう」と記しています。その後、オネスは、スズSnや鉛Pbなどでも、超伝導現象が起こることを発見しました。
また、オネスは、超伝導状態の物質に磁場を加えると、超伝導が消失することも発見しました。これら低温物理学における業績により、1913年には、ノーベル物理学賞がオネスに贈られています。超伝導状態では、電気抵抗が0になるので、電磁石のコイルに発熱なしで、いくらでも大量の電流を流すことができます。これは、超強力な電磁石の誕生を意味し、この電磁石を「超伝導磁石」といいます。東京から大阪を結ぶ「中央リニア新幹線」も、この超伝導磁石を用いています。

図.6 中央リニア新幹線は、最高設計速度505 km/hの高速走行が可能で、東京-大阪間を最短67分で結ぶ
液体ヘリウムの特異な性質は、他にもあります。液体ヘリウムは、温度の低下に伴い、2.17 Kで「超流動(superfluidity)」という状態になります。これは、液体の粘性が0になる現象です。例えば、液体ヘリウムを容器に入れて撹拌しておくと、液体ヘリウムは半永久的にグルグルと回り続けます。また、超流動状態の液体ヘリウムをコップのような上側が開いた容器中に入れておくと、液体ヘリウムが薄い膜となり、容器の内壁をよじ登って、自ら外へ流れ出してしまいます。このような超流動現象は、オネスの名前を取って、「オネス効果」と呼ぶこともあります。

図.7 超流動状態の液体ヘリウムは、勝手に内壁をよじ登り、コップの外へ流れ出る
ヘリウムHeは、水素H2に次いで、2番目に軽い気体です。その軽さを活かして、浮揚用ガスとしても使われ、広告用バルーンや天体観測用気球、軍事用偵察気球などに使用されます。空気は、窒素N2と酸素O2がだいたい4:1の割合で混合した気体ですが、ヘリウムHeは、その窒素N2や酸素O2よりはるかに軽いので、空気中で浮かびます。ヘリウムガスは、最も軽い水素ガスの約93%の浮揚力があり、1 Lのヘリウムガスを風船に詰めると、1.1 gの浮遊力が得られます。さらに、ヘリウムHeは不燃性であるため、水素ガスよりも安全な浮揚用ガスとして、風船などにも広く利用されています。
1937年5月6日にアメリカのニュージャージー州レイクハースト海軍飛行場で爆発炎上した、ドイツの巨大飛行船「ヒンデンブルグ号」に詰められていた気体は、可燃性の水素ガスでした。この事故により、乗員・乗客35人と地上の作業員1人が死亡しました。しかし、ヘリウムガスでは、そのような爆発炎上の心配をする必要がありません。ただし、ヘリウムHeのコストは水素H2よりも高く、ヘリウムHeは水素H2の4倍以上の値段がします。

図.8 ヒンデンブルグ号爆発事件は、20世紀の世界を揺るがせた大事故の1つである
また、ヘリウムガス中では、空気の場合の3倍の速さで音が伝わります。そのため、ヘリウムガスを吸入してから発声すると、声帯中の振動数が3倍となり、甲高い音色のような奇妙な声が出ます。このような声の変化のことを、「ドナルドダック効果(Donald Duck effect)」といいます。これに着目して、ヘリウムガスは、パーティーグッズとして利用されます。しかしながら、ヘリウムガスに毒性はないものの、酸素O2を混入していないヘリウムガスを吸入したことによる酸欠事故がまれに起こっています。間違っても安いからといって、風船用のヘリウムガスを吸入しないようにして下さい。

図.9 ドナルドダック効果を狙って、パーティーグッズとして利用されるヘリウムガス
月のセレナイト(透明石膏)の土壌には、「ヘリウム3」が大量に含まれています。難なく採取できる地表すれすれの深さに、約5 tものヘリウム3が存在していることが確認されているのです。放射能を持たないこの同位体元素は、地球上では大変珍しく、これほど大量に埋蔵されているところは見つかっていません。ヘリウム3は、核融合によるエネルギー生産の主要源になると考えられている物質です。月に眠る約5 tという量からは、地球全体の年間消費量の5万倍に当たる電力が得られるといいます。月のヘリウム3を利用することが可能になれば、地球のエネルギー問題は一気に解決するでしょう。

図.10 月のセレナイトの土壌には、ヘリウム3が大量に含まれる
(3) アルゴン
イギリスの化学者ヘンリー・キャベンディッシュは、18世紀後半に実験を行い、大気には酸素O2と窒素N2の他に1%ほどの何らかの成分が含まれていることに気付きましたが、それが何かを特定することはできませんでした。足りなかった成分は、地球の大気に窒素N2と酸素O2に次いで3番目に多く含まれる「アルゴン(argon)」でした。それまで存在が知られていなかったのは、アルゴンArの化学反応性がかなり低いためです。「アルゴン」の名称は、ギリシア語の「怠け者(argos)」に由来します。
19世紀末にアルゴンArを初めて発見したのは、イギリスの物理学者レイリー卿とスコットランドの化学者ウィリアム・ラムゼーです。彼らは、「大気窒素」と「化学窒素」との密度の差からアルゴンArを発見しました。2人は別々に研究を始めたのですが、後に連絡を取り合うようになり、アルゴンを1894年に発見した功績を分かち合っています。「化学窒素」とは、亜硝酸アンモニウムNH4NO2の熱分解により作られた純粋な窒素N2のことで、「大気窒素」とは異なり、貴ガスなどの不純物を含みません。一方、「大気窒素」は大気から酸素O2を除いた気体のことで、これには少量のアルゴンArや二酸化炭素CO2が不純物として含まれていました。その密度差は0.5%程度(化学窒素が1.251 g/Lに対し、大気窒素は1.257 g/L)であり、普通は見過ごしてしまう程度の量ですが、注意深い科学者の努力の末、アルゴンArは発見されたのです。
NH4NO2 → N2 + 2H2O
表.2 大気窒素と化学窒素の違い
|
|
大気窒素 |
化学窒素 |
|
成分 |
N2, Ar, CO2など |
N2のみ |
|
製法 |
空気からO2を除く |
NH4NO2の熱分解 |
|
密度 |
1.257 g/L |
1.251 g/L |
実験室でアルゴンArを得たいときは、乾燥した空気を高温の銅Cuと接触させて酸素O2を取り去り、次にマグネシウムMgと反応させて窒素N2を除きます。空気に微量含まれる二酸化炭素CO2も、マグネシウムMgと反応して除かれます。このようにすれば、実験室でアルゴンArを作り出すことができます。
2Cu + O2 → 2CuO
3Mg + N2 → Mg3N2
2Mg + CO2 → 2MgO + C
アルゴンArは、白熱電球にも使われています。白熱電球に電気を通すと、タングステンWのフィラメントが非常に高温(2,200〜2,700℃)になり、光を放つようになります。しかし、点灯時間の累積とともに、フィラメントの表面からタングステンWが昇華していきます。すると、フィラメントが細くなって切れやすくなるので、タングステンWの昇華を抑えるために、不活性ガスであるアルゴンArを入れて長持ちさせているのです。ただし、白熱電球は消費電力の約90%が熱になり、光エネルギーへの変換効率が悪いため、現在はLEDなどの新しい光源に変わりつつあります。

図.11 白熱電球は、フィラメントのジュール熱による放射を利用した電球である
・参考文献
1) 大東孝司「プラグマティック化学」河合出版(2017年発行)
2) 斉藤勝裕「最強の「毒物」はどれだ?」技術評論社(2014年発行)
3) 齊藤烈/藤嶋昭/山本隆一/他19名「化学」啓林館(2012年発行)
4) 桜井弘「元素118の新知識 引いて重宝、読んでおもしろい」講談社(2017年発行)
5) 左巻健男「面白くて眠れなくなる元素」PHP研究所 (2016年発行)
6) セオドア・グレイ「世界で一番美しい元素図巻」創元社(2011年発行)
7) 平尾一之/田中勝久/中平敦「無機化学」東京化学同人(2013年発行)
8) Hugh Aldersey-Williams「元素をめぐる美と驚き アステカの黄金からゴッホの絵具まで〔下〕」早川書房(2017年発行)