�E���F�����ʼnԉΑ̌��I
�y�ڎ��z
(1) ��������
�@ ���ɉ��f�_�J���E�������2�t�ʂ���A�������������ǂɓ����B
�A �����J���E���E�����i�g���E���E�����o���E���E�����J���V�E���̂����ꂩ1��ނ�I�сA����0.5�t�ʂ����āA�@�̎����ǂɉ�����B
�B �����ǂ����������݂ŕێ����A�K�X�o�[�i�[�őS�̂���Ŗ��ՂȂ����M����B
�C �ő̍������̗Z�����n�܂�����A�ő̍������̏㕔�����ʼn��M����B
�D �ő̍����������ׂėZ��������A�K�X�o�[�i�[���班�������A�ܗk�}��1�{������������B
�E �������R�Ĕ������I��������A�܂��ܗk�}��1�{������������B
�F �E�̑�����A���f�_�J���E���̉t�̂��Ȃ��Ȃ�܂ŌJ��Ԃ��B
(2) ���_
�u���F����(flame
reaction)�v�́A�萫���͂Ō��f�̑��݂��m�F����̂ɗL���ȕ��@�ł��B�ėp������@�́A���̐}.1�̂悤�Ȕ�������p�������̂ł��B�C�I�����܂ސ��n�t���A�_HCl�Ő�����������̐�ɏ��ʕt���A�K�X�o�[�i�[�̉��ɂ������܂��B����ƁA���ɓ��L�̐F���t���̂ł��B
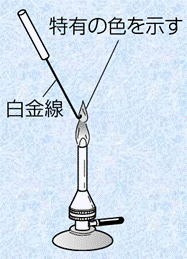
�}.1 ��������p�����u���F�����v
����́A���q�ɔM�Ȃǂ̃G�l���M�[��^����ƁA�ŊO�k�ɂ���d�q����N���ĕs����ȍ��G�l���M�[��ԂƂȂ�A�M�����������Ƃ��Ɉ���Ȓ�G�l���M�[��ԂƂȂ��āA���̂Ƃ��ɂ��̃G�l���M�[���ɑ������������o���邽�߂ł��B���̃G�l���M�[���́A�e�d�q�k�̃G�l���M�[���ʎq������Ă��邽�߁A�e���f�ɂ���Č��܂����l�����܂��B�܂�A�e���f�ɂ���āA���F�����Ŏ����F�����܂��Ă���A�܂����ꂼ��ňقȂ��Ă���̂ł��B�����ł́A�U�������傫���Ǝ��F���ɁA�U�������������ƐԐF���ɂȂ�̂ŁA�G�l���M�[�����傫���قǁA���F���ɂȂ�܂�(���@���w(�C�I���̌n������)���Q��)�B

�}.2 ��\�I�ȋ������f�́u���F�����v
�������A�������Ŋώ@���鉊�F�����́A�u�����������Ċώ@���ɂ����v�Ƃ������_������܂��B�����Ŏ������F�����̎����́A�u�����ǎ��̂����f���L�̉��F�ɋP���v�Ƃ������@�ł���A���͂̂��鉊�F�����������܂��B

�}.3 �����ǂōs�����F�����́A�������ōs�����̂������͂�����
�@���f�_�J���E��KClO3�́A400���ȏ�̍����ɂ���ƁA�Z�����ĉt�̂ƂȂ�A�������Ď_�fO2�������܂��B���̔����́A��_���}���K��MnO2�Ȃǂ̐G�}��������Ƒ��i����A�G�}������A70�����炢�̉��x�ł��_�fO2�������܂��B
2KClO3 �� 2KCl�@�{�@3O2
���f�_�J���E��KClO3�����������ł́A���F�����͋N����܂���B�������A�ܗk�}�Ȃǂ̉R��������ƁA���F�������ώ@����܂��B����́A�����R���邽�߂ɂ́A3�̗v�f�u�M�v�E�u�_�f�v�E�u�R���v���K�v���Ƃ������Ƃ�\���Ă��܂��B
���f�_�J���E��KClO3�ƒܗk�}�����ł́A���F�̃J���E��K�̉��F�������ώ@����܂��B�������A�����ɉ����i�g���E��NaCl�≖���o���E��BaCl2�Ȃǂ̋�����������ɉ�����ƁA�J���E��K�̉��F�����������������āA���̉��Ɋ܂܂�錳�f�̉��F�������ώ@�ł��܂��B����́A�J���E��K�̉��F�������A���̌��f�̉��F�����Ɣ�r���Ĕ������߂ł��B
(3) ����
�@���̕\.1�ɁA����̑g�ݍ��킹�ɂ�鉊�F�̈Ⴂ�������܂��B�����i�g���E��NaCl�≖���o���E��BaCl2�Ȃǂ̋������́A�����ǂɑ�������߂���ƁA�|������ςɂȂ�̂ŁA�������͏��ʂŏ\���ł��B
�\.1 ����̑g�ݍ��킹�ɂ�鉊�F�̈Ⴂ(����͖��ŗʂ��邱��)
|
���� |
���F |
|
���f�_�J���E��2�t |
���F |
|
���f�_�J���E��2�t�{�����J���E��0.5�t |
���F |
|
���f�_�J���E��2�t�{�����i�g���E��0.5�t |
���F |
|
���f�_�J���E��2�t�{�����o���E��0.5�t |
���ΐF |
|
���f�_�J���E��2�t�{�����J���V�E��0.5�t |
��ԐF |