・酸と塩基(電離平衡)
(6) 弱酸+強塩基の塩が加水分解する場合(弱酸+強塩基の中和点のpOH)
(7) 強酸+弱塩基の塩が加水分解する場合(強酸+弱塩基の中和点のpH)
ブレンステッドの定義における酸とは、水素イオンH+ を他の物質に与える物質のことでした。したがって、電離度が大きいほど、酸としての強さが大きいと考えられます。そこで、何か1つ塩基を決めて、その塩基に対する電離度を測定すれば、酸としての強さが評価できます。通常、この水素イオン受容体の塩基としては、溶媒として汎用される水H2Oを考えます。酸をHAとして、水H2Oと酸塩基反応させると、次のような化学反応式が書けます。ここで、水素イオンH+ を電離したあとのA- を酸HAの「共役塩基(conjugate base)」といい、水素イオンH+ を受け取ったオキソニウムイオンH3O+ を水H2Oの「共役酸(conjugate acid)」といいます。
HA(酸) + H2O(塩基) ⇄ A- (共役塩基) + H3O+ (共役酸)
「共役(conjugate)」とは、一体どういう意味でしょうか?この酸塩基反応は可逆反応なので、逆反応もある程度進行します。つまり、オキソニウムイオンH3O+ がA- と酸塩基反応することも当然起こりうることなのです。そこで、逆反応が起こるときに酸として働いているオキソニウムイオンH3O+ を共役酸、塩基として働いているA- を共役塩基と呼んでいるのです。
この酸塩基反応は、ある程度時間が経過すると、正反応と逆反応の反応速度が等しくなり、やがて平衡状態となって落ち着きます。このときの正反応の速度をv1、逆反応の速度をv2とすると、次のように表せます。なお、[H2O]は溶媒なので、一般的に反応速度式には書きません。
![]()
![]()
そして、平衡状態ではv1=v2が成り立っているので、K=k1/k2とすると、次のような化学平衡の式が導き出せます。
![]()
![]()
ここで、平衡状態にある酸HAの水溶液を2倍に薄めたと仮定しましょう。水溶液を2倍に薄めるのだから、[HA], [A-], [H3O+]は、すべて1/2倍になります。よって、正反応の速度v1は1/2倍に減少し、逆反応の速度v2は1/2×1/2=1/4倍に減少するので、v1>v2となって、もはや平衡状態ではなくなってしまいます。そこで、この反応は右へ進行し、v1が減少してv2が増加していくうちに、あるところでv1=v2となって、再び平衡状態になります。
つまり、酸の水溶液を薄めると、平衡は右に移動して、電離度は大きくなっていくのです。このように、電離度は濃度によって変わる値なので、酸の強さを評価する指標としては、少々問題があります。しかしながら、v1=v2の平衡状態において、ある温度T で平衡定数Kは常に一定に保たれる(K=k1/k2)ので、これをKaと表すことにします。
![]()
このKaは、酸の濃度によらず一定であると同時に、これが大きければ平衡で右辺の量が多いのだから、酸として電離がしやすいということも分かります。つまり、Kaは酸の強さを表す指標として使うことができるのです。このKaを「酸解離定数(acid dissociation constant)」といい、塩基に対して定義したKbを「塩基解離定数(base dissociation constant)」といいます。ただし、酸解離定数Kaは非常に小さい値になることが多いので、通常はpHの場合と同様に、酸解離定数Kaを負の対数で表したpKa(—log10Ka)が使用されることが多いです。
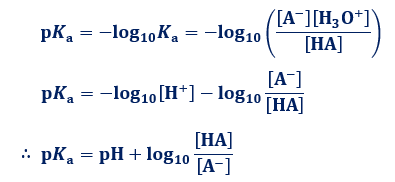
このKaならびにpKaの数学的関係が示すように、Kaが大きいか、あるいはpKaが小さいほど、その酸の酸性度は強くなります。次の表.1に、代表的ないくつかの化合物のpKa値を示しました。pH=pKaのときは1og10[HA]/[A—]=0となるので、全HAの量のちょうど半分が電離した状態([HA]=[A—])になります。例えば、酢酸CH3COOHはpKa=4.75なので、pH=4.75のときには[CH3COOH]=[CH3COO—]となります。一般的に5以下のpKa値を持つ化合物は、酸性度が比較的強いものであるとみなされ、特に0以下のpKa値を持つ化合物は、極めて酸性度が強いといえます。
表.1 代表的ないくつかの化合物のpKa値
|
名称 |
化学式 |
pKa値 |
|
塩酸 |
HCl |
−7 |
|
硫酸 |
H2SO4 |
−3 |
|
硝酸 |
HNO3 |
−1.3 |
|
ベンゼンスルホン酸 |
C6H5SO3H |
0〜2 |
|
酢酸 |
CH3COOH |
4.75 |
|
フェノール |
C6H5OH |
10 |
|
水 |
H2O |
15.7 |
|
エタノール |
C2H5OH |
15.9 |
|
アセチレン |
CH≡CH |
24 |
|
アンモニア |
NH3 |
33 |
|
エチレン |
CH2=CH2 |
44 |
|
メタン |
CH4 |
50 |
また、酸の強度と共役塩基の強度とが、逆の関係にあるということを覚えておくと便利です。すなわち、共役塩基A- が弱い塩基であるほど、その酸HAは強い酸になります。例えば、塩化水素HClは強い酸ですが、その共役塩基Cl- は弱い塩基です。すなわち、共役塩基Cl- はH+ に対して、非常に弱い親和性しか持っていないということです。それ故に、塩化水素HClが電離する平衡は右に傾き、強い酸として働くことになるのです。また、それと同様の理由で、水H2Oは弱い酸であるから、その共役塩基の水酸化物イオンOH- は強い塩基です。共役塩基OH- はH+ に対して、非常に強い親和性を持っているといえます(酸と塩基(酸と塩基の強さ)を参照)。
HCl(酸) + H2O(塩基) ⇄ Cl- (共役塩基) + H3O+(共役酸)
C mol/Lの塩酸HClの[H+]を求めてみましょう。塩酸HClは強酸なので、電離度α≒1です。したがって、C mol/Lの塩酸HClは、水溶液中ですべて電離していると考えて問題ありません。つまり、C mol/Lの塩酸HClからは、C mol/Lの水素イオンH+ が生じることになります。また、塩酸HClと同様に水H2Oの電離も考えられるので、水H2Oから電離する水素イオンH+ をa mol/Lとすると、次のようになります。
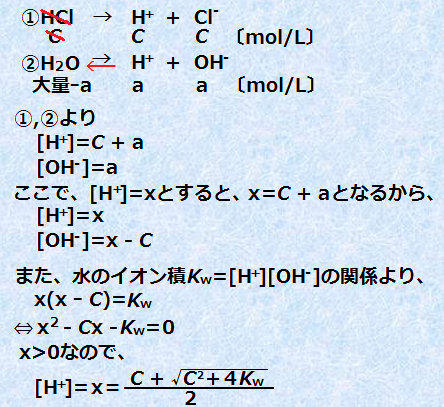
ただし、Cが十分に大きい条件、すなわちC ≧10-6 のときは、次のように水H2Oから電離する水素イオンH+ の量を無視して、a≒0として近似することができます。
![]()
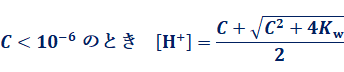
このようにC ≧10-6で近似ができるのは、水H2Oの電離によるaが、無視できるぐらいに小さいからです。例えば、C ≧10-6 のときは、C+a≧10-6 が必然的に成立します。よって、水のイオン積Kw=[H+][OH-]の式に[H+]=C+aと[OH-]=aを代入すると、次のようになります。
10-14=(C+a)×a
C+a≧10-6 なので、a≦10-8
つまり、C ≧10-6 ならばa≦10-8 となるので、Cはaの100倍以上大きい(C ≧100a)ということになります。そして、もしC とaで100倍以上の差があれば、C+a≒Cと近似しても、誤差はそれほど大きくならないので、水H2Oの電離による水素イオンH+ の量を無視することができるのです。実際にC の値を変えて、正確な[H+]を求めたものが次の表.2です。この表.2からは、C ≧10-6 なら[H+]=Cと近似できる(水の電離を無視できる)ことが分かります。
表.2 水の電離を考えた場合のCと[H+]の値
|
C〔mol/L〕 |
[H+]〔mol/L〕 |
|
10-3 |
1.00000001×10-3 |
|
10-4 |
1.000001×10-4 |
|
10-5 |
1.0001×10-5 |
|
10-6 |
1.01×10-6 |
|
10-7 |
1.62×10-7 |
|
10-8 |
1.05×10-7 |
|
10-9 |
1.005×10-7 |
強酸を水H2Oで1,000倍以上に希釈するというような特殊な状況でない限り、C <10-6 の希薄酸を扱うということはほとんどありません。したがって、一般的にC mol/Lの一価の強酸HAの[H+]は、次のように表すことができます。
[H+]=C
※ただし、C ≧10-6 のときに限る
C mol/Lの水酸化ナトリウムNaOH水溶液の[OH-]を求めてみましょう。水酸化ナトリウムNaOHは強塩基なので、電離度α≒1です。したがって、C mol/Lの水酸化ナトリウムNaOHは、水溶液中ですべて電離していると考えて問題ありません。つまり、C mol/Lの水酸化ナトリウムNaOH水溶液からは、C mol/Lの水酸化物イオンOH- が生じることになります。また、水酸化ナトリウムNaOHと同様に水H2Oの電離も考えられるので、水H2Oから電離する水酸化物イオンOH- をa mol/Lとすると、次のようになります。

ただし、Cが十分に大きい条件、すなわちC ≧10-6 のときは、次のように水H2Oから電離する水酸化物イオンOH- の量を無視して、a≒0として近似することができます。
![]()
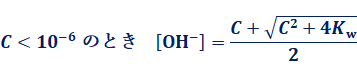
一般的には、C ≧10-6 の条件が成立していることが多いです。この場合は、水H2Oの電離による水酸化物イオンOH- の量を無視することができ、C mol/Lの一価の強塩基MOHの[OH-]は、次のように表すことができます。
[OH-]=C
※ただし、C ≧10-6 のときに限る
C mol/Lの酢酸CH3COOH水溶液の[H+]を求めてみましょう。酢酸CH3COOHは弱酸なので、電離度はα <<1です。したがって、水溶液中では、一部の酢酸CH3COOHだけが電離しています。電離度をαとすると、C mol/Lの酢酸CH3COOHからは、Cα mol/Lの水素イオンH+ が生じます。しかし、電離度αは濃度によって大きく変動する値なので、取り扱いが難しいです。そこで、電離度αを使わず、濃度によらず一定値を取る酸解離定数Kaを使って、[H+]を求める方法を考えてみます。
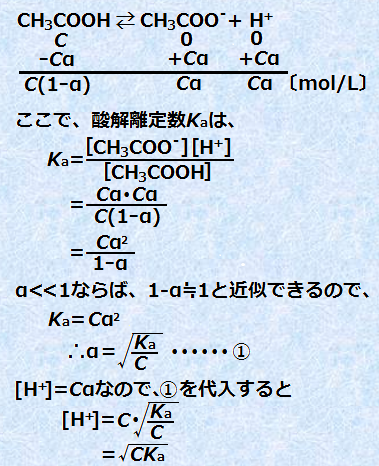
ただし、これはCα≧10-6 の条件が成立している場合に限ります。もしCα<10-6 ならば、水H2Oの出す水素イオンH+ の寄与を無視できなくなってしまうので、[H+]を求める式は、次に示すような3次方程式の解になってしまいます。これを手計算で解くのは大変困難なので、大学入試レベルの問題では、通常Cα ≧10-6 の条件が無条件に成立していると考えて問題ありません。
![]()
また1-α≒1の近似は、α <<1の場合でしか用いることができません。電離度αがある程度大きくなる条件、すなわちα>0.05(1-α<0.95)のときは、近似を用いずに次の2次方程式を解いて、αを求めなければなりません。この2次方程式の解αは、α>0.05のときの電離度となります。電離度αが0.05よりも大きい場合では、計算の誤差が大きくなるので、1-α≒1の近似が使えなくなるのです。
![]()
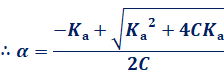
ここで、1-α≒1の近似が使えない場合を考えてみましょう。例えば、水溶液を十分に薄めて、C=Kaになったときの電離度αを求めてみます。仮に1-α≒1の近似が使えたとすると、電離度αは![]() となり、これではα <<1の仮定に矛盾します。そこで、上記の二次方程式にC=Kaを代入して計算すると、次のような簡単な計算となります。
となり、これではα <<1の仮定に矛盾します。そこで、上記の二次方程式にC=Kaを代入して計算すると、次のような簡単な計算となります。
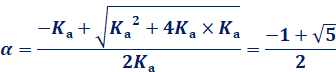
![]() として電離度αを計算してみると、α=0.565となります。よって、α≦0.05となる1つの目安が、C>>Kaということにもなります。酢酸CH3COOHであれば、25℃でKa=2.7×10-5 mol/Lなので、水で薄めて濃度Cが10-3 〜10-5 mol/Lくらいになると、計算の誤差が大きくなってきます。
として電離度αを計算してみると、α=0.565となります。よって、α≦0.05となる1つの目安が、C>>Kaということにもなります。酢酸CH3COOHであれば、25℃でKa=2.7×10-5 mol/Lなので、水で薄めて濃度Cが10-3 〜10-5 mol/Lくらいになると、計算の誤差が大きくなってきます。
しかしながら、電離度αが十分に小さい条件(α≦0.05)なら、1-α≒1と近似ができます。この場合はα≒0と考えて良いので、一般的にC mol/Lの一価の弱酸HAの[H+]は、次のように表すことができます。
![]()
※ただし、Cα ≧10-6 かつα≦0.05のときに限る
C mol/LのアンモニアNH3水溶液の[OH-]を求めてみましょう。アンモニアNH3は弱塩基なので、電離度はα <<1です。したがって、水溶液中では、一部のアンモニアNH3だけが電離しています。電離度をαとすると、C mol/LのアンモニアNH3からは、Cα mol/Lの水酸化物イオンOH- が生じます。しかし、電離度αは濃度によって大きく変動する値なので、取り扱いが難しいです。そこで、電離度αを使わず、濃度によらず一定値を取る塩基解離定数Kbを使って、[OH-]を求める方法を考えてみます。
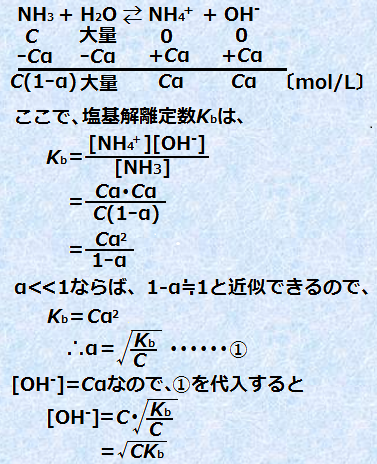
ただし、これはCα ≧10-6 の条件が成立している場合に限ります。Cα<10-6 ならば、水H2Oの出す水酸化物イオンOH- の寄与を無視できなくなるので、[OH-]を与える式は大変複雑になります。これを手計算で解くのは困難なため、弱塩基の場合でも、Cα ≧10-6 の条件が無条件に成立していると考えて問題ありません。
また1-α≒1の近似は、α <<1の場合でしか用いることができません。電離度αがある程度大きくなる条件、すなわちα>0.05のときは、近似を用いずに次の2次方程式を解いて、αを求めなければなりません。
![]()
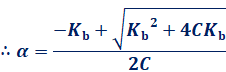
しかしながら、電離度αが十分に小さい条件(α≦0.05)なら、1-α≒1と近似ができます。この場合はα≒0と考えて良いので、一般的にC mol/Lの一価の弱塩基MOHの[OH-]は、次のように表すことができます。
![]()
※ただし、Cα ≧10-6 かつα≦0.05のときに限る
(6) 弱酸+強塩基の塩が加水分解する場合(弱酸+強塩基の中和点のpOH)
弱酸と強塩基の中和によって生じる塩が水H2Oに溶けると、「加水分解(hydrolysis)」が起こって弱塩基性を示します。ここで、C mol/Lの酢酸ナトリウムCH3COONa水溶液の[OH-]を求めてみましょう。酢酸ナトリウムCH3COONaは、水溶液中では100%が電離しており、酢酸イオンCH3COO- とナトリウムイオンNa+ とに電離しています。ナトリウムイオンNa+ は水H2Oとは反応しませんが、酢酸イオンCH3COO- の一部は水H2Oと反応します。ここで、酢酸ナトリウムCH3COONaの加水分解定数をKh、酢酸CH3COOHの酸解離定数をKa、水のイオン積をKwとすると、次のようになります。

ただし、これはCα ≧10-6 の条件が成立している場合に限ります。もしCα<10-6 ならば、水H2Oの出す水酸化物イオンOH- の寄与を無視できなくなってしまうのです。水H2Oの電離まで考えると、[OH-]を求める式は大変複雑になります。これを手計算で解くのは困難なため、弱酸と強塩基の塩が加水分解する場合でも、Cα ≧10-6 の条件が無条件に成立していると考えて問題ありません。また、加水分解度αは通常α <<1なので、一般的にC mol/Lの弱酸+強塩基の塩の[OH-]は、次のように表すことができます。
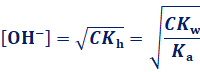
※ただし、Cα ≧10-6 のときに限る
(7) 強酸+弱塩基の塩が加水分解する場合(強酸+弱塩基の中和点のpH)
強酸と弱塩基の中和によって生じる塩が水H2Oに溶けると、加水分解が起こって弱酸性を示します。ここで、C mol/Lの塩化アンモニウムNH4Cl水溶液の[H+]を求めてみましょう。塩化アンモニウムNH4Clは、水溶液中では100%が電離しており、アンモニウムイオンNH4+と塩化物イオンCl- とに電離しています。塩化物イオンCl- は水H2Oとは反応しませんが、アンモニウムイオンNH4+の一部は水H2Oと反応します。ここで、塩化アンモニウムNH4Clの加水分解定数をKh、アンモニアNH3の塩基離定数をKb、水のイオン積をKwとすると、次のようになります。

ただし、これはCα ≧10-6 の条件が成立している場合に限ります。もしCα<10-6 ならば、水H2Oの出す水素イオンH+ の寄与を無視できなくなってしまうのです。水H2Oの電離まで考えると、[H+]を求める式は大変複雑になります。これを手計算で解くのは困難なため、強酸と弱塩基の塩が加水分解する場合でも、Cα ≧10-6 の条件が無条件に成立していると考えて問題ありません。また、加水分解度αは通常α <<1なので、、一般的にC mol/Lの強酸+弱塩基の塩の[H+]は、次のように表すことができます。
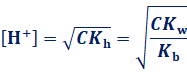
※ただし、Cα ≧10-6 のときに限る
純水H2Oに強酸や強塩基を少量加えると、そのpHは大きく変化します。しかし、酢酸CH3COOHと酢酸ナトリウムCH3COONaの混合水溶液に強酸や強塩基を少量加えても、pHの変化は小さいです。このように、酸や塩基を加えたときにpH変化を小さくする作用を「緩衝作用(buffer action)」といい、この作用の大きな溶液を「緩衝液(buffer solution)」といいます。
例えば、血液は身近な緩衝液です。血液には緩衝作用があるので、外部から多少の異物が入り込んでも、致命的な影響が生じないようになっているのです。血液は、炭酸H2CO3と炭酸水素イオンHCO3- との電離平衡により、緩衝作用を獲得しており、弱塩基性(pH=7.4)に保たれています。また、唾液にも炭酸水素イオンHCO3- が含まれており、酸っぱいものを食べたときに、緩衝作用によって酸味を和らげる働きをしています。梅干しやレモンなどを食べるときに、唾液が大量に分泌されるのはこのためです。一般的に弱酸とその塩や弱塩基とその塩の混合溶液は、緩衝作用を持つのです。
H2CO3 ⇄ HCO3- + H+
例として、酢酸CH3COOHと酢酸ナトリウムCH3COONaの混合溶液の持つ緩衝作用を考えてみましょう。酢酸CH3COOHと酢酸ナトリウムCH3COONaは、水溶液中では次のように電離しています。
CH3COOH ⇄ CH3COO- + H+
CH3COONa → CH3COO- + Na+
酢酸ナトリウムCH3COONaはイオン結合性の塩なので、そのほとんどが電離して、酢酸イオンCH3COO- になっています。しかし、酢酸CH3COOHは弱酸なので、そのほとんどは電離せずに酢酸CH3COOHのままです。よって、この混合液においては、次のような関係が成り立ちます。
[CH3COO-]=加えたCH3COONa
[CH3COOH]=加えたCH3COOH
そこで、この混合溶液に酸や塩基を少量加えると、次のような反応が起こり、加えた水素イオンH+ や水酸化物イオンOH- が中和されます。
酸を加えたとき:CH3OO- + H+ → CH3COOH
塩基を加えたとき:CH3COOH + OH- → CH3COO- + H2O
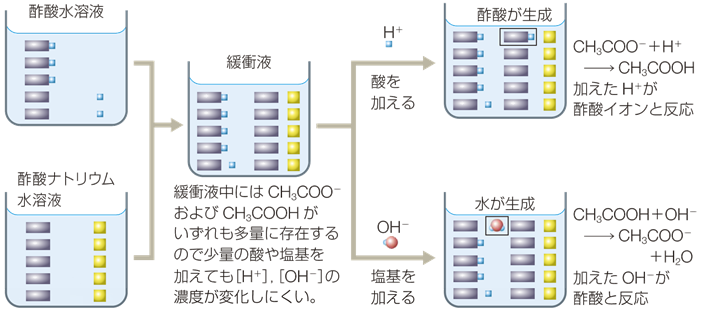
図.1 酢酸CH3COOHと酢酸ナトリウムCH3COONaの緩衝液
酸や塩基を加えたときの反応は、ほぼ100%右に進む反応です。したがって、少量の水素イオンH+ や水酸化物イオンOH- を加えても、[H+]や[OH-]の変化が抑えられ、pHの変化が緩やかになるのです。ここで、Ca mol/Lの酢酸CH3COOHとCs mol/Lの酢酸ナトリウムCH3COONaの混合溶液の[H+]を求めてみましょう。
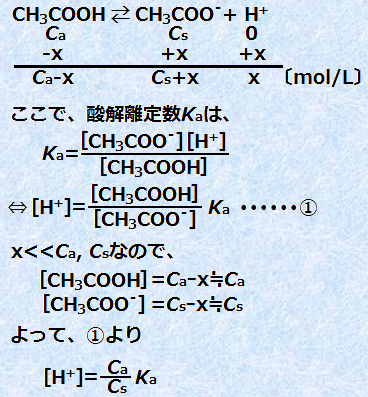
この式より、緩衝液の[H+]はCa ,Cs, Kaに依存することが分かります。また、Kaは温度一定なら一定値になるので、実質、緩衝液のpHはCa ,Csにより決定されるということも分かります。この緩衝液に酸を加えるとCsが減ってCaが増え、塩基を加えるとCaが減ってCsが増えることより、緩衝液の[H+]は容易に求めることができます。
例として、アンモニNH3と塩化アンモニウムNH4Clの混合溶液の持つ緩衝作用を考えてみましょう。アンモニアNH3と塩化アンモニウムNH4Clは、水溶液中では次のように電離しています。
NH3 + H2O ⇄ NH4+ + OH-
NH4Cl → NH4+ + Cl-
塩化アンモニウムNH4Clはイオン結合性の塩なので、そのほとんどが電離して、アンモニウムイオンNH4+ になっています。しかし、アンモニアNH3は弱塩基なので、そのほとんどは電離せずにアンモニアNH3のままです。よって、この混合液においては、次のような関係が成り立ちます。
[NH4+]=加えたNH4Cl
[NH3] =加えたNH3
そこで、この混合溶液に酸や塩基を少量加えると、次のような反応が起こり、加えた水素イオンH+ や水酸化物イオンOH- が中和されます。
酸を加えたとき:NH3 + H+ → NH4+
塩基を加えたとき:NH4+ + OH- → NH3 + H2O
酸や塩基を加えたときの反応は、ほぼ100%右に進む反応です。したがって、少量の水素イオンH+ や水酸化物イオンOH- を加えても、[H+]や[OH-]の変化が抑えられ、pHの変化が緩やかになるのです。ここで、Cb mol/LのアンモニアNH3とCs mol/Lの塩化アンモニウムNH4Clの混合溶液の[OH-]を求めてみましょう。
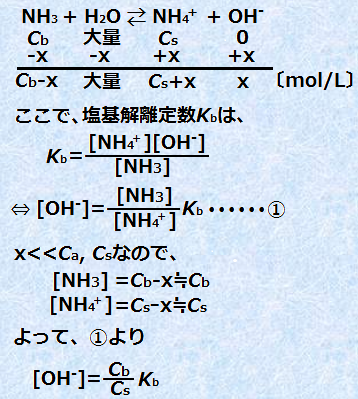
この式より、緩衝液の[OH-]はCb ,Cs, Kbに依存することが分かります。また、Kbは温度一定なら一定値になるので、実質、緩衝液のpHはCb ,Csにより決定されるということも分かります。この緩衝液に酸を加えるとCbが減ってCsが増え、塩基を加えるとCsが減ってCbが増えることより、緩衝液の[OH-]は容易に求めることができます。
・参考文献
1) 石川正明「新理系の化学(上)」駿台文庫(2005年発行)